Исследование морфофизиологических свойств дрожжей, перспективных для производства этанола
Автор: Давыденко С.Г., Меледина Т.В., Андреева А.И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (103) т.87, 2025 года.
Бесплатный доступ
Этиловый спирт широко применяется в пищевой, медицинской, косметической промышленности, а также рассматривается как альтернатива традиционному топливу благодаря своей возобновляемости и экологической безопасности. В условиях глобального роста интереса к биотопливу особое значение приобретают исследования, направленные на отбор штаммов дрожжей с высокой продуктивностью и устойчивостью к этанолу. Целью настоящей работы являлось изучение морфофизиологических характеристик и спиртоустойчивости штаммов Saccharomyces cerevisiae, применяемых в биотехнологических процессах. Объектами исследования выступали штаммы С16, С25 и С48 из коллекции Университета ИТМО, а также контрольный штамм пекарских дрожжей RCAM 02150. Проведена молекулярно-генетическая идентификация методом ПЦР и HRM-анализа. Физиологическая активность оценивалась по объему выделенного диоксида углерода и содержанию мертвых клеток после культивирования в среде с этанолом. Дополнительно исследовалась морфология и флокуляционная способность дрожжей. Полученные результаты показали, что дрожжи штамма С25 характеризуются наибольшей ферментативной активностью при сохранении высокой жизнеспособности в присутствии 10–20% этанола. Штамм С16 продемонстрировал более низкую метаболическую активность, что, вероятно, связано с повышенной флокуляцией. При этом все штаммы имеют близкое таксономическое родство и различаются по форме и размеру клеток. Выявленные различия подчеркивают необходимость использования комплексных подходов при скрининге дрожжей, включая морфологический анализ, количественную оценку клеток и определение физиологической устойчивости к этанольному стрессу.
Дрожжи, этанол, морфология, устойчивость, клетка
Короткий адрес: https://sciup.org/140309839
IDR: 140309839 | УДК: 663.127 | DOI: 10.20914/2310-1202-2025-1-190-197
Текст научной статьи Исследование морфофизиологических свойств дрожжей, перспективных для производства этанола
Этиловый спирт является востребованным сырьем в различных отраслях народного хозяйства, в частности в пищевой промышленности, медицине, косметологии. В последнее время, в связи с необходимостью снизить нагрузку на экологию, этанол используют в качестве топлива, частично заменяя бензин и дизельное топливо в двигателях внутреннего сгорания [1]. Кроме того, для многих стран, которые имеют дефицит углеродных ископаемых, замена части бензина на этанол является решением проблемы снижения себестоимости топлива. В настоящее время 95% этанола, производимого из растительного сырья, заменяет 32% бензина [2]. Для производства этанола используется быстро возобновляемое растительное сырье или отходы пищевых предприятий [3-5]. Разрабатываются технологии получения этанола из лигнин содержащих отходов после переработки древесины [6; 7], а также бытовых углеводсодержащих отходов [8]. Появляются работы, в которых предлагают получать этанол из различных экзотических для Российской Федерации растений [4]. Не зависимо от источника сырья в технологии производства биоэтанола обязательной стадией является ферментация гидролизатов, содержащих редуцируемые сахара [9]. Количество сбраживаемых дрожжами углеводов в них колеблется от 0,7 г/л [6] до 138г/л [9]. Именно поэтому меласса, содержащая до 50% сахарозы, по-прежнему является перспективным сырьем. Важно, что именно благодаря высокому содержанию сахарозы можно эффективно перерабатывать высоко концентрированные среды [2, 10]. Так, выделенные Саидом Кешкаром с поверхности ягод винограда дрожжи Hanseniaspora oputiae способны расти в среде, содержащей 50% глюкозы. Установлено, что данный вид дрожжей является спиртоустойчивым и может продуцировать до 21% этанола [11, 12]. По всей видимости и среди дрожжей сахаромицетов могут быть штаммы, которые значительно повысят выход этанола. Эти дрожжи должны характеризоваться осмо- и спирто – устойчивостью [1, 13–16].
Цель работы – исследовать морфофизиологические свойства и спиртоустойчивость дрожжей сахаромицетов, применяемых в различных биотехнологических процессах.
Материалы и методы
Объектами исследования являлись:
– штаммы спиртовых дрожжей С16, С25, С48 Saccharomyces cerevisiae из коллекции университета ИТМО (расшифровать);
– пекарские дрожжи штамм RCAM 02150 из коллекции ВКПМ (Москва).
Идентификация штаммов дрожжей методом ПЦР. Проведение ПЦР в реальном времени с последующим анализом кривых плавления высокого разрешения (HRM анализ) проводили на амплификаторе СFХ96 BioRad. Реакционная смесь объёмом 20 мкл содержала 10,0 мкл Master Mix, 2х концентрации с красителем Sybr Green, МgСl2 концентрацией 2,5 мМ производства ООО «Бигль». Использовали праймеры IТS1 и IТS4 в концентрации 0,3 мМ
ООО «Бигль» и 1,5 мкл выделенной ДНК исследуемых штаммов [17, 18].
Условия ПЦР включали предварительную денатурацию при 95 ℃ – 420 с. и 45 циклов амплификации (60 ℃ – 15 с., 72 ℃ – 15 с., 95 ℃ – 15 с.). Режим HRM -20 чтений на 1 ⁰C.
На рисунке 1 изображена кривая температуры плавления контрольного образца, в котором отсутствуют дрожжи, соответственно отсутствуют и пики плавления ДНК (черная линия).
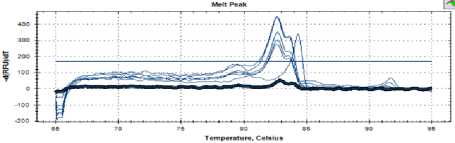
Рисунок 1. Кривая температур плавления (негативный контроль)
Figure 1. Melting temperature curve (negative control)
Результаты
Первоначальной задачей стояла оценка физиологической активности дрожжей. Для определения физиологической активности дрожжей был использован экспресс-метод С.Г. Давыденко, который дает возможность количественной оценки спиртоустойчивости и отбора перспективных штаммов для производства [19, 20]. Согласно методике, питательная среда для культивирования дрожжей содержала раствор глюкозы и восьмикратную среду YEP (8 x YEP), в состав которой входили 16% пептон и 8% дрожжевой экстракт. Количество глюкозы во всех вариантах опыта составляло 0,5 мл, среды 8 x YEP 0,25 мл, дрожжевой суспензии 10 x 107 клеток / мл – 0,5 мл. Количество воды и этанола вносили в зависимости от цели исследования (таблица 1). Общий объем суспензии в шприцах составлял 2 мл.
Для инокуляции использовали суспензию чистой культуры дрожжей исследуемых штаммов. План эксперимента по изучению влияния этанола на физиологию дрожжей приведен в таблице 1.
Таблица 1.
План эксперимента по изучению влияния этанола в концентрации 10% на физиологию дрожжей Table 1.
The plan of the experiment to study the effect of ethanol at a concentration of 10% on the physiology of yeast
|
Образец Sample |
Глюкоза, 40% Glucose, 40% |
8 x YEP |
Дрожжевая суспензия 10 x 10 7 клеток/мл Yeast suspension of 10 x 10 7 cells/ml |
Н 2 O |
Этанол ethanol |
|
Контроль | Control |
0,5 |
0,25 |
0,5 |
0,75 |
0 |
|
10% этанола | 10% ethanol |
0,5 |
0,25 |
0,5 |
0,55 |
0,2 |
Полученные растворы перемешивали, набирали в шприц вместимостью 10 мл, герметично запаивали его нижний конец. Культивирование длилось 17 ч при температуре 30 °С. Во время брожения дрожжи производили углекислый газ, который при выделении поднимал поршень шприца. Объем выделившегося газа оценивали по высоте подъема поршня.
Метаболическую активность штаммов сравнивали по количеству выделившегося диоксида углерода.
Определение концентрации мертвых клеток. Для определения концентрации мертвых клеток содержимое шприцов выливали в пробирки и центрифугировали в течение 3 минут. После центрифугирования из пробирок удаляли супернатант, в дрожжевой осадок добавляли воду до начального объема пробы. Далее окрашивание клеток метиленовым синим проводили согласно [19].
Идентификация спиртовых дрожжей с помощьюметода ПЦР. В качестве эталона был взят штамм пекарских дрожжей RCAM 02150, который принадлежит к виду Saccharomyces cerevisiae. На рисунке 2 показана кривая температуры плавления ПЦР фрагмента между участками IТS1 и IТS4 рибосомальной ДНК для дрожжей этого штамма. Выявлены 2 пика с температурами плавления 83,6 °С и 82,7 °С.
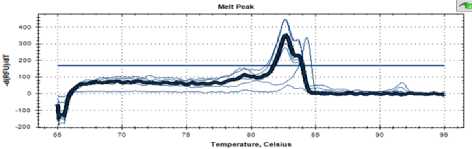
Рисунок 2. Кривая температуры плавления RCAM 02150
Figure 2. Melting temperature curve RCAM 02150
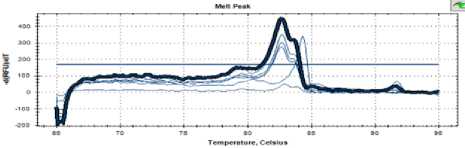
Рисунок 4. Кривая температуры плавления штамма С25
Figure 4. Melting point curve of strain С25
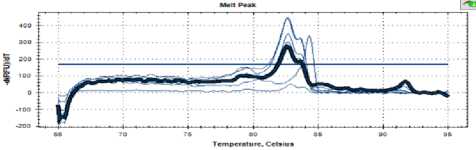
Рисунок 3. Кривая температуры плавления штамма С 16
Figure 3. Melting point curve of strain C 16
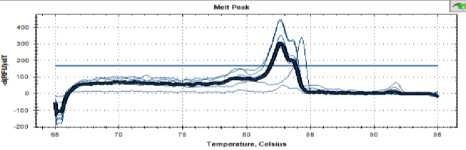
Рисунок 5. Кривая температуры плавления дрожжей С48
Figure 5. Melting point curve of strain С48
Как видно на рисунках 3, 4 и 5, кривые плавления для дрожжей штаммов С16, С 25 и С48 имели такой же профиль, как и пекарские дрожжи.
Можно сделать вывод о близком таксономическом родстве всех проанализированных штаммов.
Влияние этанола на физиологическую активность спиртовых дрожжей. На рисунке 6 приведены результаты эксперимента, в котором концентрация этанола в опытных образцах составляла 10%. Видно, что снижение выделение углекислого газа особенно выражено у спиртовых штаммов С48 и С16.
Токсичное действие этанола на физиологическое состояние дрожжей определяли по содержанию мертвых клеток путем окрашивания метиленовым синим и по количеству выделившегося диоксида углерода.

Рисунок 6. Внешний вид шприцов после 17 ч культивирования при 300 С (1 – штамм RCAM 02150 контроль, 2 – RCAM 02150 опыт, 3 – С48 контроль, 4 – С48 опыт, 5 – С25 – контроль, 6 – С25 опыт, 7 – С16 контроль, 8 – С 16 опыт)
Figure 6. Appearance of syringes after 17 hours of cultivation at 300 C (1 – strain Rcam 02150 control, 2 – Rcam 02150 experience, 3 – С48 control, 4 – С48 control, 5-С25 control, 6 – С25 control, 7 – С16 control, 8 – С16 experience)
На рисунке 7 видно, что все образцы дрожжей имеют высокую жизнеспособность, так как количество мертвых клеток в конце процесса культивирования не превышает 3%. Обращает на себя внимание различия в размерах клеток изучаемых штаммов дрожжей (рисунки 8–11). Максимальный размер имеют клетки пекарских дрожжей (9 мкм), минимальный – дрожжи С48. Анализ морфологической картины показывает, что все образцы спиртовых дрожжей имеют округлую форму, в то время как для пекарских дрожжей характерна округлоовальная форма.
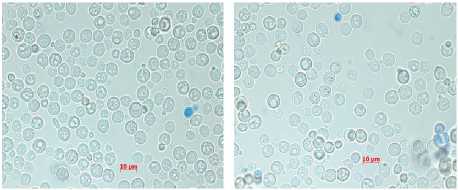
Контрольный образец Образец с концентрацией этанола 10%) D взрослых клеток = 9 рм. Форма клеток Оклеток = 9 ри. Форма клеток круглая, круглая. Наблюдаются небольшие вакуоли Наблюдаются небольшие вакуоли
Рисунок 8. Морфология дрожжей штамма RCAM 02150
Figure 8. Morphology of yeast strain RCAM 02150
ч* °СО$ с<Ъ
о со , а А'Э ■
■ • *• \. ° qQ^‘ г\ 0'°? Сл * -лО .
* eS'ls ”" /eV * cja ®® о
•■сЛ п§^Зв?« оУ&ЮаХ&в 'ГА °'
Конт рольный образец Образец с концентрацией этанола 10%) D взрослых клеток = 8рм. Форма клеток Оклеток = 8 ри. Форма клеток круглая, круглая. Наблюдаются маленькие вакуоли. Наблюдаются маленькие вакуоли
Рисунок 9. Морфология дрожжей штамм С16
Figure 9. Morphology of yeast strain С16
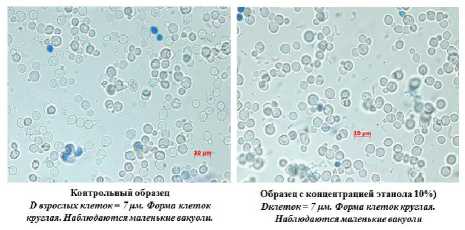
Рисунок 10. Морфология дрожжей штамма С25
Figure 10. Morphology of yeast strain С25
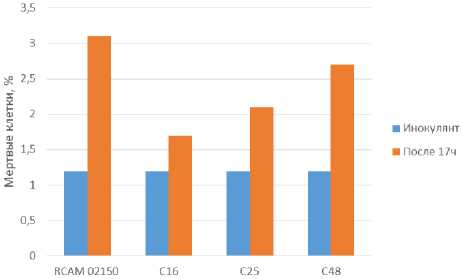
Рисунок 7. Содержание мертвых клеток после 17 ч культивирования при 30 ℃
Figure 7. The content of dead cells after 17 hours of cultivation at 30 ℃
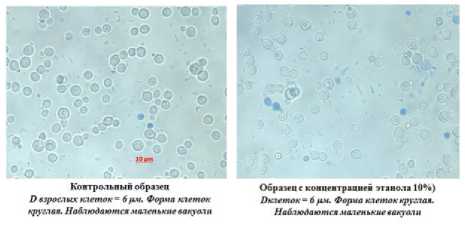
Рисунок 11. Морфология дрожжей штамма С48
Figure 11. Morphology of yeast strain С48
При сравнении метаболической активности штаммов спиртовых дрожжей, которая определялась по количеству выделившегося диоксида углерода в процессе сбраживания среды, находящейся в шприцах, установлен интересный факт (рисунок 12). При практически одинаковом содержании живых клеток во всех образцах количество образовавшегося СО2 клетками штамма С16 составляла 53,2% от контроля, т. е. контрольного варианта, не содержащего этанол, в то время как для других штаммов эта величина соответствовала 87,8% (штамм RCAM 02150), 92,1% (штамм С25) и 82,8% (штамм С48). Максимальную бродильную активность имели штаммы С25 и пекарские дрожжи (92.1% и 87.8% соответственно).
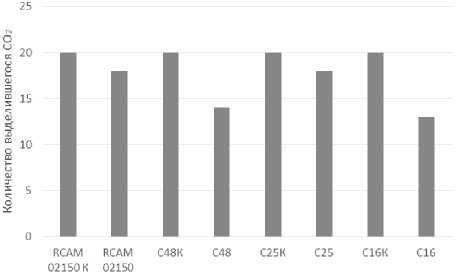
Рисунок 12. Высота подъема поршня за счет выделения СО2 при культивировании штаммов дрожжей на средах разного состава (без этанола и с 10% этанола) (1 – штамм RCAM 02150 контроль, 2 – RCAM 02150 опыт, 3 – С48 контроль, 4 – С48 опыт, 5 – С25 – контроль, 6 – С25 опыт, 7 – С16 контроль, 8 – С 16 опыт)
Figure 12. The height of the piston lift due to the release of СО2 during the cultivation of yeast strains on media of various compositions (without ethanol and with 10% ethanol) (1 – strain rcam 02150 control, 2 – strain rcam 02150 experience, 3 – strain с48 control, 4 – strain с48 control, 5-strain С25 control, 6 – strain С25 control, 7 – strain с16 control, 8 – strain с16 experience)
Для объяснения этого факта была осуществлена серия экспериментов с двумя, значительно отличавшихся по бродильной активности, штаммами дрожжей С16 и С25. Процесс брожения проходил в среде с 20% этанола. Длительность процесса культивирования составила 72 часа. Оценку концентрации дрожжей в культуральной среде проводили по оптической плотности D600. В таблице 2 приведены результаты исследования.
Таблица 2.
Оптическая плотность культуральной среды D 600 при ферментации спиртовых дрожжей
Table 2.
Optical density of the culture medium D600 during fermentation of alcoholic yeast
|
Длительность культивирования, часов Duration of cultivation, hours |
Штамм Strain |
Концентрация этанола, %-об. Ethanol concentration, % vol. |
|
|
20.0 |
0.0 |
||
|
0 |
С16 |
1,513 |
1,509 |
|
С25 |
1,572 |
2,407 |
|
|
24 |
С16 |
1,602 |
3,005 |
|
С25 |
1,578 |
2,991 |
|
|
48 |
С16 |
1,577 |
3,007 |
|
С25 |
1,551 |
2,995 |
|
|
72 |
С16 |
1,499 |
3,098 |
|
С25 |
1,568 |
2,956 |
|
На основании данных, приведенных в таблице 2, была рассчитана скорость прироста биомассы (ΔОD600 × ч-1) для обоих штаммов, которая приведена на рисунке 13.
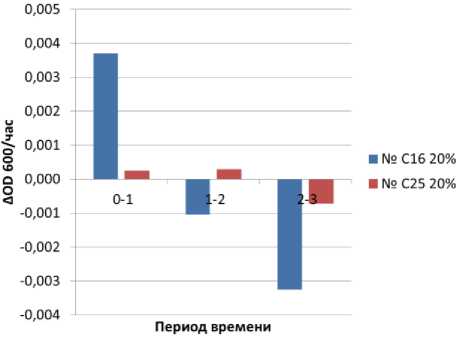
Рисунок 13. Скорость прироста биомассы (ΔОD600/ч) при ферментации питательной среды, содержащей 20% этилового спирт
Figure 13. Biomass growth rate (ΔОD600/h) during fermentation of a nutrient medium containing 20% ethyl alcohol
Как следует из рисунка 13 – дрожжи штамма С16 более интенсивно флокулируют по сравнению с дрожжами С25. Видимо этим можно объяснить более низкую бродильную активность этих дрожжей.
Заключение
В результате проведенной работы было установлено, что для оценки влияния этанола на физиологическую активность дрожжей следует использовать различные методы контроля. Так, отсутствие мертвых клеток в культуре, как показали полученные данные, не могут в полной мере объяснить метаболическую активность дрожжей в среде с этанолом. По всей видимости интенсивность этанольного стресса связана со сложными, генетически обусловленными процессами [21, 22], например, активацией развернутого белкового ответа и изменением активности ферментов ЭПР [22]. Сравнение интенсивности размножения двух штаммов спиртовых дрожжей указывают на необходимость изучения их флокуляционной активности. Кроме того, при инокуляции среды следует учитывать различия в размере клеток разных культур, которые могут существенно отличаться. Например, дрожжи штамма С16 больше по размеру клеток штамма С48 на 33%. При сравнительной оценке штаммов следует использовать только количественное определение концентрации клеток в посевном материале, а не массовую долю биомассы в нем.


