Исследование мутационного статуса гена KRAS и показателей выживаемости после циторедуктивных операций у больных с метастазами колоректального рака в печень
Автор: Каганов Олег Игоревич, Торопова Надежда Ефимовна, Швец Денис Сергеевич, Югина Оксана Васильевна, Закамова Елена Викторовна, Тетерина Юлия Юрьевна, Ткачев Максим Валерьевич, Козлов Алексей Михайлович
Статья в выпуске: 2-3 т.17, 2015 года.
Бесплатный доступ
Для выработки тактики лечения больных метастатическим колоректальным раком необходимо определить не только распространенность опухолевого процесса, но и биологическую активность самой опухоли. Мутационный статус гена KRAS опухоли имеет ключевое значение в оценке биологической активности опухоли, таким образом, может оказывать влияние на эффективность проводимого лечения и может рассматриваться в качестве прогностического фактора анализа отдаленных результатов комбинированного лечения больных метастатическим КРР.
Колоректальный рак, мутационный статус, ген kras, биологическая активность, опухоль, тактика, лечение
Короткий адрес: https://sciup.org/148102311
IDR: 148102311 | УДК: 616.351-006-089:615.849:616.15
Текст научной статьи Исследование мутационного статуса гена KRAS и показателей выживаемости после циторедуктивных операций у больных с метастазами колоректального рака в печень
Колоректальный рак (КРР) занимает третье ранговое место по заболеваемости среди мужчин и второе среди женщин [1-3]. В России заболеваемость КРР составляет 12-27 случаев на 100 тыс. [4]. Основной причиной смертности в данной группе больных является диссеминация процесса в виде отдаленных метастазов. Метастатическое поражение печени диагностируется в каждом пятом случае у больных с КРР при первом обращении и у 50-60% больных после проведения радикального хирургического лечения. Прогноз жизни онкологического больного определяется во многом характеристиками опухолевого процесса, в первую очередь, распространенностью и агрессивностью опухоли.
Основным методом лечения больных 4 стадией КРР является химиотерапия, которая
Ткачев Максим Валерьевич, врач-онколог
Козлов Алексей Михайлович, аспирант дает возможность увеличивать срок жизни данной группы больных вдвое по сравнению с таковым у тех, у кого ее не применяли. В современные схемы паллиативной химиотерапии КРР 4 стадии входят 5-фторурацил или его производные (тегафур, капецитабин), иринотекан в изолированном варианте или в сочетании с лейковорином или оксалиплатином (XELOX, FOLFIRI, FOLFOX, CAPIRI). К числу достижений в этой области относят зарегистрированные в 2004 г. препараты таргетной терапии авастин (бевацизумаб – ингибитор сосудистого эндотелиального фактора роста), эрбитукс (цетуксимаб), новый препарат панитумумаб. Последние являются моноклональными антителами, полностью идентичные человеческому IgG2, специфично связывающиеся с рецептором фактора эпидермального роста EGFR и позволившие повысить частоту объективного ответа и длительность ремиссии. Их действие приводит к ингибированию роста опухолевых клеток, индукции апоптоза, уменьшению продукции провоспали-тельных цитокинов и фактора роста сосудов, к интернализации EGFR. В ряде случаев они открывают дополнительные возможности консервативного лечения распространенных форм КРР. Эффективность лечения данными препаратами зависит от ряда факторов в том числе и от мутационного статуса гена KRAS [5-6].
Ген KRAS локализован на хромосоме 12 и кодирует небольшой внутриклеточный белок, который является ключевым компонентом сигнального каскада, регулирующего пролиферацию клеток, устойчивость к апоптозу, метастазирование и ангиогенез опухолей. Данный маркер в настоящее время используется только для определения рефрактерности к цетуксимабу при КРР. Мутация гена KRAS у больных метастатическим КРР встречается в 40-45% случаев. Исследование образца опухоли (первичной или метастатической) на выявление мутации обязательно во всех случаях до назначения препаратов моноклинальных антител к рецептору эпидермального фактора роста. Обнаружение мутаций в гене KRAS указывает на то, что препарат цетуксимаб противопоказан. Анализ эффективности проводимого лечения с учетом мутационного статуса KRAS показал достоверное преимущество применения FOLFOX-4 + цетуксимаб в группе с диким типом гена. К сожалению, в настоящее время мутационный статус гена KRAS определяют только для выбора схемы химиотерапии.
Цель работы: изучение влияния наличия мутаций гена KRAS опухоли толстой кишки на прогноз течения заболевания у больных с КРР 4 стадии после циторедуктивного лечения.
Материалы и метод. В группы исследования вошли пациенты с метастатическим КРР с множественными метастазами в печень, которым было выполнено циторедуктивное хирургическое лечение с последующим исследованием мутационного статуса гена KRAS. В I группу исследования вошло 50 пациентов, у которых при исследовании опухоли выявлен дикий тип гена KRAS. Во II группу вошло 33 пациента, у которых обнаружена мутация гена KRAS. Все больные групп исследования поступали в Самарский областной клинический онкологический диспансер (СОКОД) для хирургического лечения. Соотношение мужчин и женщин в I и II группах исследования: в группе I: мужчин – 19, женщин – 31, в II группе: мужчин – 16, женщин – 17. Средний возраст: в группе 1 – 59 лет и в группе 2 – 44 года. Локализация первичной опухоли у больных в группах представлена в табл. 1. У больных групп исследования по данным УЗИ и КТ брюшной полости были диагностированы билобарные метастазы в печени размером 2,17±0,58 см и 2,14±0,60 см (р=0,66), числом 4,05±1,30 и 4,01±1,44 (р=0,92).
Таблица 1. Распределение больных группы исследования по локализации первичной опухоли
|
Локализация первичной опухоли |
I группа |
II группа |
|
ободочная кишка |
32 |
23 |
|
прямая кишка |
18 |
10 |
|
Всего |
50 |
33 |
Таблица 2. Распределение больных 1 и 2 групп по числу метастазов КРР в печени
|
Количество метастатических очагов КРР в печени |
I группа |
II группа |
||
|
абс. |
% |
абс. |
% |
|
|
4 |
8 |
16 |
10 |
30 |
|
5 |
22 |
44 |
8 |
24 |
|
6 |
10 |
20 |
6 |
18 |
|
7 |
6 |
12 |
2 |
7 |
|
8 |
4 |
8 |
7 |
21 |
|
Всего |
50 |
100 |
33 |
100 |
Примечание: здесь и далее – критерий Пирсона 6,46; р=0,16
Пациентам обеих групп было выполнено циторедуктивное хирургическое лечение в объеме удаления первичной опухоли. Вид проведенного хирургического лечения представлен в табл. 3. В послеоперационном периоде проводилось гистологическое исследование удаленного препарата (первичной опухоли толстой киши). У всех больных была диагностирована аденокарцинома. Дифференцировка опухолевого процесса представлена в табл. 4. У пациентов групп исследования была выставлена 4 стадия КРР по системе TNM, учитывая наличие отдаленных метастазов в печень.
Таблица 3. Объем операции в I и II группах исследования
|
Объем выполненной операции |
I группа |
II группа |
|
гемиколэктоия справа |
16 |
9 |
|
гемиколэктомия слева |
2 |
2 |
|
резекция поперечно ободочной кишки |
2 |
1 |
|
резекция сигмовидной кишки |
12 |
11 |
|
резекция прямой кишки |
18 |
10 |
|
Всего |
50 |
33 |
Таблица 4. Степень дифференцировки опухоли в I и II группах исследования.
|
Степень дифференцировки опухоли |
1 группа |
2 группа |
|
G1 |
11 |
8 |
|
G2 |
22 |
13 |
|
G3 |
14 |
11 |
|
G4 |
3 |
1 |
|
Всего |
50 |
33 |
В послеоперационном периоде кроме гистологического исследования первичной опухоли проводили исследование мутационного статуса KRAS методом аппель-специфичной ПЦР в режиме реального времени. В качестве материала для анализа использовали ДНК опухолей, выделенной из ткани, фиксированной формалином и заключенной в парафин. В обеих группах исследования в послеоперационном периоде больные получали химиотерапию по схеме FOLFOX/ FOLFIRI (в качестве первой линии химиотерапии назначалась схема FOLFOX, при диагностике прогрессии заболевания на фоне проводимой терапии схема заменялась на FOLFIRI) [6]. Для оценки эффективности проводимого лечения нами была изучена безрецидивная и общая выживаемость в группах исследования.
Таблица 5. Классификация распространенности по системе TNM у больных с диагнозом КРР в 1 и 2 группах исследования
|
Стадии T |
по системе NM |
1 группа |
2 группа |
|
4 стадия |
T1N2M1 |
1 |
0 |
|
T2N0M1 |
1 |
1 |
|
|
T2N1M1 |
0 |
1 |
|
|
T3N0M1 |
1 |
1 |
|
|
T3N1M1 |
2 |
1 |
|
|
T3N2M1 |
3 |
0 |
|
|
T4N0M1 |
17 |
6 |
|
|
T4N1M1 |
13 |
16 |
|
|
T4N2M1 |
12 |
7 |
|
|
Всего |
|||
Результаты исследования. Результаты безрецидивной выживаемости в 1 и 2 группах с множественными метастазами в печени представлены на рис. 1.
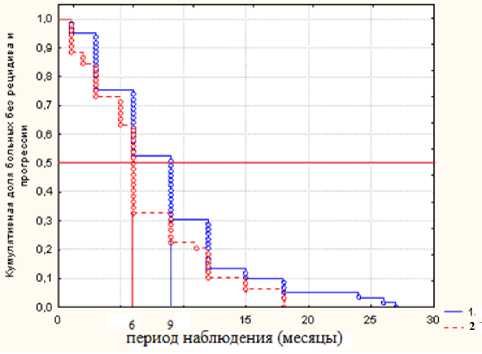
Рис. 1 . Безрецидивная выживаемость (Каплан-Мейер) у больных I и II групп с множественными метастазами КРР в печени после циторедуктивной перации
Стабилизация метастатического процесса на фоне химиотерапии была достигнута в I группе у 16 больных, во II – у 5 (р=0,002). Химиоэмболизация печени сферами с доксируби-цином проведена в 1 группе 15 больным, во 2 – 16 больным, что позволило достичь стабилизации прогрессии у 8 и 2 пациентов соответственно
(р=0,04). В 1 группе одногодичная безрецидив-ная выживаемость составила 13,5%, во 2 группе – 10,2%. В первой группе была достигнута двухлетняя выживаемость – 3,4%, в то время, как во второй аналогичный показатель равнялся нулю. Медиана безрецидивной выживаемости в 1 группе была выше, чем во 2 группе и составила 9 и 6 месяцев соответственно. Кривые безреци-дивной выживаемости в исследуемых группах различались статистически значимо (статистика логрангового критерия 2,12, р=0,05). Таким образом, у больных с диким типом гена KRAS при проведении комбинированного лечения показатели безрецидивной выживаемости были значимо выше, чем в группе больных с мутированным геном KRAS.
В случае выявления прогрессии заболевания на фоне проводимой химиотерапии в виде появления новых метастазов больных направляли на симптоматическое лечение по месту жительства. Показатели общей выживаемости в I и II группах с множественными метастазами после циторедуктивного лечения приведены на рис. 2.
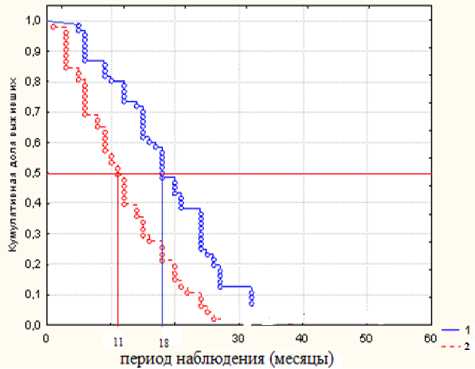
Рис. 2 . Общая выживаемость у больных (Каплан-Мейер) 1 и 2 группах с множественными метастазами КРР в печени после циторедуктивного лечения
В I группе больных КРР с множественными метастазами с диким типом гена KRAS показатели 1-, 2- и 3-летней общей выживаемости составили – 73,5%, 25,1%, 7,2%. В II группе у больных с мутированным типом гена KRAS показатели одногодичной выживаемости составили 39,6 %, двухлетней 6,3 %. Медиана общей выживаемости в I группе больных с диким типом гена KRAS достигла 18 месяцев, во II группе с мутированным типом гена – 11 месяцев. Кривые общей выживаемости в I и II группах различались статистически значимо (статистика логран-гового критерия 3,77, р=0,000).
При проведении исследования группы сравнения были сопоставимы по полу, возрасту, локализации и гистологической форме первичной опухоли, количеству и размерам метастазов в печень, способу проведенного комбинированного лечения. Результаты работы показали, что безрецидивная и общая выживаемость в группе больных КРР с диким типом гена значимо выше, чем у больных с мутированным типом гена, что было связано с эффективность проводимой химиотерапии.
Выводы: возможно мутационный статус гена KRAS может оказывать влияние на эффективность проводимого лечения и может рассматриваться в качестве прогностического фактора анализа отдаленных результатов комбинированного лечения больных метастатическим КРР.
Список литературы Исследование мутационного статуса гена KRAS и показателей выживаемости после циторедуктивных операций у больных с метастазами колоректального рака в печень
- Jemal, A. Global patterns of cancer incidence and mortality rates and trends/A. Jemal, M.M. Center, C. DeSanti, E.M. Ward//Cancer Epidemiol. Biomarkers Prev. 2010. № 19(8). Р. 1893-2907.
- Jemal, A. Global cancer statistics/A. Jemal, F. Bray, M.M. Center et al.//CA Cancer J. Clin. 2011. № 61 (2). Р. 69-90.
- Ferlay, J. Cancer incidence and mortality worldwide: IARC CancerBase/J. Ferlay, H.R. Shin, F. Bray et al.//2010. № 10 . Lyon (France): IARC; Available from: GLOBOCAN. 2008.
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2008 г.//Вестник РОНЦ им. Н.Н. Блохина РАМН. 2010. Т. 21, №2 (80) (прил. 1). 160 с.
- Крылов, Н. Паллиативное лечение больных c IV стадией рака толстой кишки/Н. Крылов, Д. Винничук//Врач. 2011. №12. С. 18-21.
- Консервативное лечение первичного и метастатического рака печени/под ред. В.А. Горбуновой. -М., Медицинское информационное агентство, 2013. 287 с.


