Исследование нуклеиновых кислот в гонадах пресноводных рыб Байкальского региона
Автор: Захарова М.А., Гомбоева С.В., Цыренов В.Ж.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Персоналии
Статья в выпуске: 2 (29), 2010 года.
Бесплатный доступ
Проведено исследование количественного содержания нуклеиновых кислот в пресноводных рыбах Байкальского региона, целью которого было изыскание перспективного источника получения низкомолеку- лярной ДНК. В выделенных препаратах были изучены биохимические характеристики, определены оценки токсичности, показавшие его безвредность. Проведена идентификация препаратов ДНК с помощью ВЭЖХ. В экспериментальных исследованиях на мышах впервые установлена анальгетическая активность выделенной ДНК
Днк, молоки пресноводных рыб, токсичность, анальгетическая активность, нук- леиновые кислоты. m
Короткий адрес: https://sciup.org/142148265
IDR: 142148265 | УДК: 641.1/.3:
Текст научной статьи Исследование нуклеиновых кислот в гонадах пресноводных рыб Байкальского региона
Сведения о способности нуклеиновых кислот повышать общую сопротивляемость организма появились уже в 80-х гг. XIX в. С каждым годом ДНК все шире используется в биологии и медицине . В настоящее время установлено, что нуклеиновые кислоты — один из важных компонентов интегрального и иммунологического гомеостаза организма [1]. Это объясняет широкий спектр общебиологических эффектов (более 10 различных феноменов) как лекарственных препаратов (нуклеоспермат натрия, деринат, ферровир), так и биологически активных добавок (БАД) к пище (ДНКаС и ДНКаВИТ, «Биостим»), созданных на основе нуклеиновых кислот. Все эти соединения обладают радиозащитным, иммуномодулирующим действием, стимулируют устойчивость организма к различным инфекциям, устраняют малокровие, повышают содержание гемоглобина, понижают возбудимость нервной системы, увеличивают мышечную силу [2]. Существуют несколько групп препаратов на основе нуклеиновых кислот: 1) препараты микробного происхождения - одним из первых получен нуклеи-нат натрия - натриевая соль низкомолекулярной дрожжевой РНК, содержащая 1,5—1,6% белка и 2% ДНК, ридостин – двуспиральная РНК, полученная из лизата дрожжей; 2) препараты животного происхождения - наиболее известным является деринат (натриевая соль низкомолекулярной нативной ДНК, полученной из молок осетровых рыб), ферровир, по-лидан, БАД к пище «Биостим» и др.; 3) синтетические препараты - представляют собой искусственно синтезированные РНК, способные стимулировать первичный и вторичный иммунные ответы [3].
Гонады лососевых, осетровых рыб и кальмаров являются основным источником получения ДНК. Несмотря на большое количество разработок в этой сфере, проблема поиска новых источников сырья остается актуальной. Гидробионты отличаются необычай- ным разнообразием по видовому составу и технологическим свойствам. Каждая группа сырья обладает не только отчетливо выраженными биологическими особенностями, но и биохимической спецификой, которая существенно варьируется в зависимости от многих причин (пола, возраста, периода года и т.д.)[4]. Учитывая положительное воздействие ДНК на организм человека, перспективным является изыскание дезоксирибонуклеиновой кислоты в других видах рыб. В данной работе проведено исследование содержания нуклеиновых кислот в пресноводных и эндемичных видах рыб Байкальского региона.
Материалы и методы
Объектами настоящего исследования послужили молоки 12 пресноводных рыб Байкальского региона, которые были выловлены в осенне-весенний период 2008-2009 гг. Сроки хранения замороженного сырья при температуре -18º не превышали 6 месяцев (ТУ 15-01-960-88). Количественное содержание ДНК в сырье определяли по методу Дише, содержание РНК по методу Мейбаума, в препарате – по разнице поглощения азотистых оснований (при 270 и 290 нм) полученных в результате гидролиза ДНК 0,5%-ной хлорной кислотой при 100-105˚С. Определение химического состава молок проводили по общепринятым методикам [1]. Для получения низкомолекулярной ДНК из мороженых молок 34 стадии зрелости использовали метод, разработанный учеными ТИНРО-центра (Пат. № 915446), который включает две стадии – экстракцию водным раствором NaCl и осаждение этиловым спиртом.
ВЭЖХ анализ проводили на хроматографе Agilent 1100 (США) с ультрафиолетовым детектором переменной частоты, установленным на 260 нм. Хроматографию осуществляли на колонке zorbax eclipse XDB – C8 4,6×150 mm 5-micron. В качестве подвижной фазы использовали 0,2 М фосфатный буфер, pH 8,0. Скорость подачи элюента составляла 1,5 мл/мин при температуре колонки 20°С. В течение первых 5 минут элюция была изо-кратической, затем в течение 10 минут следовал линейный градиент (85% фосфатного буфера и 15% воды бидистиллированной). Затем подвижная фаза вновь устанавливалась на 100% фосфатном буфере в течение 5 минут. По окончании каждого анализа колонку уравновешивали 200 мкл бидистиллированной воды. При анализе биологических образцов использовали метод внешнего стандарта. Стандартом сравнения послужил маркер ДНК pBR 322 /Alu 1 (НПО «СибЭнзим», Россия). Исследуемые препараты были приготовлены в подвижной фазе в концентрации 0,2 мг/мл, объем вводимого раствора 20 мкл. Все реактивы фильтровали через фильтр (5 мкм).
Экспресс-оценку токсичности проводили с использованием инфузорий Tetrahy-mena pyriformis [5]. Острую токсичность и анальгетическую активность изучали в Пермской государственной фармацевтической академии на белых мышах весом 20±1,0 г одного возраста, полученных из питомника одновременно и прошедших карантинный режим вивария, без внешних признаков заболеваний. Исследуемые препараты ДНК вводили животным перорально с помощью зонда в различных дозах. Острую токсичность изучали по методике Г.Н. Першина, анальгетическую активность определяли методом «уксусных корчей» на серии по 5 мышей [6].
Результаты и их обсуждения
Анализ полученных данных по содержанию нуклеиновых кислот (табл. 1) показал, что наибольшее содержание ДНК (более 3,0 %) обнаружено в молоках широколобки, омуля, окуня и тайменя. По данным результатам был определен выбор гонад для выделения низкомолекулярной ДНК. Это основано на прямой зависимости процента выхода препарата ДНК от содержания ДНК в молоках различных видов рыб [7]. Остальные виды молок рыб явились неперспективными (содержание ДНК менее 3%).
Таблица 1
Количественное содержание нуклеиновых кислот в молоках пресноводных рыб Байкальского региона, среднее ±σ
|
Молоки рыб |
Содержание ДНК, % |
Содержание РНК, % |
|
Широколобка |
6,27± 0,56 |
1,65± 0,093 |
|
Омуль |
3,75 ± 0,264 |
0,67 ± 0,035 |
|
Окунь |
3,73 ± 0,178 |
0,85 ±0,041 |
|
Таймень |
3,68±0,183 |
- |
|
Елец |
2,56± 0,125 |
0,52± 0,039 |
|
Карась |
2,45±0,116 |
- |
|
Язь |
2,09 ± 0,102 |
1,18 ± 0,067 |
|
Хариус |
1,82±0,092 |
0,2±0,014 |
|
Плотва |
1,4±0,085 |
0,09 |
|
Налим |
1,25±0.076 |
0,5±0,035 |
|
Ленок |
1,18±0,086 |
0,09±0,003 |
|
Лещ |
0.96 ±0,058 |
0.16 ± 0,008 |
Примечание. «-» - не исследованы
Из общего химического состава гонад (табл. 2) можно видеть, что они являются потенциальными поставщиками ценных белков [4]. Содержание белка выше у пресноводных (морские: кета 8,7%, треска 11,9%), но состав его существенно не отличается от состава белка морских рыб.
Таблица 2
Общий химический состав молок пресноводных видов рыб
|
Вид рыб |
Содержание, в % |
|||||
|
влага |
белок |
зола |
ДНК |
РНК |
другие |
|
|
Омуль |
75,8±1,5 |
16,5±0,9 |
2,7±0,2 |
3,75±0,264 |
0,67±0,035 |
0,58 |
|
Окунь |
79,3±1,4 |
13,7±0,81 |
2,02±0,16 |
3,73±0,178 |
0,85±0,041 |
0,40 |
|
Широколобка |
77,8±1,7 |
14,28±0,76 |
- |
6,27± 0,56 |
1,65±0,093 |
- |
|
Таймень |
68,1±1,2 |
24,3±0,98 |
2,5±0,17 |
2,09±0,16 |
1,18±0,12 |
1,83 |
|
Хариус |
80,3±1,45 |
14,83±0,89 |
1,95 |
1,82±0,092 |
0,2±0,014 |
0,9 |
Общее содержание влаги и золы в молоках пресноводных и морских рыб (кета 78,5%, сельдь 71,5%, 2,6%, треска 80,3%, 1,3%) определено приблизительно. Основные вещества могут колебаться в следующих пределах: вода — от 46,1 до 92,9%, азотистые вещества — от 5,4 до 26,8%, минеральные вещества — от 0,1 до 3%. Химический состав не является постоянным, это существенно зависит не только от вида и физиологического состояния рыбы, но и от ее возраста, пола, места обитания, времени лова и условий окружающей среды.
Выделенная низкомолекулярная ДНК представляет собой аморфный порошок светло-кремового цвета, растворимый в воде при нагревании и не растворимый в органических растворителях. Содержание нуклеиновых кислот в препарате достигает 68 – 75 %, молекулярная масса (М.м.), на примере ДНК омуля - 380 кДа. Установлено, что для получения биологически активного продукта пригодна и низкомолекулярная ДНК (М.м. 200500 кДа) [8].
Для подтверждения полученных препаратов ДНК использовали метод высокоэффективной жидкостной хроматографии. На рисунке 1 показан профиль ВЭЖХ стандартного ДНК маркера на хроматографе Agilent 1100.
D s «о
Oj6 од 1 15
Время, мин
к
Рис. 1. Хроматограмма стандартного ДНК маркера. На колонку С8 5μ нанесено 20 мкл раствора ДНК маркера pBR 322 /Alu 1 (НПО «СибЭнзим», Россия)
§ 8
s я u 8 о
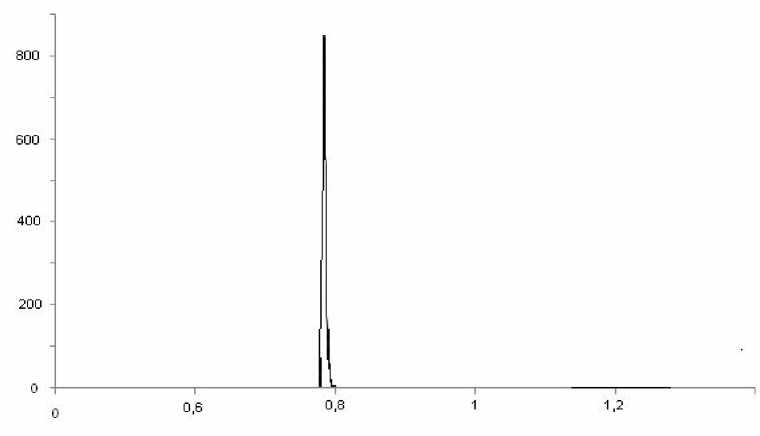
Время, мин
Рис. 2. Хроматограмма солевого экстракта ДНК молок широколобки. На колонку С8 5μ нанесено 20 мкл исследуемого раствора ДНК
Идентификацию пиков определяемых веществ на ВЭЖХ осуществляли по времени удерживания и спектральным отношениям (260 нм) с соответствующими параметрами хроматограмм стандартного ДНК маркера. На рисунках 2 и 3 показаны профили препаратов ДНК молок пресноводных рыб Байкальского региона.
5 600
g 400.
О Ч
О"
К
200 -
0 0.6 0,8 11,2
Время, мин
Рис. 3. Хроматограмма солевого экстракта ДНК молок омуля. На колонку С8 5μ нанесено 20 мкл исследуемого раствора ДНК
Исследование спектральных характеристик низкомолекулярных ДНК различного происхождения позволяет говорить о практически полном сходстве состава азотистых оснований в нуклеиновых кислотах исследованных объектов. Совпадение пиков при одних и тех же длинах волн (260 нм) свидетельствует о весьма близком количественном соотношении азотистых оснований в ДНК исследованных объектов, а различные величины пиков соответствуют установленной разнице в количественном содержании ДНК в препаратах.
При оценке безвредности препарата ДНК с использованием Tetrahymena pyriformis наблюдали наличие роста инфузорий, отсутствие деформации и угнетения подвижности. В результате чего можно сделать вывод о нетоксичности выделенных ДНК. По приросту инфузорий можно говорить, что при добавлении в среду ДНК происходит оптимизация метаболических процессов Tetrahymena pyriformis, что способствует лучшему усвоению питательных компонентов и ускорению роста. Такое действие обеспечивается содержанием в исследуемых веществах олигонуклеотидов и нуклеиновых кислот. Преимуществом использования инфузорий является большое сходство их токсико-биологической реакции с аналогичной реакцией высших организмов, высокая интенсивность обмена веществ, быстрая смена поколений (2-4 раза в сутки), что позволяет учитывать и возможное воздействие продукта на генетический аппарат клетки [5].
Опыты по определению острой токсичности проводили на белых мышах (ГФ), исследуемые препараты вводили однократно в возрастающих дозах, вызывающих гибель животных от 0 до 100%. В результате исследований установлено, что в соответствии с классификацией по К.К. Сидорову препараты ДНК относятся к 4 классу токсичности, являются малотоксичными.
Анальгетическую активность изучали методом «уксусных корчей», химическим болевым раздражением мышей [6]. Исследуемые препараты вводили перорально за час до инъекции альгогена. Анальгетический эффект оценивали по уменьшению количества корчей в процентах к контролю. Критерием эффективности при скрининге является снижение болевой реакции не менее чем на 50%. По результатам эксперимента была определена высокая анальгетическая активность у ДНК широколобки и омуля. Увеличение латентного периода от введения альгогена у ДНК широколобки составило 7,2 мин, у омуля 4,0 мин в сравнении с контролем 2,8 мин. Среднее количество корчей после введения уксусной кислоты мышам составило у ДНК широколобки 7 корчей, у омуля 13,6 корчей, напротив контроля - 18,4 корчей.
Таблица 4
Сравнение с анальгетической активностью фармацевтического препарата и ДНК из молок широколобки
|
Соединение |
Доза, мг/кг, |
Количество корчей |
Уменьшение корчей ,% |
|
Метамизол-натрия |
50 |
12,2±1,57 |
52,5 |
|
ДНК широколобки |
50 |
4,8±0,58 |
78,37 |
По результатам данного опыта провели дополнительные исследования анальгетической активности препарата ДНК широколобки в разных дозах (30, 40, 50 мг/кг). При сравнении активности лекарственного препарата (анальгина) с ДНК широколобки в одинаковой дозе выявлена больше анальгетическая активность у последнего.
Выводы
Проведенные исследования показали, что молоки широколобки, омуля, окуня и тайменя по содержанию ДНК превосходят остальных видов пресноводных рыб в 3-4 раза. Общий химический состав молок показал, что содержание белка выше у пресноводных (таймень 24,3%, омуль 16,5%) по сравнению с морскими (кета 8,7%, треска 11,9%)
Идентификацию пиков определяемых препаратов ДНК провели по времени удерживания, они совпали в поле допуска со стандартом. Спектральные характеристики свидетельствуют об одинаковом соотношении азотистых оснований для всех исследованных рыб.
Впервые выделен препарат ДНК из молок пресноводных видов рыб Байкальского региона . Содержание нуклеиновых кислот в препарате достигает 68 – 75 %, М.м. ДНК омуля - 380 кДа., данная молекулярная масса входит в пределы биологической активности (200 -500 кДа).
Экспресс-оценка токсичности с использованием инфузорий Tetrahymena pyriformis показала нетоксичность выделенных ДНК. По определению острой токсичности препараты ДНК относятся к 4 классу токсичности, являются малотоксичными.
В ходе эксперимента была выявлена высокая анальгетическая активность ДНК ши-роколобки и омуля. По данным результатам оформлена заявка на патент.


