Исследование процесса формирования пульсовых сигналов лучевых артерий
Автор: Сторчун Е.В., Бороноев В.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технические науки
Статья в выпуске: 5 (50), 2014 года.
Бесплатный доступ
Статья посвящена исследованию процесса формирования пиковых значений пульсовых сигналов лучевых артерий человека в приближении эквивалентного плоского перемещения структурных элементов биообъекта. Экспериментальные результаты получены с использованием устройства, состоящего из пьезоэлектрического преобразователя пульсового сигнала и тензорезистивного датчика силы прижима к зонам регистрации. Диаметр пелота устройства составлял (8±0,1) мм. Результаты анализа показали, что в диапазоне прижима к поверхности зоны до 2 Н длина участков артерий, формирующих пульсовые сигналы, не превышала 11 мм, что находится в пределах размеров зон, принятых в восточной медицине, и дает основание полагать отсутствие взаимного влияния пульсовых колебаний разных зон лучевых артерий при синхронной регистрации сигналов.
Датчики пульса, лучевая артерия, пульсовый сигнал
Короткий адрес: https://sciup.org/142142953
IDR: 142142953 | УДК: 519.65
Текст научной статьи Исследование процесса формирования пульсовых сигналов лучевых артерий
Эффективность диагностики функционального состояния биологических объектов, отличающихся сложностью связей и многомерностью состояний, существенно повышается при условии синхронной регистрации и анализе различных биофизических сигналов. Среди последних важное место занимают пульсовые колебания артериального давления крови, на которые ориентирована пульсовая диагностика. В последнее время большое внимание уделяется развитию методологии пульсовой диагностики по канонам восточной медицины, основанной на синхронной регистрации и анализе пульсовых колебаний в трех зонах дистальных отделах лучевых артерий человека [1]. Для этих целей был предложен ряд конструкций устройств, совмещающих первичные преобразователи сигналов. Явление взаимного влияния каналов через общие элементы устройств исследовалось в работе [2], однако плотность расположения преобразователей вдоль артерий создает неопределенность в оценках возможного взаимного влияния пульсовых колебаний разных зон через структуры биообъекта. Исследование этой проблемы предусматривает моделирование процесса формирования сигналов в биотехнической системе пульсометрии.
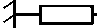
Исследование проводилось для случая регистрации силы, развиваемой пульсовыми колебаниями лучевой артерии на поверхности тела человека, на основе модели, представленной на рисунке 1 [3].
Поверхность тела
Z 2
F o ( t )

Z 1
Z d

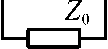
Рис. 1. Модель биотехнической системы пульсометрии: F0(t)~ сила, создаваемая пульсовыми колебаниями давления крови в артерии; Z0 , Z 1 , Z 2 , Z d - механические импедансы артериальной стенки, мягких тканей, окружающих артерию, и преобразователя соответственно
В процессе исследования была принята гипотеза, что часть силы FP прижима преобразователя к зоне регистрации сигнала, воспринимаемая элементами модели (рис. 1), равна 1| F p и остается постоянной при различных прижимах датчика.
В процессе моделирования было также принято Z2 >> Zt , что приводит к несимметрии пульсовых колебаний артерии относительно ее положения в конце диастолы.
Целью работы было моделирование пиковых значений силы Fd на входе преобразователя, которые определяются низкочастотными составляющими спектра пульсовых колебаний. Принимая во внимание диапазон частот спектра сигналов [4, 5], а также механические свойства артерий [6] мягких тканей [7], в модели учитывали только упругие составляющие механических импедансов элементов.
Пульсовые колебания артерий моделировались эквивалентным плоским (поршневым) перемещением стенки:
rV x"
V где r - радиус артерии; ---- относительное пульсовое изменение объема артерии.
V
Жесткость участка артерии K 0 определялась по упругой характеристике, полученной путем усреднения кривых 2 и 3 [8] (рис. 2).
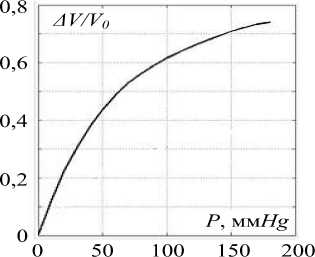
Рис. 2. Упругие характеристики артерий: А V, V 0 - изменения и начальный объем артерии; P - трансмуральное давление
Значение К0 для заданного пульсового давления (в линейном приближении) определя- лось соотношениями [9]:
K = 2-,-L-P, D.b^, b ' V у -У
, b^Vd— 0
1 V 0
0 D 1 b 1 2 V 0
где V 0 , V d , V s - объемы участка артерии, соответствующие начальному Р =0 (см. рис. 2), диастолическому и систолическому значениям артериального давления крови; L - длина участка артерии; ЛР = P s - P d ; Ps, P d - систолическое и диастолическое значения артериального давления крови.
В традициях восточной медицины пульсовый сигнал анализируется при различном внешнем надавливании, что изменяет характеристики биообъекта в зонах регистрации. В частности, изменения жесткости участка артерии моделировались зависимостью
Kо = a + b(Fd-FFp) + c(Fd-FFp)2, Fd=d i L-P,, где a ,b, c - коэффициенты аппроксимирующего значения К0 полинома, рассчитанные по упругим характеристикам артерий (см. рис. 2); Fd, FP - сила растяжения участка артерии и прижима преобразователя к поверхности зоны регистрации пульсового сигнала, соответственно; d1, L0 - диастолический диаметр и длина участка артерии; п - часть FP, действующая на К0 и К1 (см. рис. 1), а изменяющаяся длина участка артерии L - L=L0(1+s• FP); s - параметр, характеризующий изменение L в зависимости от FP.
Учитывая нелинейный характер упругих характеристик артерий, аппроксимацию значений проводили для расчетных величин К 0, полученных с шагом прироста трансмурального давления 10 мм Hg.
Величина К 1 определялась зависимостью Kx = K 10 + Т| - Р -Fp , где К 10 - жесткость элемента модели при F P = 0; в - коэффициент, характеризующий увеличение жесткости с ростом F P [10].
Входной сигнал датчика, с учетом принятых допущений, определялся соотношением (см. рис. 1)
F = (F01 + f02 )--KK d ------;
d 01 02 K 1 K d K 0 (K 1 K d )
F oi = L. (ds( F d - n F ) ) • P s - dd(F d - FFp ) • P d ) ;
F КK 0' ^F^,-F\Fp) ,
K 02 K 1
где dd , ds - диаметры артерии, соответствующие диастолическому P d и систолическому Ps значениям артериального давления крови, L - длина участка артерии, формирующего пульсовый сигнал, 5 d - пульсовые изменения диаметра артерии.
Зависимости dd(Fd-v\F p ) , ds(F d -FFp) и ( d(Fd -vF) рассчитывались для каждого обследуемого в зависимости от измеренных показателей артериального давления крови, изменяющихся в процессе имитационного моделирования диаметра артерии, упругой характеристики артерии и аппроксимировались полиномами третьего порядка.
Параметры модели п и в определялись методом итераций по двум значениям Fd1 и Fd2 , соответствующим начальным величинам FP1, F P2 . Для значения Fd1 (~ 43Д0 " 5 Н) в предположении FP= 0 и принятом начальном значении п определялась величина в по формуле:
K 10 F Kd Fd 1 (Kd K 01 ) Fd 1 Kd K 01
р =---------------------------------------------------,
Fp1 Fd1 (Kd K01) F Kd где AF F Fs-Fd, Fs = d2 • Lo • Ps; d2, Ps - систолические значения диаметра артерии и давления крови; К01= К0 (1), параметр Кю, по ранее полученным результатам, составлял (40-70) Н/м в зависимости от зоны регистрации пульсового сигнала.
Для FP2 рассчитывались значения K o (1), K 1 (3), dd , ds , 5 d и величина Fd (2). Процедура итераций (параметр п) продолжалась до равенства расчетного F d и экспериментального F d2 значений.
В процессе имитационного моделирования диаметр артерии изменялся в диапазоне значений (1,8-3,0ф10 " 3 м [11-14].
Экспериментальные исследования проводились с помощью устройства с последовательно (механически) соединенными преобразователями пьезоэлектрического (Fd) и тензо- резистивного (FР) типов. Погрешность калибровки каналов не превышала ±0,2%, а измерения Fd и FР ±0,28%, нелинейность амплитудной характеристики канала измерения FР в диапазоне (0 3) Н не превышала ±3,2%, а Fd в диапазоне (0–0,196) Н – ±2,9%. Жесткость тензорезистивного датчика (устройства) составляла (5350±235) Н/м, масса узла пьезоэлектрического преобразователя (23 ±1)·10-3 кг. Динамическая погрешность устройства на частоте 10 Гц не превышала ±1,7%, а 20 Гц – ±6,6% (степень успокоения 0,059). Верхняя граничная частота рабочего диапазона частот устройства составляла (31,6±0,5) Гц (уровень 1,3), постоянная времени электрической стороны пьезоэлектрического датчика была равна (4± 0,2) с (нижняя граничная частота (0,04±0,002) Гц, уровень 0,7). Диаметр пелота пьезоэлектрического датчика составлял (8 ± 0,1). Показатели артериального давления крови измерялись методом Рива-Роччи-Короткова.
В процессе моделирования диаметр артерии изменялся в указанном выше диапазоне значений, а величина L 0 – (2-8)·10-3 м ввиду индивидуальной неопределенности этих характеристик. Критерием моделирования было минимальное значение среднего квадратического отклонения расчетных и экспериментальных значений F d для выбранных упругой характеристики, диаметре и начальной длине участка артерии L 0 . Параметр s определялся из условия минимального значения указанного отклонения.
Исследован процесс регистрации пульсовых сигналов в 7 зонах лучевых артерий левой руки (5 человек обоего пола в возрасте (18-28) лет). Дистальная зона ЦОН (по канонам тибетской медицины) расположена в углублении между дистальным концом лучевой кости и его диафизом [1], а две другие (КАН, ЧАГ) проксимально, с интервалом ~ 13·10-3 м.
Полученные результаты иллюстрированы данными таблицы для случая мужчины в возрасте 23 года, показатели артериального давления 120/75 ммHg, пульс 59 мин-1.
Таблица
Значения параметров L 0 и s в различных зонах регистрации пульсовых сигналов лучевых артерий
|
dd , мм |
ЦОН |
КАН |
ЧАГ |
|||
|
L 01 , мм |
s 1 , 1/Н |
L 02 , мм |
s 2 , 1/Н |
L 03 , мм |
s 3 , 1/Н |
|
|
1,8 |
5 |
0,18 |
7 |
0,22 |
5 |
0,17 |
|
3,0 |
3 |
0,2 |
6 |
0,215 |
3 |
0,11 |
Полученные экспериментальные и расчетные значения F d для этого случая показаны на рисунке 3, где значки соответствуют экспериментальным, а линии – расчетным результатам.
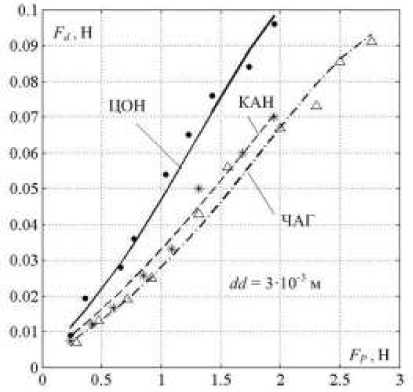
Рис. 3. Зависимость экспериментальных и расчетных пиковых значений пульсового сигнала F d от прижима датчика силы F Р к поверхности зоны регистрации
Максимальное значение FР определялось минимальной положительной величиной К0, вследствие чего зависело от зоны регистрации сигнала. Экспериментальные значения Fd , соответствующие отрицательным величинам К0 , не учитывались. Пульсовые сигналы, при условии равенства FР, также зависели от зоны регистрации.
Наибольшее отличие экспериментальных и расчетных величин F d наблюдалось при малых значениях F Р , не превышающих 32%.
Модельные оценки длины участков артерии при максимальных значениях F Р , пульсовые колебания которых определяют сигналы на поверхности зоны регистрации, зависели, помимо прочего, от диаметра и жесткости артерии и не превышали 11·10-3 м.
Проведенное исследование подтвердило ожидаемый результат: длина участка лучевой артерии, формирующего пульсовый сигнал на поверхности зоны, помимо иных факторов, зависит от диаметра и жесткости артерии. Наряду с этим полученные результаты дают основание предполагать отсутствие взаимного влияния пульсовых колебаний разных зон лучевых артерий при синхронной регистрации сигналов по канонам восточной медицины. Оценки длины участков лучевой артерии, которые определяют пульсовые сигналы на поверхности тела, не превышают длины указанных зон (~13·10-3 м).


