Исследование противовирусной активности ферментативных гидролизатов белков с обоснованием возможности их использования в составе специализированной пищевой продукции
Бесплатный доступ
Пептиды, выделенные из ферментативных гидролизатов иммунокомпетентных органов птицы или молозива коров представляют большой интерес в качестве противовирусных средств. Целью исследований является оценка влияния пищевых пептидов гидролизата молозива коров и фабрициевой сумки цыплят-бройлеров на трансдукцию вирусов в геном, проникновение лентивирусных джезикул в клетку и возможность их использования в составе пищевых продуктов функционального назначения. В качестве модельного объекта использованы клеточные линии C6 (ATCC CCL-107™) и HEK 293T (ATCCCRL-3216™). Оценку интернационализации лентивируса в геном клетки и взаимодействия с рецепторами для проникновения в мембрану осуществляли методом проточной цитометрии. Статистический анализ данных проводили с помощью алгоритмов one-way ANNOVA и two-way ANNOVA. Установлена концентрация ферментативного гидролизата, при которой за 48 часов погибает 50 % вирусных клеток, для ферментативного гидролизата фабрициевой сумки составляет 35,09 % (R2 = 0,9262), для гидролизата молозива коров - 41,05 % (R2 = 0,9267). Эффективность трансдукции вируса в геном клетки в присутствии ферментативного гидролизата фабрициевой сумки в сравнении с контролем уменьшилась в 4,1 раза, ферментативного гидролизата молозива коров - в 3,6 раза. В присутствии ферментативного гидролизата фабрициевой сумки и молозива коров эффективность проникновения лентивирусных джезикул в мембрану клетки при температуре 37 °С ниже в 3,3 и 3,1 раза. Полученные данные открывают возможность использования гидролизатов молозива и фабрициевой сумки для создания пищевых продуктов с противовирусными свойствами.
Пептиды, молозиво коров, фабрициева сумка цыплят-бройлеров, трансдукция вирусов в геном, проникновение лентивирусных джезикул в клетку
Короткий адрес: https://sciup.org/147240825
IDR: 147240825 | УДК: 636.03 | DOI: 10.14529/food230212
Текст научной статьи Исследование противовирусной активности ферментативных гидролизатов белков с обоснованием возможности их использования в составе специализированной пищевой продукции
Постоянно растущие сообщения о вирусной резистентности, возникновении и повторном возникновении вирусных эпидемий заставляют научное сообщество постоянно искать новые биомолекулы с противовирусным потенциалом. Этот поиск включает в себя множество различных подходов, и использование противовирусных пептидов представилось интересной альтернативой. Несмотря на то, что количество антимикробных пептидов с противовирусной активностью все еще невелико, они уже демонстрируют огромный потенциал для превращения в фармацевтически доступные противовирусные препараты, биологически активные добавки и пищевые продукты с противовирусной активностью [1]
Пептиды, как правило, получают в результате ферментативного гидролиза пищевого белка. Такие ферментативные гидролизаты белка обладают высокой биологической активностью, не токсичны, что позволяет считать их перспективными для включения в состав пищевых продуктов различной функциональной направленности [2].
Авторы [3] синтезировали четыре вида пептидов на основе спирали ACE2, а также оценили противовирусную активность полученных пептидов путем заражения клеток Vero E6 аутентичным SARS-CoV-2, компетентным к репликации (US_WA-1/2020). NYBSP-1 был наиболее эффективным, пре- дотвращая полное формирование цитопатиче-ских эффектов (CPE) при IC100 17,2 мкм. NYBSP-2 и NYBSP-4 также предотвращали образование индуцированного вирусом CPE с IC100 около 33 мкм.
Большинство современных противовирусных препаратов направлены на ингибирование специфических вирусов. Так, пептид Темпорин L (TL) ингибирует активность вирусов герпеса, парамиксовирусов, вируса гриппа и коронавирусов, включая SARS-CoV-2, и имеет низкую цитотоксичность [4].
Доказана противовирусная активность пептидов, полученных из парагриппа F, которые ингибирует как вирусы парагриппа, так и вирусы Nipah [5]. Авторами [6] синтезирован пептид – ингибитор парамиксовирусов. Из листьев Euphorbia hirta выделена пептидная фракция с высоким противовирусным эффектом против вируса Коксаки A13, вируса Коксаки A20 и энтеровируса C99 (EV-C99) с IC50 < 2,0 мкг/мл и селективным индексом ≥ 81. EV-C99 [7].
Многие пептиды ингибируют проникновение вирусов в оболочке в клетки, при этом некоторые из этих пептидов ингибируют множество неродственных вирусов [8].
Пептиды, обладающие противовирусной активностью, на примере вируса гриппа можно разделить на три основные группы. Первая – пептиды, блокирующие проникновение, такие как Flupep, которые взаимодействуют с гемагглютинином гриппа, блокируют его связывание с клетками-хозяевами и предотвращают слияние вирусов. Вторая группа пептидов проявляет вирулицидную активность, разрушая вирусные оболочки, например, ме-литтин. Третья – пептиды взаимодействуют с вирусным полимеразным комплексом и действуют как ингибиторы вирусной репликации [9, 10].
По данным [11] оздоровительный эффект биоактивных пептидов формируется за счет антиоксидантного, антигипертензивного, ан-титромботического, иммуномодулирующего, противомикробного, противоаллергического, противовоспалительного и другого действия.
Высокую противовирусную и противо-микробную активность проявляют пептиды, выделенные из иммунокомпетентных органов сельскохозяйственных животных, птиц, в частности, фабрициевой сумки цыплят-бройлеров и продовольственного сырья с иммуномодулирующими и бактериостатическими свойствами, в частности, молозива коров [12].
Биологическая активность молозива коров возрастет в результате ферментативного переваривания in vitro и in vivo , повышается количество биологически активных пептидов [13].
Целью исследований является оценка влияния пептидов гидролизата молозива коров и фабрициевой сумки на трансдукцию вирусов в геном, проникновение лентивирус-ных джезикул в клетку и возможность их использования в составе пищевых продуктов функционального назначения.
Объекты и методы исследований
В качестве объектов исследования использованы пепсиновые гидролизаты:
-
– молозива коров (отобранное через 4 часа после отела (агрокомплекс Аверино, Свердловская область)), полученный по следующей технологии: удаление жировой фракции центрифугированием при 3900 об/мин в течение 10 минут на центрифуге СМ-12-06 (TAGLER, Россия); введение фермента пепсина (КФ 3.4.23.1) (Самсон-Мед, Россия) в количестве 0,15 % от массы молозива на приготовленном фосфатно-буферном растворе при рН 2,0; гидролиз в течение 12 часов при температуре 40 °С; повышение температуры до 75 °С для инактивации фермента;
-
– фабрициевой сумки цыплят-бройлеров 35-дневного возраста (птицефабрика «Первоуральская»), полученный по следующей тех-
нологии: промывка сырья проточной водой в течение 10 мин при температуре воды 16– 18 °С; куттерование в течение 3 мин при частоте вращения ножей 2400 об/мин; гомогенизация при скорости вращения насадки 600 об/мин при температуре 4 °С в течение 60 мин. Измельченную фабрициеву сумку смешивали с дистиллированной водой в соотношении 1:3. Полученную массу нагревали до температуры оптимума активности фермента пепсина (40 °С) и вносили фермент пепсин (КФ 3.4.23.1) (Самсон-Мед, Россия) в количестве 0,15 % от основного сырья на фосфатнобуферном растворе с рН 2,0, гидролиз в течение 6 ч, повышали температуру до 75 °С для инактивации фермента.
Концентрация полипептидов, содержащихся в пепсиновых гидролизатах молозива коров и фабрициевой сумки цыплят-бройлеров представлена в таблице.
В качестве модельного объекта для оценки влияния пептида на трансдукцию вирусов в геном и проникновение лентивирусных джезикул в мембрану клетки использованы клеточные линии C6 (ATCC CCL-107™) и HEK 293T (ATCCCRL-3216™).
Для сборки лентивирусных частиц клетки HEK 293T рассаживали в чашку Петри диаметром 100 мм (Eppendorf, Германия) с культуральной средой DMEM (Gibco, США). По достижении конфлюэнтности 65–70 % клетки были трансфецированы плазмидами pLenti6-GFP (Addgene #35637), psPAX2 (Addgene # 12260), pVSV-G (Addgene #138479) в количестве 7 мкг, 9 мкг и 15 мкг соответственно для сборки лентивирусов. Затем культуральная среда была заменена на 3 мл OPTI-MEM (Gibco, США). Далее клетки помещались в CO 2 -инкубатор на 30 минут. За это время были подготовлены пробирки со смесью pLenti6-GFP, psPAX2, pVSV-G, OPTI-MEM и TurboFect (Invitrogen, США), OPTI-MEM). Пробирки инкубировали при комнатной температуре в течение 10 минут. Далее содержимое пробирок смешивалось и тщательно ре-суспендировалось, и инкубировалось при комнатной температуре в течение 15 минут. После во флаконы с HEK293T добавлялось содержимое пробирок и флаконы помещались в инкубатор на 12 часов. Затем среда заменялась на культуральную среду. Через 48 часов среда собиралась в отдельную пробирку и была пропущена через фильтр 0,45 µм. Затем фильтрат был центрифугирован в центрифуге
Концентрация полипептидов, содержащихся в пепсиновых гидролизатах молозива коров и фабрициевой сумки цыплят-бройлеров
|
Пепсиновый гидролизат молозива коров |
Пепсиновый гидролизат фабрициевой сумки цыплят-бройлеров |
||
|
условное обозначение пептида |
концентрация пептида, мг/мл |
условное обозначение пептида |
концентрация пептида, мг/мл |
|
RRМ1 |
0,92 |
RRФ1 |
0,98 |
|
RRМ2 |
2,25 |
RRФ2 |
0,141 |
|
RRМ3 |
1,75 |
RRФ3 |
1,545 |
|
RRМ4 |
1,54 |
RRФ4 |
2,612 |
|
RRМ5 |
1,09 |
RRФ5 |
1,665 |
|
RМ(1) |
2,49 |
RФ(1) |
1,132 |
|
RМ(2) |
2,08 |
RФ(2) |
0,751 |
|
MpRМ1 |
1,13 |
MpRФ1 |
0,457 |
|
mpRМ2 |
0,87 |
mpRФ2 |
0,337 |
Optima XPN (Beckman Coulter, США) при ускорении 100000g в течение 2-х часов и температуре 4 °С. Далее надосадочная убиралась, и осадок в виде лентивирусных частиц растворяли в 1x PBS (pH=7,4) и поместили в морозильную камеру –80 °С.
Оценку интернационализации лентивиру-са в геном клетки и взаимодействия с рецепторами для проникновения в мембрану осуществляли методом проточной цитометрии.
Результат статистической обработки ингибирующей дозы 50 % представлен в виде нелинейной регрессии. Статистический анализ данных проводили с помощью алгоритмов one-way ANNOVA и two-way ANNOVA. Достоверным считалось различие значение p<0,05.
Результаты исследований. Установлена концентрация ферментативных гидролизатов, при которой через 48 часов инкубирования погибает 50 % вирусных клеток. Это значение для ферментативного гидролизата фабрициевой сумки составляет 35,09 % (R2 = 0,9262), для гидролизата молозива коров – 41,05 % (R2 = 0,9267), которое и использовалось в дальнейших экспериментах (рис. 1).
Гибель клеточных линий С6 при культивировании отмечается при концентрации гидролизата фабрициевой сумки (ГФС) в 12 %, жизнеспособность клеток составляет 97 %. Для гидролизата молозива (ГМ) жизнеспо- собность клеточных линий С6, равная 97 %, достигается при 20 % его концентрации.
Трансдукция лентивирусных частиц в геном клетки показала наличие эффекта от ферментативных гидролизатов, наблюдаемого как уменьшение количества трансдуцирован-ных клеток по наличию в них экспрессии зеленого флюоресцентного белка (GFP). Морфология клеток не была изменена по полученным изображениям с флуоресцентного микроскопа, что подтверждает достоверность получаемых данных. На рис. 2 представлены изображения трансдуцированных клеток линии C6 в контрольном образце (А – культуральная среда, В – присутствии ГФС, С – присутствие – ГМ) (масштаб 200 мкм).
На рис. 3 показана эффективность проникновения лентивирусных джезикул в геном клетки в присутствии гидролизатов фабрициевой сумки и молозива коров.
Эффективность трансдукции лентивирус-ных частиц в геном клетки в присутствии ферментативного гидролизата фабрициевой сумки в сравнении с контролем уменьшилась в 4,1 раза, ферментативного гидролизата молозива коров – в 3,6 раза (рис. 4 и 5).
Таким образом, можно свидетельствовать о потенциальном антивирусном эффекте исследуемых ферментативных гидролизатов. Полученные результаты позволяют утверждать, что пепсиновые ферментативные гидролизаты молозива коров и фабрициевой сум-
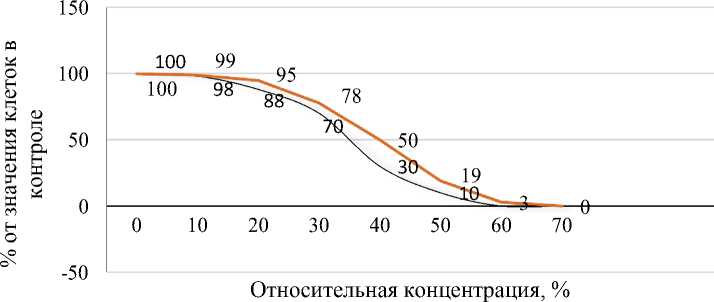
Рис. 1. Кривая нелинейной регрессии, значение ИД 50 % клеточных линий С6 при действии ГФС и ГМ
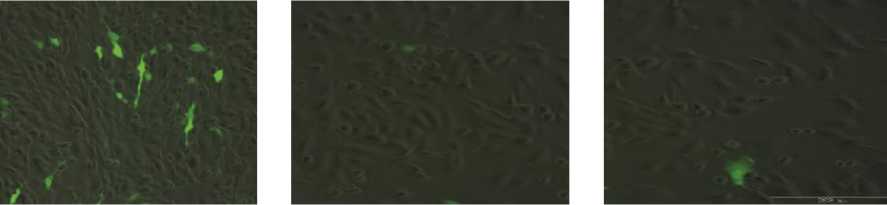
А
Б
В
Рис. 2. Трансдуцированные клетки линии C6: А – культуральная среда, Б – присутствии ГФС, В – присутствие – ГМ
■ ГФС ■ ГМ ■ КС
2,805 3,195

Вид гидролизата
11,501

Рис. 3. Сравнение эффективности проникновения лентивирусных джезикул в геном клетки в присутствии гидролизатов фабрициевой сумки и молозива коров ки препятствует инфицированию клеток вирусами. На рис. 4 приведено сравнение эффективности проникновения лентивирусных джезикул в мембрану клетки в присутствии гидролизатов.
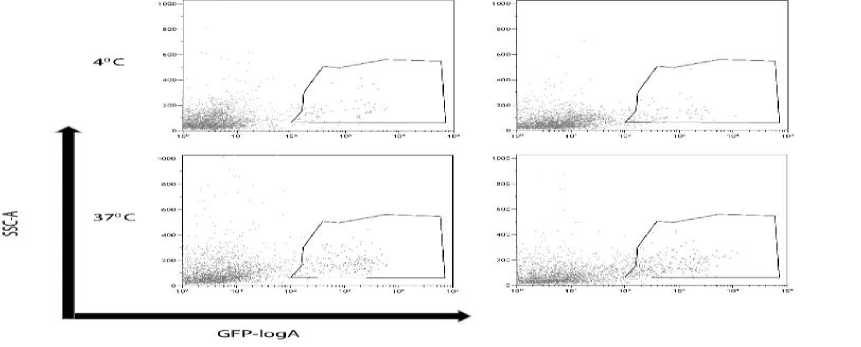
В присутствии ферментативного гидролизата фабрициевой сумки и молозива коров эффективность проникновения лентивирус-ных джезикул в мембрану клетки при температуре 37 °С ниже в 3,3 и 3,1 раза, что визу- ально отмечается на графиках SSC-A/GFP-logA (рис. 5, 6).
Полученные данные согласуются с исследованиями [14], которые утверждают, что высокими противовирусными свойствами обладают пептиды, выделенные из тканей иммунокомпетентных органов животных и птицы, в частности, глюкозаминилмурамилдипептид (ГМДП), зарегистрированный под названием, Ликопид®, а также согласуются с данными
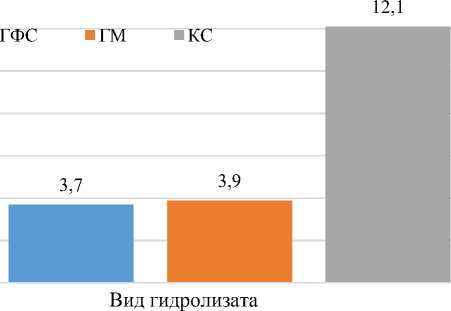
Рис. 4. Сравнение эффективности проникновения лентивирусных джезикул в мембрану клетки в присутствии гидролизатов фабрициевой сумки и молозива коров при температуре 37 °С
ГФС
КС
Рис. 5. Анализ связывания с рецепторами и проникновения в мембрану лентивирусных джезикул: ГФС – гидролизат фабрициевой сумки, КС – культуральная среда авторов [15], которые утверждают, что бурсальные пептиды обладают иммунодепрессивной активностью, в частности, пептид BP5, выделенный из фабрициевой сумки, значительно стимулирует экспрессию белка р53 в клетках рака толстой кишки HCT116. BP5 обладает сильным ингибирующим действием на рост клеток и индуцирует апоптоз в клетках HCT116.
Результаты исследований о снижении жизнеспособности клеточных линий С6 под воздействием ферментативного гидролизата молозива коров обусловлены наличием короткого пептида с аминокислотной последовательностью MR K AKCCIR, который по данным [16] участвует в инактивации Мито- ген-активируемых протеинкиназ (MAPK), фосфорилирует ERK, JNK и p38 MAP-киназы. MAPK играют важную роль в регуляции иммунных ответов на воспалительные стимулы, стресс и повреждения тканей у млекопитающих. В наших исследованиях установлено ингибирование интернационализации вирусных частиц в геном клетки под действием ферментативного гидролизата молозива коров, что наглядно показано снижением количества GFP+ клеток и подавлением проникновения лентивирус-подобных частиц в мембрану клетки. Следовательно, можно утверждать, что пептиды ферментативного гидролизата молозива коров относятся к мембраноактивным пептидам, что согласуется с иссле-
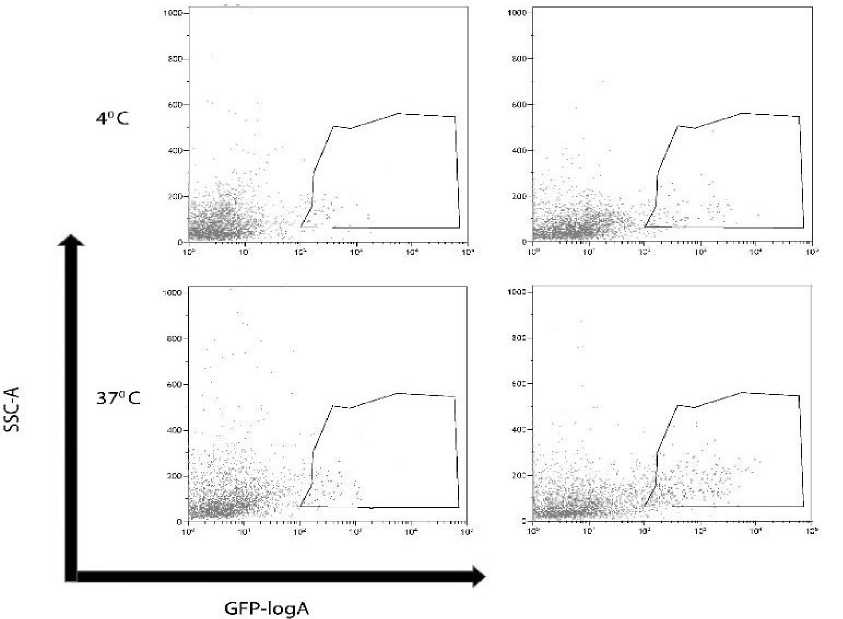
ГМ
КС
Рис. 6. Анализ связывания с рецепторами и проникновения в мембрану лентивирусных джезикул с помощью метода проточной цитометрии с детекцией GFP сигнала: ГМ – гидролизат молозива, КС – культуральная среда дованиями авторов [9], которые утверждают, что мембраноактивные пептиды блокируют поглощение и слияние с клеткой-хозяином, быстро и непосредственно взаимодействуя с вирионами, дестабилизируя вирусную оболочку и стимулируя агрегацию вируса и/или слияние межвирионной оболочки.
По результатам проведенных исследований мы предполагаем, что молекулярные характеристики, общие для этих пептидов, могут быть использованы для разработки специализированных продуктов питания с противовирусной активностью.
Предлагаемое нами направление - создание продуктов питания с противовирусными пептидами рассмотрено в работе [17], которые утверждают, что антимикробные и противовирусные пептиды используются для производства продуктов, способствующих укреплению здоровья, а также для отказа от антибиотиков.
Выводы
На основании проведенных исследований установлено, что ферментативные гидролизаты фабрициевой сумки цыплят-бройлеров и молозива коров, пептиды снижают жизнеспособность вирусов, ингибируют интернационализацию вирусных частиц в геном клетки, подавляют проникновение лентивирус-подобных частиц в мембрану. Полученные данные позволяют рассмотреть возможность создания продуктов питания для профилактики вирусных инфекций, путем введения в состав пептидов молозива коров и фабрициевой сумки цыплят-бройлеров.
Список литературы Исследование противовирусной активности ферментативных гидролизатов белков с обоснованием возможности их использования в составе специализированной пищевой продукции
- Ashaolu T.J., Nawaz A, Walayat N., Khalifa I. Potential "biopeptidal" therapeutics for severe respiratory syndrome coronaviruses: a review of antiviral peptides, viral mechanisms, and prospective needs. ApplMicrobiolBiotechnol, 2021 , vol. 105(9), pp. 457-3470. DOI: 10.1007/s00253-021-11267-l
- Timmons P.B., Hewage C.M. Ennavia is a novel method which employs neural networks for antiviral and anti-coronavirus activity prediction for therapeutic peptides. Brief Bioinform, 2021, vol. 22(6), p. 258. DOI: 10.1101/2021.03.25.436982
- Curreli F., Victor SMB., Ahmed S., et al. Stapled Peptides Based on Human Angiotensin-Converting Enzyme 2 (ACE2) Potently Inhibit SARS-CoV-2. Infection In Vitro. mBio, 2020, vol. 11(6), pp. 02451-20. DOI: 10.1128/mbio.02451-20
- Zannella C., Chianese A., Palomba L., et al. Broad-Spectrum Antiviral Activity of the Amphibian Antimicrobial Peptide Temporin L and Its Analogs. Int J Mol Sci, 2022, vol. 23(4), p. 2060. DOI: 10.3390/ijms23042060
- Mathieu C., Augusto M.T, Niewiesk S, et al. Broad spectrum antiviral activity for paramyxoviruses is modulated by biophysical properties of fusion inhibitory peptides. Sci Rep, 2017, vol. 7, p. 43610. DOI: 10.1038/srep43610
- Ogbole O.O, Akinleye T.E, Nkumah A.O, et al. In vitro antiviral activity of peptide-rich extracts from seven Nigerian plants against three non-polio enterovirus species C serotypes. Virol J, 2021, vol. 18(1), pp. 161. DOI: 10.1186/s12985-021-01628-7
- Gomara M.J, Perez Y, Martinez J.P, et al. Peptide Assembly on the Membrane Determines the HIV-1 Inhibitory Activity of Dual-Targeting Fusion Inhibitor Peptides. Sci Rep, 2019, vol. 9(1), p. 3257. DOI: 10.1038/s41598-019-40125-4
- Hoffmann A.R, Guha S, Wu E, et al. Broad-Spectrum Antiviral Entry Inhibition by Interfacially Active Peptides. J Virol, 2020, vol. 94(23), pp. 01682-20. DOI: 10.1128/jvi.01682-20
- Skalickova S, Heger Z, Krejcova L, et al. Perspective of Use of Antiviral Peptides against Influenza Virus. Viruses, 2015, vol. 7(10), pp. 5428-5442. DOI: 10.3390/v7102883
- Vanzolini T, Bruschi M, Rinaldi A.C, Magnani M, Fraternale A. Multitalented Synthetic Antimicrobial Peptides and Their Antibacterial, Antifungal and Antiviral Mechanisms. Int J Mol Sci, 2022, vol. 23(1), pp. 545. DOI: 10.3390/ijms23010545
- Chernukha, I. M., Mashentseva, N. G., Afanasev, D. A., Vostrikova, N. L. (2020). Biologically active peptides of meat and meat product proteins: a review. Part 2. Functionality of meat bioactive peptides. Theory and practice of meat processing, 5(2), 12-19. DOI: 10.21323/2414-438x-2020-5-2-12-19
- Playford R.J, Cattell M, Marchbank T. Marked variability in bioactivity between commercially available bovine colostrum for human use; implications for clinical trials. PLoS One, 2020. Jun 17;15(6), p. 0234719. DOI: 10.1371/journal.pone.0240392
- Morgan A.J, Riley L.G, Sheehy P.A, Wynn P.C. The influence of protein fractions from bovine colostrum digested in vivo and in vitro on human intestinal epithelial cell proliferation. J Dairy Res, 2014. Feb;81(1), pp. 73-81. DOI: 10.1017/s0022029913000654
- Пинегин Б.В., Хаитов Р.М. Современные принципы создания иммунотропных лекарственных препаратов // Иммунология, 2019. Т. 40, № 6. С. 57-62. [Pinegin B.V., Khaitov R.M. Modern principles of creating immunotropic drugs. Immunology, 2019, vol. 40, no. 6, pp. 57-62. (In Russ.)]
- Li J., Li T.X., Ma Y., Zhang Y., Li, D.Y., Xu HR. Bursopentin (BP5) induces G1 phase cell cycle arrest and endoplasmic reticulum stress/mitochondria-mediated caspase-dependent apoptosis in human colon cancer HCT116 cells. Cancer Cell International, 2019, vol. 19(1), pp. 130. DOI: 10.1186/s12935-019-0849-3
- Li S. et al. Comparative analysis of dual specificity protein phosphatase genes 1, 2 and 5 in response to immune challenges in Japanese flounder Paralichthys olivaceus. Fish & Shellfish Immunology, 2017, vol. 68, pp. 368-376. DOI: 10.1016/j.fsi.2017.07.042
- López-García G, Dublan-García O, Arizmendi-Cotero D, Gómez Oliván LM. Antioxidant and Antimicrobial Peptides Derived from Food Proteins. Molecules, 2022, vol. 27(4), pp. 1343. DOI: 10.3390/molecules27041343


