Исследование реакции комплексообразования 4-гидроксипролина с ионами двухвалентных 3D-металлов
Автор: Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р.
Рубрика: Зоотехния
Статья в выпуске: 1 т.225, 2016 года.
Бесплатный доступ
Получены новые комплексные соединения 4-гидроксипролина с биогенными 3 d -металлами с высокими выходами, что позволяет изучить их токсикологические и фармакологические свойства.
4-гидроксипролин, комплексонаты железа, кобальта, меди, цинка
Короткий адрес: https://sciup.org/14288751
IDR: 14288751 | УДК: 547.461.4
Текст научной статьи Исследование реакции комплексообразования 4-гидроксипролина с ионами двухвалентных 3D-металлов
4-Гидроксипролин (2S, 4R) -4-hydroxypyrrolidine-2-карбоновая кислота – lUPAC) – является широко распространенной протеиногенной заменимой гетероциклической а -аминокислотой. Имеет два центра хиральности (положение 2 и 4) и может образовывать четыре оптически активных стереоизомера. Изомер L-гидроксипролин – бесцветные кристаллы с температурой плавления 274 ° С, хорошо растворяется в воде; рK a 1,92 (СООН), 9,74 (NH), pl 5,83.С нингидрином L-гидроксипролин дает желтое окрашивание и эта реакция используется для количественного его определения фотоколориметрически. Для комплексных солей а -аминокислот чувствительность реакции с нингидрином уменьшается.
В пептидном синтезе гидроксильную группу 4-гидроксипролина защищают бензильной и трет-бутильной группами. Химические реакции по атому азота аминогруппы в молекуле 4-гидроксипролина пространственно затруднены. 4-Гидроксипролин – основной компонент белка коллагена и играет ключевую роль в обеспечении стабильности коллагена. Он также обнаружен в некоторых других белках, например в эластине.[Химик. rи-оксипролин. – Химическая энциклопедия; Гидроксипролин. Материал из Википедии, на сайте «О химии»].
4-Гидроксипролин – биологически активное вещество, используется в синтезе лекарственных средств, например оксицепрола (N-ацептил-4-гидрокси-L-пролина), который представляет интерес как нестероидное противовоспалительное средство [1].
Известно применение L-пролина, 4-гидроксипролина и солей на их основе в качестве терапевтических средств жаропонижающего и противовоспалительного действия [2].
4-Гидроксипролин может использоваться в синтезе противогрибковых препаратов и хиральных лигандов [www. liveintemet. ru/ 2719006/post 293154327].
4-Гидроксипролин представляет особый интерес для косметической промышленности, так как он обладает омолаживающим эффектом на клеточном уровне [L-гидроксипролин. foodactive. сom. ua > produktsiya.. .hydroxyproline html].
Из данных литературы следует, что 4-гидроксипролин обладает широким спектром биологического действия. Соли и N-ацетилпроизводные, полученные на его основе, являются эффективными жаропонижающими и противовоспалительными средствами.
Однако сведения о методах синтеза и физико-химических свойствах солей биогенных металлов 4-гидроксипролина в доступной литературе отсутствуют.
Известно, что органически связанные микроэлементы (марганца, железа, кобальта, меди, цинка) с а -аминокислотами характеризуются высокой биологической доступностью и усваиваются организмом легче, чем соответствующие сульфаты [3].
Для изучения токсикологических и фармакологических свойств комплексонатов 4-гидроксипролина с биогенными металлами нами проведено экспериментальное исследование реакции комплексообразования и исследования по разработке доступных способов получения комплексных соединений.
Материалы и методы . Для исследования реакции взаимодействия 4-гидроксипролина с ионами биогенных 3 d -металлов были использованы следующие реактивы: trans-4-Hydroxy-L-proline, содержание основного вещества 99,0%. New Jersey, USA; 1-800-ACROS-01; сульфаты: железа, FeSO 4 - 7Н 2 О; кобальта, СоSO4 • 7H 2 O; меди, CuSO 4 • 5H 2 O; цинка, ZnSO 4 • 7Н 2 О; гидроксид натрия, марки «хч».
-
1. Синтез комплексоната железа (II) 4-гидроксипролина. а) Раствор 1,06 г
(0,0038 моль) сульфата железа (II) FeSO 4 • 7Н 2 О в 15 мл воды нагревают до 45-50 ° С в течение 20 минут. К гомогенному раствору гидролизата (рН 3) прибавляют 1 г (0,0076 моль) гидроксипролина, выдерживают 3035 минут при 45-50 ° С и 1,5-2 часа при комнатной температуре. Гомогенный реакционный раствор имеет светло-желтый цвет. Раствор упаривают при комнатной температуре из чашки Петри. Кристаллический остаток промывают несколько раз спиртом (качественный контроль на сульфаты с BaCl 2 ) и сушат. Получают 1,3 г (96,3%) комплексоната дигидрата железа (II) 4-гидроксипролина [C5H8O3N]2Fe • 2H 2 O. Содержание азота (%): найдено – 7,80; вычислено –7,93. Дигидрат железа (II) 4-гидроксипролина кристаллический продукт темно-серого цвета с зеленоватым оттенком. Продукт растворяется в воде, но из раствора при стоянии выпадает темный порошок вследствие гидролиза соли. В спирте препарат не растворяется. При температуре 138-142 ° С наблюдается обугливание. б) К раствору 1 г (0,0076 моль) 4-гидроксипролина в 10 мл воды прибавляют 0,3 г (0,0076 моль) гидроксида натрия, перемешивают 10 минут (рН 9) и нагревают до 50-55 ° С. К гомогенному раствору прибавляют 1,06 г (0,0038 моль) сульфата железа (II), FeSO 4 • 7H 2 O при перемешивании и нагревают при 45-50 ° С в течение 30-35 минут. При этом наблюдается выпадение осадка грязно зеленого цвета гидроксида железа (II). Гетерогенную смесь перемешивают в течение 2-х часов при 45-50 ° С, охлаждают, осадок фильтруют и фильтрат упаривают при комнатной температуре. Кристаллический остаток темного цвета промывают спиртом и сушат. Получают 0,7 г (52 %) комплексоната дигидрата железа (II) 4-гидроксипролина, [C5H8O3N]2Fe • 2H 2 O. Содержание азота (%): найдено – 7,79; вычислено –7,93. При температуре 142-143 ° С препарат обугливается.
-
2. Синтез комплексоната кобальта (II) 4-гидроксипролина . Раствор 1,07 г (0,0038 моль) сульфата кобальта (II), СоSO 4 • 7H 2 O в 15 мл воды нагревают до 45-50 ° С в течение 20 минут. К гомогенному раствору гидролизата (красноватого цвета) прибавляют 1 г (0,0076 моль)
-
3. Синтез комплексоната меди (II) 4-гидроксипролина. К раствору 1 г (0,0076 моль) ) 4-гидроксипролина в 10 мл воды прибавляют 0,3 г (0,0076 моль) гидроксида натрия, перемешивают 10 минут (рН 9) и нагревают до 50-55 ° С. К гомогенному раствору прибавляют 0,95 г (0,0038 моль) сульфата меди, CuSO4 • 5H 2 O при перемешивании, нагревают до 50 ° С в течение 30-35 минут. Гомогенный реакционный раствор (ярко темно-синего цвета) выдерживают в течение 1,5-2-х часов при комнатной температуре и упаривают. Кристаллический остаток промывают несколько раз спиртом и сушат при комнатной температуре. Получают 1,55 г (96,87 %) комплексоната пентагидрата меди (II) 4-гидроксипролина [C5H8O3N]2Cu • 5H 2 O. Содержание азота (%): найдено – 674; вычислено –6,63.
-
3. Синтез комплексоната цинка (II) 4-гидроксипролина. К раствору 1 г (0,0076 моль) ) 4-гидроксипролина в 10 мл воды прибавляют 0,3 г (0,0076 моль) гидроксида натрия, перемешивают 10 минут (рН 9) и нагревают до 50 ° С. К гомогенному раствору прибавляют 1,1 г (0,0038 моль) сульфата цинка, ZnSO4 • 7H 2 O при перемешивании и нагревают до 50 ° С в течение 30-35 минут. Гомогенный светлый реакционный раствор выдерживают при комнатной температуре 1,5-2 часа и упаривают. Кристаллический остаток белого цвета промывают спиртом и сушат при комнатной температуре. Получают 1,32 г (95,65%) дигидрата цинка 4-гидроксипролина [C 5 H 8 O 3 N] 2 Zn • 2H 2 O. Содержание азота (%): найдено – 7,65; вычислено – 7,77.
гидроксипролина, выдерживают 30-35 минут при 45-50 ° С и 1,5 часа при комнатной температуре. Затем гомогенный реакционный раствор (розоватого цвета) упаривают при комнатной температуре, кристаллический остаток промывают несколько раз спиртом (качественный контроль на сульфаты с BaCl 2 ) и сушат. Получают 1,58 г (97,46 %) комплексоната гексагидрата кобальта (II)4-гидроксипролина, [C5H8O3N]2Со • 6H 2 O. Содержание азота (%): найдено – 6,45; вычислено –6,57.
Комплексонат кобальта (II) кристаллический продукт розового цветас бежевым оттенком. Препарат хорошо растворяется в воде (водный раствор разового цвета), не растворяется в спирте. При температуре 128-130 ° С продукт обугливается.
Комплексонат меди (II) кристаллический продукт темно-синего цвета, хорошо растворяется в воде, не растворяется в спирте. При температуре
165-170 ° С продукт обугливается.
Комплексонат цинка кристаллический продукт белого цвета, хорошо растворяется в воде, не растворяется в спирте. При температуре 198-201 ° С продукт обугливается.
Результаты исследований. Ранее нами был разработан способ получения комплексонатов марганца и железа с глицином [3] и марганца с 4-гидроксипролином [4] действием на реакционный водный раствор гидролизатов соответствующих сульфатов металлов а -аминокислотами в кислой среде (рН 3). В процессе гидролиза сульфатов Ме (II) образуются гидроксид марганца (II) и гидроксид железа (II), которые хорошо растворяются в кислой среде и не подвергаются окислению до гидроксидов металлов (III).
Оптимальные данные были ииспользованы нами в синтезе комплексонатов железа (II), кобальта (II) 4-гидроксипролина по схеме (I).
Схема реакции (I):
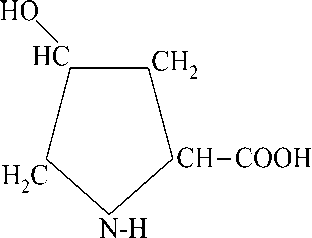
to
+ MnSO + 2HOH «—* Mе(OH) + H SO рН < 7
(_ 2Н О)
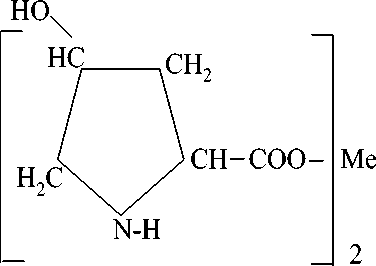
где Ме = Fe2+ (1а); Со2+ (2).
Из данных эксперимента следует, что протекание реакции и выход целевых продуктов зависит от следующих факторов: гомогенности реакционного раствора, рН среды, растворимости субстрата в воде, растворимости реагентов в кислой или щелочной средах и их устойчивости к окислению.
В оптимальных условиях реакции (кислая среда, рН = 3, гомогенность реакционного раствора) комплексонаты железа (II) 4-гидроксипролина получают с высокими выходами: 96,3 %, 97,46 %, соответственно.
Комплексообразование 4-гидроксипролина с гидроксидом железа (II) в щелочной среде (рН 9) протекает в гетерогенной фазе, так как Fe(OH)2 не растворяется в щелочных растворах, не обладает амфотерностью и выход целевого продукта составляет 52,2 % (методика 1б, схема II).
Реакция комплексообразования 4-гидроксипролина с ионами Cu2+, Zn2+ однозначно протекает в щелочной гомогенной среде (рН 9). Гидроксид меди, Cu(OH)2 в щелочной среде и при нагревании растворяется с образованием куприта Na2[Cu(OH)4];Zn(OH)2 проявляет амфотерность.
В щелочной среде при избытке Î Í -ионов аминокислоты находятся в виде анионов, так как диссоциируют протонированные аминогруппы. Скорость комплексообразования аниона аминокислоты с катионами Cu2+, Zn2+ в гомогенной фазе значительно выше, чем скорость образования малорастворимых гидроксидов.
Комплексонаты меди (II), цинка и железа (II) (1б) получают по схеме (II):
Схема реакции (II):
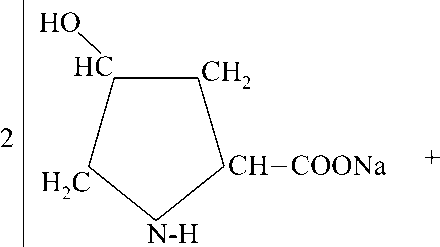
MeSO
( _ Na2SO4)
рН > 7
НО
НС
НС
СН
СН _ СОО_
Ме
N-H
где Ме = Fe2+ (1б); Сu2+ (3); Zn2+ (4.)
Сущность способа получения комплексонатов [5] по схеме (II) заключается в действии сульфата соответствующего металла (присыпание кристаллического реагента) на реакционную смесь 4-гидроксипролина и гидроксида натрия в водной среде (рН 9). В мягких условиях (температура реакции 5055 ° С, время 30-35 минут, гомогенная фаза) комплексонаты меди (II) (3) и цинка (4) 4-гидроксипролина получают с выходами 96,87 % и 95,65 %, соответственно.
Для подтверждения структуры полученных комплексонатов 4-гидроксипролина проведены качественные реакции. [6]. Соединения (1-4) дают качественную реакцию на аминогруппу: с хлоридом железа (III) образуют хелаты красного цвета; с сульфатом меди (II) c добавлением ацетата натрия – ярко синего цвета (соединения 1,2,4).
Водный раствор комплексоната железа (II) 4гидроксипролина (1а,б) с гидроксидом натрия образует осадок Fe(OH) 2 грязно зеленого цвета; с К3[Fe(CN)6] наблюдается выпадение темносинего осадка Fe 3 [Fe(CN) 6 ] 2 турнбулевой сини; с нингидрином раствор окрашивается в фиолетовый цвет.
При действии на водный раствор комплексоната кобальта (II) (2)
гидроксидом натрия выпадает осадок Со(ОН)2 розового цвета; с нингидрином водный раствор (2) окрашивается в желтый цвет.
Комплексонат меди (II) (3) в водном растворе с K 4 [Fe(CN) 6 ] образует осадок Cu 2 [Fe(CN 6 )] красно-бурого цвета.
Комплексонат цинка (4) с К 3 [Fe(CN) 6 ] в водном растворе дает осадок Zn3[Fe(CN6)]2 желто-коричневого цвета; с нингидрином раствор окрашивается в фиолетовый цвет.
Заключение. Исследована реакция комплексообразования 4-гидроксипролина с ионами железа (II), кобальта (II), меди (II) и цинка. На основе экспериментальных данных определены факторы, влияющие на процесс комплесообразования, основными из которых является рН-среды и гомогенность реакционной смеси. В оптимальных условиях получены новые комплексные соединения 4-гидроксипролина с биогенными 3 d -металлами с высокими выходами, что позволяет изучить их токсикологические и фармакологические свойства.
Meyer Hans.
Резюме
Получены новые комплексные соединения 4-гидроксипролина с биогенными 3 d -металлами с высокими выходами, что позволяет изучить их токсикологические и фармакологические свойства.
Список литературы Исследование реакции комплексообразования 4-гидроксипролина с ионами двухвалентных 3D-металлов
- Пат. BV 11422. С 1.12.30.2008. Беларусь. Способ получения N-ацетил-4-гидрокси-L-пролина/З.И. Куваева, Д.В. Лопатик, Т.А. Николаева.
- Пат. США 5827874, 27.10.1998/Meyer Hans.
- Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Разработка рационального способа получения комплексных солей марганца, железа с глицином и метионином.//Ученые записки КГАВМ им. Н.Э. Баумана. -Казань, 2013. -т. 216, с. 150-156.
- Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р. Разработка способа получения комплексонатов кальция и марганца с 4-гидроксипролином//Ученые записки КГАВМ им. Н.Э. Баумана. -Казань, 2015. -т. 223, с. 82-87.
- Кадырова Р.Г.,Кабиров Г.Ф., Муллахметов Р.Р. Биогенные свойства и синтез комплексных солей a-аминокислот биогенных металлов. -Казань: Казан. гос. энерг. ун-т, 2014. -с. 85-93.
- Грандберг И.И. Практические работы и семинарские занятия по органической химии. -М.: Дрофа, 2001. с. 136-138.


