Исследование S-алкенильных производных 8-хинолинтиола методом хроматомасс-спектрометрии
Автор: Баталов Владимир Игоревич, Мелентьев Алексей Борисович, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 33 (250), 2011 года.
Бесплатный доступ
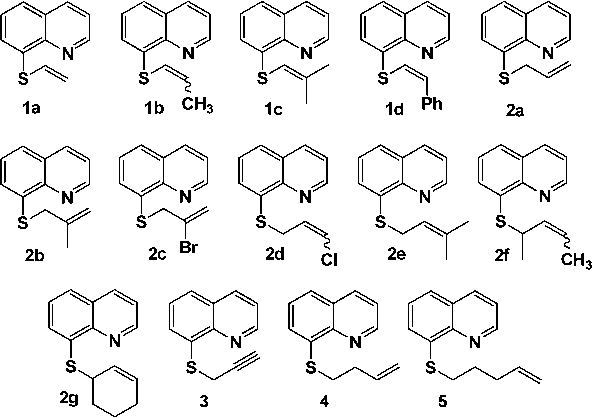
Впервые исследованы масс-спектры S-винильных, -аллильных производных 8-хинолинтиола и 8-(2-пропинил-, 3-бутенил-, 4-пентенил)-тиохинолинов. В масс-спектрах всех исследованных веществ, за исключением 8-(2-пропинилтио)хинолина, присутствует пик молекулярного иона [M]+. Для всех соединений характерен сульфидный распад по обеим связям C-S. Процесс элиминирования радикала SH приводит к образованию устойчивых пирроло[3,2,1-ij]хинолиниевых и пиридо[3,2,1-ij]хинолиниевых систем.
8-винилтиохинолин, 8-(1-пропенилтио)хинолин, 8-(2-метил-1-пропенилтио)хинолин, 8-стирилтиохинолин, 8-(2-пропенил-тио)хинолин, 8-(2-метил-2-пропенилтио)хинолин, 8-(2-бром-2-пропенил-тио)хинолин, 8-(3-хлор-2-пропенилтио)хинолин, 8-(3-метил-2-бутенил-тио)хинолин, 8-(1-метил-2-бутенилтио)хинолин, 8-(цикло-2-гексенил-тио)хинолин, 8-(2-пропинил-тио)хинолин, 8-(3-бутенилтио)хинолин, 8-(4-пентенилтио)хинолин, 8-алкенилтиохинолины, масс-спектры
Короткий адрес: https://sciup.org/147160200
IDR: 147160200 | УДК: 547.831.88+543.51
Текст научной статьи Исследование S-алкенильных производных 8-хинолинтиола методом хроматомасс-спектрометрии
Масс-спектрометрия активно используется для иccледования органических соединений, так как данные масс-спектров дают информацию об их составе, структуре и свойствах. В литературе имеется информация о масс-спектрах электронного удара алкильных производных хинолина и арилсульфидов. В масс-спектрах хинолина и его моно- и диметилпроизводных пики [M]+• имеют максимальную интенсивность, а пики фрагментных ионов незначительны. [1]. В метиларилсуль-фидах фрагментация протекает с образованием ионов [M–CH 3 ]+, [M–CH 3 –CS]+, [M–HS]+ и [M–CH 2 S]+• [1]. Для алкиларилсульфидов с длинными алкильными группами характерным является выброс молекулы олефина с образованием ионов [ArSH]+• [2]. Фрагментация фенилвинил-сульфида сопряжена с протеканием ряда скелетных перегруппировок. Так, для них характерно образование ионов [C 6 H 5 CS]+, [M–C 6 H 5 CS]+ и других вследствие миграции С 6 Н 5 к С-атому винильной группы [2]. Для алкилпиридилсульфидов наиболее характерными являются осколочные ионы, обусловленные выбросом алкена и β-разрывом. Аналогичный распад наблюдается и в случае 2-алкилтиотиазоло[5,4-d]пиримидинов, которым, кроме того, свойственен выброс частиц •SH и •SCH 3 [1]. Для 3-алкокси-2-метилтиопирролов характерны эфирный и сульфидный типы распада [3].
Наш интерес к S-производным 8-хинолинтиола связан с их структурой: молекулы содержат одновременно гетероароматическую бициклическую систему, тиоэфирную группу и ненасыщенный фрагмент. Такое сочетание с одной стороны даёт хорошо прогнозируемую картину фрагментации образующихся молекулярных ионов, т.к. объекты, содержащие все вышеперечисленные группы, довольно хорошо изучены, но с другой стороны возможно протекание новых перегруппировок и процессов фрагментации. В литературе имеются лишь краткие данные о масс-спектре 8-аллилтиохинолина [4]. Целью настоящей работы является выявление общих закономерностей и специфических особенностей распада различных S-производных 8-хинолинтиола под действием электронного удара.
Обсуждение результатов
В настоящей работе выявлены основные закономерности фрагментации под действием электронного удара следующих соединений: 8-винилтиохинолин (1а), 8-(1-пропенилтио)хинолин (1b), 8-(2-метил-1-пропенилтио)хинолин (1с), цис-8-стирилтиохинолин (1d), 8-(2-пропенилтио)- хинолин (2а), 8-(2-метил-2-пропенилтио)хинолин (2b), 8-(2-бром-2-пропенилтио)-хинолин (2c), 8-(3-хлор-2-пропенилтио)хинолин (2d), 8-(3-метил-2-бутенил-тио)хинолин (2e), 8-(1-метил-2-бутенилтио)хинолин (2f), 8-(цикло-2-гексенилтио)хинолин (2g), 8-(2-пропинилтио)хинолин (3), 8-(3-бутенилтио)хинолин (4) и 8-(4-пентенилтио)хинолин (5):
Масс-спектрометрические данные приведены в таблице.
В масс-спектрах всех исследованных веществ, за исключением соединения 3, присутствует пик молекулярного иона [M]+\ В гомологическом ряду соединений 2а, 4 и 5 интенсивность пика [M]+ возрастает при увеличении длины углеводородного радикала, что, по-видимому, связано с распределением энергии иона по колебательным степеням свободы [2]. В молекулах соединений 2f и 2g присутствие заместителя при а-углеродном атоме понижает интенсивность пика [M]+ (8 % от максимального). Для галогенсодержащих соединений 2с и 2d интенсивность пика [M]+ минимальна (2-12 %), что обусловлено лёгкостью отщепления галогена от молекулярного ион-радикала.
Основные направления распада 8-алкенилтиохинолиниевых молекулярных ионов (рис. 1) включают в себя сульфидный распад и протекают с образованием ион-радикала хинолина и 8-хинолил-катиона ( I ), ион-радикала 8-хинолинтиола и 8-хинолилтио-катиона ( II ), а также образование конденсированных систем, сопряжённое с фрагментацией заместителя и скелетными перегруппировками (направления III и IV ).
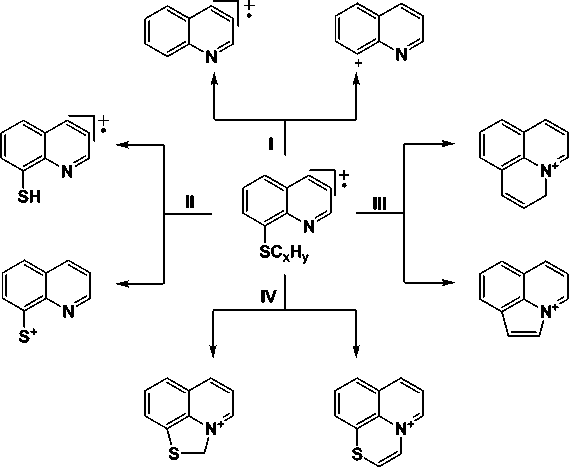
Рис. 1. Основные направления распада S-алкенильных производных 8-хинолинтиола
Органическая химия
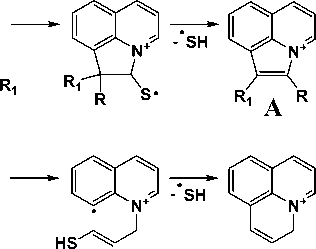
Все соединения, за исключением галогенсодержащих 2с и 2d , содержат в спектре пик [M-SH]+, что характерно для ароматических сульфидов [1]. В соединениях 1a-c, 2a, 2b и 2g он обладает максимальной интенсивностью, так как процессы фрагментации, ведущие к отщеплению радикала •SH, приводят к образованию устойчивых пирроло[3,2,1- ij ]хинолиниевых ( A ) и пиридо[3,2,1- ij ]хинолиниевых ( B ) систем (рис. 2). Интенсивность соответствующего пика в соединениях 2е и 2f составляет 88 и 83 %, соответственно.
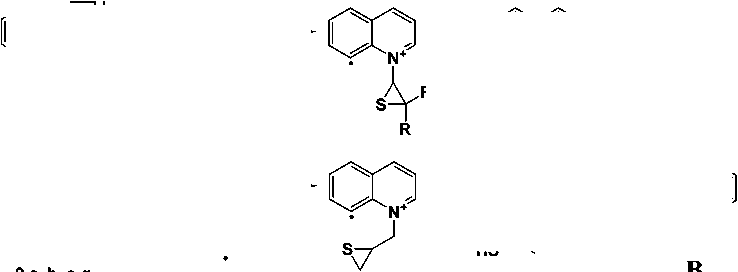
1aR=R1 =H;1bR=H,R1 =CH3;1cR=R1 =CH3;1dR=Ph,R1 =H
Рис. 2. Схема элиминирования тиольного радикала
2a,b,e-g

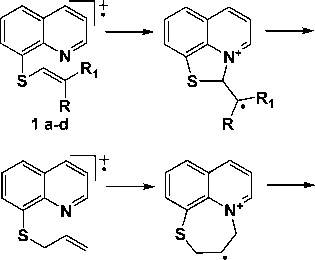
В соединениях 1b, 1с , 2a и 2b присутствует пик [M-CH3]+, его интенсивность у гомологов возрастает с увеличением метильных групп. По-видимому, относительно высокая интенсивность этого пика обусловлена образованием устойчивой трициклической системы C (рис. 3).
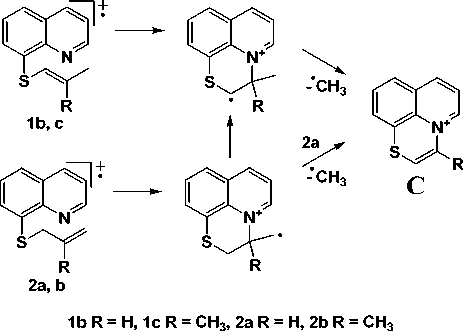
Рис. 3. Схема элиминирования метильного радикала
У соединений 1b, c, и 2a, b пик иона [M-SCH3]+ обусловлен образованием пирроло[3,2,1- ij ]-хинолиниевой системы по схеме, представленной на рис. 4.
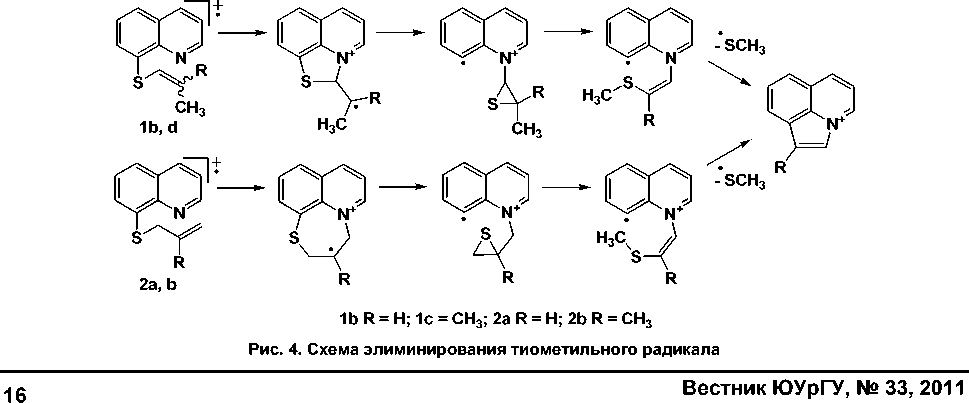
Для 2a, b процесс элиминирования частицы •SCH 3 преобладает над отщеплением •SH согласно правилу выброса максимального радикала [5]. По той же схеме протекает отщепление радикала •SC 2 H 5 из молекулы 2f c образованием иона с m/z = 168.
В соединениях 2e и 2f имеется пик иона [M–CH3SH]+, интенсивность которого повышается с увеличением количества метильных групп при γ-углеродном атоме (от 2f к 2e ) (рис. 5).
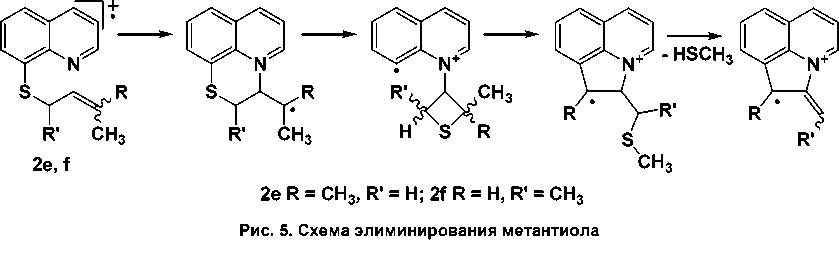
8-Пропинилтиохинолин ( 3 ) содержит тройную связь и для него, как и для 2-пропинил-тиопиррола [6], характерен пик [M–1]+ с интенсивностью 100 %, что является следствием потери радикала водорода и образования устойчивой системы D (рис. 6). Ещё одной особенностью соединения 3 является образование осколочного иона с m/z = 167, что обусловлено элиминированием атома серы и образованием структуры E .
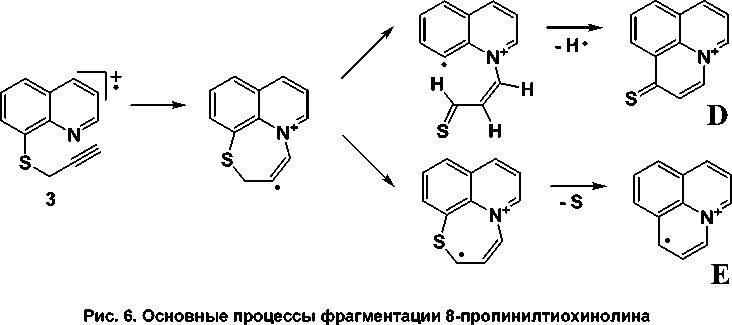
В масс-спектрах галогенпроизводных 2с и 2d присутствует пик с массой [M–Hal]+, что характерно для галогенсодержащих соединений. Отщепление молекулы галогеноводорода приводит к образованию молекулярного иона соединения 3 и последующей его перегруппировке с образованием структуры E (см. рис. 6).
Пики с m/z = 142, 154, 168, 174 и 186 соответствуют наиболее устойчивым системам, которые образуются в результате различных перегруппировок и фрагментации молекулярных ионов. На наш взгляд, этим массам соответствуют следующие структуры:
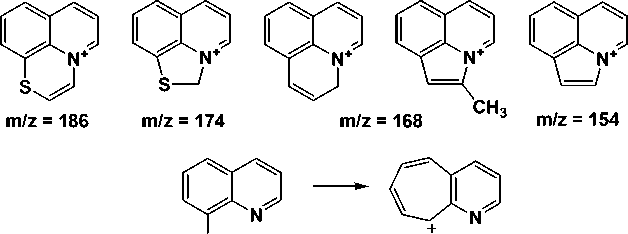
CH2+ m/z= 142
Органическая химия
Данные масс-спектров исследованных соединений
|
Соединение |
Характеристики ионов: m / z ( I , %) |
|
1a (C 11 H 9 NS) |
187 [M] + (24), 154 [M-SH]+ (100); 161 (9), 129 (35), 117 (8), 116 (8), 102 (10), 89 (18), 75 (4), 69 (3), 63 (4), 51 (3), 45 (2) |
|
1b (C 13 H 13 NS) |
201 [M]+ (32), 186 [M-CH 3 ]+ (63), 168 [M-SH]+ (100), 154 [ChH 8 N]+ (15), 142 [M-SC 2 H 3 ]+(9); 161 (23), 129 (45), 116 (13), 102 (15), 89 (13), 75 (7), 69 (4), 63 (6), 51 (5), 45 (5) |
|
1с (C 12 H 11 NS) |
215 [M]+ (67), 200 [M-CH 3 ]+ (100), 182 [M-SH]+ (100), 174 [M-C 3 H5]+ (18), 168 [M-SCH 3 ]+ (46), 154 [C 11 H 8 N]+ (8), 142 [CWH 8 N]+ (13); 161 (10), 129 (5), 116 (11), 102 (20), 89 (11), 75 (5), 69 (3), 63 (5), 51 (5), 45 (3) |
|
1d (C 17 H 13 NS) |
263 [M]+ (22), 230 [M-SH]+ (45), 186[M-Ph]+ (9), 77 [Ph]+ (11); 161 (100), 129 (39), 117 (6), 102 (20*), 89 (11), 75 (7), 69 (7), 63 (3), 51 (12), 45 (4) |
|
2a (C 12 H 11 NS) |
201 [M]+ (18), 186 [M-CH 3 ]+ (18), 168 [M-SH]+ (100), 154 [Cn^Nf (22), 142 [M-SC 2 H 3 ]+ (12); 160 (15), 129 (43), 116 (23), 102 (12), 89 (19), 75 (5), 69 (6), 63 (8), 51 (4), 45 (5). |
|
2b (C 13 H 13 NS) |
215 [M]+ (23), 200 [M-CH 3 ]+ (45), 182 [M-SH]+ (100), 174 [M-C 3 H5]+ (18), 168 [M-SCH 3 ]+ (52), 142 [CwH 8 N]+ (14); 160 (19), 129 (54), 116 (27), 102 (14), 89 (21), 75 (5), 69 (5), 63 (8), 51 (5), 45 (4) |
|
2c (C 12 H 10 NSBr) |
279 [M]+ (2), 200 [M-Br]+ (100), 167 [M-HBr-S]+ (18), 39 [C 3 H 3 ]+ (4); 161 (26), 129 (3), 116 (13), 102 (2), 89 (8), 75 (1), 69 (1), 63 (2), 51 (1), 45 (1) |
|
2d (C i2 H io NSC1) |
235 [M]+ (12), 200 [M-Cl]+ (36), 186 [M-CH 2 Cl]+ (21), 167 |M IICIS^ (100), 154 [CnH 8 N]+ (72), 142 [C 1o HN]+ (26), 39 [C 3 H 3 ]+ (12); 160 (22), 129 (67), 116 (34), 102 (14), 89 (24), 75 (10), 69 (5), 63 (9), 51 (5), 45 (5) |
|
2e (C 14 H 15 NS) |
229 [M]+ (9), 196 [M-SH]+ (88), 186 [M-C 3 H 7 ]+ (14), 181 [M-CH 3 SH]+ (35), 173 [C 1o H 8 NS]+ (8), 143 [C 10 H9W (39), 41 [C 3 H5]+ (32); 161 (100), 129 (20), 117 (31), 116 (33), 102 (6), 89 (22), 75 (4), 69 (18*), 63 (8), 51 (5), 45 (3) |
|
2f (C 14 H 15 NS) |
229 [M]+ (8), 196 [M-SH]+ (83), 187 [M-C 3 H5]+ (9), 181 IMCIhSIl^ (19), 168 [C 12 H 1o N]+ (13), 156 [C 11 HWN]+ (19), 41 [C 3 H 5 ]+ (23); 161 (100), 129 (19), 117 (28), 102 (4), 89 (19), 75 (2), 69 (15*), 63 (6), 51 (3), 45 (2) |
|
2g (C 15 H 19 NS) |
241 [M]+ (8), 208 [M-SH]+ (100), 81 [€&] + (14), 79 №] + (14), 77 [C e H5]+ (9), 53 [C 4 H 5 ]+ (9), 41 [C 3 H 5 ]+ (7); 161 (98), 129 (24), 116 (22), 102 (5), 89 (15), 75 (2), 69 (3), 63 (5), 51 (5), 45 (2) |
|
3 (C 12 H 9 NS) |
198 [M-1]+ (100), 167 [M-SH]+ (17), 154 [M-CS]+ (70), 142 [M-SC 2 H]+ (11); 160 (24), 129 (34), 116 (29), 102 (10), 89 (20), 75 (4), 69 (7), 63 (9), 51 (4), 45(3) |
|
4 (C 13 H 13 NS) |
215 [M]+ (32), 182 [M-SH]+ (8), 174 [M-C 3 H5]+ (100), 41 [C 3 H5]+ (3); 161 (92), 129 (29), 116 (16), 102 (11), 89 (12), 75 (8), 69 (4), 63 (3), 51 (5), 45 (5) |
|
5 (C 14 H 15 NS) |
229 [M]+ (42), 196 [M-SH]+ (32), 188 [M-C 3 H5]+ (100), 182 [M-SCH 3 ]+ (25), 174 [C 1o H 8 NS]+ (63), 142 [CwHNf (28), 41 [C 3 H 5 ]+ (13); 161 (50), 129 (42), 116 (24), 102 (13), 89 (16), 75 (5), 69 (5), 63 (7), 51 (5), 45 (4) |
* Осколочные ионы, образующиеся как при распаде тиохинолиниевой системы, так и при фрагментации заместителя.
Все соединения содержат в спектрах ионы с m/z = 161 или 160, образующиеся при разрыве S-C связи с образованием ион-радикала 8-хинолинтиола и 8-хинолилтио-катиона. Интенсивность пиков возрастает при увеличении массы заместителя и минимальна для винильных соединений ( 1a, b, c ), что вероятно является следствием p-п-сопряжения атома серы с двойной связью.
Пики с m/z 128 и 129 представляют собой 8-хинолил-катион и катион-радикал 8-хинолина, которые возникают при разрыве связи S-CAr. Преобладающим является процесс образования пика с m / z = 129, который проходит с отщеплением тиоалкенильного радикала и миграцией атома водорода из a-положения заместителя, об этом свидетельствует меньшая интенсивность соответствующего пика для a-непредельных производных ( 1a-d ).
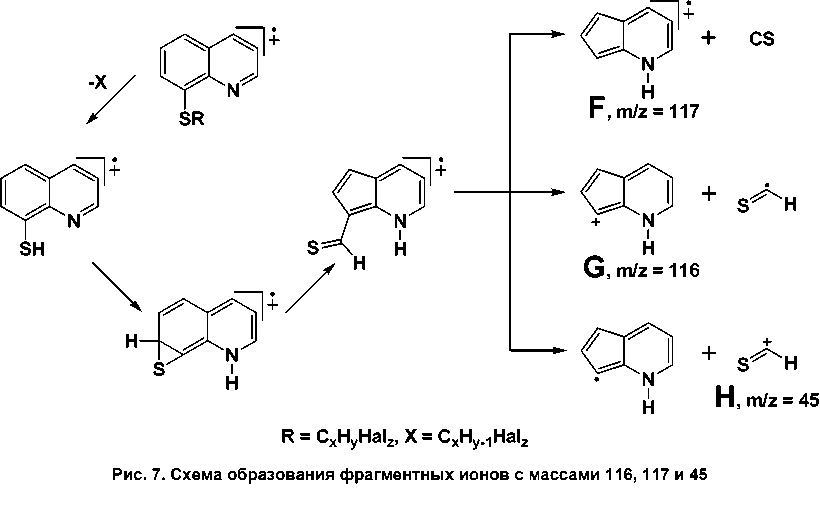
Ионы с m/z 116 и 117 образуются в результате перегруппировки (рис. 7) с образованием ароматических систем F и G. В поддержку такого механизма свидетельствует присутствие иона с m/z = 45 (H) во всех исследованных спектрах. Интенсивность пиков для F и G в среднем не превышает 30 %, а для H – не более 5 %.
Образование ионов с m/z 102, 101, 89, 75, 69 и 63 протекает в ходе более энергоёмких процессов разрушения ароматической системы. Об этом свидетельствует меньшая интенсивность пиков ионов: 102, 101, 89 – не более 20 %, для остальных – не более 10 %. На наш взгляд приведённым значениям масс соответствуют следующие структуры:
□О А) <О -О s"c" О Д
m/z = 102 m/z = 89 m/z = 75 m/z = 69 m/z = 63 m/z = 51
Интенсивности пиков перечисленных ионов не зависят от вида заместителя и имеют следующее соотношние: I(102) : I(89) : I(75) : I(69) : I (63) : I(51) : I(45) ≈ 10 : 15 : 4 : 4 : 6 : 4 : 3.
В области малых массовых чисел имеются пики углеводородных ионов. К ним относятся ионы c m/z = 39 ( 2c, f ), 41 ( 2e, f, g , 4 , 5 ) и 77 ( 1d , 2g ), что соответствует циклопропенильному, аллильному и фенильному катионам соответственно.
Экспериментальная часть
Масс-спектры электронного удара сняты на хроматомасс-спектрометре ГХ/МС-ЭВМ фирмы Hewlet Packard, газовый хроматограф HP-5890, серия II, масс-селективный детектор MSD-5972 при энергии ионизации 70 эВ. 8-Винилтио-хинолин ( 1a ) получен по методу [7], 8-(1-пропенил-тио)хинолин – по методу [7], цис -8-стирилтио-хинолин ( 1d ) – по методу [7], 8-аллилтиохинолин ( 2a ) – по методу [8, 9].
8-(2-Метил-1-пропенилтио)хинолина (1с). К раствору 0,43 г (2 ммоль) 8-(2-метил-2-пропенилтио)хинолина в 20 мл ДМСО добавляют в раствор 0,22 г (4 ммоль) KОН в 3 мл воды, нагревают на водяной бане в течение 2 ч. После охлаждения добавляют 10-кратный избыток воды. Через сутки выпавший осадок отфильтровывают и перекристаллизовывают из гексана. Т. пл. = 38 °С, выход 0,413 г (96 %).
Получение 8-алкенилтиохинолинов 2b–g, 3–5 (общая методика). К раствору 0,438 г (0,002 моль) дигидрата 8-меркаптохинолината натрия в 10 мл ДМСО (или ДМФА) добавляют 0,002 моль галогеналкена. Раствор нагревают на водяной бане в течение 30 минут, после охлаждения добавляют 10-кратный избыток воды. Через сутки образовавшийся осадок (или масло) отделяют, растворяют в дихлорментане (или эфире), сушат хлоридом кальция, фильтруют. После улетучивания растворителя остаток перекристаллизовывают из гексана.
Органическая химия
8-(2-Метил-2-пропенилтио)хинолин ( 2b ). Галогеналкен – 2-метил-3-хлор-1-пропен.
Т. пл. = 35 °С, выход 0,271 г (63 %).
8-(2-Бром-2-пропенилтио)хинолин ( 2c ). Галогеналкен – 2,3-дибром-1-пропен. Т. пл. = 26 °С, выход 0,123 г (22 %).
8-(3-Хлор-2-пропенилтио)хинолин ( 2d ). Галогеналкен – 1,3-дихлор-1-пропен. Т. пл. = 48–70 °С, выход 0,278 г (59 %).
8-(3-Метил-2-бутенилтио)хинолин ( 2e ). Галогеналкен – 1-бром-3-метил-2-бутена. Выход 0,128 г (28 %).
8-(1-Метил-2-бутенилтио)хинолин ( 2f ). Галогеналкен – 4-хлор-2-пентен. Выход 0,321 г (70 %).
8-(2-Циклогексенилтио)хинолин ( 2g ). Галогеналкен – 3-бромциклогексен. Т. пл. = 80 °C, выход 0,254 г (53 %).
8-(2-Пропинилтио)хинолин ( 3 ). Галогеналкин – 3-бром-1-пропин. Т. пл. = 59 °С, выход 0,236 г (59 %).
8-(3-Бутенилтио)хинолин ( 4 ). Галогеналкен – 4-бром-1-бутена. Выход 0,357 г (83 %).
8-(4-Пентенилтио)хинолина ( 5 ). Галогеналкен – 5-бром-1-пентен. Выход 0,298 г (65 %).
Элементный анализ соединений 1c , 2b–g , 3–5 на С, Н, N и S соответствует расчетному.
Заключение
Изучено поведение 8-винилтио-, 8-(2-метил-1-пропенилтио)-, цис -8-стирилтио-, 8-аллилтио-, 8-(2-метилаллилтио)-, 8-(2-бромаллилтио)-, 8-(3-хлораллилтио)-, 8-(3-метил-2-бутенилтио)-, 8-(1-метил-2-бутенилтио)-, 8-(цикло-2-гексенилтио)-, 8-(2-пропинилтио)-, 8-(3-бутенилтио)-, 8-(4-пентенилтио)-, 8-этилтио- и 5-бром-8-этилтиохинолина в условиях электронной ионизации. Все исследованные соединения отщепляют радикал •SH с образованием устойчивых пирро-ло[3,2,1- ij ]хинолиниевых и пиридо[3,2,1- ij ]хинолиниевых систем. 8-(2-Бромаллилтио)-, 8-(3-хлораллилтио)хинолин в первую очередь отщепляют молекулу галогеноводорода, а затем элиминируют атом S. Интенсивность пика [M–CH 3 ]+ растёт с увеличением количества метильных групп в заместителе и уменьшением его массы.
Список литературы Исследование S-алкенильных производных 8-хинолинтиола методом хроматомасс-спектрометрии
- Вульфсон, Н.С. Масс-спектрометрия органических соединений/Н.С. Вульфсон, В.Г. Заикина, А.И. Микой. -М.: Химия, 1986. -311 с.
- Полякова, А.А. Масс-спектрометрия в органической химии/А.А. Полякова, Р.А. Хмельницкий. -Л.: Химия, 1972. -367 с.
- Масс-спектры новых гетероциклов X. Основные закономерности фрагментации молекулярных ионов 1-алкил(циклоалкил, арил)-3-алкокси(арил)-2-(алкилсульфанил)-пирролов/Л.В. Клыба, Н.А. Недоля, О.А. Тарасова и др.//Журнал органической химии. -2010. -T. 46. -С. 1039-1049.
- Ким, Д.Г. Исследование N-, O-и S-алкильных производных азинов методом газовой хроматографии с масс-селективным детектором/Д.Г. Ким, А.Б. Мелентьев//Тез. докл. XV Уральской конф. по спектроскопии. -Заречный. -2001. -С. 213-214.
- Лебедев, А.Т. Масс-спектрометрия в органической химии/А.Т. Лебедев. -М.: Бином Лаборатория знаний, 2003. -496 с.
- Масс-спектры новых функциональных гетероциклов II. Синтез и масс-спектры 2-(алкил [2-пропенил-, 2-пропинил]тио)-1Н-пирролов/Л.В. Клыба, В.Н. Бочкарёв, Л. Брандема и др.//Журнал общей химии. -1999. -Т. 69. -№ 11. -С. 1805-1809.
- Ким, Д.Г. Исследование свойств 8-винилтиохинолина./Д.Г. Ким, Е.И. Данилина//Химический журнал уральских университетов. -Пермь. -1995. -Т. 2 -С. 165-169.
- Синтез и строение S-алкенильных производных 8-хинолинтиола./Д.Г. Ким, Р.М. Арсламбеков, Ю.О. Субботина, А.В. Белик//Химия гетероцикл. соед. -1999. -№ 11. -С. 1519-1522.
- Ким, Д.Г. Галогенцклизация 8-аллилтиохинолина./Д.Г. Ким//Химия гетероцикл. соед. -1997. -№ 8. -С. 781-784.


