Исследование стабильности polyQ-тракта в гене ATXN2 при наличии САА прерываний в зависимости от вязкости внешней среды
Автор: Дорохова А.А., Леонтьева О.А., Лясота О.М., Рубайло А.Д., Козлова Е.А., Свидлов А.А., Эрнандес Касерес Х.Л., Нечипуренко Ю.Д.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 4 т.29, 2025 года.
Бесплатный доступ
Ген ATXN2 играет ключевую роль в патогенезе нейродегенеративных заболеваний, таких как спиноцеребеллярная атаксия 2-го типа (СЦА2). Экспансия тринуклеотидных повторов в гене приводит к образованию аномального белка с удлиненным участком полиглутамина, который оказывает токсическое действие на нейроны и приводит к их гибели. В результате нарушается функционирование мозжечка и других структур центральной нервной системы, что проявляется прогрессирующим ухудшением координации движений и другими неврологическими симптомами. Открытым вопросом остается понимание молекулярных ос-нов нейродегенеративных процессов, вызываемых мутациями в гене ATXN2, а также влияние внешних факторов на развитие заболеваний. В связи с этим, целью исследования яв-лялось изучение влияния внешней среды на стабильность полиглутаминового тракта (polyQ) в гене ATXN2 при наличии CAA-прерывания. Для расчетов использовали угловую модель ДНК, которая рассматривает молекулу как систему взаимосвязанных маятников, что позволяет учитывать влияние вязкости среды на динамику открытых состояний (ОС) в ДНК. Исследование проводили при значениях вязкости (λ = 0,9; 1,0; 1,1) и длинах CAG-тракта (от 35 до 55 повторов). Результаты показали, что вязкость среды оказывает значительное влияние на стабильность polyQ-тракта, особенно при длине CAG-повторов более 40. Увеличение вязкости (λ = 1,1) способствовало снижению количества дополнительных зон ОС, что указывает на её стабилизирующую роль. Напротив, снижение вязкости (λ = 0,9) увеличивало вероятность образования ОС, усугубляя нестабильность тракта. Установлено, что CAA-вставки в polyQ-тракте оказывают влияние на образование дополни-тельных зон ОС и стабильность CAG тракта в зависимости от их локализации. Результаты проведенной работы служат предпосылками для понимания механизмов регуляции структурной устойчивости белков, связанных с нейродегенеративными заболеваниями. Полученные результаты могут способствовать разработке более эффективных терапевтических стратегий, направленных на стабилизацию аномальных polyQ-тракта, что потенциально за-медлит прогрессирование таких заболеваний, как спиноцеребеллярная атаксия и других полиглютаминовых патологий.
PolyQ-тракт, ATXN2, СЦА2, ДНК, вязкость среды, САА-вставка
Короткий адрес: https://sciup.org/146283242
IDR: 146283242 | УДК: 004.942/539.3: [57+61] | DOI: 10.15593/RZhBiomeh/2025.4.11
Текст научной статьи Исследование стабильности polyQ-тракта в гене ATXN2 при наличии САА прерываний в зависимости от вязкости внешней среды
RUSSIAN JOURNAL OF BIOMECHANICS
Ген ATXN 2, кодирующий белок атаксин-2, имеет весомое значение в патогенезе нейродегенеративных заболеваний. Он ассоциирован с такими расстройствами, как спиноцеребеллярная атаксия 2-го типа (СЦА2), боковой амиотрофический склероз и паркинсонизм [1–5]. Атаксия второго типа представляет собой нейродегенератив-ное заболевание, которое характеризуется прогрессирующим нарушением координации движений, паркинсонизмом и дисметрией. Эти клинические проявления обусловлены дегенерацией нейронов, что приводит к ухудшению моторной функции и координации [6].
Одним из возможных механизмов начала заболевания является аномальное увеличение количества CAG -повторов ( CAG -тракт) в гене ATXN 2 и генетическая нестабильность, приводящая к экспансии CAG -повторов. Чем больше количество повторов, тем раньше дебютирует (развивается) заболевание и тем быстрее оно прогрессирует [7–9]. В норме у человека CAG -тракт содержит 22–23 тринуклеотида, тогда как при количестве повторов ˃ 32 кодируемый белок ATXN2 приобретает токсичные свойства [10]. Увеличение числа CAG -повторов приводит к синтезу мутантного белка атаксина-2 с удлиненным полиглутаминовым трактом, что придает ему токсичность [11]. Этот дефектный белок нарушает регуляцию транскрипции и процессы агрегации, что приводит к потере нейронов [12]. В результате развивается прогрессирующая дегенерация клеток Пуркинье в мозжечке и периферическая нейропатия [13].
Установлено, что повторяющиеся последовательности в значительной степени предрасположены к расширению из-за специфичных вторичных структур, которую они образуют [14; 15]. Эти вторичные структуры, препятствуют нормальной клеточной репликации, рекомбинации и восстановлению ДНК, что приводит к вставке различного количества тринуклеотидных повторов. Из этих вторичных структур наиболее распространенным механизмом при заболеваниях с экспансией CAG -тракта является нарушение проскальзывающих репликаций [16; 17].
CAA-вставки в полиглутаминовом тракте (polyQ-тракте) имеют значительное влияние на формирование вторичных структур белков и могут быть ассоциированы с развитием различных нейродегенеративных заболеваний, включая болезнь Хантингтона [18]. Вставки CAA способствуют увеличению общего количества глутамина в тракте, что может усиливать патологические свойства белка. Это, в свою очередь, оказывает влияние на конформацию белков, способствуя образованию разнообразных вторичных структур, таких как альфа-спирали и бета-складки [19]. Избыточные глутамины могут повышать вероятность формирования неправильных (агрегированных) структур, что приводит к утрате функциональности белка и образованию токсичных агрегатов [20]. Эти структурные изменения могут нарушать взаимодействие белков с другими молекулами, что негативно сказывается на клеточных процессах и способствует патогенезу различных заболеваний.
В ряде работ было изучено [21; 22] влияние вязкости внешней среды (растворителя) на прочность пар оснований ДНК. Авторами было обнаружено, что окружающая молекулу ДНК водная среда является дестабилизирующим фактором для водородных связей между парами оснований. При этом установлено, что сила термодинамического сопротивления растворителя в парах GC, существенно сильнее, по сравнению с парами АТ, что предполагает возможность эффекта компенсации, вызванного растворителем. Показано, что увеличение вязкости может способствовать изменению конформации ДНК. При повышении вязкости молекулы ДНК могут принимать более компактные формы, что влияет на их доступность для взаимодействия с белками и другими молекулами.
В работе [23] было доказано, что образование и динамика открытых состояний в молекуле ДНК зависят от величины внешнего воздействия (торсионного момента) и от вязкости среды. Увеличение вязкости среды приводит к возрастанию крутящего момента, необходимого для возникновения ОС и раскручивания молекул ДНК, что подчеркивает важную стабилизирующую роль вязкости в динамике ДНК. Открытые состояния представляют собой локально расплетенные участки ДНК (рис. 1), играющие важную роль в процессах регуляции экспрессии генов, транскрипции и репликации, однако дополнительные зоны ОС большого размера могут мешать считыванию информации, что приводит к нарушению вышеописанных процессов.
Согласно полученным ранее результатам, установлено, что увеличение длины CAG -тракта в гене ATXN 2
приводит к повышению вероятности появления дополнительных зон ОС большого размера. Кроме того, в

Рис. 1. Зона открытых состояний молекулы ДНК численных экспериментах, посвященных исследованию влияния вязкости и длины CAG-тракта на возникновение дополнительных зон открытых состояний, было установлено, что вероятность возникновения ОС значительного размера увеличивается при длине CAG-тракта, превышающей 40, для исследуемых значений вязкости. На основе полученных данных сделан вывод о том, что при нормальных условиях (в отсутствии патологии) вязкость не оказывает статистически значимого влияния на стабильность молекулы ДНК. Однако при наличии патологических изменений увеличение вязкости способствует повышению стабильности ДНК, в то время как снижение вязкости оказывает обратный эффект [24].
В связи с тем, что экспериментальное исследование динамики молекулы ДНК имеет множество ограничений, на данный момент оптимальным методом исследования является математическое моделирование [25; 26]. Для исследования динамики ДНК разработаны различные математические модели, различающиеся подходом к описанию конформационных изменений и взаимодействий между её структурными элементами. Например, модель Пейярда - Бишопа рассматривает смещения азотистых оснований в направлении, перпендикулярном оси двойной спирали [27–29]. Данная модель хорошо описывает устойчивость ДНК при растяжении, но не учитывает вращательную динамику молекулы и стэкинг-взаимодей-ствия. Угловая модель Якушевич рассматривает вращение азотистых оснований вокруг сахаро-фосфатного остова [30]. Однако данная модель имеет ряд ограничений, в частности, не учитывает нелинейные эффекты (например, различные конформации ДНК) и не позволяет учитывать влияние внешних факторов.
Современные механические модели ДНК позволяют с высокой точностью симулировать реальные процессы в ней [31–36]. Принцип действия модели, взятой за основу в данном исследовании, стоится на рассмотрении молекулы ДНК как механической системы, состоящей из двух цепочек взаимосвязанных маятников. Впервые такая аналогия для моделирования вращательных движений оснований ДНК была применена Инглэндером и соавторами [37].
Такая модель позволяет учитывает неоднородность молекулы ДНК, возможность образования ОС в парах азотистых оснований и применять широкий спектр внешних воздействий [38].
Математическая модель угловой структуры ДНК, используемая в исследовании, позволяет учитывать динамику возникновения ОС в зависимости от вязкости среды и длины CAG -тракта в молекуле ДНК. Данный подход обеспечивает возможность количественной оценки влияния факторов внешней среды на структурную устойчивость polyQ -тракта, что открывает перспективы для прогнозирования развития заболеваний и разработки терапевтических стратегий, направленных на стабилизацию тракта и снижение нейротоксичности.
В исследовании изучалась динамика потенциальной энергии водородных связей в парах оснований и ее влияние на формирование и динамику ОС в гене ATXN2 , содержащем 34, 37, 40, 45, 50, 55 CAG -повторов ( к ) с прерываниями CAA в 25-м положении при значении крутящего момента ( M о ) от 8,28 до 8,62 пН • нм при различных значениях вязкости. Выбор расположения САА-вставки обусловлен полученными ранее данными. В предыдущих расчетах было установлено, что CAA-вставка в 25-м положении играет дестабилизирующую роль в polyQ -тракте [39].
Целью работы являлось исследование влияния вязкости внешней среды на стабильность polyQ -тракта при наличии CAA-прерывания.
Материалы и методы
Математическая формулировка задачи представляет собой систему обыкновенных дифференциальных уравнений относительно угловых отклонений маятников [34]:
I i d^t ) = K ^-( 1^ 2 ф 1 ( 1 ) +
+p i + 1 ( t ) ] - 5 i ( k i 2 R i ( R i + R 2 ) sim p ] +
+k12R1R2sin (ф^ф2))+F1(t), i = 2, n - 1,
I'.' = K 1 IX ( t ) -P 1 ( t ) ]-
-
-5 i ( k^R 1 ( R 1 + R 2 ) sin p l ) +
-
+k12.Ri R 2sin (p1 -p2))+F11( t),
i n d o^ = K n [ф Г - 1 ( t ) -ф ? ( t ) ]-
-5 i ( к П R ( R + R П ) sin p f +
+kin2RnR2n sin (фП -фП )) + Fln (t), i2 dl^=K2 [ф 2-1 (t) - 2ф 2 (t)+ф 2+1 (t)]+
-
+ 5 i ( k i 2 R 2 ( Ri + R 2 ) sin p 2 -
- - ki 2 RiR2 sin (p 2 -ф1 )) + F2 (t), i = 2, n - 1
i ; d l P -W = k 1 [p 2 ( , , p 1 ( , ) ]+
+5 i ( k } 2 R 1 ( R 1 + R 2 ) sin p 2 -
-
- k 12 R I R 2 sin ( ф 2 - ф 1 ) ) + F 2 ( t), (5)
I n d 2^ = K 2 ^ 1 ( t^n ( t ) ] +
+5 i ( k n2 R n ( R n + R n ) sin ф 2 -
-
- k n RnR 2 sin ( ^ n -^ n ) ) + F 2 2 ( t ). (6)
Здесь: фi (t) - угловое отклонение i-го маят ника j-й цепочки, отсчитываемое против часовой стрелки, в момент времени t;
I i – момент инерции i- го маятника j- й цепочки;
Ri – расстояние от центра масс i- го маятника j- й цепочки до нити;
K i – константа, характеризующая крутящий момент i- го участка j- й нити;
-
ki – константа, характеризующая упругие свойства связи i- й пары маятников;
F‘ (t) - внешнее силовое воздействие на i-й маят ник j-й цепочки в момент времени t, п - количество пар маятников в рассматриваемой системе.
В уравнениях (1)–(6) первое слагаемое справа от знака равенства описывает силовое воздействие на i-й маятник со стороны упругой нити, второе слагаемое – со стороны парного маятника, третье слагаемое – внешнее силовое воздействие. Величина внешнего воздействия d ф ‘
Fj(t) = -X₽J-* (t)+ M (t), d ф j где слагаемое -XPi —— (t) моделирует эффекты дисси-j dt пации, обусловленные взаимодействием с окружающей молекулу ДНК жидкостью, слагаемое Mi (t) - торсионный момент [24] (рис. 2). В данном исследовании нами были взяты следующие значения вязкости: λ = 0,9; λ = 1,0 и λ = 1,1, где λ=1,0 – это нормальные условия, λ = 0,9 – снижение вязкости среды, а λ = 1,1 – увеличение.
Уравнения (1)–(6) позволяют описывать водородную связь в i- й паре ( 5 i = 1) и разрыв этой связи ( 5 i = 0).
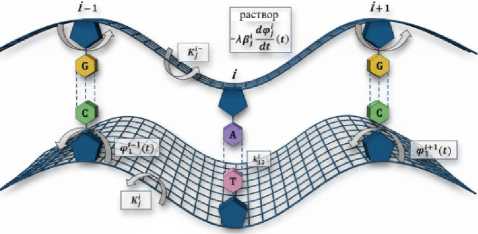
Рис. 2. Графическая иллюстрация предлагаемой математической модели ДНК.
Считаем, что в i -й паре оснований возникает разрыв, если потенциальная энергия связи в этой паре превышает критическое значение E AT для пары AT и E GC для пары GC ; связь восстанавливается, если ее потенциальная энергия становится меньше критического значения.
К уравнениям (1)–(6) добавим начальные условия:
Ф 1 ( 0 ) = Ф i > 0’ d ф 2(0) = Ф i 1 , i = 1, n , (7)
ф 2 ( 0 ) = ф 2,0 , d ф 2 (0) =Ф 2,1 ’ i = 1, n . (8)
Значения для параметров в уравнениях (1)–(6) приведены в табл. 1. Данные взяты из работ [38; 40; 41].
Значения энергии разрыва водородных связей в парах AT и GC взяты из [23]: E AT = 5,1020 пН · нм, E GC = 12,7064 пН · нм.
С помощью начальных условий (7)–(8) задавали невозмущенное состояние, т.е.
Ф 1,0 = Ф 1,1 = Ф 2,1 = 0’ Ф 2,0 = П i = 1’ 2 ’
Торсионное воздействие Mi(t) выбирали постоянным по времени и пространственно локализованным на отрезке [ i 1 , i 2 ], т.е.
M i ( t ) = M 0 , i = 1, n , причем, M i = M o при 1 < i 1 < i < i2 < n и M i = 0 для остальных значений i .
Решение системы (1)–(8) находилось численно c помощью разработанной программы [42].
В состав гена ATXN 2 входит более 130 000 пар оснований. Для расчетов был выбран участок гена ATXN 2, содержащий polyQ -тракт и при 23 CAG -повторах, включающий нуклеотиды с номерами от 4 601 до 6 600 [43], поскольку для стабильности polyQ -тракта существенными являются только около 2 000 пар в первом экзоне. В данном случае участок гена содержит первый экзон и зону возмущений, вызванную приложенным торсионным моментом на расчетном промежутке времени, что позволяет в качестве граничных условий выбрать условие отсутствия возмущений. При изменении размера polyQ -тракта правая граница расчетного участка соответственно увеличивается.
Таблица 1
Коэффициенты уравнений (1)-(6)
|
Тип основания |
A |
T |
G |
C |
|
I • 10 - 44, кг • м2 |
7,61 |
4,86 |
8,22 |
4,11 |
|
R , Å |
5,80 |
4,80 |
5,70 |
4,70 |
|
K •Ю- 18, Н^м, |
2,35 |
1,61 |
2,27 |
1,54 |
|
к Н •Ю- 2, Н/м |
6,20 |
6,20 |
9,60 |
9,60 |
|
^• 10 - 34, Н^м • с |
4,25 |
2,91 |
4,10 |
2,79 |
Результаты
Расчеты показали, что при большой длине polyQ -тракта значимые зоны ОС образуются в промоторной области при значении M 0 > 8,28 пН нм. Увеличение значения торсионного воздействия M 0 может привести к образованию дополнительных зон открытых состояний в polyQ -тракте.
На рис. 3 изображены графики угловых отклонений первой цепочки части гена ATXN 2 при M 0 = 8,0, t о = 1,0.
В работе [27] приведены примеры образования дополнительных зон ОС при различных значениях вязкости среды.
Для исследования влияния CAA-вставки и вязкости на стабильность polyQ -тракта были проведены расчеты количества возникновения дополнительных зон ОС в гене ATXN2 . Полученные данные были проанализированы и систематизированы в таблицы. В качестве примера приведен рис. 4.
Таблицы были заполнены по следующему принципу: по вертикали была отмечена правая граница торсионного воздействия i 2 , которая отсчитывалась от начала выбранного участка гена (левая граница равна левой границе промоторной области, т.е. 663-й пара оснований). По горизонтали отмечены значения величины торсионного момента M 0 . Значения в таблице отражают размер и наличие дополнительных зон ОС при определенно заданных параметрах, т.е. 1 - это наличие дополнительной зоны ОС значительного размера, а 0 - наличие дополнительной зоны ОС незначительного размера или ее отсутствие.
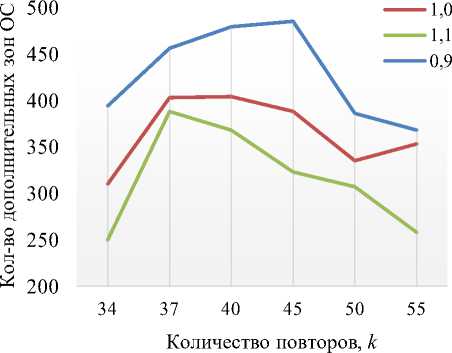
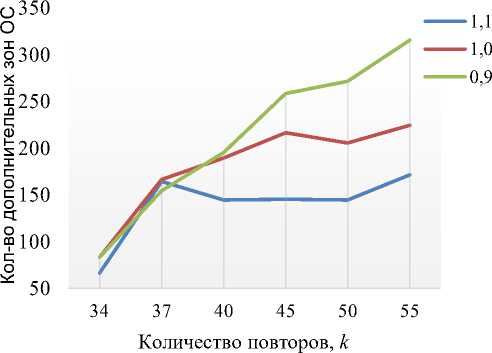
На рис. 5 приведены данные о количестве дополнительных зон ОС значимого размера в polyQ -тракте при различных значениях вязкости и при одиночной CAA-вставке (рис. 5, а ) или ее отсутствии (рис.5, б).
Обсуждение
Взаимодействие ДНК с окружающей жидкостью определяется способностью молекул воды образовывать водородные связи как с азотистыми основаниями, так и между собой, что приводит к формированию неоднородной гидратной оболочки молекулы. В математической модели ДНК не представляется возможным разделить фазы водной среды, поэтому влияние вязкости учитывается через обобщенный параметр (λ). Однако, возможно провести оценку влияния вязкости на динамику отдельных участков гена. Подобный подход имеет важное значение, поскольку энтропийные процессы, возникающие при взаимодействии ДНК с вязкой средой, способны вызывать напряжения суперспирализации в локальных областях молекулы, что согласуется с результатами, описанными в работе [44]. В ряде работ было показано, что вязкость растворителя оказывает значительное влияние на характеристики волновых колебаний ДНК [45-47].
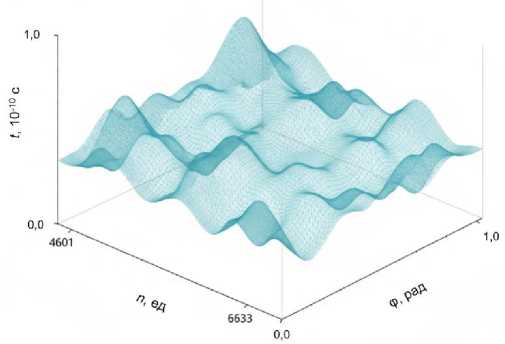
Рис. 3. Графики угловых отклонений 1-й цепочки молекулы ДНК части гена ATXN2 {633, 1255} при M о = 8,0, к = 34, t о = 1,0
Ранее было доказано, что CAA-прерывания в polyQ -тракте влияют на образование дополнительных зон ОС, и это влияние зависит от расположения CAA-прерывания [48]. Так, установлено, что не всегда CAA-вставка увеличивает стабильность polyQ -тракта [39], в 25-м положении она является дестабилизирующим фактором. В связи с этим, необходимо исследовать возможность повышения стабильности молекулы ДНК, например, с помощью изменения вязкости среды.
При сравнительном анализе проведенных расчетов установлено, что CAA-вставка в 25 положение оказывает влияние на стабильность CAG -тракта как при нормальных условиях к = 34, так и в аномалии к > 34 (рис. 5, а ). Однако стоит отметить, что при отсутствии CAA-вставок, присутствует зона пенетрантности при к > 37, после которой происходит увеличение количества дополнительных зон ОС, при этом при к < 37 вязкость не оказывает достоверного влияния на стабильность CAG -тракта, так как количество дополнительных зон ОС имеет незначительное отличие при различных значениях вязкости (рис. 5, б) . При к > 40 было зафиксировано увеличение числа дополнительных зон ОС при X = 0,9 относительно X = 1,0 и уменьшение при X = 1,1.
При вставке CAA в 25-е положение нами получен иной эффект. Вязкость оказывает влияние на стабильность CAG -тракта как при нормальных условиях, так и при количестве CAG -повторов больше 40. При X = 0,9 количество дополнительных зон ОС увеличивается относительно нормальных условий (X = 1,0), а при X = 1,1 -уменьшается. Из чего можно сделать вывод о влиянии вязкости как стабилизирующего фактора при возникновении паркинсонизма. Важно отметить, что данный эффект имеет нелинейный характер.
Расширенные CAG -повторы без CAA-вставок могут приводить к формированию различных вторичных структур, например, шпилек. Данный процесс может привести к геномной нестабильности [49]. Расположение CAA-вставок в полиглутаминовом тракте (polyQ -тракте) является одним из ключевых факторов, определяющих
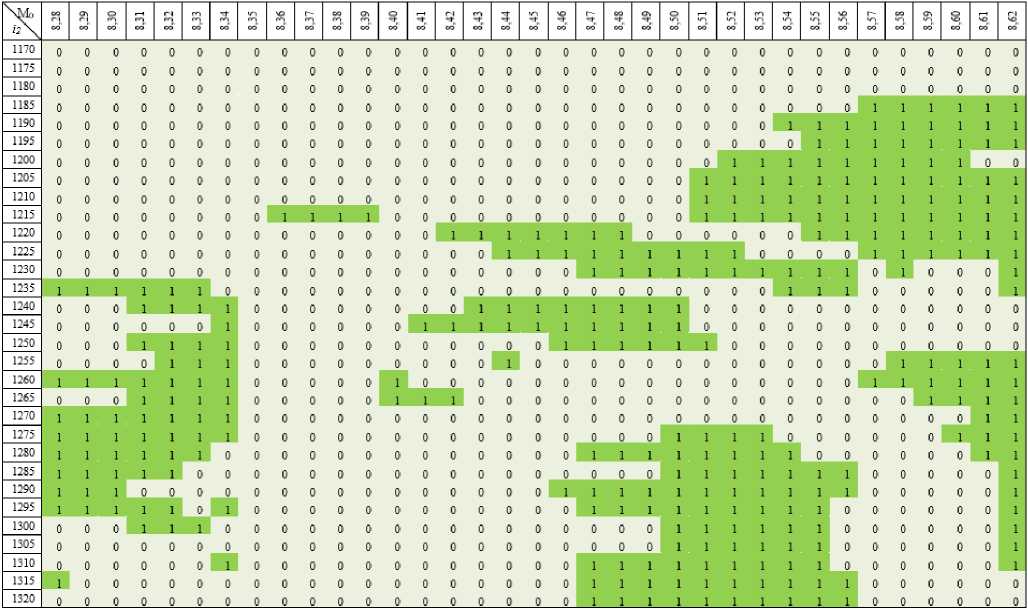
Рис. 4. Вероятность возникновения дополнительных зон ОС, возникающих при торсионном воздействии на участок гена ATXN 2 при k = 45; λ = 1,1
а
Рис. 5. Количество дополнительных зон ОС значимого размера в polyQ -тракте с различными значениями вязкости: а – при CAA-вставке в 25-е положение; б – при отсутствии САА-вставки
б
образование шпилек и других вторичных структур белков [50]. CAA-вставки в полиглутаминовом тракте (polyQ-тракте) изменяют последовательность глутамина, что может приводить к изменению пространственной конфигурации polyQ-тракта [51]. Эти изменения могут как затруднять, так и облегчать образование шпилек, в зависимости от контекста окружающих аминокислот [52]. Кроме того, CAA-вставки оказывают влияние на взаимодействие polyQ-трактов с другими белками и молекулами, что изменяет динамику сворачивания белков и их функциональные свойства [53]. Это взаимодействие может способствовать образованию агрегатов, что имеет важное значение для патогенеза нейродегенеративных заболеваний [54].
Расположение CAA-вставок может создавать дополнительные водородные связи между соседними аминокислотами, что усиливает стабильность шпилек и способствует их формированию в определенных условиях [55]. Понимание роли CAA-вставок в формировании шпилек и других структур является ключевым аспектом для разработки терапевтических стратегий, направленных на предотвращение или коррекцию патологических процессов, ассоциированных с заболеваниями тринуклеотидных повторов.
Необходимо отметить, что угловая модель ДНК имеет несколько ограничений: не учитывает влияние белков и других молекул на конформацию ДНК, что может привести к потере точности в расчетах, кроме того, пространственные ограничения, связанные с размерами и формами молекул, могут оказывать влияние на угловые параметры модели, также, ДНК может проявлять сложные деформации, что связано с её уникальной структурой и физико-химическими свойствами.
Заключение
Установлено, что CAA-вставки в polyQ -тракте играют значительную роль в формировании дополнительных зон ОС и влияют на стабильность


