Исследование структуры рафтов биологических мембран методами компьютерного моделирования
Автор: Боздаганян Маринэ Евгеньевна, Шайтан Константин Вольдемарович
Журнал: Клиническая практика @clinpractice
Рубрика: Фундаментальная медицина
Статья в выпуске: 4 (28), 2016 года.
Бесплатный доступ
Понимание структуры биологической мембраны и ее роли в клетке значительно развилось после введения классической жидкомозаичной модели Сингера и Николсона. Позже жидкомозаичная модель мембраны была переработана и дополнена, значительно усложнена. Экспериментально было доказано, что мембрана состоит из так называемых рафтов, которые представляют собой функциональные «островки» из липидов определенного состава с белками. Липидные рафты играют центральную роль во многих клеточных процессах, в том числе в барьерных функциях мембраны, поляризации клеток и передаче сигналов. Несколько групп патогенных микроорганизмов, бактерий, прионов, вирусов, паразитов используют липидные рафты для своих целей. Рафты всегда возникают с обеих сторон мембраны напротив друг друга, однако природа двуслойности рафтов до сих пор мало изучена. Ранее теоретически было рассчитано, что сдвиг монослоев рафта и возможность деформации межмонослойной поверхности являются для системы дополнительными степенями свободы, что приводит к уменьшению граничной механической энергии, и, в конечном счете, является причиной двуслойности рафта. В данной работе методами молекулярного моделирования мы изучаем энергию взаимодействия монослоев рафта, проверяя гипотезу об их сдвиге относительно друг друга.
Клеточная мембрана, рафт, молекулярная динамика, молекулярное моделирование
Короткий адрес: https://sciup.org/143164619
IDR: 143164619
Текст научной статьи Исследование структуры рафтов биологических мембран методами компьютерного моделирования
Биологические мембраны построены в основном из белков, липидов и углеводов. Белки и липиды составляют основную часть сухой массы мембран. Доля углеводов обычно не превышает 10-15%, причем они связаны либо с молекулами белка (гликопротеины), либо с молекулами липидов (гликолипиды). В мембранах различного происхождения содержание липидов колеблется от 25 до 75% по массе по отношению к белку. Липидный состав биологических мембран весьма различен и зависит от выполняемых функций, изменения в нем ведут к неправильному функционированию [1, 2].
Большое количество экспериментов указывает на то, что в мембране есть наноразмер-ные области, обогащенные сфингомиелином и холестерином – «рафты» (от англ. raft – плот). Будучи ассоциироваными с мембранными белками, рафты играют важную роль в функциональной активности клетки: мембранного транспорта, передачи сигнала, регуляции активности мембранных белков [3, 4].
Ввиду своих малых размеров рафты не могут быть детально исследованы классическими методами с помощью световой микроскопии [5]. Прямые свидетельства наличия рафтов в мембранах in vivo были получены на основе мониторинга движения мембранных белков [6] или на распределении флуоресцентных зондов в мембранных средах [7]. Методами фотонной силовой микроскопии [8] были измерены размеры липидных рафтов и показано, что рафты в плазматической мембране фибробластов диффундируют как агломераты диаметром 50 нм, что соответствует площади поверхности порядка 3000 сфинголипидов. Небольшой размер рафтов может иметь важное значение для поддержания содержащихся в нем сигнальных белков в «выключенном» состоянии. Соответственно, для активации этих белков необходимо сгруппировать малые рафты вместе с образованием большой рафтовой области, в которой функционально родственные белки могут взаимодействовать между собой [9, 10].
Одним из примеров такого процесса кластеризации рафтов, встречающихся в повседневной клинической практике, является передача сигнала от антитела IgE во время аллергического иммунного ответа [11, 12]. Чем больше участников каскада собираются в один рафт, тем выше отклик в ответ на сигнал. Неконтролируемое усиление сигнального каскада в рафте может вызвать гиперактивацию ответа с опасными для жизни последствиями, такими как отек Квинке и анафилактический шок. Таким образом, в передаче сигналов IgE липидные рафты нужны для повышения эффективности передачи за счет концентрации участвующих белков в жидкостных микродоменах, ограничивая их латеральную диффузию [13].
Другим клинически значимым примером кластеризации рафтов являются патогенетические механизмы пороформирующих токсинов, которые секретируются Clostridium , Streptococcus , и Aeromonas [14]. Эти токсины могут вызывать самые разнообразные заболевания, от легкого целлюлита до газовой гангрены и псевдомембранозного колита. Наиболее изученным является токсин аэролизин морской бактерии Aeromonas hydrophila [14, 15]. Аэролизин связывается с GPI-белком, заякоренным в рафте на поверхности мембраны клетки-хозяина. Токсин включается в мембрану после протеолиза, а затем гепта-меризуется в рафте таким образом, чтобы сформировать канал, через который внутрь клетки текут малые молекулы и ионы, нарушая гомеостаз клетки. Олигомеризация аэролизина наблюдается также и в растворе, но на поверхности живой клетки необходимая концентрация токсина ниже более чем в 105 раз [15]. Это огромное увеличение эффективности связано с тем, что при взаимодействии токсина с рафтами происходит агрегация последних, а это, в свою очередь, амплифицирует олигомеризацию большего количества токсинов.
Известно, что многие вирусы целенаправленно связываются с рафтовыми областями мембран, а также имеют сфинголипид/холе-стериновые области в своих мембранах. Вирус гриппа присоединяется к апикальной мембране эпителиальных клеток, которая обогащена липидными рафтами. Вирусная мембрана состоит в основном из рафтовых областей мембраны, что в свою очередь, ускоряет кластеризацию с рафтами клеток хозяина [16]. ВИЧ-1, который также включает в себя рафтовые области и белки хозяина, использует их, по крайней мере в четырех ключевых событиях жизненного цикла: прохождение через слизистую оболочку нового хозяина, проникновение вируса в клетки иммунной системы, передача сигнала об изменениях в функционировании клетки-хозяина, а также выход вирусных частиц из клеток и их распределение в кровеносной системе хозяина [17]. Также было показано, что белки, ответ- ственные за возникновение прионных заболеваний и болезни Альцгеймера, связаны с рафто-выми областями мембран и могут индуцировать развитие этих патологий [18, 19].
Природа основных взаимодействий, которые приводят к образованию неоднородностей в мембране, находится на стадии обсуждения [20]. Известно, что холестерин играет важную роль в стабилизации рафта: при наличии холестерина параметр порядка ацильных цепей повышается, уменьшается площадь, приходящаяся на липид, и следовательно, увеличивается упаковка – плотность – липидных молекул [21– 23]; кроме того, холестерин заполняет пустое пространство в регионе ацильных цепей липидов [21], т.е. с увеличением концентрации холестерина увеличивается жесткость изгиба мембраны. Выше была отмечена трудность выполнения экспериментов с использованием живых клеток для измерения физических свойств рафтов, таких как точный состав липидов, характеристические размеры и время жизни [21, 24, 25]. Поэтому появляется необходимость рассматривать различные модели, чтобы охарактеризовать взаимодействия, ответственные за формирование, стабильность, размер и подвижность различных мембранных доменов. Для этого создаются модельные системы, состоящие из двух и трех видов липидов.
В экспериментах на искусственных мембранах было обнаружено, что большие рафты имеют практически круглую форму и являются бислойными структурами, т.е. располагаются сразу в двух монослоях мембраны симметрично относительно межмонослойной поверхности. В настоящее время причина бислойной природы рафтов не установлена [26]. Обычно считается, что между углеводородными хвостами сфингомиелина, находящегося в разных монослоях, действует эффективное притяжение, однако его величина и причина возникновения неизвестны. Ранее в работах [27, 28] была обсуждена другая возможная причина двуслойности рафта. Авторы предположили, что монослои рафта сдвинуты друг относительно друга. На основании расчетов было показано, что относительный латеральный сдвиг границ доменов в монослоях и возможность деформации межмонослойной поверхности являются для системы дополнительными степенями свободы, что приводит к уменьшению граничной механической энергии. Основная движущая сила, стабилизирующая двуслойную структуру, – упругие дефор- мации мембраны, вызванные различием толщин монослоев рафта и окружающей мембраны. Размеры рафтов (порядка нескольких нанометров), позволяют изучать их методом молекулярной динамики [29–32]. В данной работе мы проверяли гипотезу о двуслойности рафтов в мембранах и роли сдвига монослоев в этом процессе.
Методы
Параметры для липидов, протоколы моделирования были взяты из [32]. Молекулярная динамика проводилась с использованием программного пакета GROMACS [33] Во всех численных экспериментах использовали силовое поле GROMOS (тяжелоатомное приближение) и модель воды TIP3P. Расчет равновесных траекторий проводился в NPT-ансамбле при температуре 323К с термостатом Нозе-Гувера и баростатом Парринелло-Рамана (давление 1 бар). Для потенциала Леннарда-Джонса радиус обрезания составлял 1.2 нм, для расчета электростатических взаимодействий использовался метод PME. Шаг интегрирования – 2 фс. Данные по составу системы представлены в таблице. Все мембраны перед расчетом свободной энергии взаимодействия были эквилибрированы (рис.1). Размер систем – более 450 000 атомов.
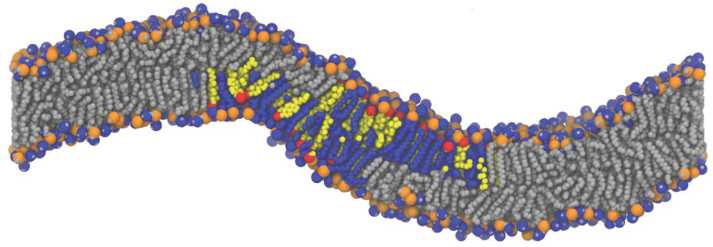
Рис. 1. Вид мембраны со встроенным рафтом: расстояние между центрами масс двух монослоев рафта – 5,4 нм. Серым цветом показаны липиды ПОФХ, синим – СМ, желтым – ХОЛ. Атомы фосфора – оранжевые сферы, атомы кислорода ХОЛ – красные.
Для изучения взаимодействия монослоев рафта был построен профиль свободной энергии для процесса их сдвига друг относительно друга. Были построены мембраны с заранее сформированным рафтом в центре (рис. 2) и различными сдвигами монослоев друг относительно друга. При расчете потенциала средней силы (ПСС) [34] использовался метод зонтичной выборки со следующими параметрами: Энергия взаимодействия двух монослоев рассчитывалась только для x-составляющей.
Константа жесткости k=1000 кДж/моль/нм2
Расстояние между монослоями (position restraints, плоскость yz) – постоянное
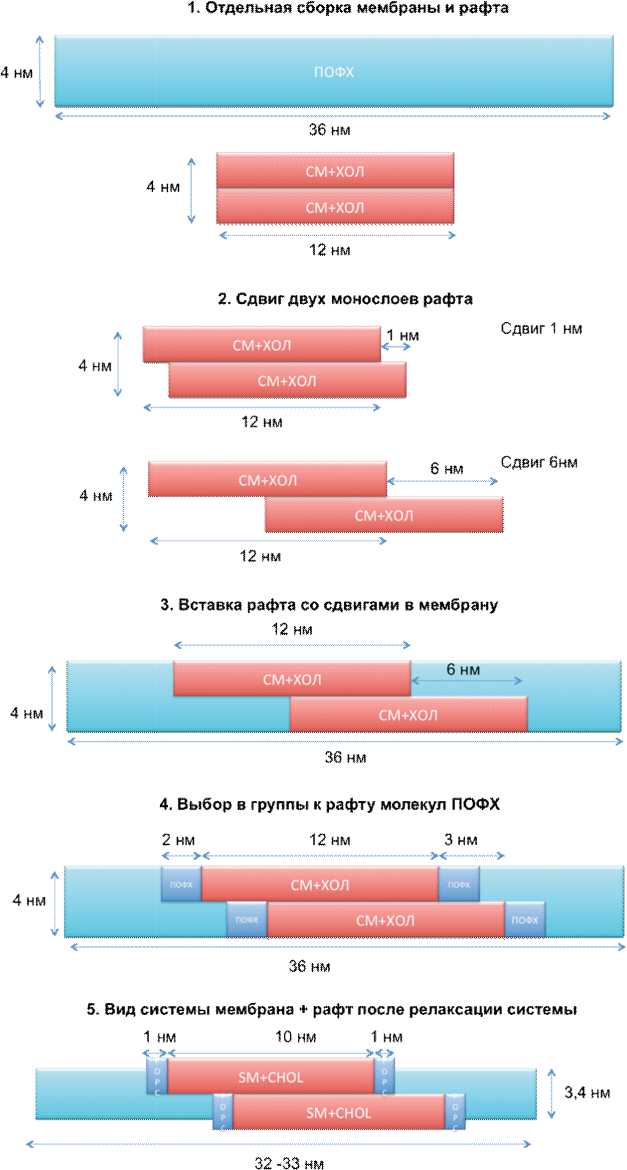
Рис. 2. Схема сборки рафтов со сдвигами монослоев в мембране. Подробное описание каждого этапа представлено в тексте.
Результаты и обсуждение
Изучение взаимодействия монослоев в рафте – трудоемкая задача, так как требует больших вычислительных мощностей, а также подбора оптимального алгоритма расчета. Схема сборки представлена на рис. 2. Сначала (1) были собраны мембрана длиной 36 нм (ПОФХ) и рафт длиной 12 нм (СМ и ХОЛ) по отдельности. На следующем этапе (2) монослои рафта сдвигались друг относительно друга на расстояние 1 нм, т.е. было получено 7 структур рафта со сдвигами: 0, 1, 2, 3, 4, 5, 6 нм. После этого (3) рафты вставлялись в центр мембраны ПОФХ.
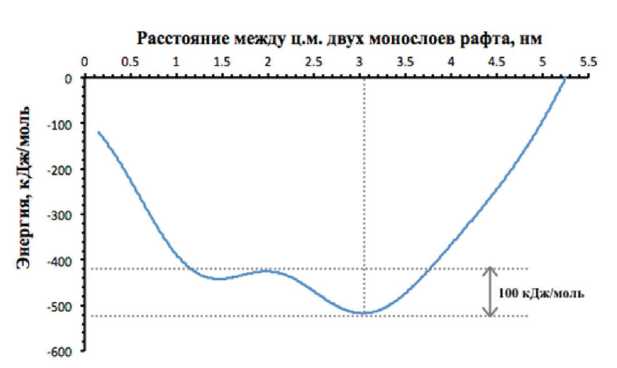
Рис. 3. Профиль свободной энергии двух монослоев рафта при различных сдвигах.
В полученной системе были выбраны несколько молекул ПОФХ (по 2 нм) с обоих концов рафта (4), которые присовокуплялись к группам верхнего («up») и нижнего («down) монослоя рафта. Это было сделано для более точного описания модели [28]. Наконец, после релаксации каждой из семи систем (5), мембрана и рафт слегка «ужались», рафт стал толще, а мембрана тоньше.
Во время релаксации рафт и прилегающие к ним липиды ПОФХ, входящие в группы «up» и «down», изогнули мембрану (Рис. 1). Изгиб мембраны связан со сдвигом монослоев рафта, ранее также были описаны искривления при формировании рафтов [35]. После релаксации полученных структур методом зонтичной выборки была рассчитана кривая взаимодействия монослоев друг с другом в зависимости от сдвига монослоев друг относительно друга. Из начальных точек (0-6 нм) верхний монослой со скоростью 10-5 нм/пс сдвигался на 1 нм. Из траектории движения выбирались положения, в которых будет рассчитана свободная энергия: 0,15, 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,4 – всего 12 точек. Траектории зонтичной выборки обрабатывались по алгоритму WHAM [36].
Кривая расчетов свободной энергии сдвига монослоев представлена на Рис. 3. Из кривой видно, что основной минимум (100 кДж/моль) приходится на сдвиг, равный 3,1 нм. Кривая, рассчитанная методом молекулярной динамики, не совпала с предложенной в [27]. Скорее всего, это связано с тем, что теоретическая модель не учитывает изгиб мембраны, возникающий при сдвиге монослоев рафта.
Заключение
В данном исследовании впервые методами молекулярной динамики был рассчитан профиль свободной энергии сдвига монослоев рафта друг относительно друга в тяжелоатом-
Таблица
Характеристика исследуемых систем
|
Мембрана |
Рафт |
Количество атомов в системе |
Сдвиги монослоев, нм |
Время расчета, нс |
||
|
ПОФХ |
СМ |
ХОЛ |
97943 |
0,15, 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,4 |
Равновесная МД |
ПСС |
|
413 |
104 |
106 |
50 |
50 |
||
Примечание: ПОФХ – пальмитоилолеилфосфатидилхолин,СМ – сфингомиелин,ХОЛ – холестерин
ном приближении. При сдвиге границ фазы рафта образовался изгиб в мембране, который ранее не учитывался авторами в теоретических расчетах.
В работе была численными методами подтверждена теория о сдвиге монослоев рафтов друг относительно друга. Это косвенно может являться доказательством бислойности рафтов по причинам, описанным выше. Кроме того, возникающий изгиб при сдвиге монослоев рафта друг относительно друга, может играть существенную роль в процессах, связанных с образованием кавеол мембран [37, 38], передаче сигналов и кластеризации рафтов и рафт-ассоциированных белков [39], изменять прони- цаемость мембраны для различных веществ и организмов [38].
Понимание процессов возникновения и формирования рафтов, их ультраструктуры может помочь в борьбе со многими инфекционными заболеваниями, вызванными различными патогенами (вирус гриппа, ВИЧ, стрептококками, клостридиями и проч.) [40, 41]. Знание механизмов взаимодействия рафтов между собой и с другими молекулами позволит найти эффективные способы борьбы со многими старческими патологиями, в том числе такими как болезнь Альцгеймера и прионными заболеваниями [19, 42].
Работа выполнена при поддержке гранта РФФИ #16-34-01047мол_а.
Список литературы Исследование структуры рафтов биологических мембран методами компьютерного моделирования
- Mouritsen OG, Kinnunen PKJ. Role of Lipid Organization and Dynamics for Membrane Functionality. Biological Membranes. 1996. pp. 463-502.
- Cullis PR, Fenske DB, Hope MJ. Physical properties and functional roles of lipids in membranes. New Comprehensive Biochemistry. 1996. pp. 1-33.
- Edidin M. The state of lipid rafts: from model membranes to cells. Annu Rev Biophys Biomol Struct. 2003;32: 257-283.
- Pike LJ. Lipid rafts: heterogeneity on the high seas. Biochem J. 2004;378: 281-292.
- Hancock JF. Lipid rafts: contentious only from simplistic standpoints. Nat Rev Mol Cell Biol. 2006;7: 456-462.
- Simons K, Vaz WLC. Model systems, lipid rafts, and cell membranes. Annu Rev Biophys Biomol Struct. 2004;33: 269-295.
- Gaus K, Gratton E, Kable EPW, Jones AS, Gelissen I, Kritharides L, et al. Visualizing lipid structure and raft domains in living cells with two-photon microscopy. Proc Natl Acad Sci USA. 2003;100: 15554-15559.
- Pralle A, Keller P, Florin EL, Simons K, Hörber JK. Sphingolipid-cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. J Cell Biol. 2000;148: 997-1008.
- Harder T, Scheiffele P, Verkade P, Simons K. Lipid domain structure of the plasma membrane revealed by patching of membrane components. J Cell Biol. 1998;141: 929-942.
- Janes PW, Ley SC, Magee AI, Kabouridis PS. The role of lipid rafts in T cell antigen receptor (TCR) signalling. Semin Immunol. 2000;12: 23-34.
- Sheets ED, Holowka D, Baird B. Membrane organization in immunoglobulin E receptor signaling. Curr Opin Chem Biol. 1999;3: 95-99.
- Holowka D, Baird B. Fc(epsilon)RI as a paradigm for a lipid raft-dependent receptor in hematopoietic cells. Semin Immunol. 2001;13: 99-105.
- Kholodenko BN, Hoek JB, Westerhoff HV. Why cytoplasmic signalling proteins should be recruited to cell membranes. Trends Cell Biol. 2000;10: 173-178.
- Lesieur C, Vécsey-Semjén B, Abrami L, Fivaz M, Gisou van der Goot F. Membrane insertion: The strategies of toxins (review). Mol Membr Biol. 1997;14: 45-64.
- Abrami L, van Der Goot FG. Plasma membrane microdomains act as concentration platforms to facilitate intoxication by aerolysin. J Cell Biol. 1999;147: 175-184.
- Zhang J, Pekosz A, Lamb RA. Influenza virus assembly and lipid raft microdomains: a role for the cytoplasmic tails of the spike glycoproteins. J Virol. 2000;74: 4634-4644.
- Alfsen A, Iniguez P, Bouguyon E, Bomsel M. Secretory IgA specific for a conserved epitope on gp41 envelope glycoprotein inhibits epithelial transcytosis of HIV-1. J Immunol. 2001;166: 6257-6265.
- Mizuno T, Nakata M, Naiki H, Michikawa M, Wang R, Haass C, et al. Cholesterol-dependent generation of a seeding amyloid beta-protein in cell culture. J Biol Chem. 1999;274: 15110-15114.
- Baron GS, Wehrly K, Dorward DW, Chesebro B, Caughey B. Conversion of raft associated prion protein to the protease-resistant state requires insertion of PrP-res (PrP(Sc)) into contiguous membranes. EMBO J. 2002;21: 1031-1040.
- Holopainen JM, Metso AJ, Mattila J-P, Jutila A, Kinnunen PKJ. Evidence for the lack of a specific interaction between cholesterol and sphingomyelin. Biophys J. 2004;86: 1510-1520.
- Falck E, Patra M, Karttunen M, Hyvönen MT, Vattulainen I. Lessons of slicing membranes: interplay of packing, free area, and lateral diffusion in phospholipid/cholesterol bilayers. Biophys J. 2004;87: 1076-1091.
- Hofsäß C, Lindahl E, Edholm O. Molecular Dynamics Simulations of Phospholipid Bilayers with Cholesterol. Biophys J. 2003;84: 2192-2206.
- Vainio S, Jansen M, Koivusalo M, Róg T, Karttunen M, Vattulainen I, et al. Significance of sterol structural specificity. Desmosterol cannot replace cholesterol in lipid rafts. J Biol Chem. 2006;281: 348-355.
- Brown RE. Sphingolipid organization in biomembranes: what physical studies of model membranes reveal. J Cell Sci. 1998;111 (Pt 1): 1-9.
- Lee AG. Lipid phase transitions and phase diagrams. II. Mictures involving lipids. Biochim Biophys Acta. 1977;472: 285-344.
- Baumgart T, Hess ST, Webb WW. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 2003;425: 821-824.
- Осипенко ДС, Галимзянов ТР, Акимов СА, Латеральное перераспределение трансмембранных белков и жидко-упорядоченных доменов в липидных мембранах с неоднородной кривизной. Биологические мембраны: Журнал мембранной и клеточной биологии. 2016;33: 176-186.
- Galimzyanov TR, Molotkovsky RJ, Bozdaganyan ME, Cohen FS, Pohl P, Akimov SA. Elastic Membrane Deformations Govern Interleaflet Coupling of Lipid-Ordered Domains. Phys Rev Lett. 2015;115: 088101.
- Niemelä PS, Ollila S, Hyvönen MT, Karttunen M, Vattulainen I. Assessing the nature of lipid raft membranes. PLoS Comput Biol. 2007;3: e34.
- Pandit SA, Jakobsson E, Scott HL. Simulation of the early stages of nano-domain formation in mixed bilayers of sphingomyelin, cholesterol, and dioleyl-phosphatidylcholine. Biophys J. 2004;87: 3312-3322.
- Pandit SA, Vasudevan S, Chiu SW, Jay Mashl R, Jakobsson E, Scott HL. Sphingomyelin-Cholesterol Domains in Phospholipid Membranes: Atomistic Simulation. Biophys J. 2004;87: 1092-1100.
- Bozdaganyan ME, Shaitan KV. Raft formation in biological membranes: A molecular dynamics simulation study. Biochemistry (Moscow) Supplement Series A: Membrane and Cell Biology. 2014;8: 290-296.
- Pronk S, Páll S, Schulz R, Larsson P, Bjelkmar P, Apostolov R, et al. GROMACS 4.5: a high-throughput and highly parallel open source molecular simulation toolkit. Bioinformatics. 2013;29: 845-854.
- Mezei M. Evaluation of the Adaptive Umbrella Sampling Method. Mol Simul. 1989;3: 301-313.
- Meinhardt S, Vink RLC, Schmid F. Monolayer curvature stabilizes nanoscale raft domains in mixed lipid bilayers. Proc Natl Acad Sci USA. 2013;110: 4476-4481.
- Kumar S, Rosenberg JM, Bouzida D, Swendsen RH, Kollman PA. THE weighted histogram analysis method for free-energy calculations on biomolecules. I. The method. J Comput Chem. 1992;13: 1011-1021.
- Sowa G, Pypaert M, Sessa WC. Distinction between signaling mechanisms in lipid rafts vs. caveolae. Proc Natl Acad Sci U S A. 2001;98: 14072-14077.
- Mattson MP. Membrane Microdomain Signaling: Lipid Rafts in Biology and Medicine. Springer Science & Business Media; 2007.
- Bacia K, Schwille P, Kurzchalia T. From The Cover: Sterol structure determines the separation of phases and the curvature of the liquid-ordered phase in model membranes. Proceedings of the National Academy of Sciences. 2005;102: 3272-3277.
- Takizawa N, Momose F, Morikawa Y, Nomoto A. Influenza A Virus Hemagglutinin is Required for the Assembly of Viral Components Including Bundled vRNPs at the Lipid Raft. Viruses. 2016;8. doi:10.3390/v8090249
- Ruiz A, Sarah Hill M, Schmitt K, Stephens EB. Membrane raft association of the Vpu protein of human immunodeficiency virus type 1 correlates with enhanced virus release. Virology. 2010;408: 89-102.
- Williamson R, Sutherland C. Neuronal Membranes are Key to the Pathogenesis of Alzheimer’s Disease: the Role of Both Raft and Non-Raft Membrane Domains. Curr Alzheimer Res. 2011;999: 1-9.


