Исследование устойчивости микроорганизмов к стрессу
Автор: Тумунова С.Б., Замбалова Н.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 3 (30), 2010 года.
Бесплатный доступ
Показано, что высокая устойчивость Bifidobacterium longum B379M и Lactococcus subsp. cremoris к измене- ниям рН и температуры обусловлена присутствием внеклеточных экзополисахаридов этих же микроорганизмов.
Экзополисахариды, биомасса
Короткий адрес: https://sciup.org/142142213
IDR: 142142213 | УДК: 637.146.3,
Текст научной статьи Исследование устойчивости микроорганизмов к стрессу
Основной задачей технологии производства бактериальных препаратов на основе живых микроорганизмов является обеспечение таких условий получения и переработки микробной массы, при которых в готовой продукции сохранялось бы максимальное число жизнеспособных клеток и не утрачивались их полезные свойства.
Однако в процессе производства бактериальных препаратов микроорганизмы испытывают различные стрессы, вызванные изменением условий получения биомассы микроорганизмов и проведением последующих технологических операций, связанных с консервированием клеток.
При подготовке биомассы к сублимационному высушиванию в процессе замораживания, высушивания и регидратации действует целый ряд повреждающих факторов: осмотическое сжатие клеток, скорость и глубина замораживания, образование кристаллов льда, концентрирование компонентов защитной среды и продуктов лизиса поврежденных клеток в незамерзающей фазе и т.д. Кроме этого, важны скорость обезвоживания, компонентный состав и температура регидратирующей жидкости и др.
Предварительное замораживание микроорганизмов как этап, непосредственно предшествующий сушке, является причиной гибели клеток. Считается, что факторы, повреждающие клетки, возникают на этапах охлаждения (замораживания) и отогрева (оттаивания) и обусловлены в основном формированием кристаллов льда, которые способствуют развитию мультифакторных воздействий на структурные компоненты клеток.
Известно, что способность микроорганизмов выживать в неблагоприятных условиях связана с работой индуцибельных адаптационных механизмов. В частности, различные авторы отмечают, что большая часть стрессовых ответов бактерий индуцируется механизмами, включающими внеклеточные компоненты, представленные веществами различной природы [1, 2].
Цель работы - изучение ответа клеток микроорганизмов на различные стрессовые воздействия при получении бактериальных препаратов.
Объекты исследований: Bifidobacterium longum B379M, Lactococcus subsp. cremoris.
Методы исследования . Количество экзополисахаридов определяли антроновым методом. Измерение роста бактериальных клеток проводили оптическим методом при λ= 540 нм. Определение выживаемости микроорганизмов - методом предельных разведений.
Стрессорные факторы. Стрессорное воздействие на микроорганизмы осуществляли путем искусственного создания низких значений рН, замораживания и высушивания биомассы микроорганизмов. рН среды изменяли подкислением до 3 и 5 ед. Замораживание проводили при температуре минус 12оС, высушивание – при температуре 40оС.
Известно, что в результате метаболической активности растущих микроорганизмов состав питательной среды изменяется. При периодическом культивировании микроорганизмов это сопровождается изменением рН среды, т.к. в результате брожения накапливаются органические кислоты, которые могут подавлять рост бактерий. С другой стороны, необходимо учитывать фазу развития культуры, т.к. на ка- ждом этапе развития микробная клетка характеризуется определенными физиологическими особенностями. Результаты выживаемости микроорганизмов при различных значениях рН среды в различные этапы культивирования представлены на рисунке 1.
X
-
■ рН
-
■ рН
-
■ рН
экспоненциальная начало поздняя фаза стационарной ф азы стационарная ф аза
Рис. 1. Влияние рН среды на выживаемость клеток
В ходе проведенных исследований установлено, что при снижении рН среды в экспоненциальной фазе роста до 5 и 3 выживало 30 и 20% клеток, соответственно.
Клетки стационарной фазы роста оказались более устойчивыми к действию низких значений рН. В начале стационарной фазы роста количество жизнеспособных клеток составило 90%, а в более поздней стационарной фазе в аналогичных условиях все клетки остались в жизнеспособном состоянии.
Одним из важных этапов при получении бакконцентратов является отделение биомассы от культуральной среды. При этом эффект выделения бактериальных клеток из культуральной жидкости определяется многими факторами, такими как форма клеток, плотность питательной среды, режим бактериоотделения и пр. При этом существенное влияние на активность полученных препаратов и на стойкость при хранении оказывает продолжительность наращивания биомассы перед ее отделением от культуральной жидкости. Мнения различных авторов на этот счет расходятся. Многие исследователи рекомендуют отделять биомассу в конце экспоненциальной фазы роста, обеспечивая тем самым максимальный выход клеток. Однако в процессе культивирования микроорганизмов в среде накапливаются различные продукты жизнедеятельности микроорганизмов, роль которых с позиции регулирования адаптационных механизмов бактерий к стрессу изучена недостаточно. Поэтому далее исследовали устойчивость микроорганизмов к температурному стрессу. Для этого микробные клетки подвергали криоконсервации и сушке. Результаты представлены на рисунках 2, 3.
Отмечено, что клетки в экспоненциальной фазе развития более подвержены температурному стрессу в отличие от клеток стационарной фазы. В случае криоконсервирования независимо от фазы развития микроорганизмов выживаемость их составила 80%. Однако при высушивании выживаемость клеток экспоненциальной фазы развития микроорганизмов составила 70%. Более устойчивыми оказались клетки стационарной фазы роста.
Вероятно, высокая устойчивость к низким значениям рН, замораживанию и высушиванию объясняется тем, что в процессе культивирования в питательной среде больше накапливается внеклеточных метаболитов, в частности, экзополисахаридов (ЭПС) (рис. 4).
стационарная фаза экспоненциальная фаза до замораживания
0 20 40 60 80 100
Жизнеспособные клетки, %
Рис. 2. Влияние замораживания на выживаемость микроорганизмов
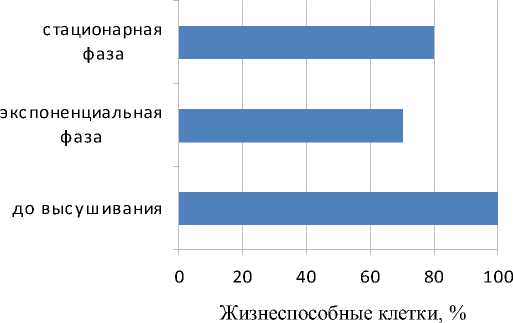
Рис. 3. Влияние лиофильной сушки на выживаемость микроорганизмов
Данные, представленные на рисунке 4, свидетельствуют, что синтез ЭПС начинается с первых часов развития микроорганизмов инокулята и продолжается на всех стадиях. Максимальное количество ЭПС отмечено в стационарной фазе роста. Вероятно, ЭПС, оказывая протекторное действие через физические и химические взаимодействия с клеточными структурами и макромолекулами, защищают клетки от повреждающих воздействий.
Таким образом, в ходе проведенных исследований установлено, что при совместном культивировании Bifidobacterium longum B379M и Lactococcus subsp. cremoris характеризуются высокой устойчивостью к действию низких значений рН среды, замораживанию и сушке. Отмечено, что наиболее устойчивыми к стрессорным воздействиям являются клетки стационарной фазы, что подтверждает протекторное действие экзополисахаридов в отношении микроорганизмов, подвергнутых неблагоприятным условиям внешней среды.
ЭПС, мкг/мл = Distance Weighted Least Squares
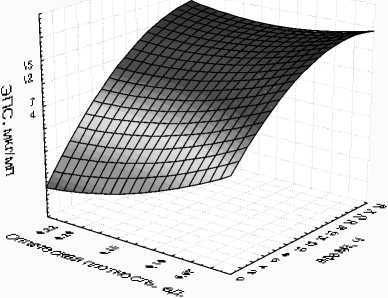
Рис. 4. Накопление биомассы и экзополисахаридов в процессе культивирования


