Исследование возможности снятия отравлений тяжелыми металлами наночастицами селена
Бесплатный доступ
Современный технологический прогресс требует новых решений для стабилизации здоровья человека и животных, в связи с все большим техногенным воздействием на окружающую среду. Каждый год нарастает производство металлов в мире, что приводит к непрерывному загрязнению окружающей среды. Особо стоит отметить негативное влияние тяжелых металлов, которые оказывают пролонгированное и негативное воздействие на живые организмы. Одним из возможных направлений использования наночастиц селена является возможность их использования для снятия отравления тяжелыми металлами, а учитывая, что в литературе есть данные о возможности применения селеноорганических соединений в данных целях, причем в малых дозах, что свидетельствует не о прямом комплекс образовании с тяжелыми металлами, а о активизации иммунной и антиоксидантной системы организма и, как следствие, предотвращении негативного воздействия токсикантов. Нами разработан новый метод синтеза наночастиц селена. Разработанная методика синтеза позволяет синтезировать наночастицы близкого друг другу размера, что положительно должно сказаться на их биологической активности. Синтез наночастиц селена осуществлялся из дихлордиацетофенонилселенида под воздействием аммиака при стабилизации наночастиц ТВИН-80. Было установлено, что наночастицы селена способны снижать степень тяжести отравления солями тяжелых металлов на примере хлорида меди, нитрата ртути и сульфата кадмия при пероральном применении на белых мышах линии BALB/c в дозе 1 мг/кг при LD50=200 мг/кг, что представляет возможность использования данных наночастиц для предотвращения токсических воздействий на организм тяжелых металлов.
Селен, наночастица, отравления тяжелыми металлами, ветеринарный препарат, сульфат кадмия, хлорид кобальта, нитрат ртути, кормовая добавка
Короткий адрес: https://sciup.org/142246740
IDR: 142246740 | УДК: 620.3:619.615:661.155.3 | DOI: 10.31588/2413_4201_1883_4_264_24
Текст научной статьи Исследование возможности снятия отравлений тяжелыми металлами наночастицами селена
Известно, что наночастицы селена могут использоваться для активации антиоксидантной системы [1, 2, 3] и регенерации тканей [4, 5, 6], так же они находят применение при онкологических заболеваниях [7, 8], и патологии щитовидной железы [9].
Тяжелые металлы, которые попадают в организм животных и человека, влияют на различные физиологические функции, повышая количество свободно радикальных реакций, что в дальнейшем приводит к увеличению окислительного стресса в клетках, разрушая клеточные мембраны. Доказано влияние тяжелых металлов и на ферменты, белки, РНК и ДНК, что приводит к широкому спектру нарушений в организме [10].
Кобальт, является незаменимым микроэлементом, однако завышенное потребление кобальта приводит к ряду заболеваний, в частности анемии, неврологическим, сердечно-сосудистым и эндокринным дисфункциям, а также нарушению слуховых и зрительных анализаторов [11].
Соли кадмия обладают токсическим эффектом с накопительными последствиями и представляют особую опасность для мочевыделительной системы, в частности к почечной недостаточности [12].
Ртуть и ее соли представляют особую опасность, связанную с накопительным эффектом и широким распространением данного металла при производстве в качестве побочного продукта, негативное воздействие ртути на организм животных и человека широк и может приводить к самым негативным воздействиям во всем спектре жизнедеятельности [13, 14, 15].
Цель работы: разработать метод синтеза наночастиц селена из селеноорганических соединений, стабилизированных разрешенных в фармацевтической практике поверхностно активным веществом ТВИН-80 и исследовать возможность их применения для снятия отравления тяжелыми металлами на примере сульфата кадмия, нитрата ртути и хлорида кобальта.
Условия, материалы и методы. Исследования проводились на базе ЦКП «Молекулярная биология» и кафедры «Микробиология и биотехнология» ФГБОУ ВО «Саратовский государственный университет генетики, биотехнологии и инженерии имени Н.И. Вавилова». Для синтеза наночастиц селена (nSe) использовался дихлордиацетофенонилселенид, который получали в одну стадию из ацетофенона, селенистой кислоты в условиях кислотного катализа. Для синтеза 1 моля дихлордиацетофенонилсе-ленида при постоянном перемешивании в плоскодонную колбу, снабженную мешалкой и температуре 20^ к 2,4 моль ацетофенона растворенного в этиловом эфире уксусной кислоты, добавляли 1,1 моль селенистой кислоты, растворенной в воде и 3 моля хлороводорода в виде концентрированной соляной кислоты, через 120 минут полученный осадок отфильтровывали, далее промывали водой и ацетоном. Затем полученный дихлордиацето-фенонилселенид растворяли в изопропиловом спирте и добавляли при постоянном перемешивании ТВИН-80, растворенный в воде при соотношении 9:1. В полученный раствор добавляли избыток аммиака и перемешивали на протяжении 5 часов, полученный раствор упаривали на роторном испарителе и получали наночастицы селена с содержанием селена 10%.
Размер частиц определяли методом динамического рассеяния света на приборе Zetasizer Nano ZS.
Для проведения токсичности были использованы белые мыши линии BALB/c, испытания проводили в соответствии с ГОСТ 326442014.
В модельных исследованиях на снятие отравления тяжёлыми металлами было создано 8 групп животных по 10 мышей в каждой.
Животным первой группы перорально вводили 0,89% раствор натрия хлорида в количестве 100 мкл в день на протяжении 7 дней, на 7 сутки через 2 часа после введения производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием внутренних органов (табл. 1, 2). Животным второй группы перорально вводили раствор наночастиц селена стабилизированных ТВИН-80 из расчета 1 мг/кг наночастиц селена в объеме 100 мкл в день на протяжении 7 дней, на 7 сутки через 2 часа после введения производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов (табл. 1, 2). Животным третьей группы перорально вводили раствор хлорида кобальта (CoCl2) в объеме 100 мкл, с дозой 200 мг/кг в течение 7 суток, на 7 сутки через 2 часа после введения токсиканта производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов (табл. 1, 2). Животным четвертой группы перорально вводили нитрат ртути (Hg(NO3)2) в количестве 100 мкл, с дозой 140 мг/кг. Вещества вводили в течение 7 суток, на 7 сутки через 2 часа после введения токсиканта производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов (табл. 1, 2). Животным пятой группы перорально вводили сульфат кадмия (CdSO4) в количестве 100 мкл, с дозой 200 мг/кг, в течение 7 суток, на 7 сутки через 2 часа после введения токсиканта производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов (табл. 1, 2). Животным шестой группы вводили наночастицы селена стабилизированные ТВИН-80 из расчета 1 мг/кг наночастиц селена в количестве 100 мкл, а через 1 час вводили CoCl2 (200 мг/кг), в течение 7 суток, на 7 сутки через 2 часа после введения токсиканта производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов (табл. 1, 2). Животным седьмой группы вводили наночастицы селена стабилизированные ТВИН-80 из расчета 1 мг/кг наночастиц селена в количестве 100 мкл, а через 1 час вводили Hg(NO3)2 (140 мг/кг), в течение 7 суток, на 7 сутки через 2 часа после введения токсиканта производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов (табл. 1, 2). Животным восьмой группы вводили наночастицы селена стабилизированные ТВИН-80 из расчета 1 мг/кг наночастиц селена в количестве 100 мкл, а через 1 час вводили сульфат кадмия (CdSO4) в количестве 100 мкл, с дозой 200 мг/кг, в течение 7 суток, на 7 сутки через 2 часа после введения токсиканта производили транслокацию шейных позвонков с дальнейшим отбором крови и исследованием органов.
Результаты и обсуждение. В результате проведенного синтеза наночастиц были получены частицы размером 15-32 нм стабилизированные ТВИН-80, что было установлено методом динамического рассеяния света (табл. 1, рис. 1), при исследовании на острую токсичность в соответствии с ГОСТ 326442014 было установлено LD 50 =200 мг/кг, что позволяет отнести наночастицы селена к 3 классу опасности.
Таблица 1 - Данные динамического рассеяния света наночастиц селена
|
Size d. nm |
Mean Volume % |
|
3,122 |
3,6 |
|
3,615 |
12,6 |
|
4,187 |
19,0 |
|
4,849 |
18,1 |
|
Size d. nm |
Mean Volume % |
|
5,615 |
14,1 |
|
6,503 |
10,3 |
|
7,531 |
7,7 |
|
8,721 |
5,7 |
|
Size d. nm |
Mean Volume % |
|
10,10 |
3,9 |
|
11,70 |
2,4 |
|
13,54 |
1,2 |
|
15,69 |
0,5 |
|
18,17 |
0,1 |
|
Size d. nm |
Mean Volume % |
|
58,77 |
0,1 |
|
68,06 |
0,1 |
|
78,82 |
0,1 |
|
91,28 |
0,1 |
Statistics Graph (1 measurements)
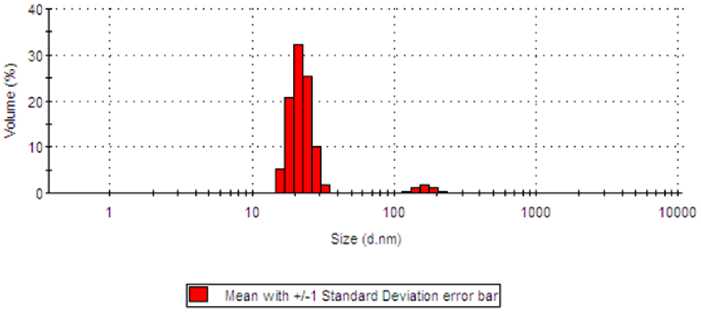
Рисунок 1 - Данные динамического рассеяния света наночастиц селена
В рамках испытания на модельных животных и по результатам вскрытия было установлено, что у животных 1, 2, 6, 7, 8 групп, отсутствие визуальных отклонений органов от нормы.
При этом установлено достоверное повышение трансаминаз в сыворотке крови мышей второй опытной группы АЛТ на 98% и АСТ на 38%, относительно интактных животных, которым в течение 7 дней вводили раствор наночастиц селена (табл. 2). При этом нарушений функциональной активности гепатобилиарной и мочевыделительной систем выявлено не было. Это подтверждается результатами вскрытия животных, а также массовыми коэффициентами внутренних органов, где отклонений от физиологических значений не установлено (рис. 2, 3). Кроме того, отличий второй контрольной группы от интактных мышей первой группы не наблюдалось. Изменения аминотрансфераз в данной группе животных предположительно свидетельствует о повышении активности данных ферментов в результате воздействия селена на их активные центры.
Таблица 2 - Биохимические показатели сыворотки крови мышей экспериментальных групп
|
Показатель |
Ед. изм. |
№ группы |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
0,89 % NaCl |
nSe |
CoCl 2 |
Hg(NO 3 ) 2 |
CdSO 4 |
nSe + CoCl 2 |
nSe + Hg (NO 3 ) 2 |
nSe + CdSO 4 |
||
|
АЛТ |
Е/л |
46 |
91 |
124 |
161 |
106 |
59 |
52 |
51 |
|
±2,9 |
±6* |
±7* |
±12* |
±9* |
±9 |
±6 |
±8 |
||
|
АСТ |
Е/л |
118 |
163 |
216 |
155 |
206 |
107 |
116 |
115 |
|
±12 |
±16* |
±29* |
±15* |
±23* |
±11 |
±8 |
±13 |
||
|
Щелочная фосфатаза |
Е/л |
113 ±5 |
123 ±11 |
296 ±23* |
299 ±22* |
204 ±21* |
119 ±7 |
123 ±14 |
125 ±9 |
|
Мочевина |
ммоль/ |
6,4 |
6,5 |
12,7 |
13,2 |
9,9 |
7,2 |
6,2 |
6,3 |
|
л |
±0,6 |
±0,6 |
±1,8* |
±1,2* |
±1,9* |
±0,9 |
±0,9 |
±0,9 |
|
|
Креати- |
ммоль/ |
25,1 |
26,1 |
81,2 |
95,8 |
82,5 |
24,5 |
26,1 |
24,9 |
|
нин |
л |
±1,3 |
±1,7 |
±4,4* |
±8,5* |
±4,4* |
±2,1 |
±2,2 |
±1,4 |
|
Глюкоза |
ммоль/ |
4,1 |
4,1 |
3,2 |
5,4 |
2,1 |
4,6 |
4,3 |
4,8 |
|
л |
±0,5 |
±0,5 |
±0,4 |
±0,4 |
±0,5* |
±0,2 |
±0,7 |
±0,6 |
|
|
Белок |
г/л |
52 |
55 |
66 |
45,8 |
71 |
55 |
57 |
59 |
|
общий |
±2,8 |
±6 |
±7* |
±3,1* |
±6* |
±4 |
±3 |
±4 |
|
|
Альбу- |
г/л |
21,4 |
22,9 |
19,1 |
16,1 |
15,2 |
23,4 |
21,2 |
21,4 |
|
мин |
±2,5 |
±2,1 |
±1,6 |
±1,6* |
±1,1* |
±1,6 |
±2,1 |
±1,4 |
|
|
Глобулин |
г/л |
35,4 |
33,4 |
44,7 |
31,2 |
56,6 |
32,8 |
33,2 |
32,7 |
|
±3,9 |
±4,8 |
±4,3* |
±2,4 |
±4,3* |
±3,8 |
±5,1 |
±6,1 |
||
Примечание: * - Различие по данному показателю статистически достоверно между относительно первой интактной группы мышей (р<0,05 при t (p,n) =2,26)
Коэффиценты массы органов, %
□ 112 3 П4 5 I б П7 П8
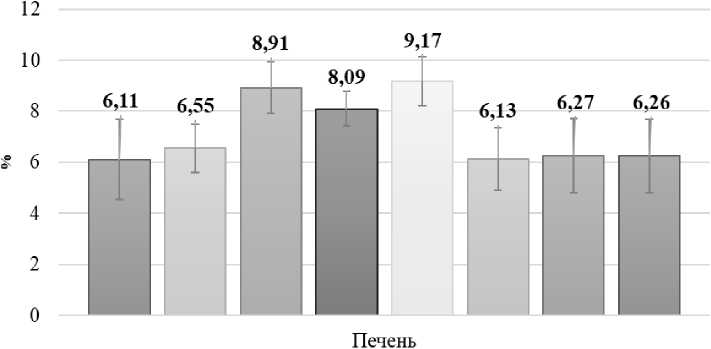
Рисунок 2 - Массовые коэффициенты печени мышей экспериментальных групп
Коэффиценты массы органов, %
2,5
1 □ 2 3 ■ 4 5 С 6 7 8
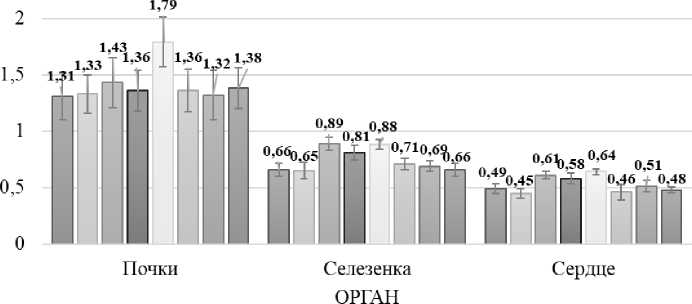
Рисунок 3 – Массовые коэффициенты внутренних органов мышей экспериментальных групп
В третьей, контрольной группе животных наблюдалось достоверное повышение индикаторных ферментов печени, АЛТ в 2,7 раза и АСТ на 83%, а также мембранного фермента щелочной фосфатазы в 2,6 раза, что указывает на повреждение клеточных мембран гепатоцитов, что подтверждается нарушением белкового метаболизма на 27%, увеличение глобулиновой фракции белка на 28%, а также достоверным снижением концентрации сывороточной глюкозы на 22%. Наряду с этим в третьей группе мышей отмечали нарушение функциональной активности почек, о чем свидетельствуют повышенные показатели мочевины на 98% и креатинина в 3,2 раза относительно интактных животных (табл. 2). Также на вскрытии наблюдали гиперемию печени, кровоизлияния в сердечной сорочке. Увеличение массовых коэффициентов печени на 46%, сердца на 24% и селезенки на 35% (рис. 2, 3).
В четвертой контрольной группе мышей, которым вводили в течение 7 суток токсикант Hg(NO3)2 отмечали достоверное увеличение активности аланин-и аспартатаминотрансфераз в 3,5 раза и 31% соответственно, щелочной фосфатазы в 2,6 раза, что указывает на повреждения печени, а также достоверное снижение общего белка на 12% за счет снижения альбуминовой фракции на 25%, что свидетельствует о нарушении функциональной активности органа. Поражение мочевыделительной системы, вызванное введением токсиканта характеризует достоверное увеличение мочевины в 2 раза и креатинина в 3,8 раза в сыворотке крови мышей (табл. 2). Также установлено достоверное увеличение массовых коэффициентов печени на 32%, селезенки на 23% и сердца на 18% (рис. 2, 3).
В пятой контрольной группе мышей, которым на протяжении семи дней орально вводили сульфат кадмия, отмечается достоверное увеличение трансаминаз (АЛТ в 2,3 раза и
АСТ на 75%) и щелочной фосфатазы на 81%, наряду со снижением альбуминовой фракции белка на 29% и достоверным повышением глобулинов на 60%. Данный факт указывает на нарушение функциональной активности печени на фоне повреждения гепатоцитов (табл. 1). Кроме того, отмечается достоверное увеличение коэффициентов печени на 50%, почек на 37%, селезенки на 33% и сердца на 31% при снижении массы тела животных (рис. 2, 3).
В опытных группах мышей, которым на протяжении семи дней наряду с токсикантами вводили раствор наночастиц селена стабилизированных ТВИН-80 показатели сыворотки крови не выходили за пределы референсных значений, отличий показателей опытных групп от интактного контроля выявлено не было (табл. 1). Массы мышей и коэффициенты внутренних органов не отличались от контрольных значений первой группы животных, которым вводили 0,89% раствор NaCl (рис. 2, 3).
Выводы . Таким образом, установлено, что сконструированные наночастицы селена имеют размер 15-32 нм, относятся согласно ГОСТ 32644-2014 к 3 классу опасности. Пероральное применение раствора наночастиц селена стабилизированных ТВИН-80 мышам, в дозе 1 мг/кг по действующему веществу, в объеме 100 мкл, за 2 часа до введения токсиканта, препятствует токсическому действию хлорида кобальта, нитрата ртути и сульфата кадмия на организм животных.
Вышеизложенное позволяет утверждать, что наночастицы могут использоваться как средства для снятия отравлениями тяжёлых металлов.


