Исследование возможности сорбции биологически активных веществ из культуральной жидкости на примере копропорфирина III
Автор: Мишуткин Станислав Николаевич, Бондаренко Филипп Владимирович, Малков Марк Абович, Малков Никита Владимирович, Виноходов Дмитрий Олегович, Гинак Анатолий Иосифович
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 3 т.7, 2019 года.
Бесплатный доступ
При выделении биологически активных веществ, полученных с помощью микробиологического синтеза одной из первых стадий, является фильтрация культуральной жидкости с получением нативного раствора. Это стадия особенно трудоемка, если продуцентом целевого вещества является бактериальная клетка размерами около 1 мкм, поскольку нерастворимые остатки питательной среды и метаболиты продуцента, а также сами клетки забивают фильтрующую поверхность, тем самым повышая гидродинамическое сопротивление настолько, что фильтрация практически останавливается. Для борьбы с этим используются различные дорогостоящие методы, например, метод постоянного обновления фильтрующего слоя путем механического снятия верхней части фильтрующего слоя вместе с твердой фракцией культуральной жидкости. Такой способ применяется на барабанных фильтрах. Барабанные фильтры крупногабаритные, занимают много места на заводе являются дорогостоящими в производстве и эксплуатации. В данной работе на примере копропорфирина III, продуцентом которого является бактерия Arthrobacter globiformis с размерами клетки около 1 мкм, рассмотрена возможность заменить стадию фильтрации более технологичным процессом сорбции целевого продукта непосредственно из культуральной жидкости. Была разработана технология выделения и очистки копропорфирина III c сорбцией копропорфирина III непосредственно из культуральной жидкости без отделения биомассы в пульсирующем-псевдоожиженном режиме с последующей десорбцией. Дальнейшие стадии выделения и очистки включают в себя осаждение целевого вещества путем изменения значения рН раствора, экстракции порфирина из осадка, хроматографической очистки на молекулярном сорбенте, перевод копропорфирина III в калиевую соль и сушку. Технология испытана в лабораторных условиях и получен конечный продукт с высокой степенью очистки.
Копропорфирин iii, пульсирующий-псевдоожиженный режим, выделение, очистка, бактериальная клетка, сорбция, десорбция, культуральная жидкость, технология, биологически активное вещество
Короткий адрес: https://sciup.org/147233283
IDR: 147233283 | УДК: 663.15 | DOI: 10.14529/food190307
Текст научной статьи Исследование возможности сорбции биологически активных веществ из культуральной жидкости на примере копропорфирина III
Фотодинамическая терапия - современный метод органощадящего лечения онкологических и ряда неопухолевых заболеваний человека. Фотодинамическая терапия новообразований опухолевой и неопухолевой природы может быть применена в тех многих случаях, где хирургия, лучевая, химиотерапия и другие методы противопоказаны. Процедура может быть проведена амбулаторно и множество раз, при этом происходит селективное разрушение больной ткани без повреждения здоровой.
Необходимо отметить перспективность неонкологического применения фотодинамической терапии, обусловленную тем, что традиционные методы лечения постепенно теряют свою эффективность. Мультирезистент- ность возбудителей инфекционных заболеваний, их устойчивость к антибактериальным препаратам и, как следствие, рост тяжести инфекционных заболеваний отмечаются во всех странах мира. Общее техногенное снижение иммунологической резистентности, истощение генофонда и ухудшение среды обитания (качества жизни) делает течение давно известных заболеваний все более тяжелыми. Новые мощные антибактериальные препараты только ускоряют процесс развития устойчивости возбудителей. В такой ситуации необходимы принципиально новые подходы к лечению различных заболеваний, в том числе инфекционных, и одним из таких перспективных направлений развития медицинской науки является антимикробная фотодинамическая терапия [1-3].
Копропорфирин III является одним из высокоэффективных фотосенсибилизаторов и способен избирательно накапливаться в злокачественных опухолях, тогда как последующее лазерное облучение разрушает их.
Продуцентом копропорфирина III является культура Arthrobacter globiformis [4].
Анализ патентной и научно-технической литературы свидетельствует о том, что традиционные методы выделения и очистки копро-порфирина III включают стадию этерификации порфиринов и разделение их эфирных производных на оксиде алюминия. Это обусловлено общепринятым мнением, что различные формы порфиринов могут быть эффективно разделены в виде эфирных производных. Таким образом, получают высоко-очищенные нерастворимые в воде формы ко-пропорфирина III.
Описанные методы является трудоёмкими, так как используется стадия получения нативного раствора из культуральной жидкости методом фильтрации. Поскольку продуцентом является бактериальная клетка, при фильтрации на фильтре образуется слой, который забивает поры. Для решения этой проблемы разработаны дорогостоящие методы фильтрации, основой которых является постоянное снятие верхнего слоя фильтрующего материала в процессе отделения твердой фазы от жидкой [5–7].
Целью данного исследования является изучение возможности выделения и очистки копропорфирина III без использования дорогостоящей и трудоемкой стадии фильтрации.
Материалы и методы
Для проведения исследования была взята культуральная жидкость, полученная в результате ферментации при использовании культуры продуцента Artrobacter globiformis на соответствующей питательной среде с содержанием копропорфирина от 200 до 250 мг/л.
Для определения чистоты готового продукта берется точная навеска, растворяется, после чего определяется чистота по следующей формуле [8]:
Х = ( 2D 401 - D 380 — D 430 ) -V-P-K 1 (1)
-
3 D0·K2·a ,
где Х3 – содержание тетракалиевой соли ко-пропорфирина III, мкг/мг; D401, D380, D430 – оптическая плотность разбавленного раство- ра копропорфирина III, при длинах волн 401, 380 и 430 соответственно; V – объем исходного раствора, мл; Р – разведение; К1 – 1,19 – коэффициент для пересчета на тетракалие-вую соль; К2 – 1,835 – поправочный коэффициент; D0 = 0,667 – оптическая плотность раствора с концентрацией 1 мкг/мл; а – масса навески, мг.
Для определения концентрации копро-порфирина III в Н+ форме в культуральной жидкости используется следующая формула [9]:
X = ( 2D 401 - D 3 8 o - D 430 ) •P•0,8170, (2) где D – оптическая плотность при соответствующей длине волны; Х – концентрация ко-пропорфирина III в водном растворе, мкг/мл (мг/л); Р – разведение исходного раствора ко-пропорфирина III; 0,8170 – поправочный коэффициент.
Для определения оптической плотности использовался спектрофотометр марки ПЭ-5400В.
Также использовалась изготовленная лабораторная многосекционная колонка (рис. 1).
Результаты и их обсуждение
Ранее были проведены исследования по определению оптимального сорбента для сорбции и последующей десорбции копро-порфирина III [10]. Результатом работы стало определение коэффициента диффузии разными способами, а именно методом моментов и с помощью уравнения Паттерсона [11–14]. Было определено что из исследованных сорбентов оптимальным является катионит марки КУ-23/100. Поэтому было решено использовать на первом этапе обработки культуральной жидкости сорбент этой марки.
Предлагаемый способ выделения и очистки копропорфирина III основан на сочетании приемов переосаждения путем доведения pH до (3,5 ± 0,1) с хроматографической очисткой на двух разных сорбентах. Данная технология позволяет получать высокоочищен-ную водорастворимую форму копропорфири-на III непосредственно из культуральной жидкости, минуя стадию отделения нативного раствора от биомассы.
Для выделения и очистки копропорфири-на III решено использовать процесс ионного обмена в псевдоожиженном режиме, с последующей хроматографической очисткой на молекулярных макропористых сорбентах.
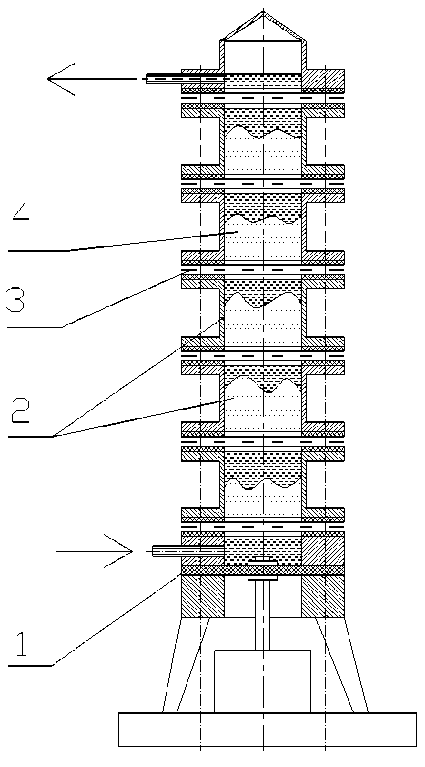
Рис. 1. Многосекционная колонка: 1 – мембрана, 2 – секции, 3 – сетка металлическая с щелевидными отверстиями, 4 – сорбент марки КУ-23/100
Была создана и испытана лабораторная установка – многосекционная колонка (см. рис. 1). Процесс сорбции протекает в псевдоожиженном режиме, культуральная жидкость подается снизу. При этом мембрана, состоящая из двойного слоя резины, пульсирует. При движении мембраны вверх, культуральная жидкость, содержащая частицы взвеси, представляющие собой остатки питательной среды, агломерации клеток продуцентов и т. п., проходит через щелевидные отверстия сетки и псевдоожиженный слой сорбента по направлению снизу вверх, при движении мембраны вниз, слой сорбента уплотняется, и частицы взвеси как бы отфильтровываются слоем сорбента, оставаясь на его поверхности, при повторной пульсации частицы взвеси продвигаются вверх еще на какое-то расстояние, оставаясь практически на том же уровне при обратной пульсации за счет уплотнения слоя сорбента. Таким образом, культуральная жидкость проходит через слой сорбента, при этом не забивая нерастворимыми остатками (взвесью) многосекционную колонну. Количество сорбента, необходимого для сорбции копропорфирина в полном объеме, рассчитывалось по обменной емкости катионита марки КУ-23/100 по отношению к целевому продукту. Поскольку концентрация копропорфирина III в культуральной жидкости колеблется, решено использовать вдвое большее количество сорбента по отношению к расчетному количеству. Колонна состоит из 5 секций, и каждая секция заполняется сорбентом на 2/3 высоты.
Общий объем колонны рассчитывается, по формуле объема цилиндра
V = 2 n RH, (3) где R – внутренний радиус колонны; H – суммарная высота секций колонны.
Объем сорбента составляет две трети от общего объема колонны.
После сорбции копропорфирина из культуральной жидкости колонна промывается водой, далее проводится десорбция целевого продукта водным раствором, содержащим цитрат натрия с концентрацией 1,5 % и мочевину с концентрацией 0,5 %, с рН, доведенным до 6,0. Мочевина и цитрат натрия ослабляют связь сорбента с копропорфирином III, рН раствора выбран в результате ряда экспериментов, в результате которых выяснено: при более высоком значении рН количество раствора для десорбции расходуется меньше, но при этом кроме целевого продукта десорбируется много балластных примесей, что в дельнейшем затрудняет очистку копропорфи-рина III. При более низком значении рН балластных примесей с целевым продуктом десорбируется меньше, но при этом расходуется больший объем элюента. Это приводит к разбавлению копропорфирина, что также усложняет в дельнейшем выделение и очистку целевого продукта.
Общая схема выделения и очистки ко-пропорфирина представлена на рис. 2 и 3. В исходную культуральную жидкость, полученную при культивации продуцента порфирина Arthrobacter globiformis , добавляется соляная кислота концентрацией 35%, из расчета 20 мл на один литр культуральной жидкости. При этом рН культуральной жидкости изменяется от 6,5–7,0 до 1,0–2,0, что переводит копро-порфирин в Н+ форму, а молекула копропор-фирина становится катионом.
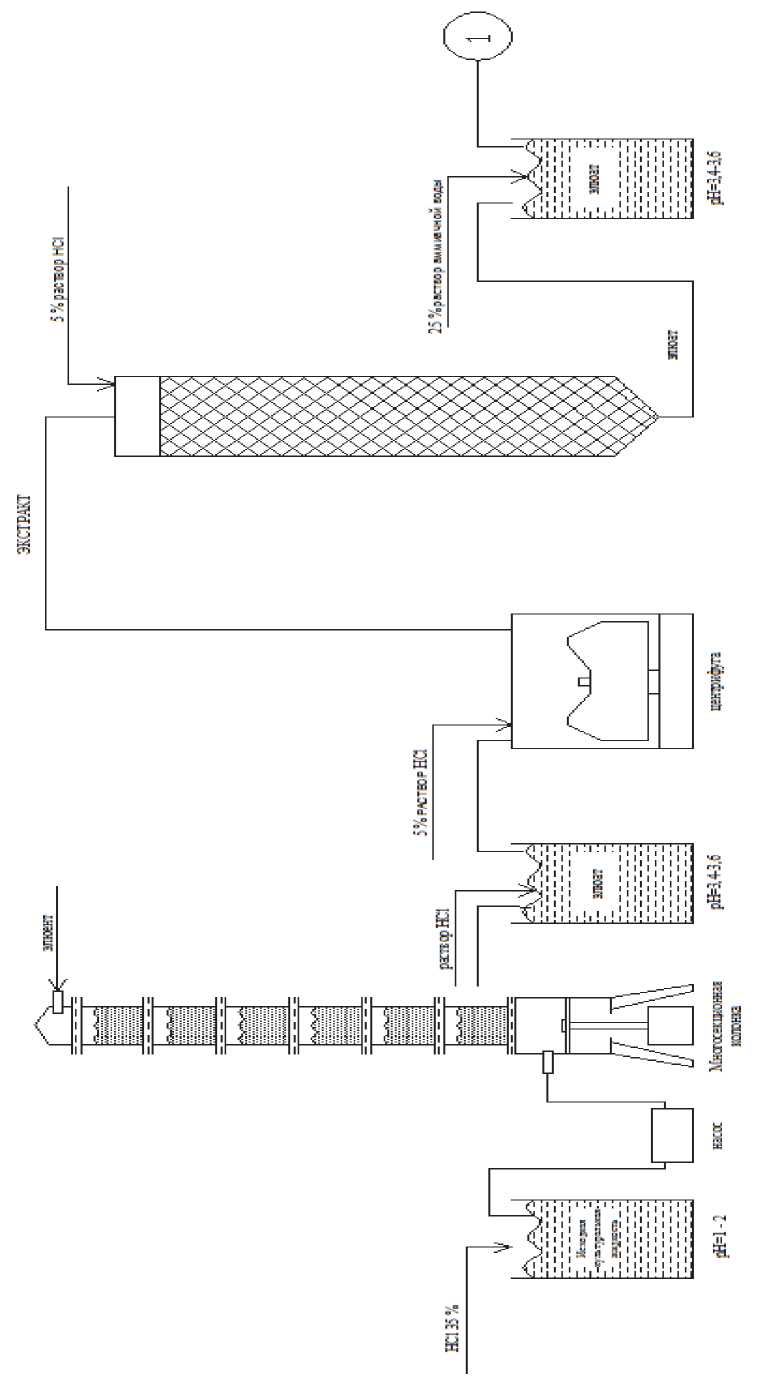
Затем при помощи перистальтического насоса культуральная жидкость пропускается через многосекционную колонку с катионитом КУ-23/100, копропорфирин сорбируется, после чего колонка промывается дистиллированной водой. Далее проводится десорбция целевого вещества с помощью элюэнтной системы, содержащей цитрат натрия и мочевину.
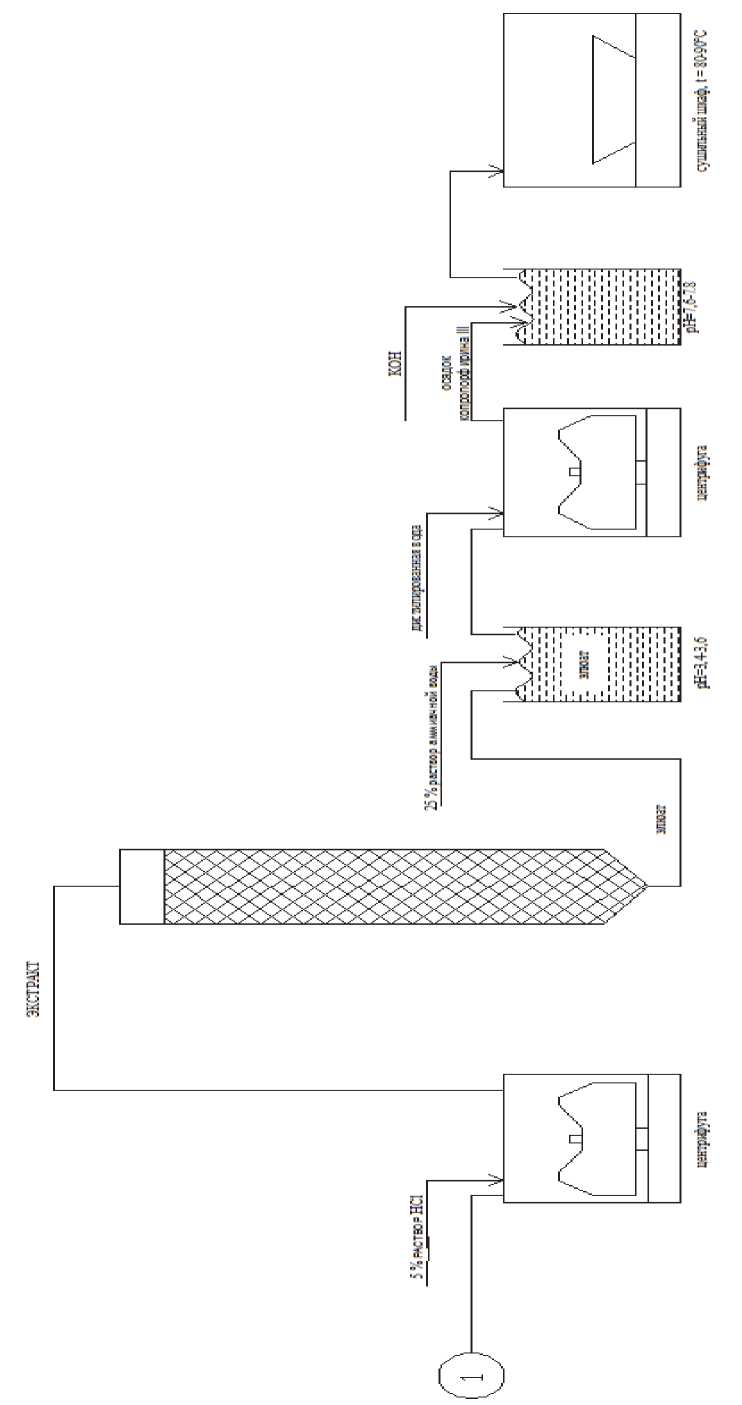
Из полученного элюата копропорфирин III выделяется путём осаждения при доведении рН до (3,5 ± 0,1). Из полученного осадка копропорфирин III выделяется путём экстрагирования 5–7 % раствором соляной кислоты. Полученный экстракт подвергается хроматографической очистке на силикагеле КСК [15]. Из полученного элюата копропорфирин III осаждается доведением рН до (3,5 ± 0,1). Полученный осадок повторно подвергается экстракции 5–7 % раствором соляной кислоты и повторно производится хроматографическая очистка копропорфирина III. Из полученного элюата целевой продукт осаждается и переводится в водорастворимую форму при подщелачивании. Данный способ при подобранной совокупности технологических приёмов позволяет получать высокоочищенный препарат водорастворимой соли копропорфирина III с чистотой 90–95 %. Выход по всем стадиям составляет около 80 %.
Таким образом, созданная технология выделения и очистки копропорфирина III позволяет существенно упростить получение высокоочищенного готового продукта путем исключения трудоемкого, особенно для продуцента – бактериальной клетки, процесса фильтрации культуральной жидкости, и заменой его более технологичным процессом сорбции на катионите. С помощью данной технологии был получен копропорфирин III 95 % чистоты, который был использован для изготовления мази, которая в дальнейшем использовалась для медицинских исследований в области лечения злокачественных опухолей методом фотодинамической терапии [1].
Список литературы Исследование возможности сорбции биологически активных веществ из культуральной жидкости на примере копропорфирина III
- Малков М.А., Петрищев Н.Н., Мишуткин С.Н. Разработка способа фотодинамической терапии для лечения неопластических новообразований с использованием фотосенсибилизатора на основе препарата копропорфирин // Фундаментальные исследования. - 2008. - № 1. - С. 142-146.
- Antonio C.Tedesco, Fernando L.Primo, Priscila da Costa Carvalho de Jesus. Antimicrobial Photodynamic Therapy (APDT) Action Based on Nanostructured Photosensitizers // Multifunctional Systems for Combined Delivery, Biosensing and Diagnostics. - 2017. - Р. 9-29.
- Juan Zhang, Chengshi Jiang, João Paulo Figueiró Longo et al. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy // Acta Pharmaceutica Sinica B. - 2018. - Vol. 8, Iss. 2. - P. 137-146.
- Быховский В.Я., Зайцева Н.И., Полулях О.В. Микробиологический синтез порфиринов / ВНИИСЭНТИ. - М., 1985. - С. 1-7.
- Process for separating porphyrins / Maruhashi kenji [JP]; Kojima ichiro [JP]; Oguchi yutaka [JP]; Endoh noboru [JP]; Satoh tetsuo [JP] // US patent no. 4436663, 1984.
- Полатовская О.Г., Барабанщикова Г.В., Малков М.А. и др. Штамм бактерий Arthrobacter Globiformis - продуцент копропорфирина III и способ получения копропорфирина III. Патент Российской Федерации № 2078138, 1993.
- Быховский В.Я., Зайцева З.И., Радина В.П. и др. Метод выделения копропорфирина III. Авторское свидетельство № 1482946, 1978.
- Falk G.E. Porphyrins and metalloporphyrins. - Amsterdam, New York, Oxford, Elsevier sci. publ. comp., 1964.
- Мишуткин С.Н., Момот Н.Н. Разработка метода анализа содержания копропорфирина III в культуральной жидкости // Журнал прикладной химии. - 2005. - Т. 78, Вып. 11. - С. 1864-1867.
- Мишуткин С.Н., Малков М.А. Изучение кинетики сорбции копропорфирина III на различных катионитах // Биотехнология. - 2009. - № 1. - С. 83-89.
- Самсонов Г.В., Тростянская Е.Б., Елькин Г.Э. Ионный обмен. Сорбция органических веществ. - Л.: Наука, 1969. - С. 240, 245, 259, 264.
- Кокотов Ю.А., Золотарев П.П., Елькин Г.Э. Теоретические основы ионного обмена: Сложные ионообменные системы. - Л.: Химия, 1986. - 280 с.
- Goldstein S. Proc. Roy. Soc., A219. 171. 1953.
- Patterson S. Proc. Physic. Soc. (London), 59, 50, 1947.
- Малков М.А., Мишуткин С.Н., Момот Н.Н. Изучение сорбционных свойств кремнеземных сорбентов. Предмет изучения - копропорфирин III // Современные наукоемкие технологии. - 2005. - № 8. - С. 35-36.


