Изменение концентрации остеотропных гормонов, остеокальцина, гормонов стресс-группы при лечении чрез- и межвертельных переломов
Автор: Свешников А.А., Каминский А.В., Ларионова Т.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2007 года.
Бесплатный доступ
В процессе лечения 24 больных с чрез- и межвертельными переломами методом Илизарова определяли концентрацию костного маркера остеокальцина, остеотропных гормонов и стресс-группы (АКТГ, альдостерон, кортизол), а также гормона роста и циклических нуклеотидов. При активном течении репаративного процесса в 3-5 раз увеличивалась концентрация остеокальцина. Из гормонов стресс-группы с первых часов после перелома в 7 раз возрастала концентрация АКТГ и на протяжении нескольких дней быстро снижалась. Одновременно было повышено содержание паратирина. Концентрация кальцитонина и соматотропина повышалась после снижения содержания паратирина. Динамика изменения циклических нуклеотидов отражает активность репаративного процесса.
Переломы бедра, гормоны стресса, остеокальцин, циклические нуклеотиды
Короткий адрес: https://sciup.org/142121027
IDR: 142121027
Текст научной статьи Изменение концентрации остеотропных гормонов, остеокальцина, гормонов стресс-группы при лечении чрез- и межвертельных переломов
Лечение переломов проксимального отдела бедренной кости, которые относятся к тяжелым повреждениям, до сих пор остается актуальной проблемой для врачей-травматологов. Особое место среди них занимают переломы вертельной области. Наличие высоко остеогенной губчатой кости в зоне перелома и хорошего кровообращения сочетаются со сложными биомеханическими условиями. Среди специалистов по остеопорозу центральная часть этой области известна под названием "пространство Варда", хотя на самом деле, это квадрат со стороной в 1 см. Это самое «слабое» место в проксималь- ной трети бедренной кости. Здесь за год до появления рентгенологических признаков методом фотонной абсорбциометрии выявляются признаки деминерализации и именно в этом месте нередко проходит линия перелома.
Динамический контроль за концентрацией остеотропных гормонов (паратирин, кальцитонин) и костного маркера остеокальцина (синтезируется остеобластами) представляет исключительный интерес для клинициста, занимающегося лечением больных ортопедотравматологического профиля.
МАТЕРИАЛ И МЕТОДЫ
Наблюдения проведены на 24 больных с переломами проксимальной трети бедренной кости. Больные были подразделены на четыре группы в зависимости от характера перелома:
-
1) чрезвертельные переломы 6 больных;
-
2) чрезвертельные с отрывом малого вертела – 6; 3) межвертельные 6; 4) вертельно-диафизарные (межвертельные) с отрывом малого вертела 6.
Чрескостный остеосинтез выполняли с помощью аппарата Илизарова [1]. Он позволял при минимальной травме мягких и костной тканей создать условия для полноценной репарации. Из-за малой травматичности остеосинтез в большинстве случаев проводили по принципам неотложной хирургии. Стабильная фиксация отломков обеспечивала оптимальные условия для регенерации кости, способствуя активизации поведения больных. Уже на следующий день после операции больные могли ходить с помощью костылей. Срок фиксации аппаратом зависел от возраста, давности поступления и тяжести травмы и составлял 50-70 дней.
Содержание гормонов в крови (АКТГ, кальцитонин, паратирин, альдостерон, кортизол, соматотропин) и остеокальцина определяли методом радиоиммунологического анализа с использованием наборов фирмы «Cea Ire Sorin bio international» (Франция), цАМФ и цГМФ – наборами фирмы «Amersham» (Англия). Измерения проводили в первые две недели после оперативного вмешательства, перед снятием аппарата (1,5 месяца фиксации) и через 4 месяца после снятия аппарата. Подсчет величины активности и расчет концентрации гормонов проводился на гамма-счетчике фирмы “Tracor Europa» (Голландия).
В качестве инструмента вычислений использовали пакет статистического анализа и встроенные формулы расчетов компьютерной программы Microsoft® Excell (Microsoft® Office 1997 – Professional Runtime).
Концентрация остеокальцина : увеличение ее свидетельствует о повышении активности остеобластов и начале репаративного процесса. Концентрация остеокальцина зависела от характера перелома (табл. 1): наиболее высокой (28,1±1,3 нг/мл, в норме 6,4±0,4 нг/мл) она была в первой группе (чрезвертельные переломы), где наиболее благоприятные условия для регенерации (трабекулярная кость).
Во второй группе (в силу отрыва малого вертела) активность вначале несколько ниже (26,3±1,9 нг/мл), чем в первой группе, но на 28-й день превосходила (41,3±3,0 нг/мл) величину в первой группе. В третьей и четвертой группах на 14-й день – концентрация была самой низкой (соответственно 24,0±1,2 нг/мл и 20,3±1,0 нг/мл).
Высокая и практически одинаковой концентрация остеокальцина была во всех группах на 28-45 дни. На 60-й день – снижалась, наиболее заметно в первой и второй группах, где репаративный процесс раньше и активнее начинался. В силу активно протекающих перестроечных процессов содержание остеокальцина приближалось к нормальным значениях лишь через 4 месяца после снятия аппарата.
Концентрация гормонов стресс-группы и остеотропных гормонов. В ответ на травму прежде всего реагировала гипофиз-адреналовая система: концентрация АКТГ на 3-й день увеличивалась в 9,3 раза. Такое значительное увеличение концентрации приводило к стимуляции продукции гормонов коры надпочечников: альдостерона в 3,5 раза и кортизола – в 2,6 раза. По существующим представлениям [5] под влиянием альдостерона уменьшается выведение калия из организма, происходит задержка воды, повышается проницаемость тканей в месте травмы, развивается асептическая воспалительная реакция. Усиленное выведение ионов калия вызывает повышение гидрофильности тканей и мышечного тонуса. Конкретным проявлением этого эффекта в наших наблюдениях являлась отечность в месте перелома [2, 3].
Существенно возрастала активность и других эндокринных желез. Концентрация паратгормона на 3-й день увеличена в 8,9 раза. К 14-му дню она достигала максимальных значений (10 раз) и сохранялась на высоких цифрах до 21-го дня, а затем уменьшалась (рис. 1).
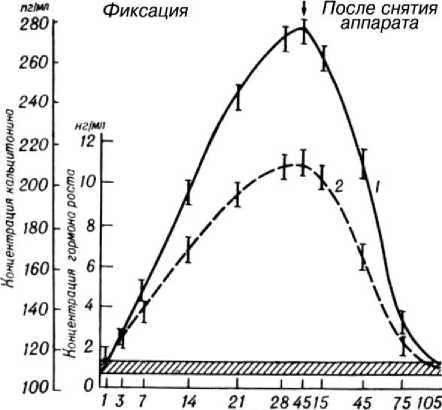
Концентрация гормона роста на 3-й день после перелома была увеличена в крови в 2,2 раза (рис. 2), затем непрерывно возрастала, достигала максимальных значений (10 раз) на 45-й день. В дальнейшем снижалась, оставаясь на высоких величинах (6,4 раза) и после снятия аппарата.
Начало повышения концентрации кальцитонина отмечено на 3-й день. Максимальные значения (увеличение в 2,6 раза) наблюдались на 45-й день. Вслед за этим концентрация уменьшалась, но в течение трех месяцев после снятия аппарата была выше нормы.
Изменения циклических нуклеотидов при лечении переломов практически не изучены. Вместе с тем, их содержание может иметь существенное значение для суждения о тяжести повреждения при травме, об активности репаративного процесса. Результаты исследования в ближайшие часы после травмы указывали на повышенное содержание (2,2 раза) цАМФ, что являлось отражением напряжения адренергических механизмов. В последующие 7 дней концентрация резко уменьшалась (рис. 3). С 7-го по 14-й день снижалась менее интенсивно. К 21-му дню находилась в пределах нормы.
Таблица 1
Концентрация остеокальцина (нг/мл) в крови в процессе лечения чрез- и межвертельных переломов проксимальной трети бедренной кости (М±m)
|
Номер группы |
Дни после перелома |
После снятия аппарата (месяцы) |
||||
|
14 |
28 |
45 |
60 |
2 |
4 |
|
|
Первая |
28,1±1,3 |
37,3±1,6 |
30,1±1,1 |
18,6±1,0 |
8,8±0,6 |
6,4±1,0 |
|
Вторая |
26,3±1,9 |
41,3±3,0 |
35,3±1,5 |
20,1±1,8 |
10,2±1,5 |
7,3±1,3 |
|
Третья |
24,0±1,2 |
38,4±1,9 |
33,4±1,2 |
26,7±1,3 |
8,2±0,4 |
6,1±1,5 |
|
Четвертая |
20,3±1,0 |
34,9±2,0 |
39,7±1,6 |
33,6±1,9 |
12,7±0,6 |
9,3±0,4 |
Примечание: нормальные значения остеокальцина 6,4±0,4 нг/мл.
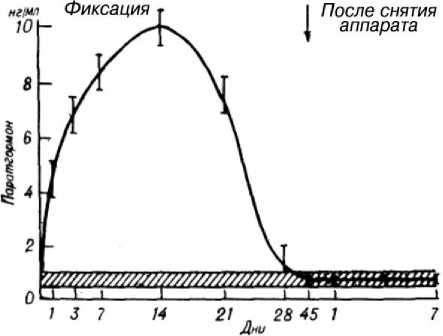
Рис. 1. Изменение концентрации паратиреоидного гормона в процессе лечения больных с чрез- и межвертельными переломами
Дни
Рис. 2. Изменение концентрации кальцитонина (1) и соматотропина (2) в процессе лечения больных с чрез- и межвертельными переломами
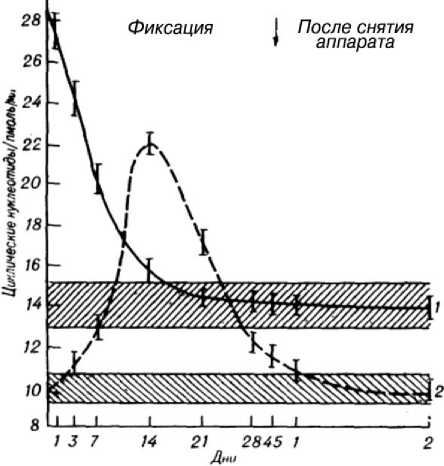
Рис. 3. Изменение концентрации цАМФ (1) и цГМФ (2) в процессе лечения больных с чрез- и межвертельными переломами
Концентрация цГМФ начинала повышаться только на 3-й день. Затем прогрессивно нарастала, достигая максимальных значений к 14-му дню. В дальнейшем снижалась и к моменту окончания фиксации приближалась к верхней границе нормы (рис. 3). Полная нормализация происходила в течение 1-й недели после снятия аппарата.
Практический интерес представляли изменения отношения цАМФ/цГМФ (рис. 4). Сразу после перелома оно было увеличено, со 2-х суток -снижалось, достигая границы нормы на 5-е сутки лечения. Уменьшение продолжалось до 14-х суток лечения. В дальнейшем отмечено его увеличение с нормализацией на 28-е сутки. Уменьшение этого отношения отражает наиболее интенсивную клеточную пролиферацию [10]. Следовательно, определение концентрации циклических нуклеотидов и их отношения имеет существенное значение для прогнозирования исхода лечения. Такое заключение основывается на известном положении о том, что цАМФ играет регулирующую роль в пролиферативном ответе стволовых клеток-предшественников костного мозга [3]. Есть основание предположить, что в период образования костного регенерата в месте перелома факторы микроокружения стволовых клеток костного мозга реализуют свое действие через индукцию синтеза цАМФ, который, в свою очередь, изменяет межклеточные контакты в дифференцирующихся тканях остеогенного аппарата [6]. В регуляции клеточного деления важна роль и цГМФ: он инициирует цепь реакций, ведущих к митозу, и клеточную пролиферацию. Индукторы пролиферации стволовых клеток, взаимодействуя с рецепторами мембран, усиливают транспорт ионов кальция внутрь клетки. Противоположная зависимость уровня цАМФ от содержания кальция обусловливает реципрокные отношения между этими циклическими нуклеотидами, а не антагонистический характер [2]. Повышенный уровень цГМФ стимулирует также освобождение лизосомальных энзимов и гистамина [9].
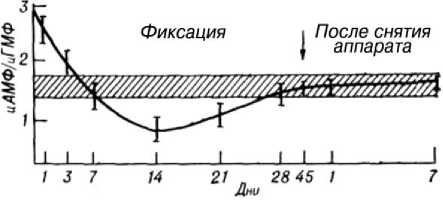
Рис. 4. Соотношение цАМФ и цГМФ в процессе лечения больных с чрез- и межвертельными переломами
Следует также отметить, что при ответе организма на травму происходит одновременное воздействие на клетки ряда гормонов. Значительное увеличение содержания паратирина в начальном периоде после перелома, концентрации кальцитонина и цГМФ на более поздних этапах фиксации согласуется с мнением авторов [1] об активации мезенхимальных клеток, усилении пролиферации костного мозга и резорбции костной ткани.
Результаты проведенных исследований дают основание считать, что жесткая фиксация травмированной конечности в аппарате не только стабилизирует процессы в месте перелома, но и способствует нормализации гомеостаза, свидетельством чего является устойчивая динамика концентрации изученных гормонов и циклических нуклеотидов.
Изменения минеральной плотности (МП) в лучевой кости. МП адекватно отражает изменения в скелете [2], тенденция к снижению ее (на 3,6 %) обнаружена на 7-й день, а статистически достоверная величина (12,6 %) – на 21-й день. Наибольшая величина снижения (15,3 %) была на 28-й день. Затем МП очень медленно увеличивалась и к 45-му дню после снятия аппарата была снижена на 4,8 %. Полное восстановление наблюдалось через месяц после снятия аппарата. Эти изменения МП указывают на существенную роль эндокринной системы, в частности, на длительно сохраняющуюся повышенную концентрацию паратирина.
Результаты исследований свидетельствуют о том, что процессы костеобразования и перестройки костной ткани идут и после наступления клинически определяемого сращения перелома, но ослабляется их интенсивность. Закономерные изменения МП в зоне перелома и в противоположной неповрежденной конечности также подтверждают мысль о первичной мобилизации организмом минеральных веществ в ответ на травму.
Увеличение концентрации паратиреоидного гормона с первых же дней после травмы приводило к растворению костного минерала в результате чего возрастало накопление меченого технефора [7]. Повышенная концентрация этого гормона тормозила продукцию кальцитонина, необходимого для минерализации вновь образующегося органического вещества. Но на 3-й неделе концентрация паратирина начинала снижаться и возрастало содержание кальцитонина и соматотропина.
Кальцитонин, как известно, ослабляет деминерализацию костных фрагментов, тормозит активность остеокластов, увеличивает массу формирующегося регенерата, способствуя перестройке его в зрелую кость. Поэтому содержа- ние этого гормона увеличено и после снятия аппарата.
Изменение соматотропина, как мы видели, происходило однонаправленно с кальцитонином. Он подавляет действие инсулина, стимулирует образование коллагена путем воздействия на биосинтез РНК и ДНК и включение аминокислот в клетки, оказывает влияние на минеральный обмен [7]. В результате такого действия в костных фрагментах прекращалась убыль минералов и их величина начинала возрастать. Изучение гормонального фона в организме явилось дополнительным диагностическим тестом репаративного процесса, в том числе и состояния его отдельных звеньев. Уровень концентрации гормонов подтверждает обоснованность заключений, делаемых по результатам радионуклидных исследований.
В данной работе использовался маркер формирования кости остеокальцин. Он продуцируется остеобластами и является неколлагеновым белком. У подростков концентрация его повышена во время пубертатного периода (1318 лет), у взрослых увеличена в случаях интенсивной перестройки кости. Снижение активности остеобластов сопровождалось уменьшением уровня остеокальцина. Поэтому он служит специфическим индикатором костеобразования. Нами обнаружена его повышенная концентрация в период формирования регенерата.
Но концентрация не всех гормонов изменялась однонаправленно. Как показали наши предыдущие исследования [8, 9], после травм снижается секреция лютеинизирующего гормона. У мужчин уменьшается концентрация тестостерона, у женщин – эстрогенов, что в известной мере снижает концентрацию гормонов, обладающих выраженными анаболическими свойствами (эстрон, андростендион, прогестерон).
Определение уровня гормонов позволило вскрыть внутренние механизмы происходящих изменений. Первоначальное увеличение, а затем снижение их концентрации приводило в движение клеточный пул, активизировало цепь реакций, ведущих к митозу, и клеточную пролиферацию, способствовало дифференцировке их в остеобласты, освобождению химических медиаторов, лизосомальных энзимов и гистамина.
Таким образом, изучение гормонального фона в организме в процессе лечения переломов позволяет контролировать состояние отдельных звеньев репаративного процесса, подтверждает обоснованность заключений, проводимых по результатам радионуклидных исследований.


