Изменения микробиома кишечника у пациентов с множественной миеломой при аутологичной трансплантации гемопоэтических стволовых клеток
Автор: Чеботкевич В.Н., Ковалв А.А., Стома И.О., Грицаев С.В., Бурылев В.В., Кулешова А.В., Киселева Е.Е., Стижак Н.П., Кострома И.И., Кайтанджан Е.И., Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.18, 2022 года.
Бесплатный доступ
Высокодозная химиотерапия с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК) остается стандартом лечения множественной миеломы (ММ). К сожалению, ТГСК часто связана с развитием тяжелой токсичности, желудочно-кишечного мукозита и инфекционными осложнениями. С 1970-х годов кишечная микробиота и ее метаболиты были признаны ключевыми медиаторами исходов аллогенной ТГСК, включая реакцию «трансплантат против хозяина» (РТПХ) и общую выживаемость (ОВ). Однако меньше известно о роли микробиома при аутологичной ТГСК (аутоТГCК). В нашем исследовании изучены изменения микробиома кишечника у 15 взрослых пациентов (9 женщин, 6 мужчин, в возрасте 54-66 лет) с множественной миеломой (ММ), перенесших аутоТГСК. Выявлено достоверное (p=0,0215) снижение индекса разнообразия микробиома после аутоТГСК. Обнаружено значительное снижение представителей Actinobacteria (p=0,0348) на уровне типа. Значимых изменений в уровне других исследованных таксономических типов Bacteroides, Firmicutes, Proteobacteria не обнаружено. Также выявлено, что состав микробиоты связан с частотой и тяжестью посттрансплантационной токсичности (особенно с тошнотой и рвотой) и фебрильной нейтропенией.
Множественная миелома, микробиом, аутологичная трансплантация гемопоэтических стволовых клеток
Короткий адрес: https://sciup.org/170193962
IDR: 170193962
Текст научной статьи Изменения микробиома кишечника у пациентов с множественной миеломой при аутологичной трансплантации гемопоэтических стволовых клеток
Множественная миелома составляет 1% среди всех онкологических заболеваний, но 10–13% от общего числа гемобластозов и 2% летальных исходов среди всех злокачественных опухолей приходится на пациентов с ММ [1]. Высокодозная химиотерапия с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (ау-тоТГСК) остается стандартом лечения множественной миеломы.
Появление новых лекарственных средств, таких как иммуномодулирующие препараты, ингибиторы протеасом и моноклональные антитела, не исключили аутоТГСК и сохранили ее важную роль в лечении больных ММ [2]. Однако значение микробиома при аутоТГСК изучено крайне недостаточно [3]. Между тем нарушение баланса кишечной микробиоты (дисбиотические состояния) приводят к развитию различных нарушений, в частности воспалительных заболеваний кишечника.
Считается, что ведущим фактором, способствующим воз- никновению нарушений микробиома, является антибактериальная терапия [4].
Целью нашего исследования явилось изучение изменений микробиома кишечника до аутоТГСК и после ее выполнения, у пациентов с множественной миеломой.
МАТЕРИАЛЫ И МЕТОДЫ
Было обследовано 15 пациентов с ММ в возрасте 48–67 лет (медиана 60 лет), госпитализированных в ФГБУ РосНИ-ИГТ ФМБА России в период с февраля 2020 по февраль 2021 года для выполнения аутоТГСК. Режим кондиционирования состоял из высокодозной химиотерапии, включавший мел-фалан в дозе 200 мг/м2. Протокол исследования включал сбор и низкотемпературное замораживание образцов кала, полученных от больных до проведения аутоТГСК и в разные сроки от 7 до 35 дней после ее проведения. Среди критериев включения пациентов в исследование было наличие ≥ 3 последовательных секвенированных биологических образцов у одного пациента. После экстракции и очищения ДНК в каждом из биологических образцов выполнялась ПЦР-
Таблица 1. Демографическая и клиническая характеристика пациентов
Всем пациентам проводили стандартную профилактику инфекций флуконазолом и ацикловиром. При развитии фебрильной нейтропении больные получали антибиотики, обладающие активностью в том числе в отношении нозокомиальных грамотрицательных патогенов. Оценку токсичности осуществляли в соответствии с общими терминологическими критериями нежелательных явлений (CTCAE) Национального института рака, версия 4.03 [5].
СТАТИСТИЧЕСКИЕ МЕТОДЫ.
Статистический анализ данных реализован в среде программирования для статистической обработки данных R. Диаграммы размаха построены с помощью пакета ggpubr. Сравнение независимых групп осуществлялось с помощью непараметрических критериев Краскела-Уоллиса (с последующим апостериорным попарным сравнением) и Манна-Уитни. Сравнение связанных групп проводилось с помощью критериев Фридмана (с последующим апостериорным попарным сравнением и Уилкоксона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Время приживления нейтрофилов составило 12 дней
(диапазон от 10 до 16 дней). Фебрильная нейтропения наблюдалась у 4 пациентов. Желудочно-кишечная токсичность 2–3 степени выявлена в 4 (27%) случаях. Всего за время наблюдения было собрано и секвенировано 58 образцов биологического материала.
На первом этапе исследования был изучен индекс альфа разнообразия микробиома (индекс Шеннона) в разные периоды аутоТГСК. Выявлено достоверное (p=0,0215) снижение индекса разнообразия в период после проведения аутоТГСК (рис.1).
Надо отметить, что влияние АутоТГСК достаточно подробно изучено именно в контексте микробиома. В частности, было показано достоверное снижение индекса биологического разнообразия микробиома (индекс Шеннона) у пациентов в динамике при проведении аллоТГСК, при этом выявлен негативный эффект антибиотиков и химиопрепаратов на многообразие микробиома. Кроме того, установлено, что эффект разнообразия микробиома является независимым фактором риска трансплантат-ассоциированной летальности в течение нескольких лет после аллоТГСК. Наши данные показывают, что достоверное снижение индекса биологического разнообразия микробиома (индекс Шеннона) наблюдается и при аутоТГСК. Анализ результатов изучения индекса разнообразия у отдельных больных (рис. 2) показал, что в 6 случаях наблюдалось снижение индекса Шеннона. В трех случаях данный показатель не изменился, и только у одного больного наблюдалось повышение индекса разнообразия в ранние сроки после ТГСК.
Известно, что разнообразный, высокодифференцированный кишечный микробиом имеет защитный эффект против ряда инфекций, включая способность предотвращать колонизацию кишечника высокоустойчивыми патогенами [6-7]. Применение антибиотиков является основным фактором, способствующим обеднению микробиоты и развитию дис-биотических состояний. Антибиотики способствуют отбору полирезистентных энтеробактерий. Среди полирезистент-ных бактерий весомую долю составляют энтеробактерии с продукцией β-лактамаз расширенного спектра (БЛРС). Колонизацию кишечника энтеробактериями с продукцией БЛРС надо рассматривать как предиктор развития бактериемий, вызванных тем же видом бактерий. В одном из наших исследовании [8] энтеробактерии с продукцией БЛРС были выявлены в 24% культур, выделенных у иммуносупресси-рованных онкогематологических пациентов, причем у всех 3 штаммов, выделенных из крови. Выявление в кишечнике энтеробактерий с продукцией БЛРС, вероятно следует расценивать как предиктор развития бактериемий, вызванных тем же видом бактерий [9].
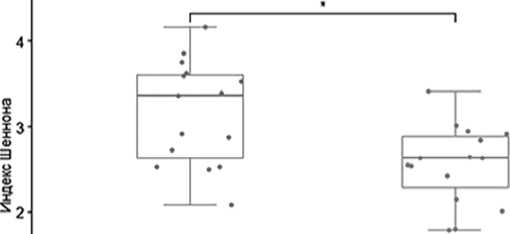
Wikoxon pared test = 20 1 ■ p value = 0 0215
до аутоТГСК
7-35 день после аутоТГСК
Рисунок 1. Индекс разнообразия микробиоты кишечника до и после проведения аутоТГСК
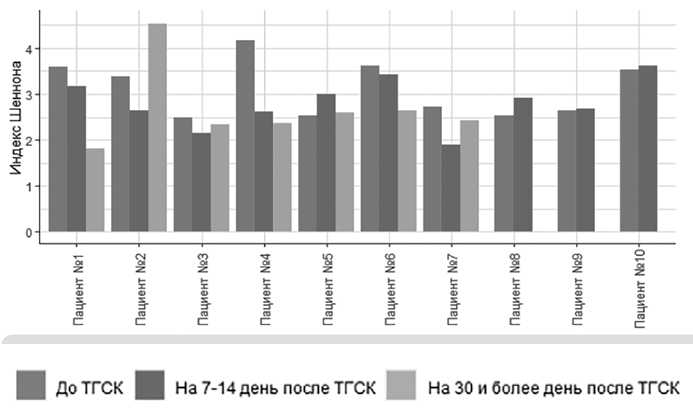
Рисунок 2. Индекс разнообразия микробиоты кишечника у пациентов до ТГСК и после ее проведения.
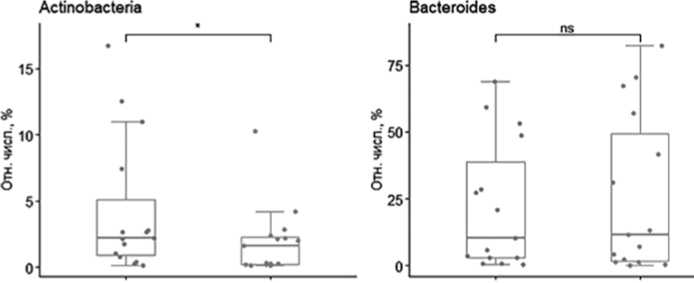
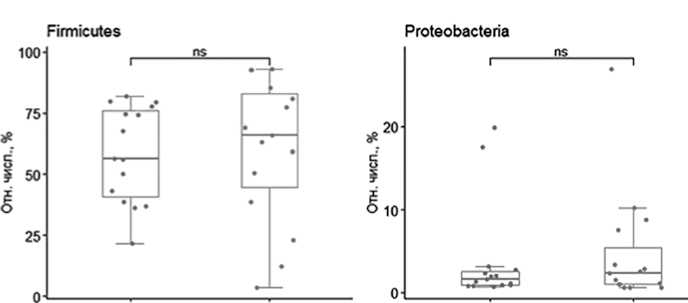
Далее нами были проведены исследования изменения отдельных бактериальных типов в разные периоды после трансплантации с помощью парного теста Уилкоксона. Изучены особенности изменения состава микробиоты на уровне типа до и после аутоТГСК (рис. 3). Установлено, что изменение микробиоты на уровне типа выявлено только в отношении Actinobacteria (Wilcoxon paired test = 18, p=0,0184). Достоверных изменений на уровне типов Bacteroides, Firmicutes, Proteobacteria не обнаружено.
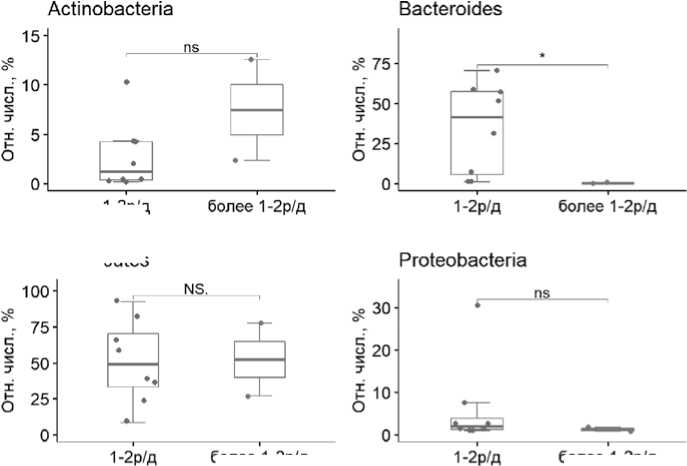
Мы исследовали также возможную связь изменения микробиоты кишечника и развития желудочно-кишечной токсичности. На наш взгляд, использование высоких доз мелфалана и проти-вомикробных препаратов у пациентов, подвергающихся аутоТГСК, приводит к микробному дисбактериозу желудочно-кишечного тракта, что значительно снижает качество жизни больных. Результаты этой серии исследований представлены на рисунке 4. Показано, что при 2 степени токсичности в микробиоте наблюдалось достоверное снижение Bacteroides (Mann–Whitney U test=16, p=0,044) по сравнению с группой больных, у которых выявлена 1 степень токсичности.
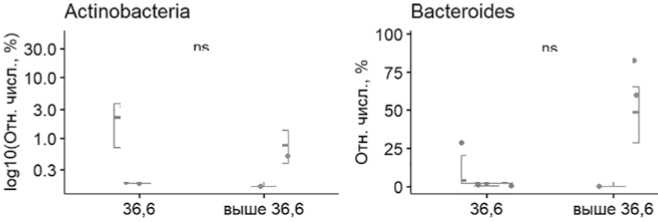
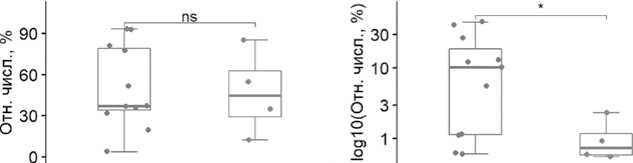
Нами проведено также исследование изменений кишечной микробиоты при развитии фебрильной нейтропении (рис.5)
до аутоТГСК
7-35 день после аутоТГСК
Показано, что при развитии фебрильной нейтропении наблюдается достоверное (Mann–Whitney U test=38, p=0,04) снижение типа Proteobacteria. Это может быть связано с немедленным назначением эмпирической антибактериальной терапии при фебрильной нейтропении, направленной в первую очередь на грамотрицательные возбудители, что существенно снижает плотность Proteobacteria в кишечном микробиоме.
ЗАКЛЮЧЕНИЕ до аутоТГСК
7-35 день после аутоТГСК
Рисунок 3. Изменение относительной численности фекальных бакте-риомов на уровне типа.
Здесь показаны 4 самых многочисленных типа. Столбцы на левом графике - до аутоТГСК, на правом - на 7-35 день после аутоТГСК. * - значимые различия между группами.
Состояние микробиоты у больных гемобластозами привлекает пристальное внимание исследователей с начала 80-х годов прошлого века. Исследованиями последнего десятилетия показана ключевая роль микробиоты при аллогенной ТГСК у больных гемобластозам. Вместе с тем следует отметить, что его значение при отдельных видах гемобластозов, в частности, при множественной миеломе, имеет свои особенности и требует дальнейшего изучения [4]. Кроме того исследования микробиома касаются в основном аллогенной трансплантации. Слабее изучена его роль при аутологичной ТГСК.
Наше исследование показало, что состав микробиоты в ранние сроки после трансплантации коррелирует с тяжестью желудочно-кишечной токсичности (оцениваемой по частоте эпизодов тош-
более 1-2р/д более 1-2р/д
1-2Р/Д
Firmicutes
Рисунок 4. Изменение относительной численности фекальных бакте-риомов при 1 степени и 2 степени желудочно-кишечной токсичности
Firmicutes Proteobacteria
36,6 выше 36,6 36,6 выше 36,6
Рисунок 5. Блок-схемы изменений относительной численности фекальных бактериомов на уровне типа.
ноты и рвоты). Так, при второй степени токсичности (частота эпизодов тошноты и рвоты 3-5 в день) по сравнению с первой степенью (частота эпизодов 1-2 раза в день) наблюдалось значимое (p=0,044) снижение типа Bacteroides в кишечной микробиоте. Эти данные подтверждаются наблюдениями El Jurdi N. et al. [4]. В частности, описана более низкая токсичность [5] у пациентов ММ с высоким содержанием типа Bacteroides в кишечной микробиоте в ранние сроки после проведения АутоТГСК. Нами установлена также взаимосвязь состава кишечной микробиоты и случаев фебрильной нейтропении при АутоТГСК у пациентов с ММ, что подтверждает ранее опубликованные результаты [4]. Кроме того, выявлено значимое (р=0.04) снижение типа Proteobacteria при фебрильной нейтропении при ММ, что может быть объяснено ранними эффектами эмпирической антибактериальной терапии на микробиту кишечника.
Таким образом, несмотря на сравнительно небольшое количество обследованных пациентов в данном пилотном клиническом исследовании, нами установлена достоверная связь изменений микробиоты с желудочно-кишечной токсичностью и развитием фебрильной нейтропении.
Конфликты интересов отсутствует Источник финансирования Исследование не имело источника финансирования
Вклад авторов
Концепция и дизайн: все авторы Сбор и обработка данных: все авторы Предоставление материалов исследования: все авторы
Анализ и интерпретация: все авторы Подготовка рукописи: все авторы Окончательное одобрение рукописи: все авторы


