Изучение ассоциации генетического полиморфизма RS1800629 гена TNFA с развитием иммунного микротромбоваскулита у взрослых в Узбекистане
Автор: Маткаримова Д. С., Каримов Х. Я., Бобоев К. Т.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.15, 2019 года.
Бесплатный доступ
Изучена ассоциация генетического полиморфизма rs1800629TNFa и иммунного микротромбоваскулита(пурпура Шенлейн - Геноха) у взрослых лицв Узбекистане. Полиморфизм rs1800629 генаTNFa оценивали с помощью анализа образцовДНК, полученных из периферической кровистандартной ПЦР. Результаты исследованияпоказали наличие значимого различияв распределении аллеля А (x2 = 4.89; Р = 0.027;OR = 2.53; 95% CI 1.09-5.89) и генотипаG/А (х2 = 5.58; Р = 0.018; OR = 2.92; 95% CI1.18-7.26) гена TNFa (rs1800629) между пациентами в стадии разгара заболеванияи контрольной группой, что в свою очередь свидетельствует о возможном участииуказанного полиморфизма в развитиииммунного микротробоваскулита.
Полиморфизм rs1800629гена tnfa, иммунный микротромбоваскулит(пурпура шенлейн-геноха), генотип
Короткий адрес: https://sciup.org/170172535
IDR: 170172535
Текст научной статьи Изучение ассоциации генетического полиморфизма RS1800629 гена TNFA с развитием иммунного микротромбоваскулита у взрослых в Узбекистане
дение профилактических прививок на фоне или сразу после ОРВИ,очаги хронической инфекции, укусы насекомых; травмы и др. [4]. Однако зачастую фактор, приведший к возникновению иммунного микротромбоваску-лита, установить невозможно.
До настоящего времени окончательно не расшифрованы и патогенетические механизмы развития иммунного микротромбоваску-лита [5].Анализлитературы свидетельствует о возрастающем интересе к изучению значимости молекулярно-генетических маркеров в формировании этого заболевания [6, 7, 8], в частности генов провоспалительных цито- кинов, таких как фактор некроза опухоли-α (TNF-α), участвующих в формировании иммунного ответа, и установлению их роли в развитии иммунного микротромбоваскули-та [9].
TNF-α является цитокином, продуцируемым в основном активированными макрофагами [10]. Данный цитокин участвует в системном воспалении и в патогенезе воспалительных заболеваний. По данным Y. H. Yang et al. (2002), TNF-α увеличивается во время острой стадии болезни Шенлейн-Гено-ха и может усиливать связывающую активность антител IgA против эндотелиальных клеток [11]. Была оценена потенциальная роль TNF-α (rs1800629) полиморфизма в патогенезе болезни Шенлейн-Геноха [3, 14]. Од-нако,некоторые авторы приводят данные об отсутствии связи между генетическим полиморфизмом TNF-α (rs1800629) и развитием заболевания [9], а другие, наоборот, утверждают о ее наличии [13].
Таким образом, результаты существующих на сегодня исследований противоречивы,что обосновывает необходимость проведения дальнейших исследований в этом направлении.
Материал и методы. Висследованиевклю-чено 75 взрослых (основная группа) неродственных пациентовузбекской национальности с установленным диагнозом иммунный микротромбоваскулит (ИМТВ) на основании современных классификационных критериев EULAR, PRINTO и PreS (2010) [11], наблюдавшиеся в консультативно-диагностической поликлинике Научно-исследовательского института Гематологии и переливания крови МзРУз в период с 2017 по 2018 г. г. Из 75 пациентов с иммунным микротромбоваскулитом 41 — находились в стадии разгара (подгруппа «А») и 34 — в стадии ремиссии (подгруппа «В»)заболевания (медиана возраста пациентов составила — 43,5 ± 3,8 лет). Контрольную группу составили 73 здоровых неродственных лица узбекской национальности без воспалительных, аллергических, системных и почечных заболеваний в анамнезе,соответ-ствовавших по полу и возрасту обследованной группе пациентов.
ДНК выделяли из лейкоцитов венозной крови в соответствие со стандартным протоколом выделения ДНК [16]. Детекцию полиморфизма rs1800629 гена TNFα проводилось методом SNP-ПЦР на программируемом термоциклере фирмы «Applied Biosystems» 2720 (США), с использованием тест-систем компании «Литех» (Россия), согласно инструкции производителя.
Специфичность и количество амплифици-рованных фрагментов проверяли методом электрофореза в агарозном геле ( рисунок 1 ).
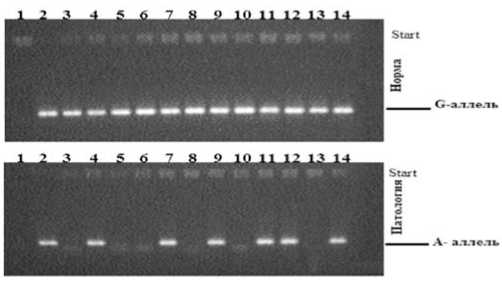
Рисунок 1. Электрофореграмма детекции полиморфизма rs1800629 гена TNF-α в группе контроля и пациентов с иммунным микротромбоваскулитом.
Статистический анализ результатов проведен с использованием пакета статистических программ «OpenEpi 2009, Version 9.3».
Результаты и обсуждение. Нами исследован биаллельный полиморфизм rs1800629 гена TNF-α, который представляет собой замену единственного нуклеотида гуанина на аденин (G/A). В наших наблюдениях у об-24
следованных пациентов с иммунным ми-кротромбоваскулитом (n = 75) в сравнении с группой контроля частота встречаемости неблагоприятного аллеля A возрастает 1,7 раза — с 7.3 % (в популяции) до 12.7 % с колебаниями от 10.3 % у пациентов «В» подгруппы и до 14.6 % у пациентов «А» подгруппы ( таблица 1 ).
Таблица 1.
Анализ результатов исследования полиморфизма rs1800629 гена TNF-α в группах пациентов с иммунным микротромбоваскулитом и группе контроля
|
Группа |
n |
Частота аллелей |
Частота распределения генотипов |
||||||||
|
G |
A |
G/G |
G/A |
A/A |
|||||||
|
n |
% |
n |
% |
N |
% |
n |
% |
n |
% |
||
|
Основная группа ИМТВ |
75 |
131 |
87.3 |
19 |
12.7 |
56 |
74.7 |
19 |
25.3 |
0 |
0 |
|
«А» подгруппа |
41 |
70 |
85.4 |
12 |
14.6 |
29 |
70.7 |
12 |
29.3 |
0 |
0 |
|
«В» подгруппа |
34 |
61 |
89.7 |
7 |
10.3 |
27 |
79.4 |
7 |
20,6 |
0 |
0 |
|
Контрольная группа |
73 |
135 |
92.3 |
11 |
7.3 |
62 |
84.9 |
11 |
15.1 |
- |
0 |
Достоверное увеличение частоты носительства неблагоприятного аллеля A в основной группе пациентов с иммунным микротромбоваскулитом (χ2 = 3.21; Р = 0.073; OR = 2.0; 95 % CI 0.93–4.31), а в подгруппах пациентов «А» — до 14,6 % (χ2 = 4.89; Р = 0.027;
Таблица 2.
Ассоциативная связь между полиморфизмом rs 1800629 гена TNF-α и риском развития ИМТВ в сравнение с контролем
OR = 2.53; 95 % CI 1.09–5.89) и «В» — до 10.3 % (χ2 = 0.46; Р = 0.50; OR = 1.41; 95 % CI 0.52–3.81) свидетельствует об ассоциации данного аллеля c повышенным риском развития иммунного микротромбоваскулита в «А» подгруппе ( табл. 2 ).
|
Статистическое различие |
|||||||
|
Исследуемые |
Аллели |
Relativerisk |
Oddsratio |
p-value (достоверность) |
|||
|
группы |
и генотипы |
(относител |
ьный риск) |
(отношени |
е шансов) |
χ2 |
|
|
RR |
95 % CI: |
OR |
95 % CI: |
||||
|
G |
0.74 |
0.56–0.98 |
0.50 |
0.23–1.08 |
3.21 |
0.073 |
|
|
A |
1.34 |
1.02–1.78 |
2.00 |
0.93–4.31 |
|||
|
Основная группа (n = 75) |
G/G |
0.71 |
0.52–0.97 |
0.46 |
0.20–1.03 |
3.65 |
0.056 |
|
G/A |
1.41 |
1.03–1.94 |
2.19 |
0.97–4.96 |
|||
|
A/A |
— |
— |
— |
— |
— |
— |
|
|
ИМТВ |
G |
0.60 |
0.40–0.89 |
0.40 |
0.17–0.92 |
4.89 |
0.027* |
|
A* |
1.67 |
1.12–2.49 |
2.53 |
1.09–5.89 |
|||
|
с геморрагическим |
G/G |
||||||
|
синдромом |
0.54 |
0.34–0.87 |
0.34 |
0.14–0.85 |
5.58 |
0.018* |
|
|
(n = 41) |
G/A* |
1.85 |
1.15–2.95 |
2.92 |
1.18–7.26 |
||
|
A/A |
— |
— |
— |
— |
— |
— |
|
|
ИМТВ |
G |
0.80 |
0.43–1.48 |
0.71 |
0.26–1.92 |
0.46 |
0.50 |
|
A |
1.25 |
0.68–2.31 |
1.41 |
0.52–3.81 |
|||
|
без геморрагического |
G/G |
0.78 |
0.40–1.51 |
0.68 |
0.24–1.96 |
||
|
синдрома |
0.51 |
0.48 |
|||||
|
(n = 34) |
G/A |
1.28 |
0.66–2.48 |
1.46 |
0.51–4.18 |
||
|
A/A |
— |
— |
— |
— |
— |
— |
|
Примечание: * — статистическое различие по сравнению с контрольной группой.
Следует отметить,что в контрольной выборке иу пациентов с иммунным микротром-боваскулитом встречались только дикий G/G и гетерозиготный G/А генотипы,а носительство неблагоприятного редкого генотипа А/А не выявлено (таблица 1). Наряду с этим, в группе пациентов,в сравнении с контролем в 1,7 раза чаще регистрировали гетерозиготный G/А генотип (25.3 % % против 15.1 %), при этом наибольший процент носительства данного генотипа отмечался в «А» подгруппе пациентов (29.3 %).
Распределениечастоты носительства гетерозиготного генотипа G/А в основной группе пациентов с иммунным микротромбоваску-литом (25.3 % против 15.1; χ2 = 3.65; Р = 0.056; OR = 2.19; 95 % CI 0.97–4.96), а в подгруппах пациентов «А» (29.3 % против 15.1; χ2 = 5.58; Р = 0.018; OR = 2.92; 95 % CI 1.18–7.26) и «В» (20.6 % против 15.1 %; χ2 = 0.51; Р = 0.48; OR = 1.46; 95 %CI 0.51–4.18) свидетельствует обассоциацииданногоаллеля cповышенным риском развития иммунного микротромбо-васкулита в «А» подгруппе (таблица 2).
Вышеописанная частота распределения генотипов полиморфизма rs1800629 гена TNFα (H obs ) как в основной группе больных, так и в контрольной группе соответствовала ожидаемому распределению (Hexp) согласно равновесию Харди-Вайнберга.
При этом замечено,что у пациентов с иммунным микротромбоваскулитом индекс гетерозиготного дефицита при полиморфизме rs1800629 гена TNFα имеет не очень высокий уровень (от 0.25 до 0.22, соответственно), ав контрольнойвыборке — низкий(значение H obs от Hexp были равны 0.15 и 0.14, соответственно), подтверждающие низкий уровень гетерозиготности этого локуса в контроле. При этом, относительное отклонение ожидаемой гетерозиготности от наблюдаемой в обеих группах оказалось положительным (+0.13 и +0.07).
Данное обстоятельство позволяет утверж-дать,что гетерозиготный G/А генотип полиморфизма rs1800629 гена TNF-α достоверно ассоциирован с развитием иммунного ми-кротромбоваскулита у лиц узбекской наци-ональности.Вероятно,это связано с потерей протективного эффекта дикого G/G генотипа у лиц с гетерозиготным типом полиморфизма гена TNF-α (rs1800629), вследствие чего могут развиваться повреждение эндотелия микрососудов.
Носительство редкого гомозиготного генотипа А/А в исследованных группах не вы-явлено,что вероятно связано с эффектом «селективного отбора против неблагоприятного генотипа», т. к. этот полиморфный вариант гена TNF-α ассоциирован с ранним проявлением множественных патологий.
Таким образом, полученные результаты показывают ассоциацию гетерозиготного варианта G/A гена TNFα (rs1800629) с развитием стадии разгара иммунного микротромбо-васкулита у лиц узбекской национальности. Эти результаты вносят вклад в формирование фундаментальных представлений о мо- лекулярно-генетических основах и патогенетических механизмах развития иммунного микротромбоваскулита в Узбекистане.
Заключение. Иммунный микротромбова-скулит является заболеванием, этиопатоге-нетические механизмы которого до настоящего времени до конца не изучены [2, 5]. На сегодня существуют ряд мнений и утверждений, что решающую роль в патогенезе иммунного микротромбоваскулита определяют генетические полиморфизмы [7, 8] . До настоящего времени проведено множество молекулярно-генетических исследований по изучению роли генов в формировании иммунного микротромбоваскулита. Однако данные проведенных исследований в разных популяциях носят противоречивый характер, что возможно связано с этническими различиями с предрасположенностью к развитию данного заболевания.В литературе описываются результаты исследований по изучению роли гена фактора некроза опухоли-α (TNF-α) — провоспалительного цитокина,принимающего участие в системном воспалении и в патогенезе воспалительных заболеваний [11]. По данным Ding GX et al.(2016) [13] аллельА полиморфизма G308A гена TNF-α увеличивает риск развития иммунного микротролмбоваскулита, тогда как другие авторы не обнаружили ассоциацию гена TNF-α с развитием заболевания [9].
В настоящем исследовании изучена генетическая ассоциация между развитием иммунного микротромбоваскулита и полиморфизмом гена TNF — α (rs1800629). Результаты наших исследований показали, что частота встречаемости аллеля А (14.6 % против 7.3 %) и гетерозиготного G/А генотипа (29.3 % против 15.1 %) гена TNF — α (rs1800629) в группе пациентов с иммунным микротромбоваскулитом в стадии разгара значимо выше по отношению к контрольной группе,что в свою очередь свидетельствует о возможном участии указанного полиморфизма в патогенезе заболевания.
Анализируя на сегодняшний день результаты проведенных исследований по изучению молекулярно-генетических механизмов развития иммунного микротромбоваскули-та, учитывая их противоречивый характер очевидно, что генетический механизм развития заболевания является весьма сложным и до конца не изученным.
Список литературы Изучение ассоциации генетического полиморфизма RS1800629 гена TNFA с развитием иммунного микротромбоваскулита у взрослых в Узбекистане
- Гуляев С. В., Стрижаков Л. А., Моисеев С. В., Фомин В. В. От пурпуры Шенлейна-Геноха до IgA-васкулита: патогенетические аспекты болезни. Терапевтический архив. 2018; 10: 109-114.
- Cojocariu С., Stanciu С., Ancuta С., Danciu М., Chiriac S., Trifan A. Immunoglobulin A Vasculitis Complicated with Clostridium difficile Infection: a Rare Case Report and Brief Review of the Literature. // J Gastrointestin Liver Dis, June 2016 Vol. 25 No 2: 235-238 DOI: http://dx. doi. org/10.15403/ jgld.2014.1121.252. csd.
- Ding G. X., Wang C. H., Che R. C., Guan W. Z., Yuan Y. G., Su M. et al. Heat shock protein 70-2 and tumor necrosis factor-alpha gene polymorphisms in Chinese children with Henoch-Schonlein purpura. World J Pediatr 2016;12:49-54.
- Gui-Xia Ding, Chen-Hu Wang, Ruo-Chen Che, Wan-Zhen Guan, Yang-Gang Yuan, Min Su, Ai-Hua Zhang, Song-Ming Huang. Heat shock protein 70-2 and tumor necrosis factor-a gene polymorphisms in Chinese children with Henoch-Schönlein purpura. World J Pediatr, Online First, November 2015. www. wjpch. com. doi: 10.1007/ s12519-015-0048-9.
- He X., Yu C., Zhao P., Ding Y., Liang X., Zhao Y., Yue X., Wu Y., Yin W. The genetics of Henoch-Schönlein purpura: a systematic review and meta-analysis. Rheumatol Int. 2013 Jun;33(6):1387-95. doi: 10.1007/s00296-012-2661-4. Epub 2013 Jan 17. PMID:23325094 D0I:10.1007/s00296-012-2661-4.
- Hetland L. E., Susrud K. S., Lindahl K. H. Bygum A. Henoch-Schönlein Purpura: A Literature Review.//Acta Derm Venereol 2017; 97: 1160-1166doi: 10.2340/00015555-2733.
- Jennette J. C., Falk R. J., Bacon P.A. et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. //Arthritis & rheumatism Vol. 65, No. 1, January 2013, pp 1-11 DOI 10.1002/ art.37715.
- López-Mejías R, Castañeda S, González-Juanatey C, Corrales A, Ferraz-Amaro I, Genre F, et al. Cardiovascular risk assessment in patients with rheumatoid arthritis: the relevance of clinical, genetic and serological markers. Autoimmun Rev 2016; 15:1013-30.
- López-Mejías R. et al. Genetics of immunoglobulin-A vasculitis (Henoch-Schönlein purpura): An updated review / Autoimmunity Reviews 17 (2018) 301-315.
- Miller S. A., Dykes D. D., Polesky H. F. A simple salting out procedure for extracting DNA from human nucleated cells. Nucl Acids Res. 1988; 16:1215.
- Ozen S., Pistorio A., Iusan S. M., et al. EULAR/PRINTO/PRES criteria for HenochSchönlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis: Ankara 2008. Part II: Final classification criteria. Ann Rheum Dis 2010; 69:798-806.
- Rigante D, Castellazzi L, Bosco A, Esposito S. Is there a crossroad between infections, genetics, and Henoch-Schönlein purpura? Autoimmun Rev. 2013;12:1016-1021
- Sohagia AB, Gunturu SG, Tong TR, Hertan HI. Henoch-schonlein purpura — a case report and review of the literature. Gastroenterol Res Pract 2010; 2010: 597648.
- Wang J. J., Shi Y. P., Huang Y., Wu C., Li X. C. Association of tumor necrosis factor-alpha gene polymorphisms with Henoch-Schonlein purpura nephritis in children. Zhongguo Dang Dai ErKe Za Zhi 2013;15:88-90.
- Yang Y. H., Lai H. J., Kao C. K., Lin Y. T., Chiang B. L. The association between transforming growth factor-beta gene promoter C-509T polymorphism and Chinese children with Henoch-Schonlein purpura. Pediatr-Nephrol 2004;19:972-5.
- Yang Y. H., Wang S. J., Chuang Y. H., Lin Y. T., Chiang B. L. The level of IgA antibodies to human umbilical vein endothelial cells can be enhanced by TNF-alpha treatment in children with Henoch-Schonlein purpura. Clin Exp Immunol 2002;130:352-7.


