Изучение биологических взаимоотношений и биохимических свойств пробиотических микроорганизмов
Автор: Щкотова А.В., Атласова Д.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 3 (86), 2022 года.
Бесплатный доступ
В статье представлены данные по изучению биологических и биотехнологических свойств отдельных штаммов пробиотических микроорганизмов (лактобактерий и бифидобактерий) с целью создания новых эффективных консорциумов. Подбор штаммов для совместного культивирования проводили по принципу биосовместимости с применением капельной методики. Выявлены особенности межбактериальных взаимодействий как с представителями своего рода, так и с другими микроорганизмами. Изучен биотехнологический потенциал пробиотических микроорганизмов с учетом протеолитической активности и адгезивной способности штаммов. Выделена группы микроорганизмов (Lactobacillus curvatus LCR-111-1, Lactobacillus plantarum 8РАЗ, Lactobacillus fermentum 44/1 и Lactobacillus paracasei к-406), перспективных в отношении совместного культивирования. Полученные данные могут быть использованы при создании новых функциональных продуктов и биологически активных добавок.
Пробиотические микроорганизмы, полиштаммовый консорциум, биосовместимость, протеолитическая активность, адгезивные свойства
Короткий адрес: https://sciup.org/142235759
IDR: 142235759 | УДК: 579.674 | DOI: 10.53980/24131997_2022_3_36
Текст научной статьи Изучение биологических взаимоотношений и биохимических свойств пробиотических микроорганизмов
Пандемия COVID-19 повысила внимание к питанию, связанному с иммунитетом. Большинство потребителей предпочитают продукты с доказанными лечебнопрофилактическими свойствами. Значительно возрос спрос на пробиотические молочные продукты из-за растущей осведомленности населения об их прямой связи с пользой для здоровья пищеварительной системы [1]. Здоровая микрофлора кишечника является одной из важнейших факторов благополучия человека [2–6]. В связи с этим производство пробиотических пищевых продуктов на основе наиболее значимых представителях микрофлоры желудочно-кишечного тракта человека остается актуальным.
В 2015 г. на съезде Федерации европейских микробиологических обществ (FEMS) была выдвинута теория о создании и использовании для профилактики ряда болезней препаратов и продуктов, содержащих поликомпонентные пробиотические консорциумы [7]. Поиск штаммов пробиотических культур, способных активно развиваться при совместном культивировании, повышая свои биологические, пробиотические и технологические свойства, является актуальным и востребованным направлением микробиологии. Одной из основных причин низкой эффективности пробиотических продуктов питания на основе поликомпонентных микробных консорциумов является неэффективный подбор видового состава микроорганизмов без учета их биосовместимости, кинетики роста и биотехнологического потенциала каждого штамма. Это приводит к снижению количества живых клеток бактерий и утрате функциональных свойств [8].
Изучение биологических межштаммовых взаимодействий пробиотических культур является основой при подборе микроорганизмов для совместного культивирования. В литературе описаны механизмы антагонизма пробиотических бактерий как по отношению к патогенным и условно-патогенным микрооорганизмам, так и к представителям своего рода [8, 9]. В консорциуме бактерии выделяют различные продукты метаболизма и конкурируют как за субстрат, так и с микрофлорой желудочно-кишечного тракта человека [8, 9]. Опубликованы работы [8], в которых указывается, что биосовместимость культур в составе консорциумов влияет на уровень накоплении биомассы (на численность бактериальных клеток штаммов при совместном культивировании). В связи с этим подбор пробиотических культур в поликомпонентный консорциум должен проводится с учетом актуальных данных о биосовместимости штаммов, входящих в его состав.
Другим немаловажным аспектом является исследование биотехнологического потенциала каждого штамма, которого планируется включить в микробный консорциум. Среди важнейших характеристик можно выделить кислотообразующую способность, протеолитическую активностью, адгезивные свойства. Использование пробиотических культур с различной протеолитической активностью позволит получать ферментированные белки молока с различными биологически активными свойствами [10]. Оценка адгезивных способностей штаммов позволит сделать вывод об их способности прикрепляться к стенкам желудочно-кишечного тракта и более длительное время задерживаться в организме, проявляя свои пробиотические свойства [11]. При создании полиштаммовых заквасок необходимо учитывать кинетику роста каждого штамма консорциума, в том числе продолжительность экспоненциальной фазы роста. С помощью этих данных можно определить время инокуляции питательной среды в случае постепенного внесения монокультуры. Такой подход повышает биологические свойства консорциума [8].
Таким образом, на стадии подбора культур для создания комплексных полиштаммовых добавок с пробиотическими свойствами необходимо оценивать биосовместимость штаммов и их биотехнологический потенциал с целью повышения общей активности консорциума.
Цель исследований - изучить биологические межштаммовые взаимодействия пробиотических культур, а также протеолитическую активность и адгезивную способность штаммов, с перспективой создания новых эффективных консорциумов, которые можно использовать при получении заквасок для кисломолочных продуктов, ферментированных и неферментированных пищевых продуктов и биологически активных добавок.
Объекты и методы исследований
Для достижения поставленной цели были определены следующие задачи: исследовать биологические межштаммовые взаимодействия пробиотических культур при совместном культивировании и отобрать сочетаемые штаммы; оценить биотехнологический потенциал культур и выявить штаммы с высокими протеолитическими и адгезивными свойствами; изучить кислотообразующую способность и динамику роста отобранных культур в монозаквасках и в микробном консорциуме для установления оптимальных условий культивирования.
Объектами исследований были 7 штаммов молочнокислых микроорганизмов: Lactobacillus paracasei к-406, Lactobacillus fermentum 44/1, Lactobacillus curvatus LCR-111-1, Lactobacillus rhamnosus 12L, Lactobacillus casei МДП-1, Lactobacillus plantarum 8РАЗ, Lactobacillus acidophilus 100АШ и 2 штамма бифидобактерии: Bifidobacterium breve DSM 20091, Bifidobacterium longum subsp. infantis, полученные из Национального биоресурсного центра Всероссийской коллекции промышленных микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» – ГосНИИгенетика.
Биосовместимость культур определяли методом прямого совместного культивирования на поверхности плотной питательной среды (капельная методика) [8, 9, 12, 13]. Метод заключается в поочередном нанесении на поверхность питательной среды (MRS) двух капель тестируемых культур. Биосовместимость оценивали в месте наложения капель: если культуры полностью сливались – они считались совместимыми, если одна из культур росла поверх другой, подавляя ее рост, это расценивали как антагонизм [8, 13, 14].
Исследование уровня протеолитической активности внутриклеточных и внеклеточных ферментов у лактобактерий проводили с использованием желатина и протеолитической среды с молочным буфером [15]. Активность эндоферментов оценивали по характеру разжижения желатина в первый и последующие дни после внесения культур методом «укол в столбик». Внеклеточную экзоферментативную активность бактерий проверяли по размеру образовавшихся светлых участков (пептонизации белков молока) вокруг культур [15, 16].
Адгезивные свойства изучали согласно методики В.И. Брилиса на формализированных эритроцитах [17]. Результат оценивали по индексу адгезивности микроорганизмов (ИАМ). Микроорганизмы считаются неадгезивными при ИАМ≤1,75, низкоадгезивными - от 1,76 до 2,5, среднеадгезивными – от 2,51 до 4,0 и высокоадгезивными при ИАМ выше 4,0 [17].
Титруемую кислотность определяли методом титрования по ГОСТ 3624-92 [18]. Количество клеток лактобактерий и бифидобактерий определяли методом предельных разведений по ГОСТ Р 56139-2014 на соответствующих питательных средах (МRS-агар и ГМК-1) [19].
Статистическую обработку полученных данных проводили с помощью пакета программы Statistica 6. Использовали непараметрический критерий Манна - Уитни (для сравнения независимых выборок). Значимыми считали различия, если вероятность ошибки р≤0,05.
Результаты и их обсуждение
При оценке характера межштаммовых взаимоотношений необходимо учитывать, что исследуемые культуры в процессе прироста бактериальной популяции способны продуцировать бактериоцины. Именно способность к выработке бактериоцинов определяет степень антагонистической активности штамма и обусловливает характер межбактериальных взаимодействий [9]. Данные о межвидовых взаимоотношениях исследуемых культур представлены в таблице 1.
Таблица 1
Межштаммовые взаимодействия лакто- и бифидобактерий при их совместном культивировании
Объект исследования
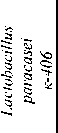

+ + + + + + + +
+ ± - + + + +
+ + + + ± +
+ + + + +
± + + ±
+ + +
+ +
+
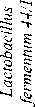
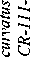
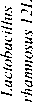
Lactobacillus paracasei к-406
Lactobacillus fermentum 44/1
Lactobacillus curvatus LCR-111-1
Lactobacillus rhamnosus 12L
Lactobacillus casei МДП-1
Lactobacillus plantarum 8РАЗ
Lactobacillus acidophilus 100АШ Bifidobacterium breve DSM 20091
Продолжение таблицы 1
|
Объект исследования |
<2 to 5 9 § 1 5 i § s. |
81 |
^ |
^ 3 *3 ~ |
S 'S |
si |
2 s | 3 |
I S Q Co |
В - S -S "§ ^ ^ §- i ■ |
|
Bifidobacterium longum subsp. infantis |
|||||||||
Примечание: «+» - штаммы совместимы, «–» - штаммы несовместимы, «±» - наблюдается антагонизм («выход наверх» одной из культур)
Полученные результаты (см. табл. 1) показывают, что большинство исследуемых лакто- и бифидобактерий можно совместно культивировать в подобранных парах, а также получать многокомпонентные пробиотические консорциумы.
В паре Lactobacillus casei МДП-1 и Lactobacillus fermentum 44/1 наблюдалась сильная антагонистическая активность (см. табл. 1). Сильный антагонизм между этими бактериями ограничивает их применение для совместного культивирования. Умеренный антагонизм наблюдался в парах: Lactobacillus fermentum 44/1 и Lactobacillus rhamnosus 12L; Lactobacillus casei МДП-1 и Lactobacillus plantarum 8РАЗ; Lactobacillus curvatus LCR-111-1 с Bifidobacterium breve DSM 20091, а также Lactobacillus casei МДП-1 и Bifidobacterium longum subsp. infantis. Внутриродовой антагонизм между Lactobacillus fermentum и Lactobacillus rhamnosus , а также Lactobacillus casei и Lactobacillus plantarum , возможно, объясняется более быстрым потреблением одной из культур питательных компонентов и «метаболическим давлением», связанным с негативным действием культуры антагониста на метаболизм другого штамма лактобактерий [20]. Антагонистическая активность лактобацил по отношению к бифидобактериям в исследуемых парах возможно объясняется тем, что в процессе жизнедеятельности лактобактерий в питательной среде MRS накапливают определенные экзометаболиты (бактериоцины), которые при данных условиях ингибирует рост Bifidobacterium breve и Bifidobacterium infantis . Штамм Lactobacillus casei МДП-1 показал самые слабые антагонистические свойства (его развитие при совместном культивировании подавлялось тремя другими штаммами). Данное обстоятельство ограничивает использование Lactobacillus casei МДП-1 в составе полиштаммовых микробных консорциумах из-за низкой устойчивости к действию бактерицидов родственных бактерий и возможной гибели этого микроорганизма.
Практический и научный интерес представляет изучение протеолитической активности пробиотических культур. Исследование уровня протеолитической активности начинали с изучения внутриклеточных и внеклеточных ферментов. Результаты исследования представлены в таблице 2.
Таблица 2
Внеклеточная и внутриклеточная протеолитическая активность разных штаммов пробиотических культур
|
Пробиотические штаммы |
Протеолитическая активность (зоны просветления на среде, мм/форма разжижжения) |
|
|
внеклеточная (разложение молочного белка) |
внутриклеточная (разжижение желатина) |
|
|
Lactobacillus paracasei к-406 |
+++ (27±4 мм) |
+++ (воронкообразное) |
|
Lactobacillus fermentum 44/1 |
+++ (10±2 мм) |
+++ (воронкообразное) |
|
Lactobacillus curvatus LCR-111-1 |
+++ (15±3 мм) |
+++ (воронкообразное) |
|
Lactobacillus rhamnosus 12L |
+++ (25±5 мм) |
+++ (воронкообразное) |
Продолжение таблицы 2
|
Пробиотические штаммы |
Протеолитическая активность (зоны просветления на среде, мм/форма разжижжения) |
|
|
внеклеточная (разложение молочного белка) |
внутриклеточная (разжижение желатина) |
|
|
Lactobacillus casei МДП-1 |
+++ (25±2 мм) |
+++ (воронкообразное) |
|
Lactobacillus plantarum 8РАЗ |
+++ (17±4 мм) |
+++ (воронкообразное) |
|
Lactobacillus acidophilus 100АШ |
+++ (15±4 мм) |
++- (воронкообразное) |
|
Bifidobacterium breve DSM 20091 |
++‒ (6±1 мм) |
- |
|
Bifidobacterium longum subsp. infantis |
+– – (3±1 мм) |
- |
Примечание: протеолитическая активность «+++» ‒ сильная зона (разложение молочного белка более 10 мм); «++–» ‒ средняя зона (разложение молочного белка 5–9 мм); «+– –» ‒ слабая (зона разложение молочного белка 1–4 мм); «– – –» ‒ отсутствует.
Из данных таблицы 2 видно, что исследуемые штаммы лактобактерий показали высокую протеолитическую активность внутриклеточных ферментов. Исследуемые штаммы лактобактерий разложили желатин в первые сутки культивирования, столбик разжижения имел форму воронки. Это указывает на то, что исследуемые культуры обладают большим количеством бактериальных протеиназ, связанных с клеточной стенкой. Именно благодаря этим внутриклеточным пептидазам олигопептиды посредством специфического пептидного транспорта будут поглощаться клеткой и гидролизоваться на короткоцепочечные пептиды и аминокислоты. Исследуемые штаммы бифидобактерий не разжижают желатин. Отсутствие желатиназы в исследуемых образцах указывает на то, что в данных культурах отсутствуют протеиназы, связанные с клеточной стенкой. Данный факт подтверждают литературные данные.
По способности пептонизировать молочный белок штаммы Lactobacillus paracasei к406, Lactobacillus casei МДП-1 и Lactobacillus rhamnosus показали более высокие показатели протеолиза (зона просветления составила 25–27 мм), у остальных штаммов Lactobacillus зоны просветления составили 10 - 17 мм, что также соответствует высокой протеолитической активности. Бифидобактерии уступают лактобактериям в этом эксперименте (см. табл. 2). По способности лизировать казеин штамм Bifidobacterium breve DSM 20091 показал более высокий показатель протеолиза: зона просветления составила 6 мм, что соответствует средней степени протеолитической активности. Штамм Bifidobacterium longum subsp. infantis проявил слабую протеолитическую активность (зона просветления казеина составила только 3 мм).
По совокупности результатов исследования протеолитической активности внутриклеточных и внеклеточных ферментов лактобактерий и бифидобактерий очевидна перспективность использования культур Lactobacillus для производства ферментированных кисломолочных продуктов.
Результаты исследований адгезивных свойств пробиотических культур представлены в таблице 3.
Таблица 3
Адгезивная способность пробиотических культур
|
Пробиотические штаммы |
СПА |
КУЭ, % |
ИАМ |
Адгезивные свойства |
|
Lactobacillus paracasei к-406 |
2,8±0,06 |
85±0,3 |
3,3±0,02 |
среднеадгезивные |
|
Lactobacillus fermentum 44/1 |
3,0±0,02 |
71±0,7 |
4,2±0,04 |
высокоадгезивные |
|
Lactobacillus curvatus LCR-111-1 |
4,2±0,08 |
87±0,6 |
4,8±0,02 |
высокоадгезивные |
Продолжение таблицы 3
|
Пробиотические штаммы |
СПА |
КУЭ, % |
ИАМ |
Адгезивные свойства |
|
Lactobacillus rhamnosus 12L |
3,1±0,04 |
89±0,2 |
3,5±0,06 |
среднеадгезивные |
|
Lactobacillus casei МДП-1 |
3,3±0,01 |
92±0,1 |
3,6±0,01 |
среднеадгезивные |
|
Lactobacillus plantarum 8РАЗ |
4,1±0,02 |
89±0,3 |
4,6±0,05 |
высокоадгезивные |
|
Lactobacillus acidophilus 100АШ |
2,6±0,05 |
84±0,5 |
3,1±0,07 |
среднеадгезивные |
|
Bifidobacterium breve DSM 20091 |
3,8±0,07 |
81±0,2 |
4,7±0,02 |
высокоадгезивные |
|
Bifidobacterium longum subsp. infantis |
4,0±0,02 |
95±0,2 |
4,2±0,01 |
высокоадгезивные |
Результаты, представленные в таблице 3, свидетельствуют о разной адгезивной способности пробиотических культур. Высокую степень адгезии проявили штаммы Lactobacillus curvatus LCR-111-1, Lactobacillus plantarum 8РАЗ и Bifidobacterium breve DSM 20091. Близкие по значению результаты показали Lactobacillus fermentum 44/1 и Bifidobacterium longum subsp. infantis . Остальные штаммы проявили среднюю степень адгезии.
По совокупности результатов исследования биосовместимости, протеолитической активности внутриклеточных и внеклеточных ферментов, а также адгезивной способности изучаемых штаммов пробиотических бактерий были отобраны следующие штаммы для составления консорциума: Lactobacillus curvatus LCR-111-1, Lactobacillus plantarum 8РАЗ, Lactobacillus fermentum 44/1 и Lactobacillus paracasei к-406.
Для отобранных штаммов и поликомпонентного консорциума из выбранных культур проводилось изучение кислотообразующей способности и динамики роста на среде MRS (рис. 1, 2). Доза вносимой комбинированной закваски составляла 5 % от объема молока. Культивирование проводили при температуре 37 °С в течение 24 ч. Контролем служили результаты изучаемых показателей по каждой монокультуре.
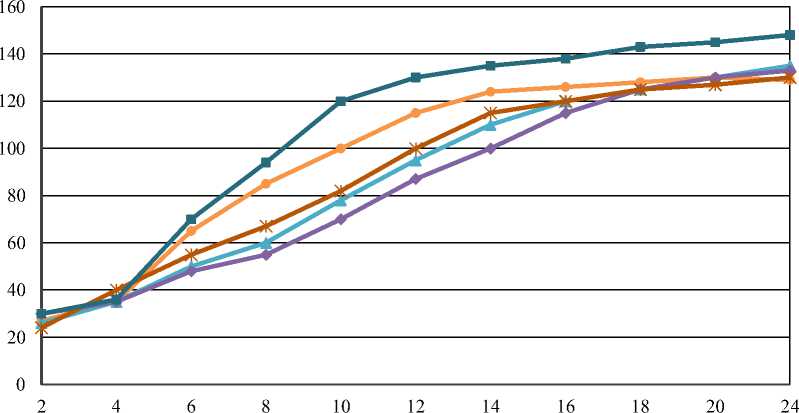
Время, ч
• Lactobacillus curvatus
—*—Lactobacillus plantarum
—♦—Lactobacillus paracasei Lactobacillus fermentum
Рисунок 1 – Активность кислотообразования заквасок на основе различных культур Lactobacillus и их консорциума (разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах)
Анализ результатов, представленных на рисунке 1, позволил сделать вывод о том, что лаг-фазы исследуемых культур практически совпадают (продолжаются первые 3–4 ч), в связи с этим полиштаммовый консорциум из выбранных культур можно составлять при одновременном смешивании четырех обобранных штаммов Lactobacillus в соотношении 1:1:1:1. Исследование показало, что в нарастание кислотности молока при добавлении микробного консорциума происходит значительно быстрее по сравнению с монокультурами. Уже через 10– 12 ч культивирования кислотность закваски, состоящей из консорциума лактобактерий достигает (120–130) °Т, тогда как в монокультурах такая кислотность наблюдалась через (14–20) ч. Это указывает на синергетический эффект между отобранными культурами. Наиболее высоким содержанием жизнеспособных клеток лактобактерий также наблюдалось в комбинированной закваске уже через 12 ч культивирования - 3×109 КОЕ/см3 (рис. 2), тогда как в монозаквасках через этот же промежуток времени количество жизнеспособных клеток составляло порядка (107–108) КОЕ/см3.
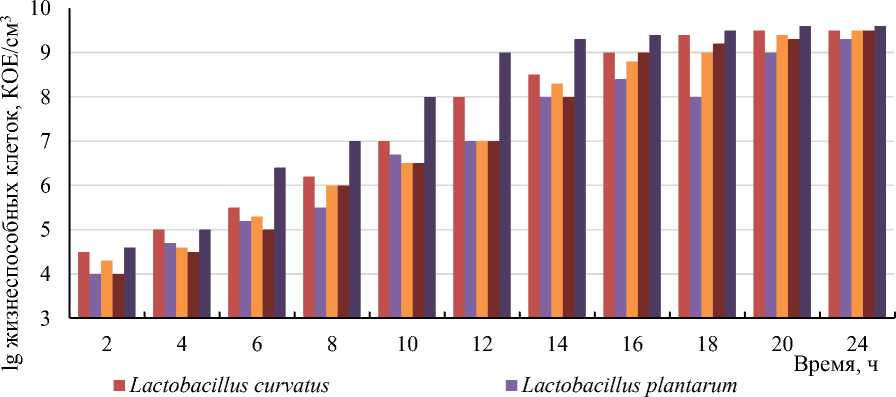
■ Lactobacillus paracasei ■ Lactobacillus fermentum
■ Комбинированный консорциум
Рисунок 2 – Количественный учет Lactobacillus в монозаквасках и в микробном консорциуме (разброс данных представлен стандартным отклонением для средних значений в трех независимых экспериментах)
Таким образом, в результате проведённых исследований подобраны оптимальные условия культивирования консорциума из выбранных культур лактобактерий: соотношение культур - 1:1:1:1, температура культивирования - 37°С, продолжительность - 12 ч. При выбранных условиях наблюдаются сбалансированный рост пробиотических микроорганизмов и установление симбиотических отношений между ними.
Заключение
Результаты исследований подтвердили, что для повышения биологических и технологических свойств полиштаммовых консорциумов необходимо учитывать биологическую совместимость входящих в консорциум штаммов и их биотехнологический потенциал. Полученные результаты коррелируют с данными, представленными другими исследователями [8, 9, 12–14]. Тщательный скрининг пробиотических штаммов на предмет их биологической и технологической пригодности позволяет отобрать штаммы с наилучшими производственными, функциональными и технологическими характеристиками.
В результате проведенных исследований были изучены биологические межштаммо-вые взаимодействия пробиотических культур вида Lactobacillus и Bifidobacterium , определены их протеолитическая активность и адгезивная способность с целью создания эффективного полиштаммового консорциума. На основе проведенных экспериментов были отобраны следующие пробиотические штаммы для составления консорциума: Lactobacillus curvatus LCR-111-1, Lactobacillus plantarum 8РАЗ, Lactobacillus fermentum 44/1 и Lactobacillus paracasei к-406. Отмечено, что взаимоотношения отобранных пробиотических бактерий относятся к синергид-ным. При совместном культивировании выбранных культур на питательной среде «капельным методом» наблюдалось полное слияние «капель», что соответствует высокому уровню биосовместимости. Высокий уровень биосовместимости, протеолитической и адгезивной активности отобранных штаммов определил целесообразность их использования в составе закваски для совместного культивирования. Lactobacillus curvatus LCR-111-1, Lactobacillus plantarum 8РАЗ, Lactobacillus fermentum 44/1 и Lactobacillus paracasei к-406 имеют одну оптимальную температуру культивирования (37 °С), схожую динамику роста и высокую устойчивость к действию бактериоцинов друг друга. Совместное культивирование отобранных штаммов приводит к сокращению ферментационного цикла и количественному увеличению жизнеспособных клеток Lactobacillus по сравнению с монозаквасками. Проявление синергизма пробиотическими культурами, их высокая протеолитическая и адгезивная активность делают возможным рекомендовать подобранный консорциум для применения в функциональных продуктах питания и пробиотических биологически активных добавках.
Научно-исследовательская работа проведена за счет средств гранта «Молодые ученые ВСГУТУ - 2022» Федерального государственного бюджетного образовательного учреждения высшего образования «Восточно-Сибирский государственный университет технологий и управления».
Список литературы Изучение биологических взаимоотношений и биохимических свойств пробиотических микроорганизмов
- Probiotics Market by Application (Functional Food & Beverages (Dairy Products, Non-dairy Beverages, Infant Formula, Cereals), Dietary Supplements, Feed), Ingredient (Bacteria, Yeast), Form (Dry, Liquid), End User, & Region – Global Forecast to 2026. URL: https://www.marketsandmarkets.com/Market-Reports/probiotic-market-advanced-technologies-and-global-market-69.html (дата обращения: 15.07.2022).
- Markowiak P., Śliżewska K. Effects of probiotics, prebiotics, and synbiotics on human health // Nutrients, 2017. – Т. 9 (9). – Р. 1021.
- Markowiak-Kopeć P, Śliżewska K. The Effect of Probiotics on the Production of Short-Chain Fatty Acids by Human Intestinal Microbiome // Nutrients, 2020. – Т. 12 (4). – Р. 1107.
- Яруллина Д.Р., Фахруллин Р.Ф. Бактерии рода Lactobacillus: общая характеристика и методы работы с ними: учеб.-метод. пособие. – Казань: Изд-во Казанского университета, 2014. – 51 с.
- Tamang J., Shin D., Jung S., Chae S. Functional Properties of Microorganisms in Fermented // Foods. Front. Microbiol., 2016. – № 7. – Р. 578.
- Ettinger G., MacDonald K., Reid G., Burton J.P. The influence of the human microbiome and probiotics on cardiovascular health // Gut Microbes, 2014. – Т. 5. – P. 719–728.
- Просеков А.Ю., Остроумов Л.А. Инновационный менеджмент биотехнологий заквасочных культур // Техника и технология пищевых производств, 2016. – Т. 43 (4). – C. 64–69.
- Волкова Г.С., Куксова Е.В., Серба Е.М. Изучение биологических межштаммовых взаимодействий и ростовых свойств производственных штаммов молочнокислых бактерий // Актуальные вопросы молочной промышленности, межотраслевые технологии и системы управления качеством. – 2020. – № 1 (1). – C. 104–109.
- Соловьева И.В., Точилина А.Г., Новикова Н.А. и др. Изучение Биологических свойств новых штаммов рода Lactobacillus // Вестник Нижегородсткого ун-та им. Н.И. Лобачевского, 2010. – № 2 (2). – С. 462–468.
- Madureira A.R. Invited review: physiological properties of bioactive peptides obtained from whey protein // J. Dairy Sci. – 2010. – Т. 93 (2). – P. 437–455.
- Головин М.А., Ганина В.И., Машенцева Н.Г. Холестеринредуцирующие пробиотические бактерии в молочной продукции // Молочная промышленность. 2014. – № 5. – C. 46–47.
- Глушанова Н.А., Блинов А.И. Биосовместимость пробиотических и резидентных лактобацилл: тез. VII Славяно-Балтийского научного форума «Санкт-Петербург – Гастро–2005» // Гастронтерология Санкт-Петербург, 2005. – № 1. – C. 31–36.
- Бегунова А.В., Рожкова И.В., Зверева Е.А. и др. Молочнокислые и пропионовокислые бактерии: формирование сообщества для получения функциональных продуктов с бифидогенными и гипотензивными свойствами // Прикладная биохимия и микробиология. – 2019. – № 55 (6). – C. 566–577. – DOI 10.1134/S0555109919060047.
- Волкова Г.С., Куксова Е.В., Серба Е.М., Мартыненко Н.Н. Изучение и оценка биологических свойств пробиотических штаммов рода Lactobacillus, перспективных для производства биологически активных добавок к пище // Вопросы питания. – 2018. – Т. 87 (5). – C. 54–55. – DOI 10.24411/0042-8833-2018-10139.
- Хамагаева И.С., Жеребятьева О.А., Щёкотова А.В. Протеолитическая активность лакто-бактерий // Молочная промышленность. – 2016. – № 11. – C. 29–31.
- Щёкотова А.В., Хамагаева И.С. Белковые концентраты, обогащенные пробиотическими культурами и эссенциальными микро- и макролементами: монография. – Улан-Удэ: Изд-во ВСГУТУ, 2017. – 264 с.
- Брилис В.И., Брилене Т.А., Ленцнер Х.П. и др. Методика изучения адгезивного процесса микроорганизмов // Лабораторное дело. – 1986. – №4. – C. 210–214.
- ГОСТ 3624-92 Молоко и молочные продукты. Титриметрические методы определения кислотности. – URL: https://internet-law.ru/gosts/gost/10071 (дата обращения: 01.08.2022).
- ГОСТ Р 56139-2014 Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов. – URL: https://internet-law.ru/gosts/gost/58168/ (дата обращения: 01.08.2022).
- Семенов А.В. Антагонизм как результат межмикробных отношений // Бюллетень Оренбургского научного центра УрО РАН. – 2013. – № 1. – С. 8.


