Изучение ферментов малат-аспартатной челночной системы у генотипов пшеницы
Автор: Гурбанова Улдуза Ахмед, Мирзалиева Минара Адиль
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 5 т.9, 2023 года.
Бесплатный доступ
Одной из важных проблем сельского хозяйства является снижение продуктивности сортов мягкой пшеницы, выращиваемых на территории Азербайджана, в условиях водного дефицита вызванного климатическими изменениями. В связи с этим засуха, являющийся одним из абиотических стрессовых факторов, способных прямо или косвенно влиять на метаболизм растений, остается активной темой дискуссий в исследованиях, проводимых в этой области в последние десятилетия. Изучена активность ферментов малат-аспартатной челночной системы у растений пшеницы, выращенной в условиях водного дефицита. Установлено, что активность ферментов аспартатаминотрансферазы и НАД-малатдегидрогеназы выше у засухоустойчивых генотипов.
Пшеница, стресс вызванный засухой
Короткий адрес: https://sciup.org/14127965
IDR: 14127965 | УДК: 577.1 | DOI: 10.33619/2414-2948/90/04
Текст научной статьи Изучение ферментов малат-аспартатной челночной системы у генотипов пшеницы
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.1
В глобализированном мире быстрый рост населения, сокращение биоразнообразия и ограниченность пригодных и продуктивных земельных площадей для сельского хозяйства представляют серьезную угрозу удовлетворению потребностей населения в продуктах питания [1]. В связи с этим, засуха, являющийся одним из абиотических стрессовых факторов, способных прямо или косвенно влиять на метаболизм растений, остается активной темой дискуссий в исследованиях, проводимых в этой области в последние десятилетия [2, 3]. Ферменты аспартатаминотрансфераза (АспАТ/АСАТ/ААТ, КФ 2.6.1.1) и НАДмалатдегидрогеназа (L-малат-НАД-оксидоредуктаза, НАД-МДГ, КФ 1.1.1.37) обеспечивают связь между углеводным обменом и метаболизмом аминокислот, играя важную роль как в процессах катаболизма, так и амаболизма. Фермент малатдегидрогеназа, катализирующий взаимное превращение малата и оксалоацетата, обнаружен во всех живых организмах и субклеточных органеллах (митохондриях, глиоксисомах, пероксисомах, хлоропластах) [4]. АспАТ обеспечивает транспорт α-аминных групп между аспартатом и глутаматом. Он катализирует обратимую реакцию превращения аспартата и α-кетоглутарата в оксалоацетат и L-глутамат. Аспартат является промежуточным метаболитом аминокислотного обмена и цикла Кребса. Аспартат, как промежуточный метаболит, участвует в росте и развитии растений, в формировании механизма стрессоустойчивости [5–11]. Основная роль аспартата в эукариотических клетках заключается в транспортировке синтезируемых в результате гликолиза восстановительных эквивалентов через мембрану митохондрий и обеспечении участия в генерации АТФ [12]. Аспартат, синтезированный в митохондриях, транспортируется в цитозоль с помощью специальных транспортеров. Аспартат в цитозоле снова превращается в малат под воздействием АспАТ и MДГ, в результате чего соотношение НАД+/НАДН увеличивается [12, 13]. Соотношение NAD+/NADH объединяет многие аспекты метаболизма и играет важную роль в процессах развития растений и реакции на стресс. Целью исследования являлась изучение роли ферментов малат-аспартатного шаттла (АспАТ и НАД-МДГ) [15] в повышении продуктивности пшеницы [14], которая составляет 18–20% пищевого белка человека.
Материалы и методы исследования
Для исследования были отобраны четыре генотипа пшеницы хранящихся в генофонде НИИСХ Минсельхоза: Муров 2, Аран, Гызыл Бугда, Зирва.
Генотипы мягкой пшеницы выращивались в лаборатории с искусственным климатом при световом периоде 16/8 ч и температуре 24°C/18°C, режиме день/ночь соответственно, и относительной влажности 50%. 14-дневные проростки были подвергнуты стрессу засухи. Измерения проводились в двух вариантах 10 биологических и 3 технических повторностях.
Для определения ферментативной активности листья промывали дистиллированной водой, сушили на фильтровальной бумаге и размельчали в течении 3 минут в ступке, используя 100 мМ Tris-HCl (pH 7,8) буфер содержащий 5 мМ ДТТ, 5 мМ MgCl 2 ×6H 2 O, 1 мМ ЭДТА×4Na, 0,5% Тритон Х-100 и 1% PVP. После фильтрации полученного гомогената, фильтрат сначала центрифугировали при 1000 g в течение 10 минут, а затем при 5000 g в течение 30 минут. Этот процесс проводили при температуре +4°С. Надосадочную жидкость использовали для определения активности ферментов.
Активность НАД-МДГ определяли спектрофотометрическим методом (Ultrospec 3300 pro, Amersham, USA) [16]. Реакционная среда состояла из 100 мМ Трис-HCl (рН 8,0) буфера содержащий 1 мМ оксалоацетат, 10 мг/мл бычий сывороточный альбумин (БСА), 10 мМ MgCl 2 , 0,15 мкМ НАДН и 5–10 мкл ферментативный препарат. Реакцию инициировали добавлением в среду 1 мМ оксалоацетата. Среда для прямой реакции состояла из 100 мМ
Трис-HCl (рН 9,0), 30 мМ малата, 0,2 мМ НАД. Измерения проводили в спектрофотометрических кюветах объемом 1,0 мл. Количество НАДН определяли по снижению оптической плотности молярной концентрации этого соединения при длине волны 340 нм в течение 1 минуты. Реакционная среда для определения активности аспартатаминотрансферазы состояла из 100 мМ HEPES-KOH (рН 7,4) и 100 мМ Трис-HCl (рН 8,5), 2 мМ ЭДТА, 2,5 мМ 2-оксоглутарата, 10 мкг/мл пиродоксальфосфата, 10 мМ ДТТ, 12 ЕД/мл МДГ и 0,2 мМ НАДН. Реакцию инициировали добавлением в среду 20 мкл экстракта листьев и 2,5 мМ L-аспартата [17].
Общее количество растворимого белка определяли с помощью 0,12% раствора Кумасси бриллиантового синего G-250. Измерения оптической плотности проводили на спектрофотометре (Ultrospec 3300 pro, Amersham) при длине волны 610 нм. Для построения калибровочной кривой использовали бычий сывороточный альбумин [18].
Все эксперименты были выполнены в 3-x повторностях и погрешности определяли с использованием программы статистического анализа Student’s t-test. Различия между средними значениями считались достоверными при значениях Р <0,01, 0,005.
Результаты и обсуждение
Активность НАД-малатдегидрогеназы определяли в листьях сортов мягкой пшеницы, выращенных в условиях искусственного климата. Активность НАД-МДГ в листьях сорта Зирва увеличивалась в 1,5 раз при стрессе (17,38±2,0 мкмоль ОА/белок мин-1) по сравнению с образцами выращенными при нормальном поливе (11,4±1,2 мкмоль ОА/белок мин-1).
Активность фермента НАД-МДГ у сортов Аран и Муров-2 была близка к сорту Зирва 85
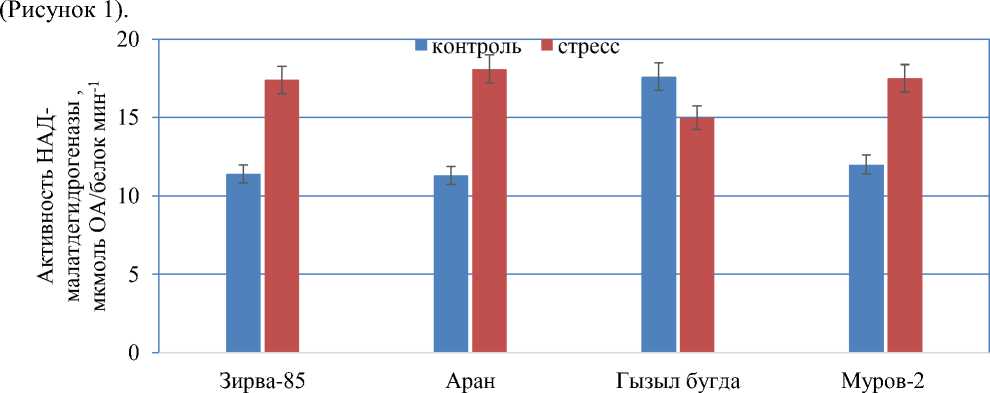
Рисунок 1. Изменение активности НАД-малатдегидрогеназы в листьях сортов мягкой пшеницы, выращенных в условиях искусственного климата
В отличие от других сортов, в листьях сорта Гызыл бугда, активность фермента НАД-МДГ уменьшалась в 1,2 раза (17,6±1,8 мкмоль ОА/белок мин-1) в стрессовых условиях по сравнению с образцами (15,0±1,45 мкмоль ОА/белок мин-1) выращенными при нормальном поливе. Наибольшая фермента НАД-МДГ наблюдалась в листьях сорта Аран (18,08±2,0 мкмоль ОА/белок мин-1) подвергнутого стрессу. Малат участвует во многих физиологических процессах, таких как обеспечение НАДН для реакции восстановления нитратов, биосинтез жирных кислот для углеродной цепи и фотодыхания, движение устьиц посредством регуляции осмотического давления, контроль клеточного рН, окислительновосстановительный гемостаз, а также транспорт и обмен восстановленных эквивалентов между клеточными компартментами. Синтез малата является результатом последовательного действия ФЕПК и МДГ. В данной работе изучали активность фермента аспартатаминотрансферазы во флаговых листьях сортов пшеницы (Рисунок 2).
Щ и я 2
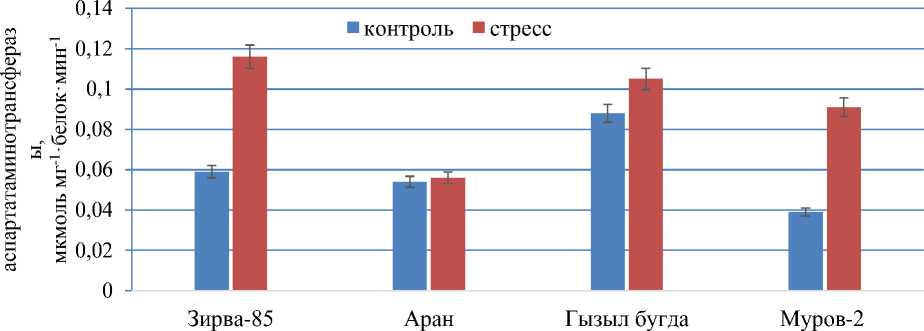
Рисунок 2. Изменение активности фермента аспартатаминотрансферазы в листьях сортов мягкой пшеницы, выращенных в условиях искусственного климата
Активность фермента АспАТ была выше в стрессовых вариантах всех изученных сортов пшеницы по сравнению с растениями выращенными при нормальном поливе. Активность фермента АспАТ повышалась в 2 раза в образцах листьев сорта Зирва в стрессовых условиях (0,116±0,02 мкмоль мг-1×белок·мин-1) по сравнению с поливом (0,059±0,007 мкмоль мг-1×белок·мин-1). Среди изученных сортов мягкой пшеницы самый высокий показатель был обнаружен у сорта Зирва выращенного в условиях засухи. Активность фермента в сорте Аран при засухе (0,056±0,007 мкмоль·мг-1×белок·мин-1) незначительно превышала значение, полученное для контрольных растений (0,054±0,008 мкмоль мг-1×белок·мин-1). Активность фермента АспАТ в контрольных и опытных вариантах составляла, соответственно, 0,088±0,01 мкмоль мг-1×белок мин-1 и 0,105±0,001 мкмоль мг-1×белок мин-1. У этого сорта активность фермента АспАТ в опытном варианте в два раза превышала значение контрольного варианта. Активность фермента АспАТ была в 2,3 раза выше у растений сорта Муров-2 (0,091±0,001 мкмоль мг-1×белка мин-1) при засухе по сравнению с растениями контрольного варианта (0,039 мкмоль мг-1×белка мин×1). Наибольшее соотношение между вариантами отмечено у сорта Муров-2. В результате изучения ферментов (АспАТ и НАД-МДГ) малат-аспартатного шаттла, играющих важную роль в повышении продуктивности растений пшеницы, установлено, что активность обоих ферментов у засухоустойчивых генотипов выше по сравнению с неустойчивыми генотипами. AspAT и НАД-МДГ НАД+/НАДН играют важную роль в процессах развития растений и реакции на стресс.
Заключение
Согласно полученным результатам, исследованные ферменты малат-аспартатного шаттла играют важную роль в адаптационных процессах высших растений — распределении углерода и энергии.
Список литературы Изучение ферментов малат-аспартатной челночной системы у генотипов пшеницы
- Ghatak A., Schindler F., Bachmann G., Engelmeier D., Bajaj P., Brenner M., Weckwerth W. Root exudation of contrasting drought-stressed pearl millet genotypes conveys varying biological nitrification inhibition (BNI) activity // Biology and Fertility of Soils. 2021. P. 1-16. https://doi .org/10.1007/s00374-021 -01578-w
- Chen Q., Wang B., Ding H., Zhang J., Li S. The role of NADP-malic enzyme in plants under stress // Plant science. 2019. V. 281. P. 206-212. https://doi.org/10.1016/j.plantsci.2019.01.010
- Kapoor D., Bhardwaj S., Landi M., Sharma A., Ramakrishnan M., Sharma A. The impact of drought in plant metabolism: How to exploit tolerance mechanisms to increase crop production // Applied Sciences. 2020. V. 10. №16. P. 5692. https://doi.org/10.3390/app10165692
- Liszka A., Schimpf R., Cartuche Zaruma K. I., Buhr A., Seidel T., Walter S., Selinski J. Three cytosolic NAD-malate dehydrogenase isoforms of Arabidopsis thaliana: on the crossroad between energy fluxes and redox signaling // Biochemical Journal. 2020. V. 477. №19. P. 36733693. https://doi .org/10.1042/B CJ20200240
- Han M., Zhang C., Suglo P., Sun S., Wang M., Su T. L-Aspartate: An essential metabolite for plant growth and stress acclimation // Molecules. 2021. V. 26. №7. P. 1887. https://doi.org/10.3390/molecules26071887
- Jia X., Sun C., Zuo Y., Li G., Li G., Ren L., Chen G. Integrating transcriptomics and metabolomics to characterise the response of Astragalus membranaceus Bge. var. mongolicus (Bge.) to progressive drought stress // Bmc Genomics. 2016. V. 17. P. 1-16. https://doi.org/10.1186/s12864-016-2554-0
- Ullah N., Yuce M., Neslihan Ozturk Gok9e Z., Budak H. Comparative metabolite profiling of drought stress in roots and leaves of seven Triticeae species // BMC genomics. 2017. V. 18. P. 112. https://doi.org/10.1186/s12864-017-4321-2
- Gargallo-Garriga A., Preece C., Sardans J., Oravec M., Urban O., Penuelas J. Root exudate metabolomes change under drought and show limited capacity for recovery // Scientific reports. 2018. V. 8. №1.P. 1-15. https://doi.org/10.1038/s41598-018-30150-0
- Khan N., Bano A., Rahman M. A., Guo J., Kang Z., Babar M. Comparative physiological and metabolic analysis reveals a complex mechanism involved in drought tolerance in chickpea (Cicer arietinum L.) induced by PGPR and PGRs // Scientific reports. 2019. V. 9. №1. P. 1-19. https://doi.org/10.1038/s41598-019-38702-8
- Barickman T. C., Ku K. M., Sams C. E. Differing precision irrigation thresholds for kale (Brassica oleracea L. var. acephala) induces changes in physiological performance, metabolites, and yield // Environmental and Experimental Botany. 2020. V. 180. P. 104253. https://doi.org/10.1016/j. envexpbot.2020.104253
- Zhang J., Chen G., Zhao P., Zhou Q., Zhao X. The abundance of certain metabolites responds to drought stress in the highly drought tolerant plant Caragana korshinskii // Acta Physiologiae Plantarum. 2017. V. 39. P. 1-11. https://doi.org/10.1007/s11738-017-2412-y
- Borst P. The malate-aspartate shuttle (Borst cycle): How it started and developed into a major metabolic pathway // IUBMB life. 2020. V. 72. №11. P. 2241-2259. https://doi .org/10.1002/iub.2367
- Easlon E., Tsang F., Skinner C., Wang C., Lin S. J. The malate-aspartate NADH shuttle components are novel metabolic longevity regulators required for calorie restriction-mediated life span extension in yeast // Genes & development. 2008. V. 22. №7. P. 931-944. https://doi.org/10.1101/gad.1648308
- Padhan B. K., Sathee L., Meena H. S., Adavi S. B., Jha S. K., Chinnusamy V. CO2 Elevation accelerates phenology and alters carbon/nitrogen metabolism vis-à-vis ROS abundance in bread wheat // Frontiers in Plant Science. 2020. P. 1061. https://doi.org/10.3389/fpls.2020.01061
- Singh J., Garai S., Das S., Thakur J. K., Tripathy B. C. Role of C4 photosynthetic enzyme isoforms in C3 plants and their potential applications in improving agronomic traits in crops // Photosynthesis Research. 2022. P. 1-26. https://doi.org/10.1007/s11120-022-00978-9
- Scheibe R., Stitt M. Comparison of NADP-malate dehydrogenase activation, QA reduction and 02 evolution in spinach leaves // Plant Physiol Biochem. 1988. V. 26. №4. P. 473-481.
- Alfonso S. U., Bruggemann W. Photosynthetic responses of a C3 and three C4 species of the genus Panicum (s.l.) with different metabolic subtypes to drought stress // Photosynthesis research. 2012. V. 112. P. 175-191. https://doi.org/10.1007/s11120-012-9763-4
- Sedmak J. J., Grossberg S. E. A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250 // Analytical biochemistry. 1977. V. 79. №1-2. P. 544-552. https://doi .org/10.1016/0003 -2697(77)90428-6


