Изучение контаминации микотоксинами виноградного вина, потребляемого в Российской Федерации
Автор: Седова И.Б., Чалый З.А., Тутельян В.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в гигиене
Статья в выпуске: 4 (48), 2024 года.
Бесплатный доступ
Виноградное вино является одним из наиболее популярных и распространенных алкогольных напитков в мире. Поражение винограда, используемого при его приготовлении, плесневыми грибами может приводить к накоплению опасных для здоровья человека соединений - микотоксинов. В связи с их высокой токсичностью и возможным риском для здоровья целью данного исследования было изучение загрязненности виноградных вин, реализуемых в России, широким спектром токсинов и оценка риска здоровью населения, связанная с его потреблением. Методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией в 36 образцах вина было определено содержание 27 микотоксинов. В их число входили регламентируемые в пищевых продуктах токсины, их производные и структурные аналоги, а также эмерджентные микотоксины (альтернариатоксины, цитринин, стеригматоцистин, циклопиазоновая, микофеноловая и тенуазоновая кислоты, монилиформин, энниатины, боверицин). Получены данные, свидетельствующие о загрязненности микотоксинами виноградных вин, потребляемых в России: 31 % проб содержал токсины на относительно низких уровнях загрязнения. Чаще других токсинов выявляли афлатоксин G2, альтенуен, микофеноловую кислоту и стеригматоцистин; в единичных случаях - зеараленон, тенуазоновую кислоту и охратоксин А. Наиболее загрязненными МТ оказались образцы красного вина. Только в полученных по импорту образцах вина были найдены фумонизин В1, зеараленон, стеригматоцистин, альтенуен и охратоксин А. В четырех исследованных образцах вина были найдены одновременно несколько токсинов. Несмотря на относительно низкий уровень контаминации микотоксинами вина, остается потенциальная опасность их хронического поступления человеку. Расчетное среднее поступление афлатоксинов может достигать 28 % от величины референтного значения, а максимальное - даже превышать эту величину. Расчетная нагрузка другими токсинами свидетельствует о незначительном вкладе виноградного вина (до 2,8 % от величины референтного значения) в их поступление на население РФ.
Микотоксины, эмерджентные микотоксины, загрязнение, вино, охратоксин а, афлатоксины, вэжх-мс/мс
Короткий адрес: https://sciup.org/142243801
IDR: 142243801 | УДК: 614.31: | DOI: 10.21668/health.risk/2024.4.06
Текст научной статьи Изучение контаминации микотоксинами виноградного вина, потребляемого в Российской Федерации
Виноград относится к наиболее любимым и потребляемым ягодам на территории России. Грибковые заболевания, вызванные Plasmopara viticola, Botrytis cinerea, Greeneria uvicola, Glomerella cingulata , а также видами Alternaria, Aspergillus, Cladosporium, Penicillium, Rhizopus, Colletotrichum и Phomopsis , снижают урожайность и качество винограда [1]. Среди грибов, вызывающих заболевания винограда, есть нитчатые грибы видов Alternaria, Aspergillus и Penicillium , способные продуцировать токсичные вторичные метаболиты – микотоксины
(МТ). Имеются сведения о выявлении в винограде альтернариола (AOH), афлатоксинов (AFL), монометилового эфира альтернариола (АМЕ), тенуазоно-вой кислоты (ТеА), фумонизинов В1 и B2 (FB1 и FB2), патулина (PAT), пенициловой кислоты (РА), циклопиазоновой кислоты (CPA), зеараленона (ZEN), цитринина (CIT) и охратоксина A (OTA) [2–5]. Их токсическое действие связано с нефротоксичностью, гепатотоксичностью, цитотоксичностью, тератогенностью и иммунотоксичностью [6]. В связи с высокой токсичностью МТ и возможным рис-
Седова Ирина Борисовна – кандидат биологических наук, старший научный сотрудник лаборатории энзимологии питания (e-mail: ; тел.: 8 (495) 698-53-65; ORCID: .
Чалый Захар Андреевич – младший научный сотрудник лаборатории энзимологии питания (e-mail: ; тел.: 8 (495) 698-53-65; ORCID: .
Тутельян Виктор Александрович – академик РАН, доктор медицинских наук, профессор, научный руководитель (e-mail: ; тел. 8 (495) 698-53-46; ORCID:
ком для здоровья населения проводятся многочисленные исследования на предмет их наличия в сырье и пищевых продуктах.
ОТА является наиболее изученным из МТ в виноградной продукции и может представлять реальную проблему для промышленности. Согласно оценкам Комиссии «Кодекс Алиментариус», вино является вторым пищевым продуктом после зерновых с наибольшим вкладом в ежедневное поступление ОТА (до 15 %) [7]. Контаминация OTA может произойти на любом этапе процесса виноделия: начиная от колонизации винограда микотоксигенными грибами, заканчивая процессом упаковки вина. Однако основное загрязнение готового продукта происходит в результате переноса микотоксинов из винограда [8]. Кроме того, процесс виноделия сильно влияет на содержание ОТА, так как в красных винах отмечаются более высокие концентрации, чем в розовых и белых винах [9].
Имеются сведения о выявлении этого токсина в вине за последние 20 лет в различных странах мира: в России (до 0,64 мкг/л) [10], США (до 8,6 мкг/л) [11], Европе: Греции (до 0,212 и 2,52 мкг/л) [12, 13], Дании (до 0,6 мкг/кг) [14], Испании (до 0,104 и 0,142 мкг/л) [12, 15], Италии (до 0,286; 1,56; 2,28 мкг/л) [12, 16, 17], Португалии (до 1,18 мкг/л) [18], Сербии (до 0,134 мкг/л) [19], Франции (до 0,088 мкг/л) [12], Хорватии (до 0,061 и 0,24 мкг/л) [2, 12], Аргентине (до 0,98 мкг/л) [20], Бразилии (до 0,62 мкг/л) [21], Израиле (до 0,065 мкг/л) [12], Китае (до 0,98 и 1,27 мкг/л) [3, 22], Таиланде (до 1,72 мкг/л) [23], Турции (до 0,101 мкг/л) [12], Южной Африке (до 0,455 мкг/л) [12].
Гигиенические регламенты содержания МТ в виноградном вине в настоящее время отсутствуют в РФ. При этом в некоторых странах мира введены ограничения содержания ОТА: в странах ЕС1 и Корее – на уровне 2 нг/г, в Бразилии – 10 нг/г [24].
Для объективной оценки контаминации виноградных вин малоизученными токсинами микроми-цетов в перечень анализируемых МТ были включены 12 видов эмерджентных МТ (ЭМТ), источниками которых могут быть как представители Fusarium sp., Aspergillus sp., Аlternaria sp., Penicillium sp., так и грибы других родов.
В связи с изложенным цель исследования – изучение частоты и уровней контаминации широким спектром МТ виноградных вин, реализуемых в России. В продуктах определяли содержание 27 МТ, включая регламентируемые в пищевых продуктах растительного происхождения, их производные, структурные аналоги и ЭМТ.
Материалы и методы. Образцы виноградного вина были приобретены в торговой сети Москвы и
Московской области в 2020 г. Всего было исследовано 36 образцов, которые включали 21 пробу красного вина, 12 – белого, 3 – розового вина. Производителями вина были Россия, включая республики Крым и Дагестан, а также Грузия, Чили, Италия, Франция, Новая Зеландия, Аргентина, Испания, Австрия и Израиль.
Отбор проб продовольственного сырья и пищевых продуктов на анализ проводился в соответствии с ГОСТ 33303-2015 «Продукты пищевые. Методы отбора проб для определения микотоксинов»2.
Во всех исследованных образцах определяли содержание МТ, продуцируемых грибами родов Penicillium и Aspergillus : OTA, AFL B1, B2, G1, G2, PAT, STC, CIT, PA, MPA, рода Alternaria : АОН, АМE, ALT, TEN и TeA, рода Fusarium : DON, FB1, FB2, токсины T-2, HT-2, ZEN, β-зеараленол (β-ЗЕЛ), ниваленол (NIV), монилиформин (МО), боверицин (BEA), энниатины А и В (ENN А и В). Среди изученных МТ CIT, STC, MPA, МО, ENN А, ENN В, BEA, ТЕN, ТеА, АОН, АМE и ALT являлись эмерд-жентными МТ (ЭМТ).
Подготовка проб вина. За основу была взята методика [14] с минимальной модификацией. Из представительной пробы объемом не менее 100 см3 в центрифужную пробирку вместимостью 50 см3 отбирали 5 ± 0,02 г вина, добавляли 5 г воды, затем 10 см3 ацетонитрила, содержащего 1 % уксусной кислоты, перемешивали в течение 1 мин при 300 об./мин. В пробирку вносили 3 г безводного сульфата магния, немедленно перемешивали в течение 1 мин, 3 см3 аликвоты ацетонитрильного экстракта (верхний слой) переносили в другую центрифужную пробирку, содержащую 450 мг безводного сульфата магния, тщательно перемешивали механически в течение 1 мин. Пробирку центрифугировали при 4000 об./мин при 10 °С в течение 4 мин. К аликвоте экстракта объемом 0,5 см3 добавляли 0,5 см3 метанола. Полученный раствор использовали для количественного анализа. Пробы готовили для анализа в двух повторностях.
Анализ образцов продуктов переработки винограда на наличие МТ проводили с использованием ВЭЖХ системы Waters Acquity H-plus HPLC, соединенной с тройным квадрупольным масс-спектрометрическим детектором с подогреваемым источником (XEVO TQ-XS), контролируемым программным обеспечением MassLynx V4.2 (Waters Corporation, США). Температура в автосамплере – 4 ºС. Разделение анали-тов осуществляли на колонке, заполненной силикагелем с привитыми группами октадецилсилана (Zorbax SB-С18, 150 × 4,6 мм, 3,5 мкм, Agilent). Температура колонки в термостате – 30 ºС. Скорость потока элюента – 0,5 мм3/мин. Объем вносимой пробы составил 10 мм3.
Градиентное элюирование было применено для разделения токсинов: фаза А – вода: метанол (95: 5 об. %); фаза Б – метанол: вода (95: 5 об. %), обе фазы модифицированы 10 мМ ацетатом аммония. Схема градиентного элюирования в условиях отрицательной полярности ионизации: от 0 до 1 мин – 0 % Б, от 1 до 7 мин – линейное увеличение Б от 0 до 70 %, от 7 до 15 мин – линейное увеличение Б от 70 до 100 %, от 15 до 19 мин – постоянно 100 % Б, от 19 до 19,5 мин – линейное снижение Б до 0 %, от 19,5 до 22 мин – уравновешивание системы при 0 % Б. Схема градиентного элюирования в условиях положительной полярности ионизации: от 0 до 7 мин – линейное увеличение Б от 10 до 75 %, от 7 до 17 мин – линейное увеличение Б от 75 до 100 %, от 17 до 19 мин – постоянно 100 % Б, от 19 до 19,5 мин – линейное снижение Б от 100 до 10 %, от 19,5 до 24 мин – уравновешивание системы при 10 % Б. МС/МС детектирование осуществляли в режиме электроспрея в динамическом режиме MRM в условиях положительной и отрицательной ионизации.
Параметры источника: ионная ловушка с ионизацией электроспреем; капиллярное напряжение – 0,5 кВ, напряжение конуса – 3 В, температура источника – 500 ºС; температура десольватации – 500 ºС; поток газа в конусе – 150 дм3/ч, поток газа десольватации – 1000 дм3/ч, поток газа для соударения – 0,15 см3/мин, давление небулайзера – 7 бар.
Стандартные растворы смесей МТ готовили из сухих стандартов (Sigma-Aldrich; Fermentek, Jerusalem, Israel). Стандартные растворы хранения AFL, STC, CIT, PA, PAT, трихотецены групп A и B, ZEN и аналоги, OTA готовили в ацетонитриле, стандартные растворы хранения токсинов Alternaria , ENN А, ENN В, BEA, MPA, МО – в метаноле, FB1, FB2 – в смеси «ацетонитрил / вода» – 50 / 50 (% об.), с концентрацией 100 или 500 мкг/см3. Из стандартных растворов готовили мультистандарты и калибровочные растворы. Все растворы хранились при температуре минус 18 °C.
Статистическая обработка данных. Статистически обработанные данные по содержанию
МТ в исследованных пробах представляли в виде М – среднего арифметического среди проб всего ряда и М конт – среднего арифметического среди загрязненных проб соответственно; и 95%-ного персентиля. При расчете среднего уровня контаминации образцов в пробах всего ряда содержание МТ в пробах, загрязненных на уровне ниже предела количественного определения метода, принимали за «ноль».
Для количественного определения МТ в виноградном вине использовали внешние градуировки на «чистой» матрице. Пределы количественного определения МТ (ПКО), рассчитанные по 10-σ критериям, для образцов (в мкг/кг) составили для STC – 0,25, ОТА – 0,30, AFL B1, Т-2, MPA, TEN – 0,40, AFL B2, G1, G2, HT-2, AME, ALT – 1,00, BEA, ENN A, ENN B – 1,50, AOH, РА – 2,00, CIT – 3,00, FB1, ZEN – 4,0, PAT, β-ZEL – 6,00, DON, NIV – 20,00, FB2 – 25,0, МО – 30,00, ТеА – 40,00.
Результаты и их обсуждение. Изучение загрязненности МТ виноградных вин показало наличие 10 из 27 анализируемых МТ в 11 (31 %) из 36 изученных образцов (табл. 1). В целом выявлены относительно низкие частота и уровни контаминации токсинами этих напитков.
В 4 образцах был обнаружен AFL G2 в количестве от 1,01 до 3,05 мкг/кг. Несколько реже, в 8 % случаев, находили ALT и MPA. В двух их 36 изученных образцов вина были выявлены TEN, FB1 и STC в количестве до 0,84, 27 и 1,70 мкг/кг соответственно. В единичных образцах обнаруживали токсины НТ-2 (1,18 мкг/кг), ОТА (0,39 мкг/кг), ZEN (5,08 мкг/кг) и TeA (146,5 мкг/кг). Содержание ОТА не превышало величин гигиенических регламентов, установленных в этом виде продукции.
О случаях выявления в образцах виноградного вина AFL в более низких концентрациях и ОТА было сообщено в [16]. В этом исследовании от 10 до 13 % образцов были загрязнены AFL В1, B2, G1, G2 в количестве до 0,035, 0,016, 0,068 и 0,033 мкг/дм3 соответственно; около 97 % изученных проб содержали ОТА – от 0,021 до 1,56 мкг/дм3.
Таблица 1
Содержание микотоксинов в образцах виноградного вина, n = 36
|
Микотоксин |
Кол-во проб, содержащих токсины |
Содержание токсинов в контам. пробах, мкг/кг |
Содержание токсинов в пробах всего ряда, мкг/кг |
|||
|
абс. |
% |
диапазон |
M конт |
М |
90 % |
|
|
AFL G2 |
4 |
11 |
1,01–3,05 |
1,74 |
0,19 |
0,50 |
|
ALT |
3 |
8 |
1,35–2,98 |
1,90 |
0,16 |
0 |
|
MPA |
3 |
8 |
3,54–5,51 |
4,37 |
0,36 |
0 |
|
TEN |
2 |
6 |
0,65–0,84 |
1,74 |
0,04 |
0 |
|
FВ1 |
2 |
6 |
26,40–27,04 |
26,72 |
0,19 |
0 |
|
STC |
2 |
6 |
0,37–1,70 |
1,04 |
0,06 |
0 |
|
НТ-2 |
1 |
3 |
1,18 |
1,18 |
0,03 |
0 |
|
ZEN |
1 |
3 |
5,08 |
5,08 |
0,14 |
0 |
|
TeA |
1 |
3 |
146,5 |
146,5 |
4,07 |
0 |
|
OTA |
1 |
3 |
0,39 |
0,39 |
0,01 |
0 |
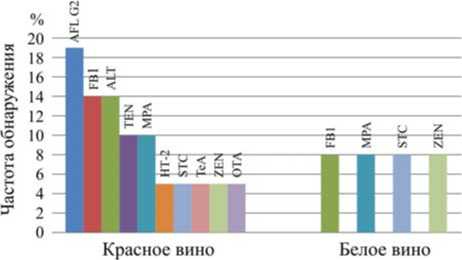
Рис. 1. Частота загрязнения токсинами красного ( n = 21) и белого ( n = 12) вина
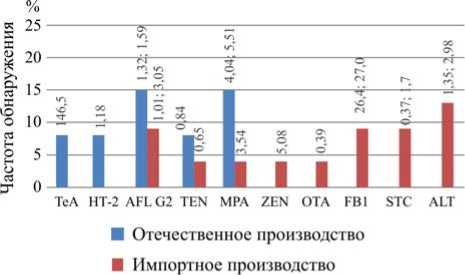
Рис. 2. Частота и уровни загрязнения микотоксинами образцов вина различного происхождения (содержание МТ указано в мкг/кг)
О выявлении альтернариатоксинов в пробах вина также сообщали [14, 17, 23, 25]. В исследовании [25] были найдены МТ TeA и TEN, однако частота загрязнения ими были значительно выше, чем по результатам наших данных. О выявлении AOH и AME в более чем половине изученных образцов сообщали [17, 25] и о единичном случае – АМЕ [23], однако ALT в исследованных ими образцах вина выявлен не был.
Имеются сведения об обнаружении в вине фумонизинов [23], НТ-2 [17], ZEN и MPA [3, 14].
В зависимости от классификации по цвету изученные образцы виноградного вина были разделены на три группы: красное – 21 образец, белое – 12, и розовое – 3. Ни в одном из трех образцов розового вина МТ не были обнаружены. В пробах красного вина были найдены 10 токсинов (рис. 1), тогда как в пробах белого вина – 4 МТ: FB1, MPA, STC и ZEN.
Наиболее часто в образцах красного вина, в 19 % случаев, обнаруживали AFL G2. В 14 % образцов выявляли FВ1 и AFL, в 10 % – TEN и MPA. Остальные токсины были найдены в единичных случаях. Следует обратить внимание, что ОТА был выявлен только в образце красного вина. При производстве красного вина его могут выдерживать в течение нескольких дней при повышенной температуре в аэробных условиях без фильтрации, что, в свою очередь, может способствовать накоплению токсина в нем, при этом при изготовлении белого вина после отжима сок винограда сразу фильтруют и подвергают ферментации [10].
По сравнению с красным вином, спектр обнаруживаемых токсинов в белом был более незначительным. Частота его контаминации FВ1 была ниже, чем в красном вине: 8 против 14 % соответственно. Кроме того, в образцах белого вина были найдены MPA, STC и ZEN, частота их обнаружения варьировалась от 4 до 10 %.
Только в отечественном вине были выявлены TeA и НТ-2 (рис. 2). Как в образцах отечественного, так и импортного вина были найдены MPA, AFL G2 и TEN, причем частота их обнаружения в отечественном вине была в несколько раз выше. Следует отметить, что только в вине, полученном по импорту, были найдены FВ1, ZEN, STC, ALT и ОТА.
Следует отметить, что в 3 образцах красного и одном образце белого вина была выявлена одновременная контаминация несколькими токсинами. Перечень загрязненных вин с указанием сорта и происхождения и обнаруженных МТ приведен в табл. 2. В образце сухого белого вина, произведенного в Италии, были обнаружены токсины STC и ZEN. В пробах сухого красного вина из Испании были найдены AFL G2 и ALT; из России – 4 токсина (AFL G2, TEN, НТ-2 и MPA). Образец красного десертного вина из Израиля был загрязнен четырьмя токсинами ОТА, STC, MPA и ALT. В двух образцах вина обнаружили по 2 МТ (STC+ZEN и ALT+AFL G2); по одному образцу содержали 4 МТ (ALT+MPA+ОТА+STC) и 5 МТ (TEN+AFL G2+НТ-2+MPA+TeA).
Таким образом, результаты проведенного исследования свидетельствуют о наличии ОТА, AFL, FВ1, STC в виноградных винах, представленных на территории России, что предполагает установление соответствующего контроля со стороны производителей и надзорных органов, в частности, за содержанием ОТА.
По данным Единой межведомственной информационно-статистической системы (ЕМИСС), ФТС, Федерального центра развития экспорта продукции АПК Минсельхоза России, Федеральной службы по регулированию алкогольного рынка [26], потребление вина на душу населения с 2018 по 2020 г. варьировалось от 6700 до 7400 cм3 на человека в год. В 2020 г. оно составило 6700 см3. Данные последних лет (2022) свидетельствуют, что больше вина потребляется в Ненецком автономном округе, Карелии, Московской области и Санкт-Петербурге (от 10 200 до 11 700 см3 на человека), а наименьшее количество – на Северном Кавказе (от 20 до 700 см3 на человека)3.
Таблица 2
Частота и уровни загрязнения МТ образцов вина в зависимости от их происхождения
|
№ п/п |
По содержанию сахара |
Страна-производитель |
Токсин (содержание в мкг/кг) |
|
Красное вино |
|||
|
1 |
Десертное |
Израиль |
ОТА (0,39) + STC (1,70) + MPA (3,54) + ALT (1,35) |
|
2 |
Десертное |
Кипр |
FВ1 (26,4) |
|
3 |
Сухое |
Грузия |
TEN (0,65) |
|
4 |
Сухое |
Испания |
AFL G2 (1,01) + ALT (2,98) |
|
5 |
Сухое |
Аргентина |
AFL G2 (3,05) |
|
6 |
Сухое |
Россия |
AFL G2 (1,59) + TEN (0,84) + НТ-2 (1,18) + MPA (5,51) + TeA (146,5) |
|
7 |
Сухое |
Чили |
ALT (1,36) |
|
8 |
Полусладкое |
Россия |
AFL G2 (1,32) |
|
Белое вино |
|||
|
9 |
Сухое |
Новая Зеландия |
FВ1 (27,04) |
|
10 |
Сухое |
Италия |
STC (0,37) + ZEN (5,08) |
|
11 |
Полусладкое |
Россия |
MPA (4,07) |
Принимая во внимание данные о среднем потреблении вина населением России, среднем и максимальном содержании в них выявленных токсинов (см. табл. 2), была рассчитана вероятная нагрузка ими на население. В качестве референтных значений для МТ ZEN, FB1+FВ2 были взяты величины условнопереносимого суточного поступления (УПСП), установленные Комитетом экспертов ФАО/ВОЗ по пищевым добавкам (JECFA): 500 нг/кг массы тела (м.т.) для ZEN и его метаболитов [27]; 2000 нг/кг м.т. для суммы фумонизинов [28]; переносимое суточное поступление для токсинов DAS, Т-2 и НТ-2 отдельно или в комбинации на уровне 25 нг/кг м.т. в сутки [29], и условно-переносимого недельного поступления (УПНП) – 112 нг/мг м.т. для ОТА [30]. В качестве ориентировочных референтных значений для AFL использовали величины среднего и высокого, соответствующего 95-му персентилю, хронического поступления AFL B1 для населения в возрасте старше 18 лет [31]; для альтернариатоксинов – порог токсического воздействия (ТТС), рассчитанный по данным Европейского агентства по безопасности пищи (EFSA): ТТС АОН и АМЕ – по 2,5 нг/кг м.т./сут, для ТЕN и TeA – 1500 нг/кг м.т./сут [32], для ALT – 1500 нг/кг м.т./сут [33]; для STC – поступление, оказывающее незначительное влияние на здоровье человека, – 16 нг/кг м.т./сут [34]. Средняя масса тела человека была принята за 70 кг.
Среднее расчетное поступление токсинов на население России в неделю варьировалось от 0,07 нг/кг м.т. (0,0007 %) для TEN до 0,35 нг/кг м.т. (22,7–27,7 %) для AFL G2; при этом для ОТА – 0,019 нг/кг м.т. (0,02 % от УПНП). Максимальное расчетное поступление ZEN, FB1, OTA, HT-2, аль-тернариатоксинов и STC составило относительно референтных значений 0,27; 0,36; 0,64; 1,25; 2,6 и 2,82 % соответственно. Наиболее высокие вероятные поступления МТ были связаны с потреблением виноградного вина, загрязненного AFL G2 на уровне 90 % загрязнения (0,50 мкг/кг) и на максимальном уровне (3,05 мкг/кг). В этом случае нагрузка могла достигать за неделю 0,91 нг/кг м.т. (от 9,6 до 31 % от референтного значения) и 5,6 нг/кг м.т. (58,8–190,5 % от референтного значения) соответственно. При этом для жителей Ненецкого автономного округа, Карелии, Московской области и Санкт-Петербурга расчетная нагрузка AFL G2 может превышать эти значения в 1,5–1,75 раза.
Полученные в данном исследовании результаты свидетельствуют о незначительном поступлении альтернариатоксинов, STC, FB1, HT-2 и OTA и более высокой нагрузке АFL G2 при потреблении виноградного вина, остается потенциальная опасность их хронического поступления в организм человека.
Выводы:
-
1. Установлено загрязнение микотоксинами 31 % образцов виноградных вин преимущественно афлатоксином G2, альтенуеном, микофеноловой кислотой, фумонизином B1 и стеригматоцистином. Среди регламентируемых токсинов в иностранных винах выявлены охратоксин А, афлатоксин G2, фумонизин В1, зеараленон и стеригматоцистин; в отечественных – афлатоксин G2.
-
2. Величина расчетного поступления микотоксинов с вином свидетельствует о низком релевантном риске (до 2,8 % от величин референтных значений) для здоровья населения России, исключение составляют афлатоксин G2, среднее поступление с вином может достигать 28 %.
-
3. Реальной угрозы для населения РФ виноградное вино как источник микотоксинов не представляет. Однако выявление высоких уровней AFL G2 в образцах виноградного вина предполагает установление соответствующего контроля со стороны производителей и надзорных органов за содержанием этого токсина и регламентируемого в странах ЕС ОТА.
Финансирование. Работа по подготовке рукописи проведена за счет средств субсидии на выполнение государственного задания в рамках темы FGMF-2022-0003.
Список литературы Изучение контаминации микотоксинами виноградного вина, потребляемого в Российской Федерации
- Welke J.E. Fungal and mycotoxin problems in grape juice and wine industries // Current Opinion in Food Science. -2019. - Vol. 29. - P. 7-13. DOI: 10.1016/j.cofs.2019.06.009
- Differences in the levels of pesticides, metals, sulphites and ochratoxin A between organically and conventionally produced wines / D.V. Cepo, M. Pelajic, I.V. Vrcek, A. Krivohlavek, I. Zuntar, M. Karoglan // Food Chem. - 2018. - Vol. 246. -P. 394-403. DOI: 10.1016/j.foodchem.2017.10.133
- Simultaneous Analysis of 20 Mycotoxins in Grapes and Wines from Hexi Corridor Region (China): Based on a QuEChERS-UHPLC-MS/MS Method / B. Zhang, X. Chen, S.-Y. Han, M. Li, T.-Z. Ma, W.-J. Sheng, X. Zhu // Molecules. -2018. - Vol. 23, № 8. - P. 1926. DOI: 10.3390/molecules23081926
- Investigation of patulin and citrinin in grape must and wine from grapes naturally contaminated by strains of Penicillium expansum / V. Ostry, F. Malir, M. Cumova, V. Kyrova, J. Toman, Y. Grosse, M. Pospichalova, J. Ruprich // Food Chem. Toxicol. - 2018. - Vol. 118. - P. 805-811. DOI: 10.1016/j.fct.2018.06.022
- From grape to wine: Fate of ochratoxin A during red, rose, and white winemaking process and the presence of ochratoxin derivatives in the final products / L. Freire, P.A. Braga, M.M. Furtado, J. Delafiori, F.L. Dias-Audibert, G.E. Pereira, F.G. Reyes, R.R. Catharino, A.S. Sant'Ana // Food Control. - 2020. - Vol. 113, № 1. - P. 107167. DOI: 10.1016/j.foodcont.2020.107167
- Prevalence of mycotoxins and their consequences on human health / O.P. Omotayo, A.O. Omotayo, M. Mwanza, O.O. Babalola // Toxicol. Res. - 2019. - Vol. 35, № 1. - P. 1-7. DOI: 10.5487/TR.2019.35.1.001
- JECFA. Evaluation of certain food additives and contaminants: sixty-eighth report of the joint FAO/WHO Expert Committee on Food Additives [Электронный ресурс] // WHO Technical Report Series. - 2007. - № 947. - URL: https://iris.who.int/bitstream/handle/10665/43870/9789241209472_eng.pdf? sequence = 1 (дата обращения: 01.04.2024).
- Ochratoxins in Wines: A Review of Their Occurrence in the Last Decade, Toxicity, and Exposure Risk in Humans / B. Ortiz-Villeda, O. Lobos, K. Aguilar-Zuniga, V. Carrasco-Sánchez // Toxins (Basel). - 2021. - Vol. 13, № 7. - P. 478. DOI: 10.3390/toxins13070478
- Evolution of ochratoxin A content during red and rose vinification / S. Lasram, A. Mani, C. Zaied, S. Chebil, S. Abid, H. Bacha, A. Mliki, A. Ghorbel // J. Sci. Food Agric. - 2008. - Vol. 88, № 10. - P. 1696-1703. DOI: 10.1002/jsfa.3266
- Аксенов И.В. Изучение содержания микотоксина охратоксина А в виноградных винах // Плодоводство и виноградарство Юга России. - 2018. - № 54 (06). - С. 124-129. DOI: 10.30679/2219-5335-2018-6-54-124-129
- High incidence and levels of ochratoxin A in wines sourced from the United States / C.L. De Jesus, A. Bartley, A.Z. Welch, J.P. Berry // Toxins (Basel). - 2018. - Vol. 10, № 1. - P. 1. DOI: 10.3390/toxins10010001
- Levels of ochratoxin in Mediterranean red wines / R. Remiro, A. Irigoyen, E. González-Peñas, E. Lizarraga, A. López de Cerain // Food Control. - 2013. - Vol. 32, № 1. - P. 63-68. DOI: 10.1016/j.foodcont.2012.11.040
- Ochratoxin A levels in Greek retail wines / Y. Sarigiannis, J. Kapolos, A. Koliadima, T. Tsegenidis, G. Karaiskakis // Food Control. - 2014. - Vol. 42. - P. 139-143. DOI: 10.1016/j.foodcont.2014.02.003
- Development, optimization and validation of a multimethod for the determination of 36 mycotoxins in Ines by liquid chromatography-tandem mass spectrometry / I.R. Pizzutti, A. Kok, J. Scholten, L.W. Righi, C.D. Cardoso, G.N. Rohers, R.C. da Silva // Talanta. - 2014. - Vol. 129. - P. 352-363. DOI: 10.1016/j.talanta.2014.05.017
- Quantification of ochratoxin A and five analogs in Navarra red wines / R. Remiro, E. González-Peñas, E. Lizarraga, A. Lopez de Cerain // Food Control. - 2012. - Vol. 27, № 1. - P. 139-145. DOI: 10.1016/j.foodcont.2012.03.006
- Determination of Aflatoxins and Ochratoxins in Sicilian Sweet Wines by High-Performance Liquid Chromatography with Fluorometric Detection and Immunoaffinity Cleanup / V. Di Stefano, R. Pitonzo, G. Avellone, A. Di Fiore, L. Monte, A.Z.T. Ogorka // Food Anal. Methods. - 2015. - Vol. 8. - P. 569-577. DOI: 10.1007/s12161-014-9934-3
- Dietary Exposure to Mycotoxins through Alcoholic and Non-Alcoholic Beverages in Valencia, Spain / D. Car-ballo, M. Fernández-Franzón, E. Ferrer, N. Pallarés, H. Berrada // Toxins (Basel). - 2021. - Vol. 13, № 7. - P. 438. DOI: 10.3390/toxins13070438
- Ochratoxin A in the Portuguese Wine Market, Occurrence and Risk Assessment / L.J.G. Silva, A.P. Rodrigues, A.M.P.T. Pereira, C.M. Lino, A. Pena // Food Addit. Contam. Part B. Surveill. - 2019. - Vol. 12, № 2. - P. 145-149. DOI: 10.1080/19393210.2019.1595169
- Risk to public health related to the presence of ochratoxin A in wines from Fruska Gora / L. Torovic, I. Laka-tos, T. Majkic, I. Beara // LWT. - 2020. - Vol. 129, № S3. - P. 109537. DOI: 10.1016/j.lwt.2020.109537
- Assessment of ochratoxin A occurrence in Argentine red wines using a novel sensitive quechers-solid phase extraction approach prior to ultra high performance liquid chromatography-tandem mass spectrometry methodology / L. Mariño-Repizo, R. Gargantini, H. Manzano, J. Raba, S. Cerutti // J. Sci. Food Agric. - 2017. - Vol. 97, № 8. - P. 2487-2497. DOI: 10.1002/jsfa.8065
- Detection of ochratoxin A in tropical wine and grape juice from Brazil / M.F. Terra, G. Prado, G.E. Pereira, H.J. Ematne, L.R. Batista // J. Sci. Food Agric. - 2013. - Vol. 93, № 4. - Р. 890-894. DOI: 10.1002/jsfa.5817
- Exposure Assessment to Ochratoxin A in Chinese Wine / Q.D. Zhong, G.H. Li, D.B. Wang, Y. Shao, J.G. Li, Z.H. Xiong, Y.N. Wu // J. Agric. Food Chem. - 2014. - Vol. 62, № 35. - P. 8908-8913. DOI: 10.1021/jf500713x
- Monitoring and health risk of mycotoxins in imported wines and beers consumed in Thailand / S. Puangkham, A. Poapolathep, U. Jermnak, K. Imsilp, P. Tanhan, C. Chokejaroenrat, S. Poapolathep // World Mycotoxin J. - 2017. - Vol. 10, № 4. - P. 401-409. DOI: 10.3920/WMJ2017.2216
- Lee H.J., Kim H.D., Ryu D. Practical Strategies to Reduce Ochratoxin A in Foods // Toxins. - 2024. - Vol. 16, № 1. -P. 58. DOI: 10.3390/ toxins16010058
- Development of a high performance liquid chromatography tandem mass spectrometry based analysis for the simultaneous quantification of various Alternaria toxins in wine, vegetable juices and fruit juices / T. Zwickel, H. Klaffke, K. Richards, M. Rychlik // J. Chromatogr. A. - 2016. - Vol. 1455. - P. 74-85. DOI: 10.1016/j.chroma.2016.04
- Баймухамбетова Л. Российское виноделие. Аналитическое исследование [Электронный ресурс] // ООО «НКР»: кредитное рейтинговое агентство. - 2021. - URL: https://ratings.ru/files/research/corps/NCR_Wine_July2021.pdf (дата обращения: 12.05.2024).
- JECFA. Safety evaluation of certain food additives and contaminants: prepared by the Fifty-third meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA) [Электронный ресурс] // WHO Food Additives Series. - 2000. -№ 44. - URL: https://inchem.org/documents/jecfa/jecmono/v44jec14.htm (дата обращения: 01.04.2024).
- FAO JECFA Monographs 19 bis. Safety evaluation of certain contaminants in food: prepared by the Sixty-eighth meeting of the Joint FAO/WHO Expert Committee on Food Additives [Электронный ресурс] // WHO Food Additives Series. -2018. - № 74. - URL: https://iris.who.int/bitstream/handle/10665/276868/9789241660747-eng.pdf?ua=1#page=423 (дата обращения: 01.04.2024).
- JECFA. Summary and conclusions: Summary report of the ninety-third meeting of JECFA. Virtual meeting, 24, 25, 29, 30 March and 1 April 2022 [Электронный ресурс]. - URL: https://cdn.who.int/media/docs/default-source/food-safety/jecfa/ summary-and-conclusions/jecfa93-summary-and-conclusions-april2022.pdf?sfvrsn=33db6aca_3 (дата обращения: 01.04.2024).
- JECFA. Safety evaluation of certain food additives and contaminants: prepared by the Sixty-eighth meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA) [Электронный ресурс] // WHO Food Additives Series. -2008. - № 59. - P. 357-429. - URL: https://iris.who.int/bitstream/handle/10665/43823/9789241660594_eng.pdf?sequence=1 (дата обращения: 01.04.2024).
- Risk assessment of aflatoxins in food / EFSA Panel on Contaminants in the Food Chain (CONTAM), D. Schrenk, M. Bignami, L. Bodin, J.K. Chipman, J. del Mazo, B. Grasl-Kraupp, C. Hogstrand [et al.] // EFSA J. - 2020. - Vol. 18, № 3. -P. e6040. DOI: 10.2903/j.efsa.2020.6040
- Dietary exposure assessment to Alternaria toxins in the European population / European Food Safety Authority, D. Arcella, M. Eskola, J.A. Gomez Ruiz // EFSA Journal. - 2016. - Vol. 14, № 12. - P. e04654. DOI: 10.2903/j.efsa.2016.4654
- Levels of Alternaría Toxins in Selected Food Commodities Including Green Coffee / C. Mujahid, M.-C. Savoy, Q. Baslé, P.M. Woo, E.C.Y. Ee, P. Mottier, T. Bessaire // Toxins (Basel). - 2020. - Vol. 12, № 9. - P. 595. DOI: 10.3390/toxins12090595T
- EFSA Panel on Contaminants in the Food Chain (CONTAM). Scientific Opinion on the risk for public and animal health related to the presence of sterigmatocystin in food and feed // EFSA Journal. - 2013. - Vol. 11, № 6. - P. 3254. DOI: 10.2903/j.efsa.2013.3254


