Изучение органолептических и физико-химических показателей снеков на основе рябины черноплодной (Aronia melnocarpa)
Автор: Васильева Е.А., Елисеева Е.А., Макарова Н.В., Игнатова Д.Ф., Солина Ю.И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 3 (81), 2019 года.
Бесплатный доступ
Объектами исследований являлись ягоды рябины черноплодной, пюре рябины черноплодной, снеки, сублимированные из рябины черноплодной, и снеки, сублимированные из рябины черноплодной с добавлением 5 % пектина. Для исследуемых образцов были определены органолептические показатели, содержание растворимых сухих веществ, сахаров, титруемая кислотность, содержание витамина С, пищевых волокон, общее содержание фенольных веществ, флавоноидов, антоцианов, антирадикальная активность по методу DPPH, восстанавливающая способность по методу FRAP. Определение общего содержания флавоноидов, антоцианов и фенольных веществ, а также восстанавливающей активности исследуемых образцов как показателей, характеризующих антиоксидантную активность соединений, показало положительное влияние измельчения как механической обработки и сублимационной сушки как тепловой обработки на антиоксидантные свойства рябины черноплодной. В результате определения содержания пищевых волокон, растворимых сухих веществ, сахаров и титруемой кислотности, антирадикальных свойств в исследуемых образцах выявлено увеличение значений данных показателей в 3-6 раз в процессе сублимационной сушки, что показывает целесообразность использования данного вида тепловой обработки при производстве функциональных продуктов на основе рябины черноплодной...
Рябина черноплодная, сублимационная сушка, экстракция, антирадикальная активность, антиоксидантная активность, сухие вещества, сахара, титруемая кислотность, витамин с, пищевые волокна, фенольные вещества, флавоноиды, антоцианы, восстанавливающая способность
Короткий адрес: https://sciup.org/140246427
IDR: 140246427 | УДК: 664.8.022.6 | DOI: 10.20914/2310-1202-2019-3-99-110
Текст научной статьи Изучение органолептических и физико-химических показателей снеков на основе рябины черноплодной (Aronia melnocarpa)
Плоды черноплодной рябины ( Aronia melnocarpa ) используются в пищевой промышленности для производства соков, консервов, настоек, фруктовых чаев и пищевых добавок. Свежие необработанные плоды черноплодной рябины редко употребляются в пищу из-за характерного горького вкуса, обусловленного присутствием значительного количества полифенолов [1]. Основными веществами, обусловливающими антиоксидантное и антиокислительное действие рябины черноплодной, являются полифенолы (3,3%), в том числе антоцианы, проантоцианидины, фенольные кислоты и флавоноиды [2]. Исследование антиоксидантной, антимикробной и нейромодулирующей активности различных полифенольных препаратов из черноплодной рябины (неочищенного экстраката, очищенного экстракта, стандартизированного до 20 и 40%, антоцианинов и проантоцианидинов, а также чистых хлорогеновой кислоты, циани-дин-3-O-галактозида, эпикатехина, рутина и кверцетина) показало, что проантоцианидины являются основным фактором, влияющим на антиоксидантную активность свежей черноплодной рябины. Тесты на антимикробную активность против десяти патогенных микроорганизмов показали сильное антимикробное свойство проантоцианидинов черноплодной рябины [3]. Сравнение содержания фенольных соединений и антирадикальной активности трех сортов рябины черноплодной: Aronia xprunifolia Nero , Aronia prunifolia Viking , Aronia melanocarpa Galicijanka и дикой черноплодной рябины показало, что общее содержание фенолов и антоцианов выше в сортах Aronia prunifolia Viking и Aronia xprunifolia Nero [4].
Исследовано [5] влияние желудочного и панкреатического пищеварения in vitro на стабильность и состав основных полифенолов сока черноплодной рябины. Установлено отсутствие значительного влияния желудочного пищеварения на антоцианы, флаван-3-олы, флавонолы и производные кофейной кислоты, содержащиеся в соке рябины черноплодной. Выявлено значительное изменение данных соединений во время пищеварения поджелудочной железы, в большей степени в отношении антоцианов (43% потерь при обработке панкреатином в течение 2 ч). В результате экспериментов установлена высокая чувствительность полифенолов черноплодной рябины к слабым щелочным условиям в тонкой кишке, выявлено положительное влияние капсаицина и капсиата на кишечную абсорбцию антоцианов рябины черноплодной [6].
Для выделения биологически активных соединений из плодов рябины черноплодной и продуктов их переработки используется экстракция. Применение экстракции под высоким давлением жидкости (с использованием 46% этанола под давлением в воде при 165 °C, содержащего 1,8% муравьиной кислоты) к выжимкам плодов черноплодной рябины, полученным после сверхкритической флюидной экстракции, позволяет сохранить высокую антиоксидантную активность и высокое содержание фенолов с выходом 72,5% [7]. Доказано влияние степени измельчения твердого вещества на степень экстракции биологически-активных соединений. Наибольшая степень экстракции наблюдалась при наибольшей степени измельчения исследуемого образца [8].
Исследовано [9] изменение полифенолов, антиоксидантной активности и липидных композиций в черноплодной рябине во время твердофазной ферментации (SSF) с Aspergillus niger и Rhizopus oligosporus . Доказано повышение количества фенольных соединений в экстракте более чем в 1,7 раза в течение обоих процессов ферментации.
Разработана технология производства микроинкапсулированного экстракта рябины черноплодной, направленная на повышение стабильности и биодоступности полифенолов, позволяющая использовать экстракты плодов в фармацевтических целях [10]. В качестве материалов стенок капсул для инкапсулирования антоцианов из высушенного методом распылительной сушки сока черноплодной рябины использовался мальтодекстрин с добавлением гуаровой камеди, гуммиарабика, пектина, β -глюкана и инулина. В образцах микрокапсул с добавлением β -глюкана наблюдалось наиболее высокое содержание антоцианов в течение 7 дней с момента инкапсулирования, образцы с добавлением пектина отличались наивысшим содержанием витамина С. Полученные данные показывают перспективность использования инкапсулирования как метода поддержания стабильности антоцианов сока черноплодной рябины [11].
Экспериментально доказано [12] влияние черноплодной рябины на радикальное окисление липидов, связанное со старением клеток организма, показан аддитивный эффект черноплодной рябины на увеличение экспрессии гена антиоксидантного фермента в печени и, как следствие, ослабление перекисного окисления липидов в сыворотке, печени и почках крыс. Выявлено положительное влияние регулярного употребления в течение 8 недель черноплодной рябины в дозировке 8 мг антоцианов на кг массы тела в день на сердечно-сосудистую систему, печень и метаболические параметры лабораторных крыс [13]. Исследование in vitro влияния экстракта черноплодной рябины на активность панкреатической амилазы и липазы у свиней продемонстрировало, что метанольный, водный и уксусный экстракты черноплодной рябины вызывают ингибирование α-амилазы и липазы, при этом наивысшую ингибирующую активность проявляют метанольный и уксусный экстракты. Наиболее эффективным ингибитором панкреатической α-амилазы была хлорогеновая кислота (0,57 ± 0,16 мг/мл). В группе антоцианинов самым сильным ингибитором α-амилазы был цианидин-3-глюкозид (1,74 ± 0,04 мг/мл), который также показал способность ингибировать реакцию, катализируемую панкреатической липазой.
Результаты исследований показывают перспективность использования черноплодной рябины в качестве функционального пищевого компонента для борьбы с ожирением [14]. Исследования показывают, что употребление экстракта высушенных плодов рябины черноплодной оказывает положительное влияние на профилактику сердечно-сосудистых заболеваний. Она имеет потенциал в качестве пищевой добавки при артериальной гипертонии [15, 16]. Доказано [17] благоприятное воздействие черноплодной рябины на организм человека при лечении и профилактике инфекций мочевыводящих путей. Установлено [18] лечебное действие порошка из черноплодной рябины при лечении неалкогольной жировой болезни печени (НАЖБП) за счет регулирования уровня экспрессии стерол-регуляторного связывающего элемента белка, ацетил-КоА-карбоксилазы и FAS, что приводит к уменьшению размера жировых капель в печени. Выявлено [1] положительное влияние черноплодной рябины при таких заболеваниях, как дислипидемия, гипертония, ожирение, нарушение метаболизма глюкозы, провоспалительные состояния и риск тромбоза. Перспективным направлением является исследование способности черноплодной рябины ингибировать развитие различных видов рака, включая лейкоз, рак молочной железы и кишечника.
Исследование полифенольного состава различных фракций жмыха рябины черноплодной, полученного в результате промышленной переработки ягод в сок, показало [19] целесообразность отделения семян в качестве ценного сырья, богатого жирами (13,9%), белками (24%) и минеральными соединениями. Фракции без косточек, характеризующиеся особенно высоким содержанием пищевых волокон (∼75%), про-антоцианидинов (12000 мг/100 г) и антоцианов (1200 мг/100 г), могут быть использованы при производстве полифенольных экстрактов и препаратов пищевых волокон.
Изучены антиоксидантные свойства и физиологическое воздействие на пищеварительную систему диетических препаратов, содержащих пшеничное или овсяное волокно, обогащенное экстрактами полифенолов из жмыха клубники, черноплодной рябины и черной смородины [20].
Таким образом, ягоды черноплодной рябины являются перспективным источником биологически активных соединений.
Материалы и методы
Объектами исследований являлись ягоды рябины черноплодной ( Aronia melnocarpa ), пюре рябины черноплодной, снеки, сублимированные из рябины черноплодной, и снеки сублимированные, из рябины черноплодной с добавлением 5% пектина.
Пюре получали путем измельчения ягод рябины черноплодной с использованием лабораторного измельчителя; снеки сублимированные получали путем сублимационной сушки пюре; для получения снеков, сублимированных на основе пюре рябины черноплодной с добавлением пектина к пюре, добавляли 5% пектина от массы пюре, затем производили сублимационную сушку.
Для проведения испытаний получали водно-этанольные экстракты исследуемых продуктов. Для получения экстрактов навеску вещества массой 2 г смешивали с 20 мл растворителя (соотношение воды дистиллированной и спирта этилового для получения этально-водного экстракта – 1:1).
В основу разработанной методики для определения органолептических характеристик сублимированных снеков были положены принципы дескрипторного анализа. Была проведена органолептическая оценка сублимированных снеков на основе пюре рябины черноплодной в соответствии с разработанной шкалой и согласно ГОСТ 5897–90, ГОСТ 31986–2012, ГОСТ ISO 11036–2017, ГОСТ ISO 11037–2013, ГОСТ ISO 13299–2015, ГОСТ ISO 16779–2017, ГОСТ ISO 6658–2016. В соответствии с разработанной шкалой члены экспертной комиссии оценивали образцы по показателям «интенсивность флейвора», «внешний вид», «отсутствие вреда здоровью», «быстрота гомогенизации в ротовой полости» и «хруст» (таблица 1).
Определение содержания растворимых сухих веществ в ягодах рябины черноплодной (Aronia melnocarpa), пюре рябины черноплодной, снеках, сублимированных из рябины черноплодной, и снеках, сублимированных из рябины черноплодной с добавлением 5% пектина проводили по ГОСТ 33977–2016; содержание сахара по ГОСТ 8756.13–87; титруемую кислотность по ГОСТ 34127–2017; содержание пищевых волокон по ГОСТ Р 54014–2010; содержание витамина С по ГОСТ 24556–89 флуорометрическим методом.
Общее содержание фенольных веществ в образцах определяли по методу Folin-Ciocalteu [21]. К экстракту ягод рябины черноплодной ( Aronia melnocarpa ), пюре рябины черноплодной, снеков, сублимированных из рябины черноплодной, и снеков, сублимированных из рябины черноплодной с добавлением 5% пектина объемом 1 мл добавляли 1 мл реагента Фолина-Чокальто и 1 мл насыщенного водного раствора Nа 2 СО 3. Инкубировали в течение 30 мин при 25 °C и спектрофотометрировали при 750 нм. Общее содержание фенолов расчитывали как эквивалент галловой кислоты (мг галловой кислоты / 100 г исходного сырья) по калибровочной кривой.
Общее содержание флавоноидов в образцах определяли по методике [22]. К 0,5 мл экстракта ягод рябины черноплодной (Aronia melnocarpa), пюре рябины черноплодной, снеков, сублимированных из рябины черноплодной, и снеков, сублимированных из рябины черноплодной с добавлением 5% пектина добавляли 2,5 мл воды дистиллированной и 0,15 мл раствора нитрита натрия концентрацией 5%. Выдерживали в течение 5 мин при 25 °C, затем добавляли 0,3 мл раствора хлорида алюминия (III) и выдерживали в течение 5 мин, затем спектро-фотометрировали при 510 нм. Содержание флавоноидов рассчитывали как эквивалент катехина (мг катехина/100 г исходного сырья) по калибровочной кривой.
Общее содержание антоцианов определяли согласно ГОСТ Р 53773–2010 путем спектрофото-метрирования при двух различных рН (1,0 и 4,5) при 515 и 700 нм. Содержание антоцианов выражали в мг цианидин-3-гликозида/100 г исходного сырья.
Антирадикальную активность определяли по методу DPPH [23]. Методика основана на способности антиоксидантов исходного сырья связывать стабильный хромоген-радикал 2,2–дифенил-1-пикрилгидрозил (DPPH). Аликвоты исследуемого экстракта (0,05; 0,10; 0,40; 0,80; 1,00 и 5,00 мл) растворяли в 100 мл дистиллированной воды. Затем 2 мл каждого раствора добавляли к 2 мл раствора DPPH при 20 °C. Ан-тирадикальную активность выражали в виде концентрации исходного экстракта в мг/мл, при которой происходило связывание 50% радикалов.
Восстанавливающую силу экстрактов определяли по методике FRAP [24]. Для анализа использовали свежеприготовленный раствор FRAP: к 10 мл ацетатного буфера (рН 3,6) добавляли 1 мл 10%-ного раствора хлорида железа (III) и 1 мл раствора 2,4,6–трипири-дил-5-триазина (10 ммоль/л 2, 4, 6 трипири-дил-5-триазина в 40 ммоль/л НСl) и выдерживали 10 мин при температуре 37 °C. К 0,1 мл исследуемого экстракта добавляли 3 мл дистиллированной воды и 1 мл раствора FRAP и выдерживали в течение 4 мин при 37 °C. Спектрофотометри-ровали при 593 нм. Восстанавливающую силу определяли по калибровочному графику и выражали в ммоль Fе2+/1 кг исходного сырья.
Таблица 1.
Результаты органолептической оценки снеков, сублимированных на основе пюре рябины черноплодной, и снеков, сублимированных на основе пюре рябины черноплодной с добавлением 5% пектина
Table 1.
The results of the organoleptic evaluation of snacks sublimated on the basis of mashed chokeberry and snacks on the basis of mashed chokeberry with the addition of 5% pectin
|
Образец | Sample |
Балльная оценка | Scoring |
||||
|
Интенсивность флейвора | Flavor intensity |
Внешний вид | Appearance |
Отсутствие вреда здоровью | No harm to health |
Быстрота гомогенизации в ротовой полости | Homogenization rate in the oral cavity |
Хруст | Crunch |
|
|
Снеки, сублимированные из пюре рябины черноплодной | Sublimated snacks from mashed chokeberry |
5 |
4 |
5 |
5 |
5 |
|
Снеки, сублимированные из рябины черноплодной с добавлением 5% пектина | Sublimated snacks from chokeberry with the addition of 5% pectin |
5 |
5 |
5 |
5 |
5 |
Результаты и обсуждение
В результате органолептической оценки нового вида сублимированных снеков (таблица 1) было выявлено, что оба образца обладают высокими органолептическими показателями и могут являться перспективными направлениями исследований для создания функциональных пищевых продуктов. Однако было установлено, что добавление пектина к пюре рябины черноплодной при сублимации позволяет придать снекам более равномерную пористость и, как следствие, улучшить внешний вид.
Результаты определения содержания витамина С, сухих веществ, титруемой кислотности и пищевых волокон в образцах представлены в таблице 2.
Таблица 2.
Результаты определения содержания витамина С, сухих веществ, титруемой кислотности, сахаров и пищевых волокон в исследуемых образцах
Table 2.
Results of determination of the content of vitamin C, dry substances, titrated acidity, sugars and dietary fibers in the studied samples
|
Измеряемый показатель | Measurable indicator |
>х о X ч о о о Ри g У нн о t? |
я & b я дО С |
i е & к S "8 И у> о Л -- *0-0 § Я У О §-5 Ри S У § g 6 s g S х 133 X Ю и |
Ри и У m S g S g ® 5 m 5 о V G ° -g "5 ° Я « сл ti g о ° ,o В ч S о 5 to g я s 5
— 2 с я X |
|
Содержание растворимых сухих веществ, % | The content of soluble solids, % |
2,6 |
2,6 |
6,5 |
6,5 |
|
Содержание сахаров, % | Sugar content, % |
1,1 |
1,1 |
6,5 |
6,5 |
|
Титруемая кислотность, г/дм3 Titratable acidity, g/dm3 |
1,3 |
1,3 |
5,3 |
5,3 |
|
Содержание витамина С, % | The content of vitamin C, % |
16,1 |
16,1 |
17,6 |
17,6 |
|
Содержание пищевых волокон, % | The content of dietary fiber, % |
4,1 |
4,4 |
8,4 |
8,7 |
Пищевая ценность черноплодной рябины и продуктов ее переработки зависит от содержания растворимых сухих веществ, представленных сахарами (глюкоза, фруктоза и сахароза), органическими кислотами (лимонная, яблочная и винная) и многоатомными спиртами (сорбитол) [25]. Результаты определения растворимых сухих веществ в образцах показывают, что ягоды рябины черноплодной и пюре рябины черноплодной содержат наименьшее количество растворимых сухих веществ, тогда как снеки, сублимированные на основе пюре рябины черноплодной, и снеки, сублимированные на основе пюре рябины черноплодной с добавлением 5% пектина, обладают наивысшими значениями содержания сухих веществ. Более высокое содержание растворимых сухих веществ в сублимированных образцах (в 2,5 раза выше, чем в ягодах рябины черноплодной и пюре ягод рябины черноплодной) может объясняться отсутствием в них влаги, присутствующей в несублимированных ягодах и пюре.
Содержание сахаров в плодово-ягодной продукции обусловливает сладость продукта, то есть непосредственно влияет на его органолептические характеристики. Растворимые сахара в плодах и ягодах представлены в основном глюкозой, фруктозой и сахарозой [26]. Анализ данных таблицы 2 позволяет отметить, что наименьшим содержанием сахаров обладают ягоды рябины черноплодной и пюре рябины черноплодной, а наибольшим – снеки. Увеличение содержания сахаров в 6 раз в процессе сублимации может объясняться повышением концентрации сухих веществ в сублимированном продукте после полного удаления влаги.
Органические кислоты, содержащиеся в растительном сырье, способствуют активизации деятельности пищеварительных желез, и, как следствие, лучшему усвоению пищи организмом [27].
Согласно данным таблицы 2 ягоды рябины черноплодной и пюре рябины черноплодной обладают более низкими значениями титруемой кислотности по сравнению со снеками.
Сублимационная сушка ягод рябины черноплодной и пюре рябины черноплодной позволяет получить продукт, значения титруемой кислотности которого в 4 раза превышают значения исходного сырья.
Витамин С играет важную роль в качестве клеточного антиоксиданта. В водной фазе он может нейтрализовать гидроксильный, алкоксиль-ный, пероксидный (RООО) радикалы. Кроме того, витамин С может нейтрализовать радикальную форму других антиоксидантов, таких как глутатионовый радикал и витамин Е, и регенерировать эти антиоксиданты. Сам витамин С легко регенерируется из ацетил-КоА с помощью NADH или NADPH-зависимых редуктаз [28].
Анализ данных о содержании витамина С в исследуемых образцах (см. табл. 2) позволяет сделать вывод о близких значениях показателей всех исследуемых образцов. Содержание витамина С в сублимированных снеках незначительно превышает содержание витамина С в ягодах рябины черноплодной и пюре. Однако в результате сублимации продукт полностью обезвоживается, сохраняя сухие вещества, в результате чего их концентрация в сублимированном продукте должна возрастать пропорционально потерям влаги. Незначительное увеличение содержания витамина С в сублимированных образцах (в 1,1 раз) показывает неустойчивость витамина С в процессе сублимационной сушки.
Пищевые волокна не перевариваются и не поглощаются организмом человека, а подвергаются бактериальной ферментации в желудочно-кишечном тракте и, следовательно, влияют на бактериальный состав ЖКТ [29].
Согласно данным таблицы 2 наименьшим содержанием пищевых волокон обладают ягоды рябины черноплодной, наивысшим – снеки, сублимированные на основе пюре рябины черноплодной с добавлением пектина. Данные таблицы 2 позволяют сделать вывод об увеличении содержания пищевых волокон в 2 раза в процессе сублимационной сушки.
Анализ данных таблицы 2 позволяет сделать вывод об увеличении показателей титруемой кислотности, содержания пищевых волокон, сухих растворимых веществ и сахаров в процессе сублимации в 3–6 раз. При этом образцы рябины черноплодной и пюре обладают близкими по значениям показателями, так же как и снеки, пюре рябины черноплодной что может объясняться сохранением экстрактивных веществ в процессе сублимации при одновременной потере влаги, что приводит к увеличению концентрации экстрактивных веществ в массе исходного пюре. Результаты показывают перспективность использования нового вида снеков на основе пюре рябины черноплодной в качестве функционального продукта для восполнения дефицита пищевых волокон в организме.
Биологическая активность ягод рябины черноплодной ( Aronia melnocarpa ) отчасти объясняется антиоксидантными свойствами составляющих ее полифенолов. Выявлено, что многие пищевые полифенольные компоненты, полученные из растений, являются более эффективными антиоксидантами in vitro , чем витамины E или C, и могут вносить значительный вклад в защитные эффекты in vivo [30].
На рисунке 1 представлены результаты измерений общего содержания фенольных веществ в образцах.
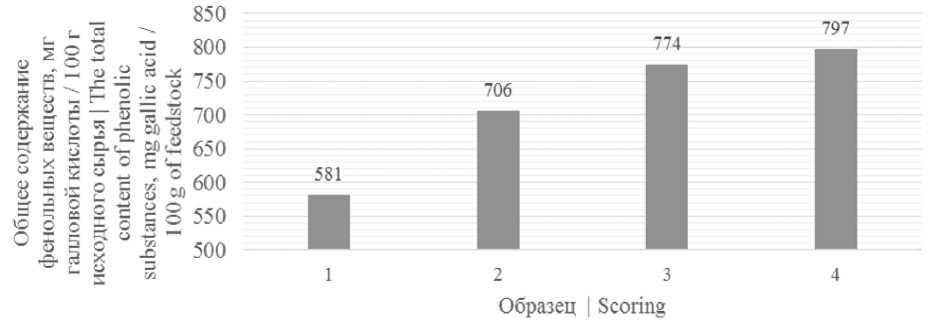
Рисунок 1. Общее содержание фенольных веществ в исследуемых образцах: 1 – ягоды рябины черноплодной; 2 – пюре ягод рябины черноплодной; 3 – снеки, сублимированные из пюре рябины черноплодной; 4 – снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина
Figure 1. The total content of phenolic substances in the samples: 1 – berries of mountain ash; 2 – puree of chokeberry berries; 3 – freeze-dried snacks from mashed chokeberry; 4 – freeze-dried snacks from mashed chokeberry with the addition of 5% pectin
Согласно данным рисунок 1 наибольшим содержанием фенольных веществ обладали снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина, наименьшим – ягоды рябины черноплодной, что свидетельствует об увеличении содержания фенольных соединений в процессе механической и тепловой обработки (сублимационной сушки) ягод рябины черноплодной.
Флавоноиды (биофлавоноиды) являются вторичными метаболитами растений и содержатся в фотосинтезирующих клетках плодов и ягод. Антиоксидантный эффект флавоноидов обусловлен их гидроксильными группами и способностью к хелатированию ионов металлов [31].
На рисунке 2 представлены результаты измерений общего содержания флавоноидов в образцах.
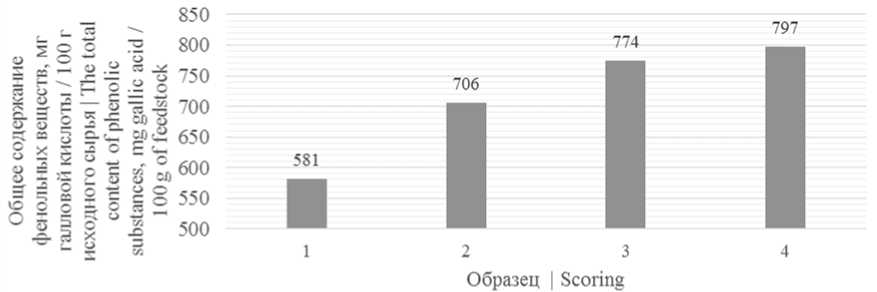
Рисунок 2. Общее содержание флавоноидов в исследуемых образцах: 1 – ягоды рябины черноплодной; 2 – пюре ягод рябины черноплодной; 3 – снеки, сублимированные из пюре рябины черноплодной; 4 – снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина
Figure 2. The total content of flavonoids in the samples: 1 – berries of mountain ash; 2 – puree of chokeberry berries; 3 – freeze-dried snacks from mashed chokeberry; 4 – freeze-dried snacks from mashed chokeberry with the addition of 5% pectin
Данные рисунка 2 свидетельствуют о том, что наименьшим содержанием флавоноидов обладали ягоды рябины черноплодной, наибольшим – снеки, сублимированные на основе пюре рябины черноплодной с добавлением пектина. При этом снеки, сублимированные на основе пюре рябины черноплодной, и снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина, обладают близкими по значениям показателями содержания флавоноидов.
Антоцианы являются потенциальными фармацевтическими ингредиентами, поскольку оказывают профилактическое и лечебное действие на организм человека. Исследования показывают, что антоцианины обладают антиоксидантной и антимикробной активностью, оказывают благоприятное воздействие на нервную систему, обладают защитными свойствами в отношении некоторых неинфекционных заболеваний [32].
На рисунке 3 представлены результаты измерений общего содержания антоцианов в образцах.
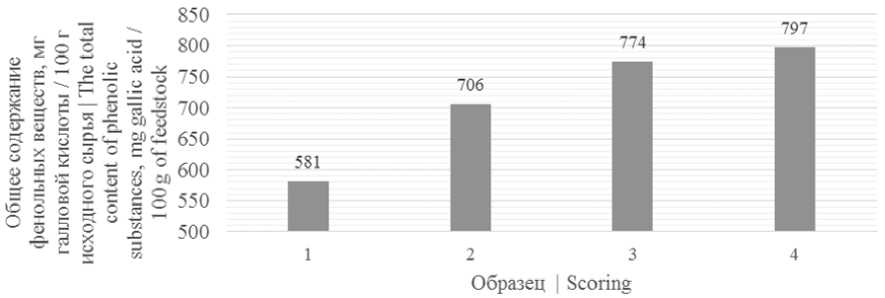
Рисунок 3. Общее содержание антоцианов в исследуемых образцах: 1 – ягоды рябины черноплодной; 2 – пюре ягод рябины черноплодной; 3 – снеки, сублимированные из пюре рябины черноплодной; 4 – снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина
Figure 3. The total content of anthocyanins in the studied samples: 1 – berries of mountain ash; 2 – puree of chokeberry berries; 3 – freeze-dried snacks from mashed chokeberry; 4 – freeze-dried snacks from mashed chokeberry with the addition of 5% pectin
Анализ данных рисунка 3 позволяет сделать вывод о близких значениях показателей антоцианов ягод рябины черноплодной и пюре, т.е. образцов, не прошедших сублимационную сушку, и показателей снеков, т. е. образцов, прошедших тепловую обработку в виде сублимационной сушки. Данный факт свидетельствует о перспективности использования сублимационной обработки ягод рябины черноплодной для получения функциональных продуктов с повышенным содержанием антоцианов.
Данные рисунков 1–3 позволяют сделать вывод об увеличении количества фенольных веществ, флавоноидов и антоцианов в процессе сублимационной сушки пюре рябины черноплодной. Наиболее низкое содержание фенольных веществ, флавоноидов и антоцианов в экстракте цельных ягод рябины черноплодной может объясняться наименьшей степенью измельчения исходного сырья и, как следствие, более низкой степенью экстракции фенольных веществ, что согласуется с литературными данными [8]. Отмечено увеличение содержания биологически активных веществ при добавлении пектина к пюре рябины черноплодной при сублимационной сушке.
Свободные радикалы являются продуктами нормального клеточного метаболизма и могут быть определены как атомы или молекулы, содержащие один или несколько неспаренных электронов на внешней орбитали, способные к независимому существованию. Свободные радикалы могут иметь как эндогенное происхождение (митохондрии, пероксисомы, эндоплазматическая сеть, фагоцитарные клетки), так и происходить из экзогенных источников (алкоголь, табачный дым, тяжелые металлы, пестициды, некоторые лекарства). Свободные радикалы могут оказывать неблагоприятное воздействие на различные важные классы биологических соединений, такие как нуклеиновые кислоты, липиды и белки, тем самым изменяя нормальный окислительно-восстановительный баланс организма, что приводит к усилению окислительного стресса [33].
В настоящее время понятия «антиоксидантная» и «антирадикальная активность» ошибочно рассматриваются как единые. Рассмотренные выше вещества (антоцианы, флавоноиды, фенольные вещества) характеризуют антиоксидантные свойства продукта, то есть способность к ингибированию процесосв окисления. Антирадикальная активность же характеризует реакционную способность вещества к связыванию свободных радикалов в организме [34]. Результаты определения антирадикальной активности в образцах по методу DPPH представлены на рисунке 4.
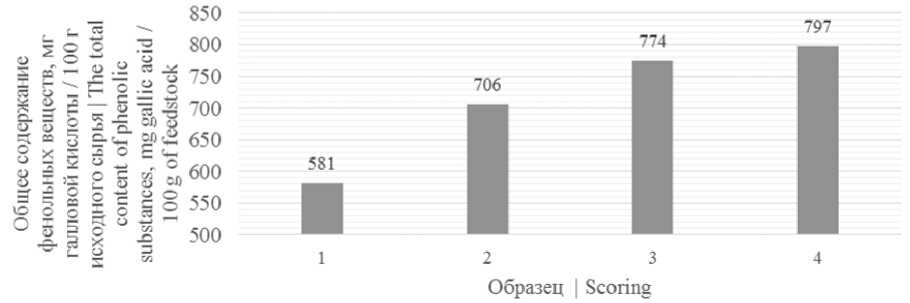
Рисунок 4. Антирадикальная активность исследуемых образцов: 1 – ягоды рябины черноплодной; 2 – пюре ягод рябины черноплодной; 3 – снеки, сублимированные из пюре рябины черноплодной; 4 – снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина
Figure 4. Antiradical activity of the studied samples: 1 – berries of mountain ash; 2 – puree of chokeberry berries; 3 – freeze-dried snacks from mashed chokeberry; 4 – freeze-dried snacks from mashed chokeberry with the addition of 5% pectin
Согласно данным рисунка 4 наименьшей антирадикальной активностью обладали ягоды рябины черноплодной, наибольшей – снеки, сублимированные на основе рябины черноплодной с добавлением пектина.
Известно, что такие металлы, как медь и железо, усиливают окислительный стресс. Эти ионы (Fе2+ и Cu+) реагируют с Н2О2, являющейся продуктом, образованным дисмутацией О2-, с образованием высокореакционноспособного гидроксильного радикала, окисляясь до Fе3+ и Сu2+ соответственно. Некоторые вещества, обладающие антиоксидантной активностью, способны останавливать процесс окисления металлов [28]. На рисунке 5 предсталены результаты определения восстанавливающей способности в образцах.
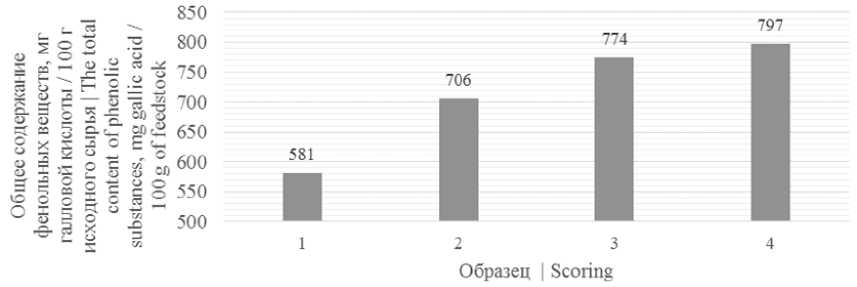
Рисунок 5. Восстанавливающая способность исследуемых образцов: 1 – ягоды рябины черноплодной; 2 – пюре ягод рябины черноплодной; 3 – снеки, сублимированные из пюре рябины черноплодной; 4 – снеки, сублимированные из пюре рябины черноплодной с добавлением 5% пектина
Figure 5. The restoring ability of the studied samples: 1 – berries of mountain ash; 2 – puree of chokeberry berries; 3 – freeze-dried snacks from mashed chokeberry; 4 – freeze-dried snacks from mashed chokeberry with the addition of 5% pectin
Данные рисунка 5 свидетельствуют о положительном влиянии механической обработки и сублимационной сушки на восстанавливающую способность исследуемых образцов, что коррелирует с результатами определения содержания антоцианов, флавоноидов и фенольных веществ в образцах. Это позволяет сделать вывод о положительном влиянии механической обработки и сублимационной сушки на антиоксидантные свойства веществ в целом.
Заключение
Были проведены исследования, направленные на определение органолептических и физико-химических показателей, антиоксидантной и антирадикальной активности рябины черноплодной и продуктов ее переработки – пюре рябины черноплодной, нового вида снеков, сублимированных на основе пюре рябины черноплодной, нового вида снеков, сублимированных на основе пюре рябины черноплодной с добавлением 5% пектина.
Разработана методология органолептической оценки нового вида сублимированных снеков на основе пюре рябины черноплодной. Установлено, что новый вид снеков обладает высокими органолептическими показателями, что делает их производство перспективным направлением.
Определение общего содержания фенольных веществ, флавоноидов, антоцианов, а также восстанавливающей активности исследуемых образцов как показателей, характеризующих антиоксидантную активность соединений, показало положительное влияние измельчения как механической обработки и сублимационной сушки как тепловой обработки на антиоксидантные свойства рябины черноплодной.
Определение содержания витамина С в исследуемых образцах позволяет сделать вывод об отрицательном воздействии сублимационной сушки на содержание витамина С в рябине черноплодной.
В результате определения содержания пищевых волокон, растворимых сухих веществ, сахаров и титруемой кислотности в исследуемых образцах выявлено увеличение значений данных показателей в 3–6 раз в процессе сублимационной сушки, что показывает целесообразность использования данного вида тепловой обработки при производстве функциональных продуктов на основе рябины черноплодной.
Список литературы Изучение органолептических и физико-химических показателей снеков на основе рябины черноплодной (Aronia melnocarpa)
- Sidor A., Dro?d?y?ska A., Gramza-Micha?owska A. Black chokeberry (Aronia melanocarpa) and its products as potential health-promoting factors - An overview // Trends in Food Sci. Technol. 2019. V. 89. P. 45-60. 10.1016/ j.tifs.2019.05.006 DOI: 10.1016/j.tifs.2019.05.006
- Appel K., Meiser P., Mill?n E., Collado J.A. et al. Chokeberry (Aronia melanocarpa (Michx.) Elliot) concentrate inhibits NF-?B and synergizes with selenium to inhibit the release of pro-inflammatory mediators in macrophages // Fitoterapia. 2015. V. 105. P. 73-82. DOI: 10.1016/j.fitote.2015.06.009
- Denev P., ??? M., Kratchanova M., Blazheva D. Black chokeberry (Aronia melanocarpa) polyphenols reveal different antioxidant, antimicrobial and neutrophil-modulating activities // Food Chem. 2019. V. 284. P. 108-117. 10.1016/ j.foodchem.2019.01.108 DOI: 10.1016/j.foodchem.2019.01.108
- Jakobeka L., Drenjan?evi? M., Juki? V., ?eruga M. Phenolic acids, flavonols, anthocyanins and antiradical activity of "Nero", "Viking", "Galicianka" and wild chokeberries // Scientia Horticulturae. 2012. V. 147. P. 56-63. 10.1016 /j.scienta.2012.09.006 DOI: 10.1016/j.scienta.2012.09.006
- Berm?dez-Soto M.J., Tom?s-Barber?n F.M., Garc?a-Conesa M.T. Stability of polyphenols in chokeberry (Aronia melanocarpa) subjected to in vitro gastric and pancreatic digestion // Food Chem. 2007. V. 102 (3). P. 865-874. DOI: 10.1016/j.foodchem.2006.06.025
- Takahashi A., Sakaguchi H., Higuchi O., Suzuki T. et al. Intestinal absorption of black chokeberry cyanidin 3glycosides is promoted by capsaicin and capsiate in a rat ligated small intestinal loop model // Food Chem. V. 277. P. 323-326.
- DOI: 10.1016/j.foodchem.2018.10.094
- Brazdauskas T., Montero L., Venskutonis P.R., Iba?ez E. et al. Downstream valorization and comprehensive two-dimensional liquid chromatography-based chemical characterization of bioactives from black chokeberries (Aronia melanocarpa) pomace // J. Chromatography A. 2016. V. 1468. P. 126-135.
- DOI: 10.1016/j.chroma.2016.09.033
- D'Alessandro L.G., Dimitrov K., Vauchel P., Nikov I. Kinetics of ultrasound assisted extraction of anthocyanins from Aronia melanocarpa (black chokeberry) wastes // Chem. Eng. Res. Design. 2014. V. 92 (10). P. 1818-1826.
- DOI: 10.1016/j.cherd.2013.11.020
- Dulf F.V., Vodnar D.C., Dulf E.H., Diaconeasa Z. et al. Liberation and recovery of phenolic antioxidants and lipids in chokeberry (Aronia melanocarpa) pomace by solid-state bioprocessing using Aspergillus niger and Rhizopus oligosporus strains // Food Sci. Technol. 2018. V. 87. P. 241-249.
- DOI: 10.1016/j.lwt.2017.08.084
- ?uji? N., Trifkovi? K., Bugarski B., Ibri? S. et al. Chokeberry (Aronia melanocarpa L.) extract loaded in alginate and alginate/inulin system // Ind. Crops Prod. 2016. V. 86. P. 120-131.
- DOI: 10.1016/j.indcrop.2016.03.045
- Pieczykolan E., Kurek M.A. Use of guar gum, gum arabic, pectin, beta-glucan and inulin for microencapsulation of anthocyanins from chokeberry // Int. J. Biol. Macromol. 2019. V. 129. P. 665-671.
- DOI: 10.1016/j.ijbiomac.2019.02.073
- Song E.K., Park H., Kim H.S. Additive effect of walnut and chokeberry on regulation of antioxidant enzyme gene expression and attenuation of lipid peroxidation in d-galactose-induced aging-mouse model // Nutr. Res. 2018.
- DOI: 10.1016/j.nutres.2018.09.011
- Bhaswant M., Shafie S.R., Mathai M.L., Mouatt P. et al. Anthocyanins in chokeberry and purple maize attenuate diet-induced metabolic syndrome in rats // Nutrition. 2017. V. 41. P. 24-31.
- DOI: 10.1016/j.nut.2016.12.009
- Worsztynowicz P., Napiera?a M., Bia?as W., Grajek W. et al. Pancreatic ?-amylase and lipase inhibitory activity of polyphenolic compounds present in the extract of black chokeberry (Aronia melanocarpa L.) // Proces. Biochem. 2014. V. 49 (9). P. 1457-1463.
- DOI: 10.1016/j.procbio.2014.06.002
- ?uji? N., Savikin K., Miloradovic Z., Ivanov M. et al. Characterization of dried chokeberry fruit extract and its chronic effects on blood pressure and oxidative stress in spontaneously hypertensive rats // J. Functional Foods. 2018. V. 44. P. 330-339.
- DOI: 10.1016/j.jff.2018.02.027
- Loo B.M., Erlund I., Koli R., Puukka P. et al. Consumption of chokeberry (Aronia mitschurinii) products modestly lowered blood pressure and reduced low-grade inflammation in patients with mildly elevated blood pressure // Nutr. Res. 2016. V. 36 (11). P. 1222-1230.
- DOI: 10.1016/j.nutres.2016.09.005
- Handeland M., Grude N., Torp T., Slimestad R. Black chokeberry juice (Aronia melanocarpa) reduces incidences of urinary tract infection among nursing home residents in the long term-a pilot study // Nutr. Res. V. 34 (6). P. 518-525.
- DOI: 10.1016/j.nutres.2014.05.005
- Park H., Liu Y., Kim H.S., Shin J.H. Chokeberry attenuates the expression of genes related to de novo lipogenesis in the hepatocytes of mice with nonalcoholic fatty liver disease // Nutr. Res. 2016. V. 3 (1). P. 57-64.
- DOI: 10.1016/j.nutres.2015.10.010
- S?jka M., Ko?odziejczyk K., Milala J. Polyphenolic and basic chemical composition of black chokeberry industrial by-products // Ind. Crops Prod. 2013. V. 51. P. 77-86.
- DOI: 10.1016/j.indcrop.2013.08.051
- Kosmala M., Zdu?czyk Z., Karli?ska E., Ju?kiewicz J. The effects of strawberry, black currant, and chokeberry extracts in a grain dietary fiber matrix on intestinal fermentation in rats // Food Res. Int. 2014. V. 64. P. 752-761.
- DOI: 10.1016/j.foodres.2014.07.010
- Alessandro L.G., Kriaa K., Nikov I., Dimitrov K. Ultrasound assisted extraction of polyphenols from black chokeberry // Separation and Purification Technology. 2012. V. 93. P. 42-47.
- Rugina D., Scontxa Z., Leopold L. Antioxidant activities of chokeberry extracts and the cytotoxic action of their anthocyanin fraction on HeLa human cervical tumor cells // Journal of Medicinal Food. 2012. V. 15 (8). P. 700-706.
- Демидова А.В., Макарова Н.В. Влияние режимов бланшировки на физико-химические свойства и антиоксидантную активность фруктового сырья на примере вишни, сливы, черноплодной рябины, клубники // Пищевая промышленность. 2016. № 2. С. 40-44.
- Макарова Н.В., Зюзина А.В. Исследование антиоксидантной активности яблок различных сортов // Техника и технология пищевых производств. 2011. № 4 (23).
- Дубодел Н.П., Победа М.И., Шашин Д.Л. Сравнительная оценка методов анализа растворимых сухих веществ в концентрированных фруктовых и овощных пюре // Пиво и напитки. 2015. № 3. С. 40-43.
- Magwazaa L.S., Opara U.L. Analytical methods for determination of sugars and sweetness of horticultural products - A review // Scientia Horticulturae. 2015. V. 184. P. 179-192.
- DOI: 10.1016/j.scienta.2015.01.001
- Анисимович И.П., Отман Р., Дейнека Л.А., Дейнека В.И. и др. Определение кислотности некоторых плодов, соков и прохладительных напитков // Научные ведомости БелГУ. 2011. № 9(104). С. 250-257.
- L? J-M., Lin P.H., Yao Q., Chen C. Chemical and molecular mechanisms of antioxidants: experimental approaches and model systems // J. Cell. Mol. Med. 2010. V. 14 (4). P. 840-860. 10.1111/j. 1582-4934.2009.00897.x
- DOI: 10.1111/j.1582-4934.2009.00897.x
- Holscher H.D. Dietary Fiber and Prebiotics and the Gastrointestinal Microbiota // Gut microbes. 2017. V. 8 (2). P. 172-184.
- DOI: 10.1080/19490976.2017.1290756
- Rice-Evans C., Miller N., Paganga G. Antioxidant properties of phenolic compounds // Trends in Plant Sci. 1997. V. 4 (2). P. 152-159.
- DOI: 10.1016/S1360-1385(97)01018-2
- Bose S., Sarkar D., Bose A. Natural Flavonoids and Its Pharmaceutical Importance // The Pharma Review. 2018. P. 61-75.
- Khoo H.E., Azlan A., Tang S.T., Lim S.M. Anthocyanidins and anthocyanins: colored pigments as food, pharmaceutical ingredients, and the potential health benefits // Food Nutr Res. 2017. V. 61 (1). P. 1-21. 10.1080/ 16546628.2017.1361779.
- DOI: 10.1080/16546628.2017.1361779
- Phaniendra A., Jestadi D.B., Periyasamy L. Free Radicals: Properties, Sources, Targets, and Their Tirzitis G., Bartosz G. Determination of antiradical and antioxidant activity: basic principles and new insights // Acta Biochim. Pol. 2010. V. 52 (2). P.139-142.
- Implication in Various Diseases // Ind. J. Clin. Biochem. 2015. V. 30 (1). P. 11-26.
- DOI: 10.1007/s12291-014-0446-0


