Изучение природных пищевых антиокислителей CO2-экстракта Mentha piperita L.
Автор: Каленик Т.К., Сенотрусова Т.А., Моткина Е.В., Фади Дарвиш, Разгонова М.П.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 1 (80), 2021 года.
Бесплатный доступ
В статье представлены результаты изучения биологически активных веществ экстракта CO2-Mentha piperita L., который содержит соединения, способные увеличивать сроки годности пищевых продуктов, в том числе из сырья животного происхождения. Экстракт получали с помощью сверхкритической флюидной экстракции. С помощью ВЭЖХ-МС/МС анализа были идентифицированы биологически активные вещества в экстрактах CO2-Mentha Piperita L. Идентифицировано 42 биологически активных компонента. Было обнаружено 9 новых соединений (скополетин, феруловая кислота, стеаридоновая кислота, цирсимаритин, 15,16-дигидротаншинон, изотаншинон IIA, альфитоловая кислота, изорамнетин-3-(6-O-ферулоил) глюкозид и 5-десметилнобилетин). Результаты исследования показали, что экстракт CO2-Mentha Piperita L. обладает высоким содержанием флавоноидов, что позволяет рекомендовать сверхкритические экстракты в качестве источника природных антиокислителей для использования в пищевой промышленности.
Пищевые антиокислители, сверхкритическая co2-экстракция, вэжх-мс/мс, мята (mentha piperita l.), экстракты, флавоноиды
Короткий адрес: https://sciup.org/142228799
IDR: 142228799 | УДК: 633.822:
Текст научной статьи Изучение природных пищевых антиокислителей CO2-экстракта Mentha piperita L.
Ароматические растения, известные как пряные травы, веками использовались в качестве пищевых консервантов и лекарственных растений. В настоящее время спрос на эти растения и их производные возрос, поскольку они являются натуральными, экологически чистыми и безопасными продуктами [1]. Экстракты трав представляют собой сложные смеси, 29
они содержат множество биологически активных соединений, в большей массовой доле содержат полифенолы, которые обладают антимикробными, антиоксидантными и противовоспалительными свойствами [2]. Мята перечная (семейство Lamiaceae ) - одна из трав, которые известны терапевтическими свойствами и содержанием ароматических соединений. Эти соединения используются при получении различных продуктов питания, в том числе из сырья животного происхождения. Мята перечная выращивается в нескольких частях света (Азия, Европа, Южная Африка, США и др.) и давно используется в качестве специи (в виде порошка почек), пряных трав (свежие или сушеные листья), ароматизатора, красителя, консерванта при производстве пищевых продуктов. Экстракт мяты перечной содержит богатый состав фитохи-мических веществ, который давно исследуется учеными с целью получения соединений с противораковой активностью, противовоспалительными, противовирусными, антибактериальными и антиоксидантными свойствами [3-8]. Фенольные соединения (фенольные кислоты, флавоноиды, терпены и т.д.) являются основными биологически активными фитохимиче-скими веществами, содержащимися в экстрактах мяты перечной. В частности, в листьях мяты перечной было обнаружено высокое содержание полифенолов, таких как розмариновая кислота, эриоцитрин, гесперидин, 7-O-рутинозид лютеолина, апигенин и салициловая кислота [9 - 11]. Розмариновая кислота является фенольным соединением и эфиром кофейной кислоты, которая встречается в природе в некоторых растениях семейства Lamiaceae . Это соединение проявляет антиокислительное действие, что важно для продления сроков годности пищевых продуктов [12]. Подробно изучено содержание розмариновой кислоты в некоторых растениях, ее содержание было следующим: Melissa offialis 36,5 мг/г, Mentha spicata 58,5 мг/г, Rosmarinus fi 7,2 мг/г Thymus citriodorus 31,5 мг/г, и наибольшая массовая доля розмариновой кислоты была обнаружена у видов Mentha [13].
Сверхкритическая жидкостная экстракция (SFE) используется с конца 1970-х гг. для анализа пищевых продуктов, выделения биологически активных веществ и определения уровней липидов в продуктах питания, а также уровней токсичных веществ. Одним из наиболее важных преимуществ использования этого метода является то, что в продуктах отсутствуют остатки органических растворителей, которые возникают при использовании традиционных методов экстракции, а растворители могут быть токсичными, например в случае метанола и н-гексана [14].
Целью исследования явилась идентификация состава биологически активных веществ, присутствующих в экстракте CO 2 - Mentha Piperita L ., которые обладают свойствами улучшения окислительной стабильности и продления сроков годности пищевых продуктов.
Материалы и методы исследования
В научно-исследовательской работе были использованы следующие материалы: листья мяты перечной ( Mentha piperita L ., г. Тартус, Сирия), собранные до цветения, затем их подвергали высушиванию. Семена мяты перечной выращивали в следующих тепличных условиях: при температуре от 20 до 25 °С и влажности 80 % в период с апреля по май в 2019 г. Свежая мята была высушена в сушильном шкафу (Binder oven M115 P M, Germany) при 55 °С в течение 200 мин. Высушивание осуществляли до содержания влаги 12 ± 1 %.
Экстрагирование мяты выполнено с помощью системы флюидной экстракции Thar SFE-500F-2-FMC50 (США). В исследовании давление CO 2 варьировалось от 200 до 300 бар, время воздействия - от 0,5 ч до 2 ч, применялся сорастворитель этанол. Температура варьировалась от 31 до 70 °С. Разделение многокомпонентных смесей проводили методом ВЭЖХ с использованием жидкостного хроматографа высокого давления Shimadzu LC–20 Prominence HPLC (Shimadzu, Япония), оборудованного спектрофотометрическим детектором SPD–20A и колонкой с обратной фазой Shodex ODP-40 4E. Программа градиента элюции (вода – ацетонитрил)
следующая: 0-4 мин, 100 % Н 2 О, 0 % ацетонитрила (CH 3 CN); 4-60 мин, 100-25 % Н 2 О, 075 CH 3 CN; 60-75 мин, 25-0 % Н 2 О, 75-100 % CH 3 CN; контрольная промывка 75-120 мин 0 % Н 2 О; 100 % CH 3 CN. Весь ВЭЖХ-анализ сделан с DAD-детектором при длинах волн 230 и 330 нм; температура - 17 °С. Объем впрыска составлял 1 мл. Идентификацию БАВ проводили методом тандемной масс-спектрометрии с помощью масс-спектрометра AmaZon SL (производство фирмы «BRUKER DALTONIKS», Германия), оснащенного источником ионизации электрораспылением ESI в режимах отрицательных и положительных ионов. Оптимизированные параметры получены следующим образом: температура источника ионизации - 70 °С, поток газа 4 л/мин, газ-небулайзер (распылитель) - 7,3 psi, капиллярное напряжение - 4500 V, напряжение на изгибе торцевой пластины - 1500 V, фрагментатор - 280 V, энергия столкновения - 60 eV. Масс-спектрометр использовался в диапазоне сканирования m/z 100-1,700 для MС и МС/МС. Скорость захвата составляла 1 спектр/с для MС и 2 спектра/с для МС/МС. Сбор данных контролировался программным обеспечением Windows для BRUKER DALTONIKS.
Результаты исследований и обсуждение
Известно, что метод сверхкритической экстракции является эффективным способом выделения биологически активных веществ по сравнению с традиционными методами [15]. Mentha piperita L. экстрагировали методом сверхкритической СО 2 -экстракции. Идентификацию биологически активных веществ СО 2 -экстрактов Mentha piperita L . проводили методом тандемной масс-спектрометрии с использованием масс-спектрометра AmaZon SL, оснащенного источником ионизации электрораспылением ESI в режимах отрицательных и положительных ионов. На рисунке 1 представлена плотность распределения целевых аналитов на ионной хроматограмме СО 2 -экстракта Mentha piperita L . реализованная с помощью масс-спектрометрии в режиме двухступенчатого разделения ионов (MS/MS-режим).
m/z
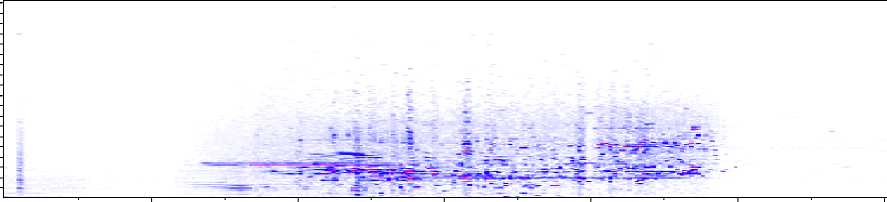
Time [min]
Рисунок 1 - Плотность распределения анализируемых целевых аналитов на ионной хроматограмме CO 2 -экстракта Mentha piperita L.
Int. 108

Обнаружение урсоловой кислоты, кофейной кислоты можно привести в качестве примеров хроматомасс-спектрометрической идентификации отдельных соединений в экстрактах мяты. На рисунке 2 приведен спектр MSn (ион-аддукт [М +H]+) при m/z 457,13, урсоловая кислота. Масс-спектрометрия с ионом-аддуктом составила 475,13[М +H]+, соответственно фрагментированные ионы: 411,16; 393,15; 177,08; 297,11. Данные измерения урсоловой кислоты подтверждаются данными масс-спектрометрии, приведенными в работе Xu, L. L. и др. (2017) [16].
x10
x10
0.5
0.0
Intens. x107 1
|
212. 1+ 259.12 |
1+ 439. 5 1+ 457.13 , If |
648.94 |
800.84 |
3+ 912.84 |
FADI extract 1(dark) 1_01_191.d: +MS, 79.8min #3293 |
|
|
212. |
1+ 411.16 |
FADI extract 1(dark) 1_01_191.d: +MS2(457.13), 79.9min #3295 |
||||
|
♦ |
||||||
|
191.12 |
1 !♦ |
|||||
|
212. |
FADI extract 1(dark) 1_01_191.d: +MS3(457.13->411.16), 79.9min #3298 |
|||||
|
177.08 297.11 |
393.15 |
|||||
|
11 ili li|lldi. L . |
If |
|||||
|
200 |
400 |
600 |
800 |
1000 |
1200 |
1400 1600 1800 m/z |
Рисунок 2 – Масс-спектр урсоловой кислоты из Mentha Piperita L. , m / z 457,13
Масс-спектр в моде положительных ионов кофейной кислоты показан на рисунке 3, и ион [M + H] + образовал фрагмент с m / z 163,04. Он был идентифицирован ранее в экстрактах из Triticum aestivum L. (Sharma et al., 2016), из Eucalyptus globulus Labill (Santos et al., 2011), из Mehthae Haplocalycis Herba (Xu et al., 2017) [16-18].
Intens. x107 2
x1006
2 x1005
4 2 0
1+
181.05
1+ L
60.63.04
FADI extract 1(dark) 1_01_191.d: +MS, 47.5min #1901
1+ 360.93
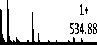
683.87
1+ 360.91
200 400
1000 1200
FADI extract 1(dark) 1_01_191.d: +MS2(181.05), 47.5min #1904
FADI extract 1(dark) 1_01_191.d: +MS3(181.05->163.04), 47.6min #1907
1400 1600
1800 m/z
Рисунок 3 – Масс-спектр кофейной кислоты из Mentha Piperita L ., m / z 181,05
В таблице приведены молекулярные массы, химическая формула и фрагментные ионы биологически активных соединений, выделенных из сверхкритического CO 2 -экстракта Mentha Piperita L . Были идентифицированы различные категории химических соединений путем сравнения данных с результатами других статей [4, 16-32].
Таблица
Компоненты, идентифицированные в сверхкритическом CO 2 -экстракте Mentha Piperita L.
|
№ п/п |
Название |
Химическая формула |
Классификация |
Молекулярная масса |
Ион-аддукт [M-H]- |
Ион-аддукт [M+Na]+ |
Фрагментирование ионов n1 и n2 |
Литература |
|
1 |
Галловая кислота |
C 7 H 6 O 5 |
Фенольная кислота |
170,1195 |
171,12 |
148,05; 112,08 |
[18, 20] |
|
|
2 |
Кофейная кислота |
C 9 H 8 O 4 |
Фенольная кислота |
180 |
181,05 |
163,04 |
[16] |
|
|
3 |
Скополетин |
C 10 H 8 O 4 |
Флавоноид |
192,1681 |
193,04 |
149,12; 150,17 |
[19] |
|
|
4 |
Феруловая кислота |
C 10 H 10 O 4 |
Фенольная кислота |
194,184 |
193,06 |
178; 136,04 |
[17, 20] |
|
|
5 |
Сальвиановая кислота А |
C 9 H 10 O 5 |
Фенольная кислота |
198,1727 |
199,1 |
171,07; 117,07; 144,08 |
[29] |
|
|
6 |
Сериновая кислота |
C 9 H 10 O 5 |
Фенольная кислота |
198 |
197 |
179; 161,01 |
[26] |
|
|
7 |
Стеаридоно-вая кислота |
C 18 H 28 O 2 |
Жирная кислота |
276 |
277,11 |
164,99; 146,98 |
[28] |
Продолжение таблицы
|
8 |
15,16-дигид-ротаншинон |
C 18 H 14 O 3 |
Дитерпен |
278,3 |
279,17 |
261,10; 243,08; 149,09 |
[28] |
|
|
9 |
Изотаншинон IIA |
C 19 H 18 O 3 |
Дитерпен |
294,3 |
295,08 |
277,09; 163,03; 259,10 |
[28] |
|
|
10 |
Кофеилмале-вая кислота |
C 13 H 12 O 8 |
Фенольная кислота |
296,2296 |
297,11 |
278,02; 272,55; 223,01; 161,96; 132,04; 259,89; 235,03; 204,99 |
[22] |
|
|
11 |
Апигенин-7,4'-димети-ловый эфир |
C17H14O5 |
Флавоноид |
298 |
298,97 |
283,92; 255,94 |
[27] |
|
|
12 |
Диосметин |
C 16 H 12 O 6 |
Флавоноид |
300,2629 |
299,1 |
283,95; 237,12; 136,99; 256,01; 221,16 |
[16, 25] |
|
|
13 |
Дигидрокверцетин |
C 15 H 12 O 7 |
Флавоноид |
304,2216 |
303,16 |
257,05; 303,15 127,05 |
[18, 20] |
|
|
14 |
Галлокатехин |
C15H14O7 |
Флавоноид |
306,2675 |
305,12 |
260,08; 127,21 243,04 |
[20,21, 24] |
|
|
15 |
Цирсимари-тин |
C17H14O6 |
Флавоноид |
314 |
314,97 |
299,95; 299,93; 167,98 |
[27] |
|
|
16 |
Кверцетин диметиловый эфир |
C 17 H 13 O 7 |
Флавоноид |
330 |
329,18 |
313,92; 211,11; 183,05 |
[26] |
|
|
17 |
Сальвигенин |
C18H16O6 |
Флавоноид |
328 |
328,97 |
295,91; 267,95 |
[27] |
|
|
18 |
Джейсеози-дин |
C 17 H 14 O 7 |
Флавоноид |
330 |
330,98 |
315,91; 297,94; 201,95 |
[16] |
|
|
19 |
5,6,4’-тригид-роксил-7,8-диметоксифлавон |
C 17 H 14 O 7 |
Флавоноид |
330 |
330,98 |
301,01; 219,05; 57,04; 175,83; 262,24 |
[16] |
|
|
20 |
5, 7, 3 ', 4'-тетраметоксифлавон |
C19H18O6 |
Флавоноид |
342 |
342,97 |
327,90; 328,93 |
[25] |
|
|
21 |
Ксантомик-рол |
C 18 H 16 O 7 |
Флавоноид |
344 |
344,93 |
329,91; 314,92 |
[16] |
|
|
22 |
Цирсилинеол |
C 18 H 16 O 7 |
Флавоноид |
344,3 |
344,94 |
311,92; 283,94 |
[27] |
|
|
23 |
Неваденсин |
C 18 H 16 O 7 |
Флавоноид |
344 |
344,93 |
329,91; 314,92 |
[16] |
|
|
24 |
Хлорогеновая кислота |
C 16 H 18 O 9 |
Фенольная кислота |
354,3087 |
353,3 |
353,23; 177,06; 179,05 |
[23] |
|
|
25 |
Феруловая кислота-O-гексозид |
C 16 H 20 O 9 |
Флавоноид |
356,3246 |
355,1 |
179,06; 353,09; 236,99; 133,11 205,02; 177,04 |
[22] |
|
|
26 |
Горденин B |
C 19 H 18 O 7 |
Флавоноид |
358 |
359 |
329,97; 311,95 |
[16] |
|
|
27 |
Ретузин |
C 19 H 18 O 7 |
Флавоноид |
358 |
358,94 |
343,92; 315,89 |
[30] |
|
|
28 |
Сидерито-флавон |
C 18 H 17 O 8 |
Флавоноид |
360 |
360,94 |
345,91; 330,91 |
[16] |
|
|
29 |
Секоизолари-цирезинол |
C 20 H 26 O 6 |
Флавоноид |
362,4168 |
363,06 |
193,06 193,02; 147,93 |
[32] |
|
|
30 |
5, 7, 3 ', 4', 5'-пентаметоксифлавон |
C20H20O7 |
Флавоноид |
372 |
372,93 |
357,89; 300,96 |
[25] |
|
|
31 |
5,6-дигид-рокси-7,8,3’, 4'-тетраме-токсифлавон |
C 19 H 18 O 8 |
Флавоноид |
374 |
374,96 |
341,93; 269,97 269,95; 13,94; 277 |
[16] |
|
|
32 |
5-десметил-нобилетин |
C 20 H 20 O 8 |
Флавоноид |
388,4 |
388,96 |
358,92; 343,91 |
[25] |
Продолжение таблицы
|
33 |
6'-гидрокси-3,4,5,2', 3', 4'-гексаметок-сихалкон |
C 21 H 24 O 8 |
Флавоноид |
404 |
405,07 |
387,12; 203,8 369,06; 273,18 |
[25] |
|
|
34 |
Сальвианоло-вая кислота D |
C20H18O10 |
Фенольная кислота |
418 |
418,91 |
400,91; 325,89 297,91; 253,94 |
[31] |
|
|
35 |
Урсоловая кислота |
C 30 H 48 O 3 |
Терпеноид |
456 |
457,13 |
411,16; 191,12 393,15; 297,11; 177,08 |
[16] |
|
|
36 |
Альфитоло-вая кислота |
C 30 H 48 O 4 |
Терпеноид |
472,6997 |
473,12 |
187,05; 286; 457 |
[23] |
|
|
37 |
Мирицетин-О-гексозид |
C 21 H 20 O 13 |
Флавоноид |
480,3757 |
480,97 |
254,95; 49,97; 398,95; 316,99; 163,08 |
[21] |
|
|
38 |
8-C-пен-тозил-6-C-гексозил лю-теолин |
C 26 H 28 O 15 |
Флавоноид |
580,4915 |
581,05 |
468,97; 509,08; 418,99; 330,99; 287,13; 243,13; 199; 169; 349; 293 |
[32] |
|
|
39 |
Диосмин |
C 28 H 32 O 15 |
Флавоноид |
608 |
609 |
591; 316,98; 531 |
[16] |
|
|
40 |
Гесперидин |
C 28 H 34 O 15 |
Флавоноид |
610 |
611,19 |
593,18; 475,86; 333,04; 315,06; 275,04 |
[16] |
|
|
41 |
Лютеолин-O-глюкуронид |
C 27 H 26 O 18 |
Флавоноид |
638,4845 |
639,15 |
553; 375; 315; 286,98; 418,93; 375; 330,95; 287,06; 154,97 |
[29] |
|
|
42 |
Изорам-нетин-3- (6-O-ферулоил) глюкозид |
C 32 H 30 O 15 |
Флавоноид |
654,5716 |
655,13 |
317; 373; 483; 619; 583; 316 |
[20] |
Из данных таблицы можно сделать вывод о том, что всего в экстрактах CO 2 - Mentha Piperita L. было идентифицировано 42 биологически активных компонента: 29 флавоноидов, 8 фенольных кислот, 1 жирная кислота, 2 тритерпеноида и 2 дитерпена. Сравнивая результаты анализа биологически активных веществ в экстракте мяты с результатами работы других ученых [4, 16, 26, 29-31], впервые обнаружили 9 новых веществ: скополетин, феруловую кислоту, стеаридоновую кислоту, цирсимаритин, 15,16-дигидротаншинон, изотаншинон II A, альфито-ловую кислоту, изорамнетин-3-(6-O-ферулоил) глюкозид и 5-десметилнобилетин.
Выводы
В настоящем исследовании был проанализирован состав CO 2 -экстракта Mentha piperita L. с помощью ВЭЖХ с идентификацией МС/МС. В результате было идентифицировано 42 соединения. По сравнению с предыдущими работами по изучению данных растений настоящее исследование дает характеристику множества соединений из разных классов в одном опыте, среди которых некоторые были описаны впервые (скополетин, феруловая кислота, стеаридоновая кислота, цирсимаритин,15,16-дигидротаншинон, изотаншинон II A, альфито-ловая кислота, изорамнетин-3-(6-O-ферулоил) глюкозид и 5-десметилнобилетин). Исследованный экстракт может быть использован как важный источник природных антиокислителей в пищевой промышленности, в том числе в мясоперерабатывающей и молочной, с целью повышения качества продукции и продления сроков годности.
Список литературы Изучение природных пищевых антиокислителей CO2-экстракта Mentha piperita L.
- Shan B., Cai Y.Z., Sun M. et al. Antioxidant capacity of 26 spice extracts and characterization of their phenolic constituents // Journal of agricultural and food chemistry, - 2015. – Vol. 53, N 20. – P. 7749-7759.
- Christaki E., Bonos E., Giannenas I. et al. Aromatic plants as a source of bioactive compounds // Agriculture. - 2012. – Vol. 2, N 3. – P. 228-243.
- Bode A.M., Dong Z. Toxic phytochemicals and their potential risks for human cancer // Cancer prevention research. - 2015. – Vol. 8, N 1. – P. 1-8.
- Cirlini M., Mena P., Tassotti M. et al. Phenolic and volatile composition of a dry spearmint (Mentha spicata L.) // Molecules. - 2016. – Vol. 21, N 8. – P. 1007.
- Bai Z., Yu R., Li J. et al. Application of several novel natural antioxidants to inhibit oxidation of tree peony seed oil // CyTA-Journal of Food. - 2018. – Vol. 16, N 1. – P. 1071-1078.
- Guldiken B., Ozkan G., Catalkaya G. et al. Phytochemicals of herbs and spices: Health versus toxicological effects // Food and Chemical Toxicology - 2018. – Vol. 119. – P. 37-49.
- Şahin S. Evaluation of Stability against Oxidation in Edible Fats and Oils // Journal of Food Science and Nutrition Research. - 2019. – Vol. 2, N 3. – P. 283-298.
- Wu Z., Tan B., Liu Y. et al. Chemical Composition and Antioxidant Properties of Essential Oils from Peppermint, Native Spearmint and Scotch Spearmint // Molecules. - 2019. – Vol. 24, N 15. – P. 2825.
- Bahadori M.B., Zengin G., Bahadori S. et al. Phenolic composition and functional properties of wild mint (Mentha longifolia var. calliantha (Stapf) Briq.) // International journal of food properties. - 2018. – Vol. 21, N 1. – P. 183-193.
- Tvrdá E., Konečná N., Zbyňovská K. et al. Antioxidant Effects of Peppermint (Mentha piperita) Extract on the Oxidative Balance of Rabbit Spermatozoa // Journal of Advanced Agricultural Technologies. - 2018. – Vol. 5, N 2. – P. 117-122.
- Cortés-Rojas D. F., de Souza C. R. F., Oliveira W. P. Clove (Syzygium aromaticum): a precious spice // Asian Pacific journal of tropical biomedicine. - 2014. – Vol. 4, N 2. – P. 90-96.
- Alfieri A., Giovanni E.M. Bioactive nutraceuticals and stroke: activation of endogenous antioxidant pathways and molecular mechanisms underlying neurovascular protection. Bioactive Nutraceuticals and Dietary Supplements in Neurological and Brain Disease. – Academic Press, 2015. – P. 365-379.
- Shekarchi M., Hajimehdipoor H., Saeidnia S. et al. Comparative study of rosmarinic acid content in some plants of Labiatae family // Pharmacognosy magazine. - 2012. – Vol. 8, N 29. – P. 37.
- Razgonova M., Zakharenko A., Ercisli S. et al. Comparative Analysis of Far East Sikhotinsky Rhododendron (Rh. sichotense) and East Siberian Rhododendron (Rh. adamsii) Using Supercritical CO2-Extraction and HPLC-ESI-MS/MS Spectrometry // Molecules. - 2020. – Vol. 25, N 17. – P. 3774.
- Tyśkiewicz K., Konkol M., Ró E. The application of supercritical fluid extraction in phenolic compounds isolation from natural plant materials // Molecules, 2018. – Vol. 23, N 10. – P. 1-27.
- Xu L.L., Xu J.J., Zhong K.R. et al. Analysis of non-volatile chemical constituents of Menthae Haplocalycis herba by ultra-high performance liquid chromatography-high resolution mass spectrometry // Molecules. - 2017. – Vol. 22, N 10. – P. 1756.
- Sharma M., Sandhir R., Singh, A. et al. Comparative analysis of phenolic compound characterization and their biosynthesis genes between two diverse bread wheat (Triticum aestivum) varieties differing for chapatti (unleavened flat bread) quality // Frontiers in plant science. - 2016. – Vol. 7. – P. 1870.
- Santos S.A., Freire C.S., Domingues M.R.M. et al. Characterization of phenolic components in polar extracts of Eucalyptus globulus Labill. bark by high-performance liquid chromatography–mass spectrometry // Journal of agricultural and food chemistry. - 2011. – Vol. 59, N 17. – P. 9386-9393.
- Siwinska J., Kadzinski, L., Banasiuk R. et al. Identification of QTLs affecting scopolin and scopoletinbiosynthesis in Arabidopsis thaliana // BMC plant biology. - 2014. – Vol. 14, N. 1. – P. 1-14.
- Goufo P., Singh R.K., Cortez I. Phytochemical A Reference List of Phenolic Compounds (Including Stilbenes) in Grapevine (Vitis vinifera L.) Roots, Woods, Canes, Stems, and Leaves // Antioxidants. - 2020. – Vol. 9, N 5. – P. 398.
- Jaiswal R., Jayasinghe L., Kuhnert N. Identification and characterization of proanthocyanidins of 16 members of the Rhododendron genus (Ericaceae) by tandem LC–MS // Journal of Mass Spectrometry. - 2012. – Vol. 47, N 4. – P. 502-515.
- Spínola V., Pinto J., Castilho P.C. Identification and quantification of phenolic compounds of selected fruits from Madeira Island by HPLC-DAD–ESI-MSn and screening for their antioxidant activity // Food Chemistry. - 2015. – Vol. 173. – P. 14-30.
- Sun L., Tao S., Zhang S. Characterization and quantification of polyphenols and triterpenoids in thinned young fruits of ten pear varieties by UPLC-Q TRAP-MS/MS // Molecules. - 2019. – Vol. 24, N 1. – P. 159.
- Yasir M., Sultana B., Anwar F. M.LC–ESI–MS/MS based characterization of phenolic components in fruits of two species of Solanaceae // Journal of food science and technology. - 2018. – Vol. 55, N 7. – P. 2370-2376.
- Zhang J.Y., Li N., Che Y.Y. et al. Characterization of seventy polymethoxylated flavonoids (PMFs) in the leaves of Murraya paniculata by on-line high-performance liquid chromatography coupled to photodiode array detection and electrospray tandem mass spectrometry // Journal of pharmaceutical and biomedical analysis, 2011. – Vol. 56, N 5. – P. 950-961.
- Taamalli A., Arráez Román D., Abaza L. et al. LC MS based metabolite profiling of methanolic extracts from the medicinal and aromatic species Mentha pulegium and Origanum majorana // Phytochemical Analysis. - 2015. – Vol. 26, N 5. – P. 320-330.
- Pandey R., Kumar B. HPLC-QTOF-MS/MS-based rapid screening of phenolics and triterpenic acids in leaf extracts of Ocimum species and their interspecies variation // Journal of Liquid Chromatography & Related Technologies. - 2016. – Vol. 39, N 4. – P. 225-238.
- Yang S.T., Wu X., Rui W. et al. UPLC/Q-TOF-MS analysis for identification of hydrophilic phenolics and lipophilic diterpenoids from Radix Salviae Miltiorrhizae // Acta Chromatographica. - 2015. – Vol. 27, N 4. – P. 711-728.
- Bodalska A., Kowalczyk A., Włodarczyk M. et al. Analysis of Polyphenolic Composition of a Herbal Medicinal Product-Peppermint Tincture // Molecules. - 2020. – Vol. 25, N 1. – P. 69.
- Li X., Tian.T. Phytochemical Characterization of Mentha spicata L. Under Differential Dried-Conditions and Associated Nephrotoxicity Screening of Main Compound With Organ-on-a-Chip // Frontiers in pharmacology. - 2018. – Vol. 9. – P. 1067.
- Chen X., Zhang S., Xuan Z. et al. The phenolic fraction of Mentha Haplocalyx and its constituent linarin ameliorate inflammatory response through inactivation of NF-κB and MAPKs in lipopolysaccharideinduced RAW264. 7 cells // Molecules. - 2017. – Vol. 22, N 5. – P. 811.
- Dinelli G., Marotti I., Bosi S. et al. Lignan profile in seeds of modern and old Italian soft wheat (Triticum aestivum L.) cultivars as revealed by CE MS analyses // Electrophoresis. - 2007. – Vol. 28, N 22. – P. 4212-4219.


