Эффективность и безопасность применения пидотимода в сочетании с антибактериальной терапией нифурателом при лечении хронического рецидивирующего цистита у женщин
Автор: Раснер П.И., Шульженко А.Е., Серегин А.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Инфекционно-воспалительные заболевания
Статья в выпуске: 2 т.16, 2023 года.
Бесплатный доступ
Введение. Цистит наиболее частое клиническое проявление инфекции нижних мочевых путей. Основными причинами высокой заболеваемости и частых рецидивов цистита является снижение иммунологической резистентности организма. Цель исследования. Оценить отдаленные результаты лечения пациенток с хроническим рецидивирующим циститом (ХРЦ) комбинацией препарата нитрофуранового ряда и иммуномодулирующей терапии. Материалы и методы. Многоцентровая проспективная наблюдательная программа «ПИНЦЕТ» проведена с октября 2021 по апрель 2022 гг. в клинических центрах 19 городов Российской Федерации. 447 женщин в возрасте 34 ± 8 лет с диагнозом ХРЦ в стадии обострения получали одновременно нифурател (Макмирор®) по 400 мг 3 раза в сутки в течение 7 дней и пидотимод (Имунорикс®) по 800 мг 2 раза в сутки на протяжении 14 дней с последующим переходом на поддерживающий режим лечения пидотимодом 800 мг один раз в сутки еще 60 дней. Наблюдение в течение полугода включало 4 визита через 14; 30±7; 90±7 и 180±7 дней после начала терапии. Первичной конечной точкой являлась оценка частоты обострений ХРЦ на протяжении 6 месяцев наблюдения. Также оценивалось скорость разрешения клинической картины заболевания (опросник симптомов острого цистита -Acute Cystitis Symptom Score (ACSS)) и профиль безопасности терапии. Статистическая обработка данных проводилась в программе StatTech v. 2.8.8 Результаты. Процент пациенток с наличием хотя бы одного обострения ХРЦ к 1-му, 3-му и 6-му месяцам наблюдения составил 2%, 9% и 13,9% соответственно. Более 86% пациенток (385/447) было избавлено от рецидивов в течение 6 месяцев наблюдения. Отмечено достоверное снижение частоты эпизодов ХРЦ в течение полугода на фоне назначенной терапии в сравнении с исходными данными (0,1 против 2,5, соответственно, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Инфекции мочевыводящих путей, хронический цистит, рецидив, пидотимод, нифурател
Короткий адрес: https://sciup.org/142238996
IDR: 142238996 | DOI: 10.29188/2222-8543-2023-16-2-140-150
Текст научной статьи Эффективность и безопасность применения пидотимода в сочетании с антибактериальной терапией нифурателом при лечении хронического рецидивирующего цистита у женщин
Цистит является наиболее частым клиническим проявлением инфекции нижних мочевых путей, сопро вождающимся расстройством мочеиспускания и тазо выми болями. В России ежегодно регистрируется не менее 26–36 млн случаев острого бактериального ци стита [1]. Воспалительная реакция в мочевом пузыре может быть как инфекционной, так и неинфекционной этиологии.Различают острый и хронический инфек ционный цистит, отдельно выделяют рецидивирующую инфекцию нижних мочевыводящих путей (ИМП). После впервые перенесенного острого неосложненного цистита в течение 6 мес.рецидив заболевания реги стрируется у 27% женщин, в течение года – у 50%, при этом у 75% больных рецидивы возникают более 4 раз в год [2–4]. В обзорных зарубежных работах, в том числе в статье K. Naber от 2022 г., посвященных хроническим рецидивирующим циститам, приводятся похожие дан ные – независимо от схемы лечения острой фазы, ре цидивы в течение последующих 6–12 месяцев регистрируются у 30–50% женщин с ИМП [5–7].
Хроническим рецидивирующим циститом счита ется воспалительное заболевание мочевого пузыря, возникающее не менее трех раз в год или два раза за полгода. Согласно действующим Клиническим Реко мендациям Минздрава России,основной линией тера пии острого неосложненного цистита являются фосфомицина трометамол, нитрофурантоин и фурази дин. В качестве возможной альтернативы указан пре парат цефиксим. Окончательно ушли из клинических рекомендаций антибактериальные препараты из группы фторхинолонов [8]. Установлено, что длительный прием антимикробных препаратов в субингиби-рующих дозах приводит к селекции резистентных штаммов микроорганизмов, способствует образованию биопленок,а после прекращения лечения отмечается высокая частота рецидивов, достигающая 60%. Основной упор в клинических рекомендациях сделан на лечение первого эпизода и обострений ИМП полными курсовыми дозами антимикробных препаратов.
В апреле 2021 года в г. Москва был проведен междисциплинарный Совет Экспертов, посвященный проблеме лечения инфекций мочевых путей [9]. Анализ причин неэффективности лечения рецидивирующих ИМП, в частности антибиотикорезистентности, неэффективности лечения смешанных инфекций урогенитального тракта у женщин и низкой частоты обращаемости к врачу, показал необходимость поиска альтернативных схем лечения.Особое внимание экспертов вызвал нифурател как один из антимикробных препаратов нитрофуранового ряда, оказывающий антимикробное действие на основные уропатогены и возбудители вагинальных инфекций. При этом нифурател не оказывает бактерицидного действия на «нормальную» микрофлору [9]. Важно отметить, что систематический обзор 2021 года эффективности и безопасности нифуратела для пациентов с инфекцией нижних мочевыводящих путей, включавший 9 исследований и 442 пациентки, показал высокую эффективность нифура тела, сопоставимую и в ряде случаев превосходящую эффективность других антибиотиков [10]. В приведенных сравнительных исследованиях нифурател продемонстрировал большую терапевтическую

эффективность и лучшую переносимость, чем нитро фурантоин.
К числу факторов, обуславливающих широкое распространение и высокий риск рецидивов ИМП, по мимо увеличивающейся антибиотикорезистентности, относят иммунологические нарушения и снижение ло кальной антимикробной защиты мочеполовой си стемы. Для достижения долгосрочного эффекта терапии рецидивирующих ИМП вместе с назначением адек ватной антибактериальной терапии может быть рас смотрена возможность проведения курсов лечения иммуностимулирующими препаратами [9, 11]. В соот ветствии с рекомендациями иммунологов, показанием для назначения иммуномодулятора в составе комплекс ной терапии является клиническая картина вторичного иммунодефицита, характеризующаяся наличием у па циента хронического, часто рецидивирующего инфек ционно-воспалительного процесса, например, рецидивирующей инфекции мочевыводящих путей [9].
В последнее время значительно расширились пред ставления о роли иммунных механизмов в патогенезе ИМП. Проникая через слизистые оболочки, инфек ционные агенты вызывают не только локальные де структивные нарушения, но и оказывают влияние на функциональную активность факторов местного имму нитета, в частности, нарушение механизмов фагоцитоза [12]. Процесс протекает по типу незавершенной реак ции, в которой преимущественно принимают участие гранулоциты, что приводит к затяжному течению ин фекционно-воспалительного процесса. Кроме того, в случаях развития ИМП имеет место нарушение регуля торной функции интертейкина 2 (IL–2), снижение сек реции IL–8, выступающего мощным хемоаттрактантом для нейтрофилов и секреторного IgA, блокирующего процесс фиксации бактерий на клетках эпителия [13].
Нарушения иммунологической реактивности, ко торые могут сопровождать течение инфекционно-вос палительного процесса мочевыводящих путей, не ограничиваются лишь зоной слизистой оболочки моче вого пузыря. В системном кровотоке отмечается сни жение популяции естественных клеток-киллеров – NK-клеток (CD16), абсолютного количества Т-лимфо цитов (CD3) и Т-хелперов (CD4), сдвиг иммунорегуля торного индекса (CD4/CD8) в сторону цитотоксичес ких Т-клеток [12, 14].При выборе иммунотропных ле карственных средств следует отдавать предпочтение иммуномодуляторам, нормализующим активность им мунной системы, способным корректировать основные ее механизмы в зависимости от исходных значений, не проявляя при этом избыточного стимулирующего или супрессорного воздействия на иммунитет [6]. Одним из перспективных препаратов в лечении ИМП является пидотимод – синтетический пептидный иммуномоду лятор. Пидотимод – высокоочищенная субстанция, воздействующая одновременно на несколько звеньев иммунного ответа: активация фагоцитов, нейтрофилов, цитотоксической функции NК-клеток, стимуляция вы работки Т и В-лимфоцитов, нормализация соотноше ния между Т-хелперами и Т-супрессорами, продукция лимфокинов (IL-2) и экспрессия специфических рецеп торов лимфоцитами, образование антител (секретор ного IgА), а также противовирусного цитокина-γ-интерферона [15, 16]. Препарат эффективен в острой фазе заболевания, в периоде реконвалесценции и между рецидивами заболеваний бактериальной или ви русной природы. Отсутствие лекарственного взаимо действия позволяет принимать пидотимод в составе комплексной терапии с антибиотиками, жаропонижаю щими и другими препаратами [17]. Препарат обладает хорошей биодоступностью при пероральном использо вании, которая зависит от сопутствующего приема пищи, поэтому пидотимод следует принимать за 2 часа до или через 2 часа после еды [18]. С 1995 г. по настоя щее время было проведено более 60 международных клинических исследований пидотимода. Препарат вхо дит в официальный список иммуномодуляторов ВОЗ и уже более 30 лет активно используется в терапии и профилактике обострений инфекций дыхательных и мочевыводящих путей [19, 20]. Пидотимод усиливает клинический ответ на антибиотикотерапию и снижает риск развития антибиотикорезистентности,в связи с чем может использоваться в качестве адъюванта при антибиотикотерапии [21]. Важно отметить, что высо кий профиль безопасности пидотимода сопоставим с плацебо [22]. Исходя из вышеизложенного, мы посчи тали актуальным проведения клинического исследова ния эффективности и безопасности применения пидотимода в сочетании с антибактериальной тера пией нифурателом при лечении обострений хрониче ского рецидивирующего цистита у женщин.
МАТЕРИАЛЫ И МЕТОДЫ
Проспективная многоцентровая наблюдательная программа «ПИНЦЕТ» (PiNCET – Pidotimod Nifuratel Cystitis Efficient Therapy) была проведена в период с ок тября 2021 по апрель 2022 гг. в клинических центрах 19 городов Российской Федерации: Москва, Санкт-Пе тербург, Омск, Уфа, Екатеринбург, Челябинск, Новоси бирск, Кунгур, Пермь, Волгоград, Ставрополь, Воронеж, Краснодар, Липецк, Самара, Ростов-на-Дону, Саратов, Симферополь, Казань.
Критериями включения являлись:женский пол, возраст от 25 до 45 лет на момент включения, наличие хронического рецидивирующего цистита в стадии об острения, решение врача о необходимости проведения медикаментозной терапии заболевания нифурателом и пидотимодом, подписание пациенткой информирован ного согласия на участие в наблюдательном исследова нии. В исследование включались пациентки, обратив- экспериментальная и клиническая урология

шиеся с жалобами на дизурию, учащенное мочеиспускание, ургентные позывы к мочеиспусканию в течение 2-х дней и более при отсутствии патологических выделений из влагалища (за исключением менструальных). В программу не включались пациентки, у которых присутствовал любой из нижеследующих «критериев не-включения»:1) беременность; 2) лактация; 3) наличие жалоб на дискомфорт во влагалище или аномальные влагалищные выделения; 4) аллергические реакции к компонентам препарата в анамнезе; 5) одновременное применение другой иммунной терапии ИМП.
На визите скрининга проводился сбор социодемо-графических данных (возраст пациенток, рост, вес) и гинекологического анамнеза (число родов, наличие половой жизни в течение последнего года, наличие эпизода влагалищной инфекции (бактериального вагиноза, вагинита, кандидоза или инфекции, передаваемой половым путем (ИППП) за последний год, в том числе рецидивов), а также данных анамнеза заболевания (длительность, оценка факта наличия связи между появлением дизурии и половой жизнью, данные о предшествующей терапии заболевания за последний год с указанием использованных препаратов и анализом их клинической эффективности). Учитывались продолжительность безрецидивного промежутка и число рецидивов заболевания за последний год и полгода.
К факторам, которые позволяли определить случай в разряд «осложненных инфекций мочевыводящих путей», относились следующие: сахарный диабет, наблюдение онкологом в течение последнего года,факт приема в течение последнего года глюкокортикостероидов, цитостатиков, применение лучевой терапии, наличие аутоиммунных заболеваний (системная красная волчанка, ревматоидный артрит), нейрогенной дисфункции мочевого пузыря (в том числе остаточная моча более 100 мл), необходимости проведения катете-ризации/дренирования мочевого пузыря, реконструктивных операций на мочевыводящих путях или аномалий развития мочевой системы в анамнезе,эпизода острого пиелонефрита или почечной колики за предшествующий месяц, почечная недостаточность.
Диагноз хронического цистита в стадии обострения устанавливался на основании результатов клинического обследования и данных анамнеза. Врач оценивал выраженность клинической картины заболевания с помощью шкалы опросника симптомов острого цистита – Acute Cystitis Symptom Score (ACSS).
Скрининг проведен у 700 женщин, обратившихся к урологам поликлиник и амбулаторных диагностических центров с жалобами на дизурию. В исследование включена 501 пациентка, соответствующая описанным выше критериям включения и невключения.Данным пациенткам по решению врача назначен курс терапии оригинальными препаратами – нифурателом (Макми-рор®) в комбинации с пидотимодом (Имунорикс®), дозировки и продолжительность приема которых соот ветствовали инструкциям по медицинскому применению. Нифурател назначался по 400 мг (2 таблетки) внутрь 3 раза/сут в течение 7 дней. Одновременно с нифурателом пациентки начинали прием пидотимода, который назначался по 800 мг (2 флакона) внутрь 2 раза/сут на протяжении 14 дней с последующим переходом на поддерживающий режим лечения 800 мг (2 флакона) внутрь один раз в сутки еще в течение 60 дней.
Все включенные в исследование пациентки в рамках наблюдательной программы осуществляли 5 визитов к врачу: первый вышеописанный визит включения с назначением терапии (визит 1, день 0) и четыре визита наблюдения через 14 (визит 2), 30±7 (визит 3), 90±7 (визит 4) и 180±7 (визит 5) дней от первого визита. На каждом визите наблюдения проводилась оценка клинической эффективности и безопасности терапии, включая заполнение пациентками опросника Acute Cystitis Symptom Score (ACSS)), состоящего из 18 вопросов.
Первичной конечной точкой являлась оценка:
-
• доли пациенток с наличием симптомов рецидива хронического цистита к 1, 3 и 6 месяцу после назначения терапии.
Вторичной конечной точкой являлась оценка:
-
• скорости разрешения симптомов обострения хронического цистита к 14-му и 30-му дням терапии;
-
• динамики суммы баллов по шкале ACSS на 2–5 визитах;
-
• динамики количества эпизодов обострений заболевания после терапии в течение 6 месяцев;
-
• времени возникновения первого рецидива (длительность безрецидивного промежутка) на фоне проведенной терапии;
-
• частоты возникновения нежелательных явлений (НЯ) во время проведения наблюдательной программы, а также доли пациенток с необходимостью отмены терапии вследствие НЯ.
Клиническая эффективность терапии обострения хронического цистита в нашем исследовании оценивалась врачом исходя из следующих категорий: «полное выздоровление» – полное исчезновение клинических признаков и симптомов,«частичное выздоровление» – частичное исчезновение клинических признаков и симптомов,«неэффективность терапии» – неадекватный ответ на терапию, требующий назначения дополнительных антибактериальных средств. Клиническую эффективность лечения врач оценивал на визитах 2 и 3 (14 и 30-й дни наблюдения) в рамках комплексной оценки,включая данные опросника симптомов острого цистита. В случаях, когда было отмечено полное разрешение симптомов обострения заболевания, регистрировалось на какой день от начала терапии это частоты клинических экспериментальная и клиническая урология №2 2 0 2 3 рецидивов проводился на 3–5 визитах, т.е. на 30±7, 90±7 (визит 4), 180±7 (визит 5) день наблюдения соот было зафиксировано развитие реци дива заболевания,то врач отмечал на какой день от начала терапии он возник и вычислял длительность безрецидивного промежутка (количество дней между полным разрешением на фоне терапии и рецидивом). На визитах 2–4 врач отмечал факт приема пациентом поддерживающего курса пидотимода и,по заверше нию лечения,указывал его продолжительность. На 2–5 визитах пациентки оценивали переносимость при меняемой терапии как хорошую,удовлетворительную или неудовлетворительную. Также фиксировалась ча стота возникающих в ходе программы НЯ и случаи от мены препарата вследствие их возникновения.
В соответствии с дизайном программы для анализа демографических и иных характеристик исследуемой популяции, применялись методы описательной и сравнительной статистики с использованием программы StatTech v. 2.8.8 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе иссле дуемых менее 50) или критерия Колмогорова-Смир нова (при числе исследуемых более 50). В случае отсутствия нормального распределения количествен ные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Направление и теснота корреляционной связи между двумя количе ственными показателями оценивались с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормаль ного). При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах, использовался критерий Уилкоксона.
РЕЗУЛЬТАТЫ
Комбинированная терапия пидотимодом в соче тании с нифурателом на визите включения была на значена 501 пациентке. На втором визите (14 день) под наблюдением оставалось – 499 пациенток,на третьем (30 день) – 494, на четвертом (90 дней) – 457 и на за ключительном пятом (180 дней) – 447 пациенток (89% от исходной выборки). Данные именно этих 447 паци енток были взяты за основу при проведении статисти ческого анализа.
Средний возраст пациенток составлял 34±8 лет, индекс массы тела (23±3,54) соответствовал норме. В среднем каждая пациентка имела одни роды. Регуляр ную половую жизнь в течение последнего года вели 85% (378 из 447) пациенток. Наличие эпизодов влагалищной инфекции (бактериального вагиноза, вагинита, кандидоза или ИППП) за последний год отмечали 32,4% пациенток, среди них рецидивирую щие вагинозы – 53,7% пациенток.
Длительность хронического цистита на момент первого визита составляла в среднем 4 года, при этом наличие связи между появлением симптомов цистита и половой жизнью отмечало 30% (134 из 447) женщин. В течение последнего года до включения в исследова ние пациенты получали фосфомицин в 43,2% (193 из 447) случаев с эффективностью в 77% (150 из 193), нит рофурантоин – в 8,5% (38 из 447) с эффективностью 71,1% (27 из 38), фуразидин – в 22,4% (100 из 447) слу чаев с эффективностью 77% (77 из 100). Согласно анамнестическим данным пациенток,после терапии фосфомицином рецидив возникал через 2,6±1,7 меся цев, нитрофурантоином – 2,7±2,3 месяца, фуразиди ном – 2,7±1,5 месяца. Напомним, что основным крите рием включения было наличие не менее 3 рецидивов цистита в год или не менее 2 эпизодов в течение полу года. При этом в исследуемой выборке среднее число ре цидивов за последние 6 месяцев до включения в исследование составляло 2,5±1,4. Безрецидивный про межуток составлял в среднем 2,49±1,43 месяцев. Оценка этих исходных показателей была необходима для сопо ставления с результатами наблюдения после терапии.
Согласно данным шкалы ACSS, исходный средний балл раздела типичных симптомов цистита составлял 10,3 из 18 возможных. Влияние симптомов на качество жизни пациента оценивалось 6,4 балла из 9 возмож ных по данным соответствующего домена вопросника ACSS.
Наличие хотя бы одного фактора, соответствую щего осложненному течению заболевания,наблюда лось в 7,8% случаев (35 из 447 пациенток). У остальных 412 пациенток диагностирован хронический неослож ненный цистит.
При оценке первичной конечной точки доля па циенток с наличием хотя бы одного обострения хро нического цистита к 1-му, 3-му и 6-му месяцам после назначения терапии выглядели следующим образом: 2%, 9% и 13,9% соответственно. Таким образом, более 86% пациенток были избавлены от рецидивов в тече ние 6 месяцев наблюдения (рис. 1).
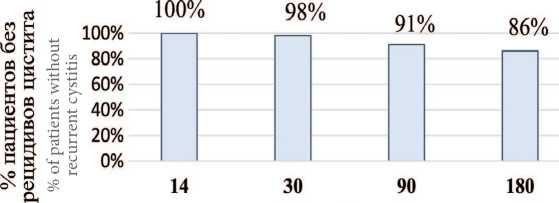
Оbservation days
Рис. 1. Процент пациенток с безрецидивным течением хронического цистита с распределением по визитам
Fig. 1. Percentage of patients with a non-recurrent course of chronic cystitis with distribution by visits экспериментальная и клиническая урология

Анализ частоты клинических рецидивов цистита в течение 6 месяцев наблюдения в зависимости от на личия осложняющих течение заболевания факторов выявил, что в подгруппе неосложненного течения ци стита (n=412) рецидивы встречались достоверно реже в сравнении с показателями подгруппы осложненного хронического цистита (n=35) (табл. 1).
Анализ исходов в подгруппе неосложненного ци стита (n=412) показал схожие с общей выборкой ре зультаты по первичной конечной точке – доля пациенток без рецидива к 1-му, 3-му и 6-му месяцам после назначения терапии наблюдения составляла 98% (403 из 412), 91% (376 из 412) и 87,1% (359 из 412). Вероятно, это обусловлено незначительным числом пациенток с осложненным циститом, вошедших в группу финального статистического анализа. Необхо димо отметить,что все пациенты получили полный курс острой фазы (14 дней) и продолжали прием под держивающего курса пидотимода в среднем 48±15 дней. При этом только 60% пациентов завершили пол ный курс поддерживающей фазы пидотимода (60 дней) (268/447).
Оценка вторичных конечных точек, в частности скорости разрешения симптомов обострения хрони ческого цистита к 14-му и 30-му дням терапии, пока зала, что в группе неосложненного цистита на 14-й день полное выздоровление наблюдалось у 68% (305 из 447) пациентов, частичное – у 30% (137 из 447). Время разрешения клинической картины цистита для упомя нутых выше 305 пациенток (оценивалось на Визите 2) составило в среднем 6,7 дней. К 30-му дню наблюдения (визит 3) отмечалась выраженная положительная ди намика: полное выздоровление – у 87,5% (391 из 447) пациенток, частичное у 10% (45 из 447).
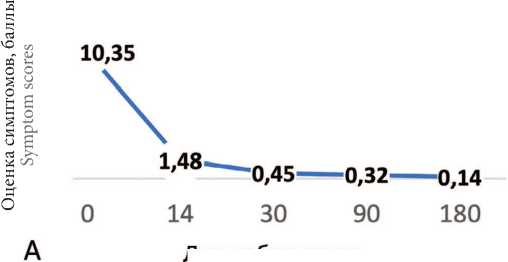
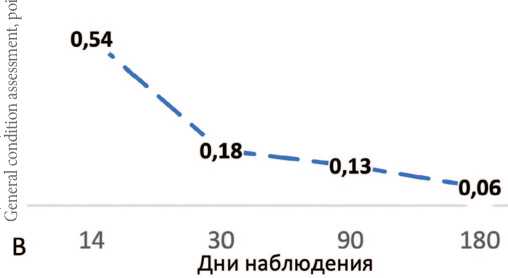
Динамика суммы баллов по шкале опросника ACSS на 14-й, 30-й, 90-й и 180-й день наблюдения показало достоверное улучшение всех показателей с сохранением результата в течение 6 месяцев во всей выборке (n=447) (рис. 2). Данные ответов на вопросы разделов ACSS на визитах 1, 2 и 3 представлены в таблице 2.
Сравнение числа эпизодов обострения заболева ния до и после проведенной терапии течение 6 месяцев наблюдения показало достоверное снижение веро ятности ИМП – примерно в 25 раз для общей выборки и пациенток с неосложненным циститом, для
Дни наблюдения
Оbservation days
R
ей О
8 * ей X
Е
ей
X О
3 £-
ОО
6,38
1,13.
0,4
Б
14 30
0,23
0,06
Дни наблюдения
Оbservation days
R Й
о т § О о
Оbservation days
Рис. 2. Динамика показателей разделов опросника ACSS на фоне лечения. А. Динамика клинических симптомов цистита (суммарный средний балл раздела Typical), средний балл
Б. Динамика качества жизни (суммарный средний балл раздела Quality of life), средний балл
В. Динамика общего состояния пациенток (средний балл раздела Dynamics), средний балл
Fig. 2. Dynamics of the indices of the ACSS sections during the treatment
A. Dynamics of clinical symptoms of cystitis (total average score of the Typical section), average score
Б. Dynamics of the quality of life (total average score of the Quality of life section), average score
В. Dynamics of the general condition of patients (average score of the Dynamics section), average score
Таблица 1. Процент пациенток с рецидивом хронического цистита за 6 месяцев после назначения лечения в зависимости от наличия факторов, осложняющих течение заболевания
Table 1. Percentage of patients with chronic cystitis recurrence within 6 months after the treatment appointment, depending on the factors complicating the course of the disease
|
Показатель Index |
Категории Categories |
Неосложненный хронический цистит Uncomplicated chronic cystitis |
Осложненный хронический цистит Complicated chronic cystitis |
p-value |
|
Наличие рецидива за 6 месяцев наблюдения Presence of recurrence within 6 months of follow-up |
Нет No |
359 (87,1%) |
26 (74,3%) |
0,021 |
|
Есть Yes |
53 (12,9%) |
9 (25,7%) |
пациенток с осложненным циститом – в 9,6 раз (табл. 3). Примечательно, что среди пациенток с возникшим после лечения рецидивом хронического цистита (62 из 447) только у 1 пациентки (1,6%) отмечено 2 обост рения за 6 месяцев наблюдения.
Оценка времени возникновения первого реци дива на фоне проведенной терапии (так называемого безрецидивного промежутка) проводилась только среди пациенток с рецидивами (n=62 из 447). Из этой выборки данные по времени возникновения рециди вов были доступны у 40 пациенток (среди них 32 жен щины с неосложненным циститом и 8 – с ослож ненным).
По данным, представленным в таблице 4, очевидна тенденция к удлинению безрецидивного промежутка после проведенной терапии.Различие оказалось ста тистически не достоверным при анализе в общей вы борке и в подгруппе неосложненных циститов.При
Таблица 2. Данные ACSS на визитах «включения» и наблюдения
Table 2. ACSS data from the «inclusion» and follow-up visits
|
Показатели ACSS, средние значения ACSS scores, mean values |
День 0 (Визит1) Day 0 (Visit 1) |
День 14 (Визит 2) Day 14 (Visit 2) |
День 30 (Визит3) Day 30 (Visit 3) |
|
Раздел типичные симптомы, средний балл (min – 0, max – 3) Section typical symptoms, average score (min – 0, max – 3) |
|||
|
Q1 Учащенное мочеиспускание малыми объемами мочи Q1 Frequent urination with small volumes of urine |
2,35 |
0,51 |
0,2 |
|
Q2 Срочные позывы к мочеиспусканию Q2 Urgent urge to urinate |
1,79 |
0,36 |
0,14 |
|
Q3 Боль/жжение при мочеиспускании Q3 Pain/burning during urination |
2,21 |
0,3 |
0,1 |
|
Q4 Чувство неполного опорожнения МП Q4 Feeling of incomplete emptying of the bladder |
1,88 |
0,36 |
0,1 |
|
Q5 Боль или дискомфорт внизу живота Q5 Pain or discomfort in the lower abdomen |
1,90 |
0,28 |
0,09 |
|
Q6 Наличие крови в моче Q6 Presence of blood in urine |
0,60 |
0,07 |
0,03 |
|
Раздел качества жизни, средний балл (min – 0, max – 3) Quality of life section, average score (min – 0, max – 3) |
|||
|
Q11 Выраженность чувства дискомфорта Q11 Severity of discomfort |
2,45 |
0,57 |
0,25 |
|
Q12 Симптомы мешали повседневной активности Q12 Symptoms interfere with daily activities |
2,34 |
0,45 |
0,2 |
|
Q13 Симптомы мешали общественной активности Q13 Symptoms interfered with social activities |
2,36 |
0,5 |
0,18 |
Таблица 3. Количество эпизодов обострения цистита на одного пациента в течение 6 месяцев, предшествующих включению в исследование, и на протяжении периода наблюдения после начала терапии
Table 3. The number of episodes of exacerbation of cystitis per one patient during the 6 months before inclusive in the study and during the follow-up period after the start of therapy
|
Число обострений цистита на 1 пациента The number of exacerbations of cystitis for 1 patient |
|||
|
Группа пациентов Group of patients |
В течение 6 месяцев наблюдения до терапии Within 6 months before therapy |
К 3 месяцу после начала лечения By 3 months after starting treatment |
К 6 месяцу после начала лечения By 6 months after starting treatment |
|
Вся выборка (n=447) All patients (n=447) |
2,5 |
0,06* |
0,1* |
|
Группа пациентов с неосложненным циститом (n=412) Group of patients with uncomplicated cystitis (n=412) |
2,6 |
0,07* |
0,1* |
|
Группа пациентов с осложненным циститом (n=35) Group of patients with complicated cystitis (n=35) |
2,6 |
0,06 |
0,27 |
Примечание: *р-value<0,05 при сравнении результатов с исходными значениями Note: *p-value<0.05 when comparing results with baseline values экспериментальная и клиническая урология
этом числовые различия сравниваемых показателей остаются заметными. Такой статистический результат вероятно, обусловлен малым число рецидивов в под группе пациенток с сложенным течением заболевания.
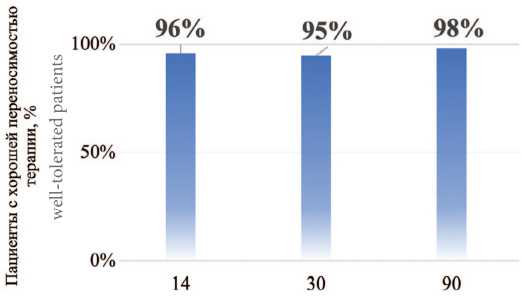
В среднем, в 95% случаев отмечалась хорошая пе реносимость проведенной терапии на каждом визите наблюдения (2–4 визиты) (рис. 3). НЯ наблюдались в 6,7% случаев (30 из 447), и только у 2 пациентов потре бовалась временная отмена терапии на 14-й и 30-й дни наблюдения в связи с обострением хронических забо леваний желудочно-кишечного тракта.
Дни наблюдения Оbservation days
Рис. 3. Доля пациентов с хорошей переносимостью терапии в течение 3 месяцев наблюдения после терапии
Fig. 3 Proportion of patients with good tolerance to therapy during 3 months of follow-up after therapy
ОБСУЖДЕНИЕ
Данное исследование является первым масштабным опытом сочетанного назначения пидотимода (Имуно рикс®) и нифуратела (Макмирор®) для лечения инфекций нижних мочевых путей, поэтому в обсуждении нам при дется апеллировать к литературным ссылкам, описываю щим раздельное использование этих препаратов или содержащим отчеты об их назначении в других комбинациях.
Нифурател – химиотерапевтический препарат из группы нитрофуранов, обладающий активностью в отношении целого ряда возбудителей (аэробных и анаэробных бактерий, грибов, простейших), в том числе в отношении E. coli, Klebsiella spp., Enterobacter spp, Enterococcus spp., Proteus mirabilis и других микроорганизмов, которые являются наиболее частыми возбудителями ИМП [23]. Нифурател отнесен Федеральными клиническими рекомендациями «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов» 2022 г. к препаратам, которые могут применяться в лечении острых неосложненных циститов, а также для профилактики посткоитального цистита [24].
Нифурател обладает высокой эффективностью и низкой токсичностью, что обуславливает широкий спектр его клинического применения. R.N. Gruneberg в своем исследовании сравнивал бактериологические параметры нифуратела с нитрофурантоином в отношении 409 уропатогенов [25]. Минимально ингибирующие концентрации у нифуратела были ниже, чем у нитрофурантоина.
Важным свойством нифуратела является его активность в отношении возбудителей вагинальных инфекций, в том числе бактериального вагиноза, которые являются фактором риска развития обострения хронического цистита [8, 26].
Добавление к антибактериальным препаратам лекарственных средств с иммуномодулирующими свойствами является стандартной практикой на протяжении последних 15 лет. Пидотимод имеет более чем 30-летний опыт использования в лечении респираторных инфекций у детей и взрослых, в то время как публикаций о применении препарата в урологической практике встречается значительно меньше, что послужило поводом к проведению представленной выше работы.
Таблица 4. Длительность безрецидивного периода у пациенток с рецидивами хронического цистита до и после включения в исследование
Table 4. Duration of the relapse-free period in patients with relapses of chronic cystitis before and after inclusion in the study
|
Группа пациентов Group of patients |
Средняя длительность безрецидивного периода до терапии пидотимод + нифурател, месяцы (M ± SD) Mean relapse-free period before pidotimod + nifuratel therapy, months (M ± SD) |
Средняя длительность безрецидивного периода до терапии пидотимод + нифурател, месяцы (M ± SD) Mean relapse-free period before pidotimod + nifuratel therapy, months (M ± SD) |
p-value |
|
Пациенты с рецидивами из всей выборки (n=40) Relaps patients from all patients (n=40) |
2,49 ± 1,43 |
3,18 ± 1,79 |
0,055 |
|
Пациенты из группы с неосложненными циститами (n=32) Patients with uncomplicated cystitis(n=32) |
2,50 ± 1,44 |
2,92 ± 1,71 |
0,225 |
Примечание: M – среднее значение, SD – стандартное отклонение Note: M – the average value, SD the standard deviation
В ходе похожего по дизайну с настоящей работой исследования оценивалась эффективность пидотимода в профилактике рецидивов хронической мочевой инфекции у детей на протяжении 6 месяцев наблюде ния. Результаты показали, что в группе пациентов, по лучавших пидотимод в сочетании с антибактериальной терапией,рецидивы инфекций мочевой системы отсутствовали, в то время как в группе сравнения (мо нотерапия антибиотиками без иммуномодуляции) примерно в 30% случаев были отмечены обострения мочевой инфекции [27]. Эти данные полностью кор релируют с полученными нами результатами. Авторы описали снижение частоты эпизодов пиелонефрита в течение 6 месяцев в сравнении с исходными данными и группой контроля ( р <0,01), сокращение длительно сти рецидивов (5,6 против 9,9 дней) и длительности применения антибактериальных средств для их купи рования (10,6 против 14,7 дней) в сравнении с группой контроля ( р <0,01). Также было отмечено увеличению безрецидивного промежутка (4,2 мес. против 2,6 мес.). В лабораторных показателях было зафиксировано снижение уровня провоспалительных цитокинов (IL-6 и IL-8) и нормализация гранулоцитарно-макро фагального колониестимулирующего фактора, что косвенно свидетельствует об уменьшении активности воспалительного процесса в паренхиме почек. За счет использования пидотимода удалось обеспечить сти муляцию клеточного иммунитета – отмечено досто верное снижение содержания IL-10 с тенденцией к повышению интерферона ϒ (ИФН ϒ ), значительное нарастание соотношения ИФН ϒ /IL-10 [27].
Аналогичные закономерности описаны в статье Е. Clemente и соавт. Кроме снижения риска рецидивов ИМП на 69% у пациентов, получавших пидотимод, ис следователи зафиксировали более быстрое исчезнове ние симптомов заболевания – 9,6 дней на фоне комбинированного лечения против 12,3 дней в группе стан дартной антибактериальной терапии. На фоне имму номодулирующей терапии продолжительность курса приема антибактериальных препаратов оказалась ко роче – 6,9 против 8,3 дней. При этом достигнутый те рапевтический и симптоматический эффекты оказались тождественными.Серьезных побочных эффек тов в ходе исследования не наблюдалось. Легкие реак ции (4 эпизода тошноты/рвоты, 1 эритема) зафиксированы у 5 пациентов (2 пидотимода, 3 плацебо), и, по мнению авторов статьи, были связаны с сопутствую щей антибактериальной терапией [28].
В проспективном наблюдательном исследовании А.В. Ануфриевой и соавт. сочетанное применение пи дотимода с антибиотиком у детей при обострении хронического пиелонефрита сопровождалось более быстрым купированием основных симптомов заболе вания в сравнении со стандартной терапией.Анализ лабораторных показателей иммунного ответа свиде тельствовал о нормализации показателей. На фоне применения пидотимода зафиксировано снижение уровня IL-17 в моче в 3 раза, а иммуноглобулин А (sIgA) повысился в 16,9 раза, отмечено снижение ак тивности щелочной фосфатазы лейкоцитов и умень шение интенсивности свободнорадикального окисления на системном уровне [29].
Попытки применения других иммуномодулято ров для профилактики рецидивов хронической ин фекции МВП не всегда были столь успешными. Так, A. Hattner и соавт. опубликовали данные об опыте при менения вакцины, приготовленной из 4 серотипов ExPEC4V E.coli . С 20 января 2014 г. по 27 августа 2014 г. 93 женщины получали целевую дозу ExPEC4V, а 95 – получали плацебо.Вакцина хорошо переносилась: серьезных нежелательных явлений, связанных с вак циной, не было. Были получены значимые колебания иммуноглобулина G (IgG) для всех серотипов: на 30-й день по сравнению с исходными титрами конъюгатов антигенов полисахаридов E. coli O1A повысились в 4,6 раза, титры O2 – в 9,4 раза, O6A – в 4,9 раза и О25В – в 5,9 раз выше (суммарный р <0,0001 ). Иммунный ответ сохранялся через 270 дней. Лизинговая актив ность опсонофагоцитов показала функциональность антител, но при этом снижение заболеваемости ИМП в группе иммунотерапии по сравнению с плацебо-группой зафиксировано не было ( p =0,522) [30].
В другом исследовании описан опыт использова ния препарата ОM-89S (лиофилизированный лизат E. coli ), полученного с использованием модифициро ванного литического процесса,в рамках рандомизи рованного двойного слепого исследования с участием 451 женщины с рецидивирующими неосложненными ИМП. Препарат назначали курсом на 3 месяца с последующим 3-месячным наблюдением. Больным контрольной группы назначалось плацебо. В следую щей фазе исследования лиофилизированный лизат E.coli назначался тремя последовательными месяч ными курсами, состоявшими из 10 дней активной те рапии и последующими 20 днями приема плацебо. Группой сравнения для второй фазы исследования по служили пациенты, получавшие 50 мг нитрофуран тоина ежедневно в течение 30 дней с последующим 3-месячным наблюдением. В обеих фазах исследова ния достоверных различий в полученных результатах между сравниваемыми группами не выявлено [31].
Следует отметить публикации о положительном опыте иммуноактивной профилактики ИМП с приме нением перорального бактериального лизата OM-89. В ходе 6-месячного проспективного обсервационного исследования, проведенного в семи странах (Египет, Германия, Ливан, Перу, Польша, Португалия и Швей цария) в 2005–2006 гг., из 575 участников 5% не полу чали профилактики, в то время как остальные (95%)
получали OM-89 (QD в течение 90 дней), после чего следовал 3-месячный период без лечения. Оценка на строения с использованием Госпитальной шкалы тре воги и депрессии (HAD) показала, что у 32%, 28% и 2% пациентов в начале исследования наблюдалась легкая, умеренная и тяжелая степень депрессии соответ ственно. После 6-месячной профилактики отмечено снижение общего балла HAD на 32%. Число рецидивов ИМП сократилось на 59%,что было статистически значимым ( p ≤0,0001). Примечательно, что полученные нами данные демонстрируют большую эффективность пидотимода по этому показателю, хотя разница в ди зайне исследований не позволяет проводить прямых сравнений [32].
Складывается впечатление, что синтетические иммуномодуляторы, к которым относится пидотимод, могут иметь хорошие перспективы в лечении рециди вирующей ИМП. Демонстрируемая клиническая ре зультативность пидотимода объясняется его мульти-направленным механизмом действия. Препарат, моду лируя активность врожденных и адаптивных компо нентов иммунитета на разных этапах, позволяет обеспечить полноценную иммунную защиту орга низма от инфекционных агентов.
Полученные нами данные являются основанием для дальнейших исследований клинико-лабораторной эффективности применения пидотимода на фоне ан тибактериальной терапии нифурателом у пациентов с хроническими рецидивирующими ИМП.
ВЫВОДЫ
По итогам полученных результатов исследования можно сделать следующее заключение.
-
1. Применение пидотимода на фоне антибактери альной терапии нифурателом позволяет достичь ремис сии хронического цистита у женщин в течение 6 месяцев наблюдения в 86% случаев: у пациенток с осложненным хроническим циститом – в 74,3%; у пациенток с не осложненным циститом – в 87,1%.
-
2. У пациенток с неосложненным хроническим ци ститом полное разрешение симптомов заболевания от мечено в среднем на 7-й день терапии.
-
3. На фоне терапии получено достоверное улучше ние клинических симптомов цистита, а также качества жизни с сохранением результатов в течение 6 месяцев наблюдения.
-
4. Отмечено достоверное снижение числа рециди вов хронического цистита после терапии при наблюде нии в течение 6 месяцев.
-
5. Наблюдается устойчивая тенденция к удлинению безрецидивного промежутка после терапии в сравнении с исходным данными при наблюдении в течение 6 месяцев.
-
6. Хорошая переносимость терапии зафиксирована у 95% пациентов на протяжении всего курса лечения.
Достигнутые в исследовании показатели позво ляют рекомендовать описанную схему назначения этих препаратов к практическому использованию для лече ния и профилактики хронической рецидивирующей ИМП у женщин.
Список литературы Эффективность и безопасность применения пидотимода в сочетании с антибактериальной терапией нифурателом при лечении хронического рецидивирующего цистита у женщин
- Лоран О.Б., Петров С.Б., Синякова Л.А., Перепанова Т.С. Эффективность применения фосфомицина трометамола (Монурала 3 г) в лечении больных хроническим рецидивирующим циститом. Эффективная фармакотерапия 2008;20(4):14–6. URL: https://umedp.ru/upload/iblock/970/monural.pdf. [Loran O.B., Petrov S.B., Sinyakova L.A., Perepanova T.S. The efficacy of fosfomycin trometamol (Monural 3 g) in the treatment of patients with chronic recurrent cystitis. Effektivnaya farmakoterapiya = Effective pharmacotherapy 2008;20(4):14–6. URL: https://umedp.ru/upload/iblock/970/monural.pdf. (In Russian)].
- Foxman B. Recurring urinary tract infection: incidence and risk factors. Am J Public Health 1990;80(3):331–3. https://doi.org/10.2105/ajph.80.3.331.
- Hooton TM, Stamm WE. Diagnosis and treatment of uncomplicated urinary tract infection. Infect Dis Clin North Am 1997;11(3):551–81. https://doi.org/10.1016/s0891-5520(05)70373-1.
- Wagenlehner F, Wullt B, Ballarini S, Zingg D, Naber KG. Social and economic burden of recurrent urinary tract infections and quality of life: a patient webbased study (GESPRIT). Expert Rev Pharmacoecon Outcomes Res 2018;18(1):107–17. https://doi.org/10.1080/14737167.2017.1359543.
- Naber KG, Tirán-Saucedo J, Wagenlehner FME, RECAP group. Psychosocial burden of recurrent uncomplicated urinary tract infections. GMS Infect Dis 2022;10:Doc01. https://doi.org/10.3205/id000078.
- Foxman B. The epidemiology of urinary tract infection. Nat Rev Urol 2010;7(12):653–60. https://doi.org/10.1038/nrurol.2010.190.
- Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am 2014;28(1):1–13. https://doi.org/10.1016/j.idc.2013.09.003.
- Перепанова Т.С., Синякова Л.А., Локшин К.Л. Клинические рекомендации. Цистит у женщин. 2021;35 с. URL: https://cr.minzdrav.gov.ru/recomend/14_2. [Perepanova T.S., Sinyakova L.A., Lokshin K.L. Clinical guidelines. Сystitis in women 2021. 35 p. URL: https://cr.minzdrav.gov.ru/recomend/14_2. (In Russian)].
- Лоран О.Б., Пушкарь Д.Ю., Аль-Шукри С.Х., Зайцев А.В., Хаитов М.Р. Совет экспертов «Иммунитет мочевых путей в контексте хронических инфекций». Как повысить эффективность лечения? РМЖ. Медицинское обозрение 2021;5(3):134–6. [Loran O.B., Pushkar D.Yu., Al-Shukri S.Kh., Zaitsev A.V., Khaitov M.R. Expert council «Urinary tract immunity in the scope of chronic infections». How to improve the treatment efficacy? RMZH. Meditsinskoye obozreniye = RMJ. Russian Medical Inquiry 2021;5(3):134–6. (In Russian)]. https://doi.org/10.32364/2587-6821-2021-5-3-137-144.
- Касян В.Н, Зайцев А.В., Перепанова Т.С., Пивазян Л.Г., Григорян Б.Л., Куприянов Ю.А. и др. Систематический обзор эффективности и безопасности нифуратела для пациентов с инфекцией нижних мочевыводящих путей. Акушерство и Гинекология 2021;(6):168–76. [Kasyan V.N., Zaitsev A.V., Perepanova T.S., Pivazyan L.G., Grigoryan B.L., Kupriyanov Yu.A. et al. Systematic review of the efficacy and safety of nifuratel for patients with lower urinary tract infection. Akusherstvo i Ginekologiya = Obstetrics and Gynecology 2021;(6):168–76. (In Russian)]. https://doi.org/10.18565/aig.2021.6.168-176.
- Ибишев Х.С. Современный взгляд на лечение и профилактику рецидивирующей инфекции нижних мочевых путей. Эффективная фармакотерапия. Урология и Нефрология 2015;(26):28–31. URL: https://umedp.ru/upload/iblock/ccd/viferon.pdf. [Ibishev Kh.S. A modern view on the treatment and prevention of recurrent lower urinary tract infection. Effektivnaya farmakoterapiya. Urologiya i Nefrologiya = Effective pharmacotherapy. Urology and Nephrology 2015;(26):28–31. URL: https://umedp.ru/upload/iblock/ccd/viferon.pdf. (In Russian)].
- Condron C, Toomey D, Casey RG, Shaffii M, Creagh T, Bouchier-Hayes D. Neutrophil bactericidal function is defective in patients with recurrent urinary tract infections. Urol Res 2003;31(5):329–34; https://doi.org/10.1007/s00240-003-0344-z.
- Suman E, Gopalkrishna Bhat K, Hegde BM. Bacterial adherence and immune response in recurrent urinary tract infection. Int J Gynaecol Obstet 2001;75(3):263–8. https://doi.org/10.1016/s0020-7292(01)00480-5.
- Hopkins WJ, James LJ, Balish E, Uehling DT. Congenital immunodeficiencies in mice increase susceptibility to urinary tract infection. J Urol 1993;149(4):922–5. https://doi.org/10.1016/s0022-5347(17)36260-2.
- Coppi G, Manzandro S. Experimental immunological screening tests on pidotimod. Arzneimittelforschung 1994;44(12A):1411–6.
- Taramelli D, Malabarba MG, Basilico N, Sala G, Mattina R, Cocuzza C. Effects of Pidotimod on macrophage functions in methylprednisolone treated mice. Arzneimittelforschung 1994;44(12A):1425–30.
- Passali D, Calearo C, Conticello S. Pidotimod in the management of recurrent pharyngotonsillar infections in childhood. Arzneimittelforschung 1994;44(12A):1511–6.
- Инструкция по медицинскому применению лекарственного препарата Имунорикс®, раствор для приема внутрь, рег.уд. № ЛСР-005105/07. URL: https://imunorix.ru/instrukcziya. [Instructions for the medical use of the drug Imunorix®, oral solution, reg. certificate № LSR-005105/07. URL: https://imunorix.ru/instrukcziya. (In Russian)].
- Караулов А.В. Препарат пидотимод — новое эффективное средство в иммунопрофилактике и иммунотерапии респираторных инфекций у детей. Вопросы современной педиатрии 2008;7(1):96–100. URL: https://vsp.spr-journal.ru/jour/article/view/1347/0. [Karaulov A. Pidotimod is a new efficient product in immunological prophylaxis and immunological therapy of respiratory infections in children. Voprosy Sovremennoj pediatrii = Current Pediatrics 2008;7(1):96–100. URL: https://vsp.spr-journal.ru/jour/article/view/1347/0. (In Russian)].
- Niu H, Wang R, Jia YT, Cai Y. Pidotimod, an immunostimulant in pediatric recurrent respiratory tract infections: A meta-analysis of randomized controlled trials. Int Immunopharmacol 2019;(67):35–45. https://doi.org/10.1016/j.intimp.2018.11.043.
- Ferrario BE, Garuti S, Braido F, Canonica GW. Pidotimod: the state of art. Clin Mol Allergy 2015;13(1):8. https://doi.org/10.1186/s12948-015-0012-1.
- Careddu P, Mei V., Venturoli V, Corsini A. Pidotimod in the treatment of recurrent respiratory infections in pediatric patients. Arzneimittelforschung 1994;44(12A):1485–9.
- Перепанова Т.С. Нитрофураны в урологической практике: все ли они одинаковые. Экспериментальная и клиническая урология 2018;(3):91–100. URL: https://cyberleninka.ru/article/n/nitrofurany-v-urologicheskoy-praktike-vse-li-oni-odinakovye-i-pochemu-myvozvraschaemsya-k-nim-segodnya/viewer. [Perepanova T.S. Nitrofurans in the urological practice: are they all the same and why are we getting back to them today. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2018;(3):91–100. URL: https://cyberleninka.ru/article/n/nitrofurany-v-urologicheskoy-praktike-vse-li-oni-odinakovye-ipochemu-my-vozvraschaemsya-k-nim-segodnya/viewer. (In Russian)].
- Перепанова Т.С., Руднов В.А., Синякова Л.А., Палагин И.С. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. ИД «УроМедиа», М., 2022. 126 с. [Perepanova T.S., Rudnov V.A., Sinyakova L.A., Palagin I.S. Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs. Federal clinical guidelines. Publishing house «UroMedia», M., 2022. 126 p. (In Russian)]
- Gruneberg RN. The use of nitrofurans in the treatment of urinary tract infections with some observations on the in vitro properties of nifuratel. In: F. Gasparri, G. Gargani, P. Periti. Diagnosis and Chemotherapy of urogenital infections. Edizioni Medicine P. Periti, Firenze, Italy 1972;109–12.
- Gilbert NM, O'Brien VP, Lewis AL. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathog 2017;13(3). https://doi.org/10.1371/journal.ppat.1006238.
- Кириллов В.И., Зайцева О.В., Богданова Н.А. Эффективность иммунокоррекции с помощью синтетического дипептида при пиелонефрите у детей. Вопросы современной педиатрии 2013;12(1):24–9. URL: https://cyberleninka.ru/article/n/effektivnost-immunokorrektsii-s-pomoschyu-sinteticheskogo-dipeptida-pri-pielonefrite-u-detey/viewer. [Kirillov V.I., Zaitseva O.V., Bogdanova N.A. Efficacy of immunocorrective treatment with synthetic dipeptide in children with pyelonephritis. Voprosy sovremennoj pediatrii = Current Pediatrics 2013;12(1):24–9. URL: https://cyberleninka.ru/article/n/effektivnost-immunokorrektsii-s-pomoschyu-sinteticheskogo-dipeptida-pri-pielonefrite-u-detey/viewer. (In Russian)].
- Clemente E, Solli R, Mei V, Cera R, Caramia G, Carnelli V, et al. Therapeutic efficacy and safety of pidotimod in the treatment of urinary tract infections in children. Arzneimittelforschung 1994;44(12A):1490–4.
- Ануфриева А.В., Евсеева Г.П., Лебедько О.А., Ефименко М.В., Козлов В.К. Применение иммуномодулятора пидотимода в комплексной терапии хронического пиелонефрита у детей. Дальневосточный медицинский журнал 2014;(3):54-8. URL: https://cyberleninka.ru/article/n/primenenie-immunomodulyatora-pidotimoda-v-kompleksnoy-terapii-hronicheskogo-pielonefrita-u-detey/viewer. [Anufrieva A.V., Evceewa G.P., Lebed'ko O.A., Efimenko M.V., Kozlov V.K. Application of immunomodulator pidotimod in a complex therapy of chronic pyelonephritis in children. Dal'nevostochnyy meditsinskiy zhurnal = Far East Medical Journal 2014;(3):54–8. URL: https://cyberleninka.ru/article/n/primenenie-immunomodulyatora-pidotimoda-v-kompleksnoy-terapii-hronicheskogo-pielonefrita-u-detey/viewer. (In Russian)].
- Huttner A, Hatz C, van den Dobbelsteen G, Abbanat D, Hornacek A, Frölich R, et al. Safety, immunogenicity, and preliminary clinical efficacy of a vaccine against extraintestinal pathogenic Escherichia coli in women with a history of recurrent urinary tract infection: a randomised, single-blind, placebo-controlled phase 1b trial. Lancet Infect Dis 2017;17(5):528–37. https://doi.org/10.1016/S1473-3099(17)30108-1.
- Wagenlehner FM, Ballarini S, Pilatz A, Weidner W, Lehr L, Naber KG. A randomized, double-blind, parallel-group, multicenter clinical study of escherichia coli-lyophilized lysate for the prophylaxis of recurrent uncomplicated urinary tract infections. Urol Int 2015;95(2):167–76. https://doi.org/10.1159/000371894.
- Renard J, Ballarini S, Mascarenhas T, Zahran M, Quimper E, Choucair J, et al. Recurrent lower urinary tract infections have a detrimental effect on patient quality of life: aprospective, observational study. Infect Dis Ther 2014;4(1):125–35. https://doi.org/10.1007/s40121-014-0054-6.


