Эффективность использования антибактериальных покрытий титановых имплантатов при лечении огнестрельных переломов
Автор: Давыдов Д.В., Брижань Л.К., Керимов А.А., Хоминец И.В., Бекшоков К.К., Грицюк А.А., Кукушко Е.А., Беседин В.Д.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Обзорная статья
Статья в выпуске: 4 т.31, 2025 года.
Бесплатный доступ
Введение. Высокий риск инфекционных осложнений при огнестрельных ранениях остается актуальной проблемой военной медицины. Анализ структуры санитарных потерь показывает, что ранения конечностей составляют от 55 % до 81,4 %, при этом около 35 % из них сопровождаются переломами костей. Выполнение операций по окончательной стабилизации данных переломов в условиях первичной микробной контаминации ассоциируется с высоким риском развития инфекционных осложнений. Однако использование антибактериальных покрытий на внутренних имплантатах значительно снижает риски развития таких осложнений. Цель работы — на основании анализа российских и зарубежных литературных источников определить эффективность использования антибактериальных покрытий титановых имплантатов при огнестрельных переломах. Материалы и методы. Поиск научных публикации осуществляли в поисковых системах eLibrary, PubMed и Connected Papers по ключевым словам: antibacterial coatings, gunshot fractures, implantassociated infection, internal osteosynthesis, infectious complications, антибактериальное покрытие, огнестрельные переломы, инфекционные осложнения, периимплантная инфекция. Источники отобраны исходя из гипотезы о возможности применения антибактериальных покрытий в клинической практике. Глубина поиска — с 2009 по 2025 гг. Результаты и обсуждение. Существующие системы доставки антибактериальных препаратов в зону проведения оперативного вмешательства демонстрируют высокую клиническую эффективность в профилактике периимплантной инфекции. На сегодняшний день наиболее изученными агентами для создания покрытий являются ионы металлов, полимеры, а также композиты, содержащие в своем составе антибактериальные/антисептические препараты. При этом наиболее эффективными являются многофункциональные и интеллектуальные покрытия, оказывающие комбинированное воздействие на микробные биопленки благодаря выраженным антиадгезивным и биоцидным свойствам. Отмечен дефицит исследований по применению многофункциональных покрытий в травматологии и ортопедии. В настоящее время отсутствуют публикации, посвященные использованию антибактериальных покрытий при лечении огнестрельных переломов и их последствий. Заключение. Применение полимерных и многофункциональных антибактериальных покрытий, гидрогелей, оксидов серебра, йода и цинка демонстрируют высокую эффективность в профилактике инфекционных осложнений после проведения внутреннего остеосинтеза, и могут быть использованы в клинической практике при лечении пострадавших с огнестрельными переломами костей конечностей.
Антибактериальное покрытие, внутренний остеосинтез, огнестрельные переломы, инфекционные осложнения, периимплантная инфекция
Короткий адрес: https://sciup.org/142245429
IDR: 142245429 | УДК: 616.71-001.515-089.843-77:546.82:621.793:615.281:616-089.168 | DOI: 10.18019/1028-4427-2025-31-4-520-536
Текст научной статьи Эффективность использования антибактериальных покрытий титановых имплантатов при лечении огнестрельных переломов
На сегодняшний день в лечении боевой хирургической патологии можно выделить две наиболее значимые проблемы, которые не теряют своей актуальности на протяжении длительного времени: сочетание огнестрельных ранений с обширными тканевыми дефектами и высокий процент инфекционно-воспалительных осложнений, вызванных полирезистентной микрофлорой [1, 2]. Развитие инфекционных осложнений при переломах костей, вызванных воздействием огнестрельных снарядов и боеприпасов, в первую очередь связано с тяжестью получаемых тканевых повреждений, первичной микробной контаминацией раневого канала, а также развитием вызванных повреждающим действием огнестрельных боеприпасов вторичных некробиотических изменений в окружающих раневой канал тканях.
Ранения, возникающие вследствие воздействия огнестрельных и взрывных боеприпасов, имеют ряд характерных особенностей, напрямую влияющих на процент развития осложнений и тактику лечения. Среди них можно выделить сложную конфигурацию раневого канала, неравномерную протяженность омертвевших и некротизирующихся тканей вокруг раневого канала, первичную микробную контаминацию, а также частое сочетание данных ранений с переломами костей и травмами сосудисто-нервных образований [3]. Особенности раневой баллистики при воздействии ранящих снарядов приводят к возникновению обширных комплексных (мягкотканных и костных дефектов), которые по своим патоморфологическим свойствам характеризуются значительным повреждением костномозговой полости и собственных питающих артерий, обуславливая тем самым гипоксию окружающих тканей, что замедляет репаративные процессы и зачастую является пусковым механизмом развития огнестрельного остеомиелита [4]. Так, к примеру, в результате анализа исходов лечения 148 раненых с огнестрельными переломами костей конечностей В.В. Хоминец и др. выявили развитие инфекционных осложнений среди пациентов основной и контрольных групп в 5,8 % и 9,7 % соответственно [5]. А.С. Lee et al. в многоцентровом ретроспективном исследований по анализу осложнений огнестрельных переломов большеберцовой кости выявили развитие инфекционно-воспалительных осложнений после проведения остеосинтеза в 14 % наблюдений [6].
Дополнительные сложности в лечении огнестрельных переломов вносит наличие в раневом канале разнообразной по своему составу и резистентной к воздействию антибиотиков микрофлоры, которая во многом и обуславливает неэффективность классических методик лечения [7].
Исходя из вышеизложенного, выполнение окончательных реконструктивно-восстановительных операций (остеосинтез, эндопротезирование и др.) при огнестрельных переломах возможно только при стабилизации общего состояния пациента и соблюдения строгих рекомендации по переходу на внутреннюю фиксацию [8]. Однако даже в случае соблюдения данных требований при проведении остеосинтеза сохраняется высокий риск возникновения инфекционных осложнений.
В связи с этим разработка и оптимизация существующих систем доставки антибактериальных, антисептических и репаративных агентов к поврежденным тканям в целях профилактики и лечения инфекционно-воспалительных осложнений является одной из перспективных передовых технологий в оказании комплексной специализированной медицинской помощи пациентам с огнестрельными ранениями, сопровождающимися переломами костей скелета [9, 10].
Цель работы — на основании анализа российских и зарубежных литературных источников определить эффективность использования антибактериальных покрытий титановых имплантатов при огнестрельных переломах.
МАТЕРИАЛЫ И МЕТОДЫ
Критерии включения :
-
— полнотекстовые научные публикации, в которых представлены результаты анализа эффективности различных антибактериальных покрытий, используемых в травматологии и ортопедии, в том числе при открытых и огнестрельных переломах;
-
— полнотекстовые систематические обзоры литературы и мета-анализы, освещающие тему использования антибактериальных покрытий в хирургии и опубликованные преимущественно за последние 5–10 лет.
Критерии невключения : тезисы научно-практических конференции, авторефераты кандидатских и докторских диссертации, а также статьи, не соответствующие в полной мере критериям включения.
Для анализа отобрано 85 статьей (70 иностранных и 15 отечественных).
РЕЗУЛЬТАТЫ
Современное состояние проблемы имплантат-ассоциированной инфекции
Развитие гнойно-воспалительных процессов в области проведения хирургического вмешательства является серьезным осложнением остеосинтеза, а их лечение в значительной мере затруднено наличием в очаге воспаления металлоконструкции, колонизированной микробными биопленками. Распространенность данных осложнений в послеоперационном периоде при проведении операции погружного остеосинтеза переломов мирного времени составляет от 2 до 22,4 % [11]. При лечении раненых с огнестрельными переломами, у которых развитие инфекционных осложнений наблюдается чаще, чем при открытых переломах мирного времени, проблема развития имплант-ассоциированной инфекции является наиболее актуальной [12].
По результатам различных исследований, даже при проведении плановых оперативных вмешательств эндопротезирования крупных суставов распространённость перипротезной инфекции может составлять до 15 % [13]. Традиционно профилактика и лечение имплантат-ассоциированной инфекции заключались в проведении радикальной хирургической обработки, местной и системной антибио-тикотерапии, а также имплантации цементных «спейсеров», высвобождающих молекулы антибактериальных препаратов [14]. Однако массовое применение антибиотиков широкого спектра действия способно оказывать на организм выраженные токсические эффекты и приводит к увеличению числа антибиотикорезистентных бактерий, что требует поиска альтернативных методов профилактики и лечения периимплантной инфекции [15].
Наличие в очаге воспаления ортопедических имплантатов неизбежно приводит к адгезии колониеобразующих бактерий, которые формируют на их поверхности микробную биопленку, способную противостоять воздействию защитных сил организма и антибиотических препаратов [16]. Биопленку при этом можно определить как микробное сообщество бактерий, прикрепленных к субстрату и внедренных в матрицу, которую они произвели в процессе своей жизнедеятельности [17]. Бактерии, находящиеся в состоянии биопленки, демонстрируют повышенную устойчивость к антимикробным агентам и меньшую восприимчивость к воздействию систем иммунологической защиты организма [18]. В мировой литературе имеются сведения, что формирование биопленок на поверхности имплантатов может происходить в течение 12–18 часов после выполнения оперативного вмешательства [19]. В связи с этим главной задачей лечения при имплантат-ассоциированных инфекциях является именно предотвращение образования биопленок.
Характеристика основных возбудителей имплантат-ассоциированной инфекции при огнестрельных ранениях
Повреждения, полученные при воздействии огнестрельных и взрывных боеприпасов, представляют собой наиболее сложный вид ранений, что обусловлено массивным повреждением тканей различной локализации, подвергающим стерильные участки тела контаминации огромным количеством бактерий. При боевых повреждениях основой для развития инфекционных осложнений является загрязнение бактериями из собственной микрофлоры или попавшими в рану из окружающей среды вместе с экзогенными агентами (пулями, фрагментами ткани, пылью, грязью, водой). При этом возможна и вторичная контаминация из нозокомиальных источников на этапах оказания медицинской помощи [20]. Кроме того, на видовой состав этиологических агентов в контаминированных огнестрельных ранах влияют вид ранящего снаряда, поврежденная область тела, временной интервал между ранением и хирургической обработкой, климатические факторы, эколого-географические и санитарно-гигиенические условия местности.
Среди микробиологических агентов, связанных с образованием на имплантатах микробной биопленки и последующим развитием имплантат-ассоциированной инфекции, наиболее изучены S. aureus, S. epidermidis, P. aeruginosa , а также метициллин-резистентный S. aureus (MRSA) [21].
-
Е.В. Крюков и др. в работе, посвященной анализу антибиотикорезистентности микрофлоры раневого отделяемого, при сопоставлении результатов исследования раневого отделяемого за 2022 г. и 2020 г. обнаружили резкое изменение спектра возбудителей раневой инфекции: увеличение доли
Acinetobacter spp., Bacillus spp., Enterococcus spp., P. aeruginosa, Klebsiella pneumoniae ; снижение доли ряда грамотрицательных бактерий, в том числе Proteus spp . и Esherichia coli ; выраженное пятикратное сокращение доли Streptococcus spp . и S. aureus [7].
Адгезия бактерий на поверхность титанового импланта является первым этапом в развитии имплан-тат-ассоциированной инфекции. Наиболее частыми микробными агентами, обуславливающими развитие данного инфекционного осложнения, являются стафилококки S. aureus и S. epidermidis , на долю которых приходится 18,4–37,4 % случаев [22]. Способность S. aureus к формированию трехмерной структуры, состоящей из бактерий и внеклеточных биополимеров (полисахаридов и/или белков), называемых биопленкой, является центральным звеном в процессе развития инфекций, связанных с наличием в организме имплантатов.
Развитие множественной лекарственной устойчивости у микроорганизмов представляет собой одну из наиболее значимых проблем во всем мире и рассматривается как угроза национальной безопасности [23]. Полирезистентные штаммы S. aureus обуславливают сложности профилактики и лечения инфекционных осложнений переломов костей, что особенно актуально при оказании помощи в условиях ограниченных ресурсов. В. Vijayakumar et al. в результатах когортного исследования сообщают, что 75 % изолятов, полученных от 100 пациентов, были устойчивы к гентамицину, 81 % — к ципрофлоксацину, 59 % — к цефотаксиму [24].
Еще одним значимым микробным агентом, обуславливающим развитие инфекционных осложнений у раненых, является P. aeruginosa , грамотрицательный условно-патогенный микроорганизм, играющий важную роль в развитии инфекционных осложнений при огнестрельных переломах благодаря способности к размножению в различных средах, образовыванию биопленок и устойчивости к антибиотикам [25]. Огнестрельные ранения, особенно полученные на открытом воздухе и/или в боевых условиях, часто загрязнены почвой, водой и другими объектами, которые являются резервуарами P. aeruginosa в окружающей среде. В медицинских учреждениях P. aeruginosa также может колонизировать организм раненых, особенно при длительном их пребывании в стационаре [26].
Упомянутые выше бактерии существуют на поверхности титановых имплантатов в виде микробных колоний и защищены капсулой, обуславливающей резистентность микроорганизмов к действию антибактериальных агентов. При этом следует упомянуть тот факт, что далеко не все случаи микробной контаминации имплантатов во время проведения хирургического вмешательства сопровождаются развитием клинически выраженной периимплантной инфекции и зачастую протекает в виде микробного носительства, что подтверждается данными L. Knabl et al. [27].
Данные особенности инфекционного процесса при наличии ортопедических имплантатов в организме обуславливают необходимость разработки стратегии для предотвращения колонизации поверхности имплантата, например, покрытия, содержащего антибиотики, или интраоперационного нанесение лечебного геля на имплантат.
Антибактериальные покрытия титановых имплантатов
Титан и его сплавы на сегодняшний день признаны «золотым стандартом» благодаря стойкости к коррозии и хорошей биосовместимости с костной тканью. В течение последних пятидесяти лет их широко применяют в травматологии и ортопедии в качестве материала для изготовления имплантатов, компонентов эндопротезов и фиксаторов для остеосинтеза переломов костей (интрамедуллярные штифты, накостные пластины и винты) [28]. По мнению Y. Wang et al., титан или его сплавы сами по себе не способны предотвратить возможное развитие имплантат-ассоциированной инфекции, а системная антибиотикотерапия, несмотря на доказанную эффективность, имеет ряд недостатков (токсическое воздействие на органы и ткани, сложность доставки лекарственного средства в область оперативного вмешательства, развитие антибиотикорезистентности у бактерии) [29]. Перспективным направлением профилактики имплант-ассоциированных инфекций в области хирургического вмешательства является покрытие титановых имплантатов антимикробными агентами. Для достижения данных свойств поверхность имплантатов покрывают антибактериальными веществами с помощью различных методов модификации поверхности.
Существующие покрытия против бактериальных инфекций можно разделить на две категории: пассивные (для предотвращения прикрепления бактерий) и активные (для уничтожения бактерий и ингибирования их роста). Пассивные покрытия предназначены для предотвращения инфекции путем сопротивления адгезии патогенов вместо их прямого уничтожения. Данную стратегию обычно применяют при модификации структуры поверхности имплантата. Стандартными материалами пассивных покрытий являются полиэтиленгликоль, гиалуроновая кислота и др. Активное покрытие использует ионы металлов, антибиотики и антимикробные пептиды для функционализации поверхности имплантата и уничтожения бактерий посредством контактного устранения или высвобождения антибак- териальных средств в окружающие ткани. Кроме того, совместно с антибактериальными материалами могут быть нанесены другие биоматериалы, способствующие остеоинтеграции, ангиогенезу и иммуномодуляции [30].
По мнению K. Bruellhoff et al., «идеальное» антибактериальное покрытие, наносимое на поверхность имплантатов, применяемых в травматологии и ортопедии, должно быть биологически совместимым и не оказывать местного раздражающего действия, а также проявлять выраженные бактерицидные свойства в раннем послеоперационном периоде, при этом сохраняя поверхностную бактерицидную активность в отношении широкого круга микроорганизмов в течение всего срока имплантации. Кроме того, покрытие должно препятствовать адгезии бактерий к поверхности имплантата и подавлять образование микробных биопленок [31].
В настоящее время в большинстве случаев нанесение антибактериального покрытия предполагает создание дополнительного слоя на поверхности импланта без нарушения природных свойств основного материала. Это можно осуществить различными методами, например, электрохимическим осаждением, ионизированным струйным осаждением, золь-гель методом, микродуговым оксидированием и др. [32, 33]. Для профилактики инфекционных осложнений, предотвращения образования биопленок и улучшенной интеграции в ткани, покрытия могут содержать различные антимикробные агенты: антибиотики, неорганические элементы, полимеры, гибридные органические и органические компоненты, бактериальные пептиды [34] (рис. 1).
Покрытия, содержащие антибактериальные и/или антисептические препараты
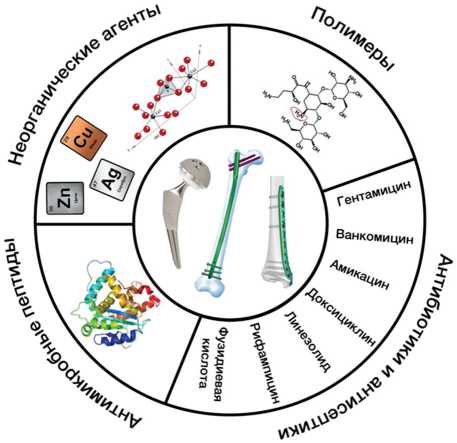
Рис. 1. Виды антибактериальных покрытий имплантатов (иллюстрация — авторская)
По данным литературы, наиболее применяемыми агентами для профилактики инфекционных осложнений после операции внутреннего остеосинтеза являются покрытия на основе антибактериальных препаратов. Для покрытия имплантата, высвобождающего антибиотик, решающее значение имеют концентрация лекарственного вещества и скорость его выделения. Проведенные клинические испытания доказали эффективность покрытий, содержащих антибиотики (гентамицин, ванкомицин, амикацин, доксициклин, линезолид, рифампицин и фу-зидиевая кислота), в отношении широкого спектра возбудителей хирургической инфекции [21].
Гентамицин является популярным антибиотиком, имеющим широкий бактерицидный спектр, низкую токсичность и высокую биосовместимость, его широко используют в клинической практике при множестве инфекций. Выраженность бактерицидного действия гентамицина зависит от концентрации препарата в составе антибактериального покрытия. Согласно некоторым сообщениям, покрытия на основе гентамицина улучшают остеоинтеграцию и предупреждают развитие остеомиелита, а также эффективны при инфекциях, вызванных золотистым стафилококком, синегнойной и кишечной палочкой. Проведено множество исследований, доказывающих эффективность амоксициллина, ванкомицина и тетрациклина в качестве покрытий поверхности имплантатов для предотвращения инфекции [35].
Согласно результатам исследования M.A. Harris et al., имплантаты с антиадгезивным покрытием с добавлением амикацина оказывают комбинированное воздействие на основные возбудители имплан-тат-ассоциированной инфекции и проявляют высокую биоцидную активность in vitrо , что может быть использовано при изготовлении покрытий ортопедических имплантатов [36]. Однако применение антибиотиков на поверхности имплантата вызывает опасения по поводу антибиотикорезистентности в связи с распространенностью устойчивых к антибиотикам штаммов бактерий.
Доксициклин является антибиотиком широкого спектра действия, для которого задокументирована высокая бактерицидная активность к основным возбудителям имплантат-ассоциированной инфекции (даже для MRSA). Он менее нефротоксичен и проникает в клетки организма эффективнее, чем гентамицин [37]. Линезолид — синтетический антибиотик с низким потенциалом развития внутренней резистентности и отсутствием перекрестной резистентности к другим системно вводимым антибиотикам, имеет 100 % пероральную биодоступность, хорошую фармакокинетику и хорошее проникновение в соединительные ткани. Моксифлоксацин, используемый в золь-гелевых покрытиях, обеспечивает противоинфекционную активность как in vivo, так и in vitro в имплантатах Ti [38]. Использование антибиотика фосфомицин, по данным исследования A. Gulcu et al., не эффективно для уничтожения бактерий и профилактики образования биопленки [39]. Важным недостатком покрытий на основе антимикробных препаратов является постоянное снижение концентрации антимикробного препарата.
В нашей стране сотрудниками НМИЦ ТО имени академика Г.А. Илизарова в ходе проведения экспериментального исследования обнаружено, что нанесение на поверхность титана кальций-фосфатного покрытия, содержащего антибиотики, способно эффективно подавлять рост грамотрицательной микрофлоры и может быть успешно использовано для профилактики развития имплантат-ассоции-рованной инфекции. Однако эффективность данных покрытий напрямую зависит от используемого антибиотика и его концентрации [40].
Костный цемент на основе полиметилметакрилата с добавлением термостабильных антибактериальных препаратов, обладающих локальным бактерицидным действием, активно применяют в ортопедических клиниках на протяжении длительного времени как для лечения, так и для профилактики периимплантной инфекции [41]. Кроме того, костный цемент с добавлением антибиотиков хорошо зарекомендовал себя при лечении пострадавших с открытыми, в том числе огнестрельными, переломами, что подтверждено рядом исследований [42, 43]. Однако при изучении отдаленных результатов использования данного метода выявлены его очевидные недостатки: кратковременность высвобождения антибактериальных препаратов, образование биопленок на цементном покрытии, непредсказуемость концентрации препарата в окружающих тканях и т.д. При этом, несмотря на все имеющиеся недостатки, данная методика и по сей день остается «золотым стандартом» лечения пациентов с костно-суставной инфекцией, эффективность которого составляет от 60 до 87,5 %, а процент рецидивиро-вания инфекционного процесса — от 6,3 до 40 % [44].
Еще одним популярным направлением предотвращения развития имплантат-ассоциированной инфекции является нанесение на поверхность имплантатов антисептических препаратов. Применение антисептиков оказывает мгновенный результат по сравнению с отсроченным воздействием антибиотиков, поскольку они напрямую воздействуют на бактериальную клеточную мембрану в отличие от ингибирования бактериального ДНК-зависимого синтеза РНК или ингибирования бактериальной РНК-полимеразы и синтеза белка, которые заложены в механизм действия антибиотиков [45].
Антибактериальные покрытия на основе наночастиц металлов и оксидов металлов
Наночастицы металлов и их оксиды способны оказывать избирательное бактерицидное действие на прокариотические клетки, распознавая их через металлопротеины и систему транспорта частиц металлов. Данные наночастицы способны обеспечивать длительное антибактериальное и бактериостатическое действие путем генерации активных форм кислорода, которые повреждают структуру бактериальных клеток, нарушая метаболические реакции и ингибируя синтез ДНК, что в итоге вызывает гибель клетки [46]. Более того, оксиды металлов взаимодействуют с бактериальными клетками на основе действия электростатических сил, разрушающих клеточную стенку бактерий, ферменты и ДНК посредством так называемого «кислородного взрыва». Наночастицы металлов и их оксиды обычно убивают бактериальные клетки несколькими способами, включая взаимодействие с билипидным слоем бактериальных клеточных стенок, прилипание к цитозольным белкам бактериальных клеток (включая ДНК и ферменты). Примерами металлов, используемых в составе антибактериальных покрытий, являются серебро, золото, железо, галий, оксид цинка, оксид магния и оксид титана, они оказывают эффективное бактерицидное действие в отношении различных грамположительных и грамотрица-тельных бактерий [47]. Однако, по мнению E. Zhang, при использовании покрытия на основе металлов и их оксидов необходимо проявлять настороженность, так как высокие концентрации ионов металлов и их оксидов способны вызвать локальное и системное повреждающие действия на клетки и ткани организма [48].
Серебро
На сегодняшний день серебро является одним из наиболее широко используемых металлов для изготовления покрытий титановых имплантатов. Ионы серебра имеют широкий спектр антибактериальной активности и оказывают длительный антибактериальный эффект, который меньше зависит от лекарственной устойчивости бактерий и способен предотвратить адгезию бактерии к поверхности имплантатов. Кроме того, покрытия с ионами серебра характеризуются хорошей биосовместимостью, очень низкой гено- и цитотоксичностью и потенциалом применения в различных типах биоматериалов [49].
Также наночастицы серебра оказывают значительное биоцидное действие против полирезистентных бактерий и грибков и по сравнению с местным и системным применением антибиотиков являются привлекательной альтернативой для снижения риска лекарственной устойчивости у бактерий [50].
Аналитический обзор Q. Yang и L. Chen показал, что антимикробные свойства покрытий, содержащих серебро, напрямую зависят от количества высвобождаемых ионов [51]. Теоретически более высокая концентрация ионов серебра в локальной депо-системе приводит к лучшему антимикробному эффекту. Однако токсические эффекты усиливаются с увеличением концентрации ионов серебра, а их избыток в организме человека может вызвать повреждение печени, почек, легких, сердца и кишечника. Цитотоксичность ионов серебра в различных клетках млекопитающих зависит как от их размера, дозы и формы, так и от продолжительности взаимодействия с клетками. Наночастицы серебра способны не только накапливаться в печени и селезенке, но и пересекать гематоэнцефалический барьер, вызывая повреждение головного мозга. В ходе испытаний по культивированию клеток in vitro установлено, что наночастицы серебра токсичны для нескольких линий клеток человека, включая бронхиальные эпителиальные клетки человека, эндотелиальные клетки пупочной вены человека, эритроциты, мононуклеарные клетки периферической крови человека, бессмертные кератиноциты человека, клетки печени и т.д. При этом ряд исследований показали, что низкая концентрация ионов серебра может оказывать антибактериальное действие без серьезных побочных эффектов на организм. Однако ионы серебра проявляют антибактериальные свойства только при концентрациях выше 0,2 %. Медленное высвобождение ионов серебра и их терапевтическая концентрация являются ключевыми факторами в клинической практике. Однако необходимо учитывать, что слишком медленное высвобождение ионов серебра с поверхности покрытия неспособно оказывать должного антибактериального действия [52].
В исследовании М. Thukkaram et al. титановые подложки, легированные наночастицами серебра, полученные путем плазменного электролитического окисления титана с последующей ионной имплантацией, оказывали выраженное бактерицидное действие против метициллинрезистентных золотистых стафилококков и устойчивых к антибиотикам E. coli . Антибактериальная активность покрытия и выделение ионов при этом зависели от концентрации ионов серебра. В ходе исследования наблюдали первоначальное быстрое высвобождение ионов серебра в концентрациях, подходящих для предотвращения инфекций после имплантации, за которым следовало медленное, длительное высвобождение ионов в течение семи дней [53].
Таким образом, ионы серебра, входящие в состав антибактериальных покрытий, оказывают выраженное антибактериальное воздействие против грамположительных и грамотрицательных бактерий, воздействуя на них различными механизмами. Кроме того, различные формы серебра могут быть использованы в качестве антибактериального вещества в ортопедических имплантатах, гелях, мазях и хирургических инструментах, что делает возможным его широкое применение в медицинской практике.
Медь, цинк и селен
К металлам, обладающим выраженной антибактериальной активностью, помимо серебра относятся медь, цинк и селен. Данные легирующие металлы являются востребованными благодаря их антибактериальной природе, низкой стоимости и способности стимулировать остеогенез. Упомянутые металлы являются микроэлементами, необходимыми организму для обеспечения нормального функционирования систем и органов, поэтому их использование в составе антибактериальных покрытий способствует повышению биосовместимости внедряемых в ткани хирургических имплантатов. Более того, по мнению W. Zhu et al., цинксодержащие покрытия способствуют дифференцировке остеобластов и улучшают коррозионную стойкость титановых имплантатов [54].
В исследовании L. Wang et al. показано, что титановые подложки, содержащие покрытия на основе полимолочной кислоты с различными концентрациями хлорида меди (CuCl 2 ), эффективно ингибируют рост золотистого стафилококка и оказывают остеогенный эффект in vitro и in vivo . Исследования in vitro продемонстрировали дозозависимое взрывное высвобождение иона Cu2+ и его антибактериальное действие, направленное на золотистый стафилококк [55].
Наночастицы селена являются выгодной платформой для разработки следующего поколения антимикробных покрытий, поскольку они обладают способностью уничтожать микробы при помощи нескольких механизмов, стабильны в условиях in vitro и in vivo и могут быть легко иммобилизованы на различных поверхностях. Кроме того, селен, нанесенный на микропористые покрытия из диоксида титана, с кальцием и фосфором на титановых подложках способен улучшить антибактериальные, антионкогенные и остеогенные свойства имплантата [56].
-
J. Zhou et al. установили, что покрытие, содержащее 8 мас. % селена, является оптимальным и обеспечивает 97 %-ную эрадикацию E. coli и S. aureus , максимальную остеогенную активность и проявляет антионкогенные свойства. Более высокие дозы селена препятствуют пролиферации клеток, в то время как низкие дозы не оказывают значительного антибактериального действия [57].
Аналогичным образом свое антибактериальное действие оказывает цинк в виде комплексов цинка и наночастиц оксида цинка. Комплексы цинка проявляют противогрибковую активность, тогда как оксиды цинка проявляют свою антимикробную активность посредством реализации двух различных ме- ханизмов, а именно высвобождении активных форм кислорода (фотокаталитический процесс) или же наночастиц оксида цинка, которые приводят к образованию внутриклеточных кислородных радикалов, вызывая повреждение клеток [58].
Йод
Йодсодержащие антибактериальные покрытия и антисептики обладают широким спектром бактерицидного действия, а также проявляют высокую биоцидную активность по отношению к различным вирусам и грибкам, что делает их весьма эффективным средством для профилактики развития послеоперационных осложнений [59]. Кроме того, являясь микроэлементом, необходимым для синтеза гормонов щитовидной железы, йод практически не вызывает развития аллергических реакции.
D. Inoue et al. в ходе проведения экспериментального исследования установили, что нанесенное на поверхность титановых имплантатов йодное покрытие проявляет активное биоцидное действие по отношению к MRSA, P. aeruginosa , метициллин-резистентным S. epidermidis и C. albicans . При этом антибактериальная эффективность титановой поверхности, покрытой йодом, была выше, чем у титановых имплантатов с оксидной пленкой, нанесенной путем анодирования [60].
А S. Yamaguchi et al. разработали новый раствор и способ термической обработки поверхности имплантатов посредством ионообменной реакции с использованием слоистой структуры титаната кальция, при котором большое количество положительно заряженных ионов йода вводят в титановый имплантат и на его поверхность. Образованный таким образом титанат кальция, содержащий йод, медленно высвобождает 5,6 × 10–6 ионов йода в течение 90 дней [61].
Результаты упомянутых исследований свидетельствуют о том, что титановые имплантаты с йодным покрытием могут иметь большой потенциал при разработке инновационных антибактериальных имплантатов, которые способны предотвратить раннее начало периимплантной инфекции, в том числе и при остеосинтезе огнестрельных переломов.
Другие металлы
Покрытия, содержащие кальций, стронций, галлий, висмут, также могут использовать для усиления биологически активных свойств титановых имплантатов. M.R. Katunar et al. сообщают, что керамика, содержащая стронций, усиливает бактерицидное действие и способствует росту и регенерации костной ткани [62]. Помимо этого, Q. Zhao et al. установили, что микропористое покрытие из диоксида титана, легированного цинком или стронцием, способствует адгезии остеобластов и ингибирует рост золотистого стафилококка [63].
Таким образом, одним из наиболее важных ограничений всех используемых металлов в качестве антибактериального покрытия является отсутствие доступных данных исследований in vivo с долгосрочными результатами, обобщающими применение данных имплантатов в клинической практике.
Представленные результаты включенных в данный обзор исследований in vitro и in vivo настоятельно предлагают травматологам-ортопедам применение традиционных и новых антимикробных модификаций поверхности имплантатов при лечении пациентов с периимплантной инфекцией. Отсутствие опыта использования в клинических условиях вызывает опасения относительно долгосрочных результатов этих имплантатов и роста множественных резистентных микроорганизмов в результате их клинического применения.
Антибактериальные неорганические покрытия с остеоинтегративными свойствами
К антибактериальным покрытиям, обладающим свойством повышения остеоинтеграции имплантатов, относятся покрытия на основе гидроксиапатита (Ca 10 (PO 4 ) 6 (OH) 2 ), магния и другие. Гидроксиапатит, являясь естественным неорганическим компонентом костной ткани, хорошо зарекомендовал себя в клинической практике благодаря высокой биосовместимости и бактерицидной активности. Кристаллическая структура гидроксиапатита позволяет в небольших масштабах замещать Ca2+ различными чужеродными ионами, способствуя адгезии остеобластов и расширяя возможности модификации поверхности имплантатов для повышения бактерицидной активности и остеокондуктивных свойств [64].
-
К. Batebi et al. разработали структуру антибактериального гидроксиапатита путем замещения в нем различных Ca2+ на ионы Ag+, Cu2+ и Zn2+. Среди данных ионов наночастицы серебра наиболее эффективно нарушали целостность бактериальной клетки, связываясь с белками и ферментами внутри бактерий. Это серьезно разрушало клетку и нарушало ее основные функции (регуляция ферментативной сигнальной активности, проницаемость, клеточное окисление, дыхательные процессы), что в конечном итоге приводило к гибели бактерии [65]. M. Turkoz et al. синтезировали композит гидроксиапатита с добавлением ионов серебра и фтора методом осаждения и обнаружили, что присутствие фтора в композите не только улучшило антибактериальный эффект гидроксиапатита против E. coli , но также
повысило его плотность и остеоинтегративные свойства. Авторы показали, что полученное соединение обладало хорошей антибактериальной активностью против клеток E. coli и S. aureus и улучшало остеоинтегративные свойства имплантатов [66].
Магний и его соединения относятся к биодеградируемым материалам, используемым в травматологии и ортопедии, обладают высокой механической прочностью и жесткостью, наряду с другими биоразлагаемыми материалами, что позволяет им прочно удерживать костные отломки при их использовании в качестве материала для изготовления ортопедических имплантатов. Кроме того, являясь макроэлементом, необходимым для нормальной жизнедеятельности, магний из покрытий имплантатов переходит в окружающую костную ткань, ускоряя при этом репаративную регенерацию костей и остеоинтегративные свойства имплантатов. Кроме того, магний активно препятствует колонизации S. aureus на поверхности имплантатов, что позволяет использовать его в качестве материала для изготовления антибактериальных покрытий. При этом магний проявляет и выраженные противогрибковые свойства [67]. Согласно данным обзора М. Pogorielov et al., добавление магния в хирургические имплантаты ускоряет образование твердой костной мозоли за счет адгезии остеобластов и ремоделирования кости [68].
Покрытия на основе антимикробных пептидов
Покрытия на основе антимикробных пептидов (АМП) в настоящее время широко используют в качестве альтернативы обычным методам обработки поверхности титановых имплантатов, поскольку они обладают широким спектром действия и требуют низких концентраций для эффективного антимикробного эффекта, а также способны снизить рост численности антибиотикорезистентных штаммов бактерий. Аминокислоты, входящие в состав данных пептидов, могут быть катионными или амфипатическими, взаимодействовать с плазматической мембраной бактерий, приводя к их гибели [69]. В настоящее время существует множество исследований, посвященных изучению эффективности использования АМП. L. Caselli et al. утверждают, что АМП на поверхности имплантатов усиливают антимикробные эффекты фотокаталитических наночастиц оксида титана, не оказывая при этом токсического действия на организм [70]. P. Keikhosravani et al. демонстрирует успешное использование АМП CATH–2 при разработке покрытий титановых имплантатов, что предполагает многообещающие результаты в разработке антибактериальных покрытий для профилактики образования биопленки и лечения периимплантной инфекции [71].
Покрытия на основе полимеров
Для создания антибактериальных покрытий поверхности титановых имплантатов используются как натуральные, так и синтетические полимеры, поскольку их можно легко модифицировать при помощи биоактивных компонентов. Полимеры на основе хитозана, азотсодержащих полиэтиленами-нов и четвертичных аммониевых соединений обладают собственными биоцидными свойствами, в то время как другие полимеры включают в состав антибиотиков для получения антибактериальной активности. Хотя нанесение антибиотиков на полимеры и дает желаемый антибактериальный эффект, оно не обеспечивает длительного высвобождения препарата. По сравнению с синтетическими большинству натуральных полимеров не хватает механической прочности и быстрой деградации, что может привести к неравномерному вымыванию частиц лекарственного препарата из имплантата. Следовательно, данные полимеры часто включают в состав неорганических систем, таких как оксиды металлов, гидроксиапатит и др., для повышения антибактериального действия. Поэтому для оказания биоцидного действия можно провести модификацию полимерной цепи путем присоединения четвертичного аминного звена, которое придаст полимеру бактерицидные свойства, вместо того, чтобы превращать полимер в носитель антибиотиков [72].
Существует множество примеров использования подобных модификации полимерных покрытий. G. Kaleli-Can et al. обнаружили, что титановые имплантаты с покрытием из диэтилфосфита, нанесенным при помощи плазменной полимеризацией, демонстрируют отличную цитосовместимость и подавляют образование биопленки. Исследования in vitro показали антибактериальную активность данного покрытия против S. aureus и клеток C. albicans , что доказывает многообещающий потенциал их применения при лечении пациентов с периимплантной инфекцией [73]. Разработанное J. Peng et al. антибактериальное покрытие на основе полигексаметиленбигуанида позволило почти на 100 % подавить рост S. aureus и E. coli на поверхности имплантатов. Исследования in vivo на модели инфицированных крыс дополнительно подтверждают бактерицидную природу разработанного покрытия [74].
Одним из перспективных полимеров с антибактериальными свойствами, активно использующимися в настоящее время для разработки покрытий имплантатов, является хитозан. Он является природным катионным полисахаридом с хорошей биосовместимостью и отсутствием цитотоксичности, чьи положительно заряженные аминогруппы могут генерировать электростатические взаимодействия с от- рицательно заряженными мембранами бактериальных клеток, тем самым изменяя проницаемость клеточных мембран и вызывая лизис и гибель бактерий. В связи с этим ожидается, что хитозан станет эффективным средством для предотвращения образования биопленки на поверхности ортопедических имплантатов. Z.X. Peng et al. оценили влияние гидроксипропилтриметиламмонийхлорида хитозана в трех различных концентрациях компонентов (6 %, 18 % и 44 %) на предотвращение образования биопленки на поверхности титановых имплантатов с помощью тестов in vitro и обнаружили, что три вида разработанного соединения, в особенности два последних, могут значительно ингибировать образование биопленки на поверхности имплантатов, а также оказывать эффективное терапевтическое воздействие на ранее сформированные зрелые биопленки [75].
Многофункциональные и интеллектуальные покрытия
Помимо придания поверхности имплантатов бактерицидных свойств стратегия разработки антибактериальных покрытий может реализовываться путем повышения биосовместимости имплантатов, увеличения их остеогенных эффектов, а также обеспечения их иммуномодулирующими и противоопухолевыми свойствами. Покрытия с такими дополнительными функциями могут напрямую стимулировать репаративную регенерацию кости. При этом стимулирование остеогенеза и остеоинтеграции также способно снизить бактериальную адгезию и пролиферацию. Однако регенерация кости подавляется в условиях бактериальной инфекции, наличия костных секвестров и дефицита васкуляризации, что будет постоянно приводить к персистенции инфекции. В связи с этим, будущие исследования в этом направлении должны определить, как эффективно сдерживать инфекцию и усиливать процесс регенерации кости с помощью многофункциональных покрытий [76].
На сегодняшний день в мировой литературе имеется множество работ, посвященных изучению интеллектуальных покрытий. Y. Zhang et al. путем использования ванкомицина и пептидного конъюгата разработали чувствительную к S. aureus пептидную последовательность, а затем конъюгировали антибиотик с этим специально созданным пептидом. Затем конъюгат связывали с поверхностью титанового имплантата, где пептид может быть распознан и расщеплен ферментом, секретируемым S. aureus , что позволяет высвобождать антибиотик только в присутствии S. aureus , тем самым достигая доставки антибактериального средства именно при возникновении инфекционного процесса [77].
F. Zhang et al. описали чувствительное к изменению рН самоадаптирующееся покрытие с антибактериальными, противовоспалительными и остеоинтеграционными свойствами. Данное интеллектуальное покрытие состояло из антибактериального сополимера, содержащего соли четвертичного аммония, нанесенные на поверхность титана путем самосборки слоев. Изменение поверхностного заряда покрытий подтверждено измерением дзета-потенциала, покрытия демонстрировали отрицательный заряд в нейтральной среде и положительный заряд в кислой среде. Кислотная среда при этом запускает антибактериальный эффект положительного контроля. Данный эффект меняется на противоположный, когда рН высокий, создавая самоадаптирующееся покрытие. При проведении испытаний in vitro данное покрытие демонстрирует высокую эффективность в отношении E. coli и S. aureus [78].
Полимерные гели
В последние годы все большее внимание исследователей привлекает использование так называемых полимерных гелей в качестве локальных депо-систем для профилактики развития послеоперационных инфекционных осложнений. Клинический разбор D. Pressato et al. показал, что модификация поверхности титановых имплантатов и доставка антимикробных веществ при помощи локальных депо-систем, в дополнение к системной антибиотикотерапии, перспективны и высокоэффективны в снижении риска периимплантной инфекции. Однако данное направление требует дальнейшего изучения, так как отсутствуют литературные данные о длительной эффективности и безопасности данной методики [79].
Проведенное в 2023 г. в НМИЦ ТО им. Н.Н. Приорова клиническое исследование полимерных гидрогелей на основе ненасыщенных производных поливинилового спирта продемонстрировало высвобождение более 70 % загруженного в гель антибактериального препарата из состава матрицы против 10 % из полиметилметакрилата за весь период исследования (28 дней). При этом максимальное высвобождение препарата (до 90 %) наблюдали в течение первой недели [80].
Тем самым, полимерные гидрогели, в состав которых входят антибактериальные препараты, имеют более широкий спектр потенциального клинического применения по сравнению с костным цементом благодаря своей биорезорбируемой природе и контролируемому высвобождению антимикробного агента, обеспечивающему десяти-/стократное увеличение местных концентраций лекарственного препарата вокруг импланта. Кроме того, резорбция гидрогеля устраняет характерный для полиметилметакрилата риск развития антибиотикорезистентности у бактерий.
Применение аддитивных технологий при изготовлении антибактериальных покрытий
В течение последних лет аддитивные (3D) технологии выходят на передовые места в производстве медицинских изделий. Основным преимуществом 3D-печати является возможность изготовления индивидуальных имплантатов, имеющих сложную геометрическую форму, для конкретных пациентов, а также деталей с высокой усталостной прочностью и коррозионной стойкостью. В травматологии и ортопедии аддитивные технологий на протяжении длительного времени успешно применяют при эндопротезировании суставов и других реконструктивно-восстановительных операциях. Однако из-за относительной новизны технологии 3D-печати при производстве титановых медицинских имплантатов наблюдаются отсутствие базовых научных знаний о данном процессе (фазообразование, новые легирующие элементы и т.д.), а также сложности при проведении процедур постобработки (стерилизация, полировка, заполнение решеточных структур в имплантатах) [81].
К.П. Головко и др. при проведении анализа эффективности изготовленного ими антибактериального покрытия на основе хитозана и поливинилпирролидона показали, что разработанное с помощью 3D-печати антибактериальное покрытие имело высокую биосовместимость, атравматичность, эластичность и адгезию к раневой поверхности. Кроме того, коллектив авторов установил, что использование аддитивных технологий для изготовления биоинженерной конструкции обеспечивает поддержание асептических условий, необходимой влажности, pH и температуры при создании имплантатов [82].
J.A. Inzana et al. в своем исследовании эффективности применения аддитивных технологий при лечении имплантат-ассоциированной инфекции продемонстрировали, что локальная доставка в зону хирургического вмешательства рифампицина и ванкомицина из 3D-печатного кальций-фосфатного скаффолда проявляет большую эффективность по сравнению с антибактериальными спейсерами из полиметилметакрилата, который не способен к переносу рифампицина. Однако данный метод не приводит к эрадикации микробной биопленки, что создает необходимость модификации поверхности данных имплантатов с целью придания им бактерицидных свойств [83].
ОБСУЖДЕНИЕ
На основании анализа современной литературы можно прийти к выводу, что многообразие существующих на сегодняшний день покрытий с антибактериальными свойствами говорит о незавершенности поиска «идеального» способа профилактики развития периимплантной инфекции. Развитие данных технологий по-прежнему остается актуальной темой для проведения научных исследований.
Применяющиеся в клинической практике локальные депо-системы доставки антибактериальных и антисептических препаратов в зону оперативного вмешательства, позволяют с различной степенью эффективности предотвращать развитие имплантат-ассоциированной инфекции (табл. 1). Однако до сих пор не существует единого мнения о том, какими свойствами должно обладать «идеальное антибактериальное покрытие. Большинство исследователей склоняются к мнению, что именно сочетание высокоэффективного бактерицидного воздействия и устойчивости к прикреплению бактерий, хорошей биосовместимости, стимуляции остеоинтеграции и остеогенеза является многообещающим направлением для разработки новых антибактериальных покрытий имплантатов [10, 30, 31, 84].
На основании проведенного анализа мы сделали выводы, что основными требованиями к антибактериальными покрытиям являются:
-
1) биологическая совместимость покрытий и отсутствие у них локального раздражающего воздействия на ткани;
-
2) высокая биоцидная активность, поддерживаемая на протяжении длительного времени и в условиях колебаний термохимических показателей внутренней среды организма;
-
3) эффективное биоцидное действие в отношении к широкому спектру микроорганизмов (бактерий, вирусов, грибов);
-
4) сочетание у покрытий антиадгезивных и биоцидных свойств, оказывающих комплексное действие на возбудители имплантат-ассоциированной инфекции;
-
5) предотвращение развития резистентности бактерий к антибиотикам при использовании покрытий.
Таблица 1
Анализ эффективности используемых в клинической практике антибактериальных покрытий
|
Состав |
Техника нанесения покрытия |
Антимикробная эффективность in vitro / in vivo |
Источник |
|
Покрытия, содержащие антибактериальные препараты |
|||
|
Цис-2-деценовая кислота (C2DA) и амикацин |
Покрытие титана фосфатидилхолином с добавлением антибиотика |
Уменьшение образования биопленки |
[36] |
|
Имплантаты титана, покрытые биоразлагаемой полимерно-липидной инкапсуляционной матрицей с добавлением доксициклина |
Полимерно-липидная инкапсуляция |
Подавление роста MRSA и MSSA стафилококков на имплантатах |
[37] |
|
Спицы Киршнера, покрытые полимолочной кислотой с добавлением фосфомицина |
Химическое осаждение из раствора |
Добавление фосфомицина в полимолочную кислоту не влияет на эффективность профилактики имплантат-ассоциированной инфекции |
[39] |
|
Диски из сплава титана с кальций-фосфатным покрытием, импрегнированные антибиотиками |
Микродуговое оксидирование |
Высокая биоцидная эффективность по отношению к возбудителям периимплантной инфекции |
[40] |
|
Мантия из полиметилметакрилата с добавлением антибиотиков на трансплантате из подвздошной кости |
Нанесение мантии на поверхность имплантатов |
Эффективная профилактика инфекции при лечении открытых переломов |
[43] |
|
Покрытия, содержащие антисептические препараты |
|||
|
Титановые диски, погруженные в растворы 6 различных антисептиков |
Погружение дисков в растворы антисептиков |
Высокая антибактериальная активность против P. gingivalis и S. mutans |
[45] |
|
Покрытия на основе наночастиц металлов и их оксидов |
|||
|
Легированный ионами Ag TiO 2 |
Плазменное электролитическое окисление |
Значительное снижение ( p < 0,05) количества числа E. coli, S. aureus на поверхности имплантата |
[53] |
|
Микропористое покрытие имплантатов ионами Cu и TiO 2 |
Микродуговое оксидирование |
Эффективное ингибирование роста золотистого стафилококка, увеличение биосовместимости и оказание остеогенного эффекта in vitro и in vivo |
[55] |
|
Титановые имплантаты, покрытые TiO 2 и наночастицами Se |
Поверхностное зародышеобразование |
Высокая биоцидная активность, антибактериальные, антионкогенные и остеогенные свойства на поверхности титанового импланта |
[56] |
|
Se, нанесенный на микропористые покрытия из TiO 2 с Ca и P на титановые имплантаты |
Микродуговое оксидирование |
Эрадикация 97 % E. coli и S. aureus в исследовании in vitro на поверхности имплантатов, остеогенные и антионкогенные свойства |
[57] |
|
Покрытие на основе гидроксиапатита с нанесением ZnO на поверхность имплантата |
Химическое осаждение из раствора |
Резкое сокращение численности E. coli и S. aureus после 4 час экспозиции |
[58] |
|
Покрытия на основе наночастиц металлов и их оксидов |
|||
|
Имплантаты, покрытые титанатом кальция с добавлением йода |
Метод термообработки поверхности имплантата, который контролируемо включает от 0,7 % до 10,5 % йода в титан |
Антибактериальная активность по отношению к MRSA, E. coli и S. aureus 99 % |
[61] |
|
Биоактивное покрытие на основе Si с частицами биоактивного стекла, легированного Sr |
Золь-гель |
Усиление антибактериального действия и придание имплантам остеогенных свойств |
[62] |
|
Покрытие поверхности имплантатов TiO 2 , легированного ионами Zn и Sr |
Микродуговое оксидирование |
Уменьшение численности колонии S. aureus на поверхности имплантатов |
[63] |
|
Антибактериальные неорганические покрытия с остеоинтегративными свойствами |
|||
|
Композитное покрытие, содержащее Ag, F и гидроксиапатит |
Золь-гель |
Снижение численности E. coli на 96 % в течение 6 час. после имплантации |
[65] |
|
Покрытие на основе гидроксиапатита, содержащее ионы Ag и F |
Метод осаждения |
Высокая антибактериальная активностью против E. coli и S. aureus и улучшение остеоинтегративных свойств |
[66] |
Таблица 1 (продолжение)
Анализ эффективности используемых в клинической практике антибактериальных покрытий
|
Состав |
Техника нанесения покрытия |
Антимикробная эффективность in vitro / in vivo |
Источник |
|
Покрытия на основе антимикробных пептидов |
|||
|
Покрытие TiO 2 синтезированным АМП LL-37 |
Фотокаталитический метод |
Усиление антимикробных эффектов TiO 2 без токсического влияния на организм |
[70] |
|
Титановые имплантаты с нанесенным АМП CATH-2 |
Метод послойной сборки полимеров и электрораспыления |
Высокая антибактериальная активность против E. coli и S. aureus , биосовместимость с клетками организма |
[71] |
|
Покрытия на основе полимеров |
|||
|
Титан, покрытый плазмаполимеризованным диэтилфосфитом |
Плазменная полимеризация |
Высокая биоцидная активность in vitro по отношению к S. aureus и C. albicans |
[73] |
|
Сложноэфирные блок-полимеры с добавлением диэтил(гидроксиметил)фосфоната |
Полимеризация с обратимым присоединением-фрагментацией с цепным переносом (RAFT) |
Почти 100 % антибактериальная активность по отношению к S. aureus и E. coli |
[74] |
|
Покрытие на основе хитозана с гидроксипропилтриметиламмо-нийхлоридом с различной степенью замещения четвертичного аммония |
Полимеризация молекул хитозана и глицидилтриметиламмония |
Значительное ингибирование образования и разрушение уже сформированных биопленок |
[75] |
|
Многофункциональные и интеллектуальные покрытия |
|||
|
pH-чувствительный антибактериальный полимер, содержащий катионные четвертичные аммониевые соли и карбоксильные группы |
Метод послойной самосборки |
Покрытие обладает хорошими антибактериальными и противовоспалительными свойствами при имплантации и показывают хорошую остеоин-теграционную эффективность |
[78] |
|
Полимерные гели |
|||
|
Полимерный гель на основе гиалуроновой кислоты, загруженный различными антибиотиками |
Полимеризация молекул |
Высвобождение более 70 % загруженного в гель антибактериального препарата из состава матрицы против 10 % из полиметилметакрилата в течении 28 дней |
[80] |
|
Покрытия, полученные с помощью аддитивных технологии |
|||
|
Покрытие из 4 % гидрогеля среднемолекулярного хитозана с добавлением 1 % повидон-йода и дермальных фибробластов |
Метод экструзионной 3D-биопечати |
Высокая биосовместимость, атравматичность и адгезия покрытия к раневой поверхности, эффективное антибактериальное и регенеративное воздействие |
[82] |
|
3D-печатный кальций-фосфатный скаффолд с добавлением рифампицина и ванкомицина |
Метод экструзионной 3D-биопечати |
Значительная эффективность в предотвращении имплантат ассоциированной инфекции в исследовании in vivo |
[83] |
Проведенный нами систематический обзор литературы позволяет судить о том, что на сегодняшний день при совершенствовании технологий разработки антимикробных покрытий титановых имплантатов основное внимание должно уделяться полимерным покрытиям, гидрогелям, многофункциональным интеллектуальным покрытиям, а также аддитивным технологиями, позволяющим наносить покрытие путем 3D-печати [10, 30, 31, 84, 85].
Что же касается возможности применения вышеупомянутых технологий при лечении огнестрельных переломов, то мы склоняемся к тому, что даже несмотря на высокие риски развития инфекционных осложнений при остеосинтезе данных переломов, предотвратить их развитие способно использование в ходе оперативного вмешательства полимерных, многофункциональных покрытий, гидрогелей, а также оксидов таких металлов как серебро, йод и цинк.
ЗАКЛЮЧЕНИЕ
На сегодняшний день существует большое разнообразие покрытий с антибактериальными свойствами, успешно применяющихся в клинической практике при лечении и профилактики имплантат-ассо-циированной инфекции. Однако в мировой литературе по-прежнему отсутствуют исследовательские работы, посвященные изучению эффективности вышеперечисленных покрытий при лечении огнестрельных переломов.
Поиск и разработка эффективных методов профилактики инфекционных осложнений при лечении раненых с огнестрельными переломами остается актуальной темой для проведения научных исследований.


