Эффективность синтеза внеклеточных полисахаридов штаммами дрожжей Lipomyces
Автор: Хусаинов И.А., Якубов Е.Р., Канарская З.А., Канарский А.В., Максимова И.А., Качалкин А.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (78), 2018 года.
Бесплатный доступ
Образование внеклеточных полисахаридов - достаточно хорошо изученное свойство бактерий, которое используется для промышленного производства таких внеклеточных бактериальных как ксантан, декстран, геллан, гиалуронан и др. Также широко применяются и полисахариды, синтезируемые грибами, как например, шизофиллан и склероглюкан. Однако полисахариды, синтезируемые дрожжами и дрожжеподобными грибами, пока не нашли широкого промышленного применения, за исключением пуллулана, продуцируемого дрожжами Aureobasidium pullulans, несмотря на то, что имеется ряд перспективных разработок по использованию дрожжевых полисахаридов в медицине. Дрожжи синтезируют полимеры, в составе которых содержатся маннаны, глюканы, фосфоманнаны, галактоманны и глюкуроноксилманнаны. Полисахариды, продуцируемые разными видами, а иногда даже разными штаммами одного и того же вида могут различаться по химическому составу и структуре. Такое разнообразие состава и свойств открывает большие перспективы применения их в самых разнообразных областях: медицине, химической, пищевой и косметической промышленностях, а также в качестве кормовых добавок...
Внеклеточные полисахариды, психрофилы, культивирование, меласса
Короткий адрес: https://sciup.org/140244274
IDR: 140244274 | DOI: 10.20914/2310-1202-2018-4-269-277
Текст научной статьи Эффективность синтеза внеклеточных полисахаридов штаммами дрожжей Lipomyces
DOI:
Образование внеклеточных полисахаридов – хорошо изученное свойство бактерий, которое используется для промышленного производства таких внеклеточных бактериальных полисахаридов, как ксантан, декстран, геллан, гиалуронан и др. Также широко применяются и полисахариды, синтезируемые грибами, как, например, шизофиллан и склероглюкан. Однако полисахариды, синтезируемые дрожжами и дрожжеподобными грибами, пока не нашли широкого промышленного применения, за исключением продуцируемого дрожжами Aureobasidium pullulans пуллулана [1]. Однако имеется ряд перспективных разработок по использованию дрожжевых полисахаридов в медицине [2, 3].
Дрожжи синтезируют полимеры, в составе которых содержатся маннаны, глюканы, фосфоманнаны, галактоманны и глюкуроноксилман-наны. Полисахариды, продуцируемые разными видами, а иногда даже разными штаммами одного и того же вида могут различаться по химическому составу и структуре. Такое разнообразие состава и свойств открывает большие перспективы применения их в самых разнообразных областях: медицине, химической, пищевой и косметической промышленностях, а также в качестве кормовых добавок [4]. В этой связи поиск новых продуцентов полисахаридов весьма актуален.
Дрожжи рода Lipomyces встречаются в почвах южного и северного полушария Земли, кроме высокогорных районов и почв тундры, где почвообразовательные процессы находятся на ранних стадиях развития, однако богаты этими дрожжами почвы степной и лесной зон [5].
Липомицеты в отличие от микромицетов играют не столь существенную роль в деструкции и разложении растительных остатков в лесных почвах, выступая, преимущественно, в качестве симбиотической микрофлоры для более активных почвенных микроорганизмов [6].
Внеклеточные полисахариды липомицетов. Согласно данным ИК-спектроскопии внеклеточные полисахариды липомицетов представляют собой группу родственных соединений, отличающихся друг от друга по соотношению отдельных моносахаридов, типом связей между моносахаридными остатками и конфигурациями последних. На это указывают данные и значения углов вращения нативных полисахаридов [7].
Цель работы – определение перспективности применения дрожжей рода Lipomyces в индустриальных условиях для получения биомассы и синтеза внеклеточных полисахаридов.
Материалы и методы
В работе использованы штаммы аскомице-товых дрожжей рода Lipomyces из коллекции кафедры биологии почв, факультета почвоведения Московского государственного университета им. М.В. Ломоносова (WDCM CCINFO 1173).
Поскольку первоначальная видовая идентификация коллекционных культур дрожжей была выполнена более 30 лет тому назад, была проведена их повторная идентификация на основе анализа нуклеотидных последовательностей D1/D2 доменов региона 26S (LSU) рДНК. Выделение ДНК, проведение ПЦР осуществляли по методике, описанной ранее [8]. Для амплификации интересующего нас региона рДНК, содержащего D1/D2 домены, использовали праймеры: IТS1f (5'-CTT GGT CAT TTA GAG AAG TA) и NL4 (5'-GGT CCG TGT TTC AAG ACG G). Секвенирование ДНК проводили с использованием праймера NL4 на секвенаторе AppliedBiosystems 3130хl Genetic Analyzer в Научно-производственной компании «Син-тол» (Москва). Идентификацию полученных результатов проводили, используя данные генбанка NCBI ( и базы данных МусоID (. Видовые обозначения дрожжей приводятся в статье после их повторной идентификации.
Культивирование дрожжей проводили на питательной среде, приготовленной из гидролизата кукурузной биомассы. Для приготовления питательной среды к сухой растительной биомассе кукурузы, полученной после водной экстракции сахарозы, добавляли воду в соотношении 1:10 (сухое вещество: вода). Предварительный гидролиз с целью делигнификации проводился при температуре 95 °С на водяной бане в течение 2 ч с добавлением NаОН в количестве 3% и перекиси водорода в количестве 2% к массе сухого вещества. Полученная разваренная масса промывалась проточной водой и отжималась. Концентрация сухого вещества разваренной массы доводилась до 3% добавлением воды с последующим гидропомолом на лабораторном измельчителе ножевого типа. Затем с помощью 14%-ного раствора соляной кислоты рН доводился до 5,0–5,5. Полученная масса нагревалась до 50 °С, вводился фермент Accellerase 500
в количестве 0,20–0,25 мл/г сухого вещества для ферментативного гидролиза растительных полимеров. Гидролиз производился в течение 24 ч. Полученная масса центрифугировалась, надосадочная жидкость стерилизовалась и использовалась в качестве питательной среды.
Культивирование дрожжей проводили в колбах объемом 100 мл при непрерывном перемешивании на шейкере в течение 6–7 сут, варьируя температуру.
Для определения количества дрожжевых клеток в культуральной жидкости использовали камеру Горяева-Тома. Оптическую плотность определяли фотометрическим методом при длине волны 540 нм в кюветах шириной 5 мм по предварительно построенному калибровочному графику. Концентрацию внеклеточных полисахаридов определяли по разнице концентраций редуцирующих веществ в культуральной жидкости до и после кислотного гидролиза.
Удельную скорость роста μ определяли логарифмическим отношением количества биомассы m 1 , полученной за время t , к количеству биомассы дрожжей m 2 , засеянных в колбы, по формуле:
ln m 1
Ц =
m 2 t
Время генерации определяли по формуле q = 0,693 / ц .
Выход биомассы дрожжей определяли отношением количества биомассы m 1 , полученной за время t , к количеству редуцирующих веществ m 2 ассимилированных дрожжами за время t , по формуле:
B = ml- - 100% .
m 2
Результаты и обсуждение
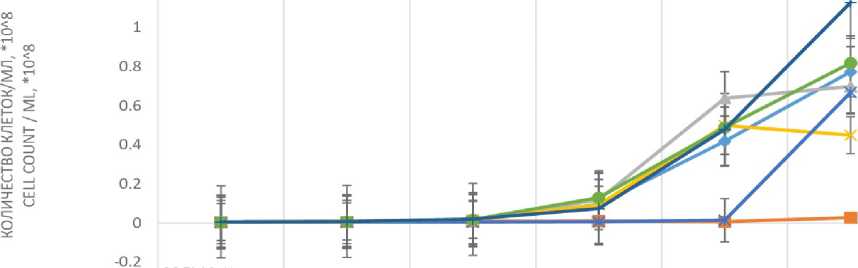
Культивирование при 20 °С. Изменение численности клеток практически у всех штаммов за исключением КБП Y-6258 и КБП Y-6234 начинается примерно с 60-го ч культивирования. Линейный характер прироста клеток, начиная с 72-го ч культивирования и до окончания культивирования на 168-м ч, отмечен у штаммов КБП Y-6267, КБП Y-6265 и КБП Y-6264. При этом наибольшая концентрация клеток дрожжей отмечена у штамма КБП Y-6267. У штамма КБП Y-6234 линейный прирост численности клеток начинается с 96-го ч, тогда как штаммы КБП Y-6268 и КБП Y-6266 в это время достигают максимума численности клеток. Численность клеток КБП Y-6258 изменяется незначительно в течение всего исследуемого периода культивирования при данных условиях (рисунок 1) .
Наибольший прирост биомассы также характерен для штамма КБП Y-6267. Однако наибольшее значение удельной скорости роста и наименьшее время генерации отмечено у штамма КБП Y-6266 (таблица 1) .
1.4
1.2
ВРЕМЯ, Ч
TIME, Н
|
0 |
24 |
48 |
72 |
96 |
168 |
|
|
—А—КБП Y-6265 |
0.0052 |
0.0092 |
0.017 |
0.095 |
0.42 |
0.775 |
|
■ КБП Y-6258 |
0.00425 |
0.00625 |
0.00975 |
0.0105 |
0.0072 |
0.028 |
|
А КБП Y-6266 |
0.0075 |
0.0095 |
0.014 |
0.12 |
0.64 |
0.7 |
|
X КБП Y-6268 |
0.0055 |
0.0085 |
0.017 |
0.094 |
0.5 |
0.45 |
|
Ж КБП Y-6234 |
0.005 |
0.0052 |
0.0052 |
0.0072 |
0.015 |
0.67 |
|
—•—КБП Y-6264 |
0.0055 |
0.0075 |
0.0187 |
0.13 |
0.49 |
0.82 |
|
1 КБП Y-6267 |
0.0067 |
0.0087 |
0.02 |
0.074 |
0.48 |
1.13 |
Рисунок 1. Влияние продолжительности культивирования на изменение количества клеток штаммов дрожжей
Lipomyces при 20 °С
Figure 1. The effect of the duration of cultivation on the change in the number of cells of the yeast Lipomyces strains at 20 ° С
Таблица 1.
Кинетические характеристики роста и выход биомассы при 20 °С
Table 1.
Kinetic characteristics of growth and biomass yield at 20 °С
|
Показатели Indicators |
Штаммы | Strains |
||||||
|
КБП Y-6265 |
КБП Y-6258 |
КБП Y-6266 |
КБП Y-6268 |
КБП Y-6234 |
КБП Y-6264 |
КБП Y-6267 |
|
|
Удельная скорость роста, ч-1 | Specific growth rate, h-1 |
0,038±0,004 |
0,005±0,002 |
0,145±0,033 |
0,135±0,012 |
0,049±0,01 |
0,039±0,009 |
0,042±0,008 |
|
Время генерации, ч Generation time, h |
26,100±1,963 |
201,380±4,259 |
6,880±0,697 |
7,410±1,002 |
20,400±2,744 |
25,700±4,648 |
23,670±2,545 |
|
Выход биомассы, % Biomass yield, % |
43,050±4,199 |
2,150±0,247 |
38,040±2,309 |
45,450±2,464 |
25,020±3,288 |
32,490±3,015 |
56,160±3,218 |
Р 95
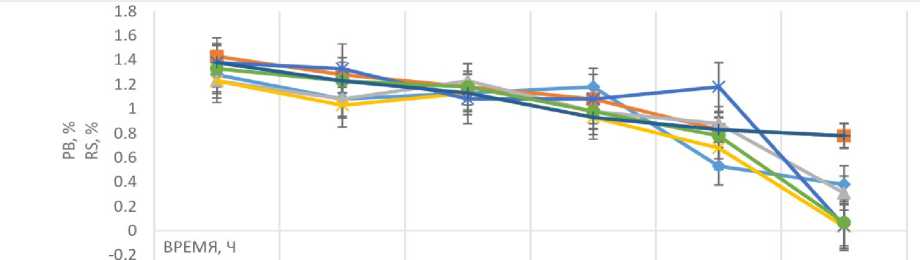
Практически полное потребление РВ питательной среды на 168-м часу культивирования характерно для штаммов КБП Y-6268, КБП Y-6264 и КБП Y-6234. Наибольшая остаточная концентрация РВ питательной среды соответствует штамму КБП Y-6258. Штаммы КБП Y-6267, КБП Y-6266 и КБП Y-6268 по остаточной концентрации РВ занимают промежуточное положение (рисунок 2).
TIME, H
О 24 48 120 144 168
—♦— КБП Y-6265 1.28 1.08 1.13 1.18 0.53 0.38
—■— КБП Y-6258 1.43 1.28 1.18 1.08 0.83 0.78
—*—КБПУ-6266 1.23 1.08 1.23 0.98 0.88 0.31
■ 'И КБП Y-6268 1.23 1.03 1.13 0.93 0.68 0.036
—Ж—КБП Y-6234 1.38 1.33 1.08 1.08 1.18 0.041
—•— КБП Y-6264 1.33 1.23 1.18 0.98 0.78 0.068
—I—КБП Y-6267 1.38 1.23 1.13 0.93 0.83 0.78
Рисунок 2. Изменение содержания редуцирующих веществ в питательной среде при культивировании дрожжей
Lipomyces при температуре 20 °С
-
Figure 2. The change in the content of reducing substances in the substratum during the cultivation of Lipomyces yeast at a temperature of 20 °C
Штаммы КБП Y-6267 и КБП Y-6264, имеющие наибольший прирост численности клеток, также демонстрируют высокую полиса-харид-синтезирующую способность. Штамм КБП Y-6258, имеющий наименьший прирост численности клеток, имеет также наименьшую концентрацию внеклеточного полисахарида. Однако зависимость концентрации полисахарида от численности клеток не соответствует штамму КБП Y-6265, который при значительной численности клеток имеет низкую концентрацию полисахарида (рисунок 3). Остальные штаммы занимают промежуточное положение по данному параметру.
Штамм
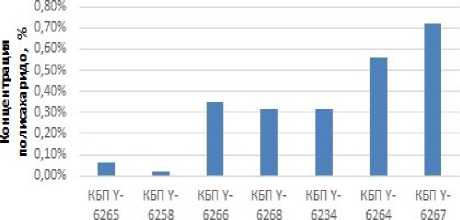
Рисунок 3. Концентрация внеклеточных полисахаридов при синтезе различными штаммами при 20 °С
-
Figure 3. Concentration of extracellular polysaccharides in the synthesis of different strains at 20 °C
Штаммам КБП Y-6267 и КБП Y-6264, имеющим наибольший прирост клеток и концентрацию полисахарида, характерны также близкие значения ксиланазной и целлобиазной активности (таблица 2) . При этом штамму КБП Y-6258, имеющему наименьший прирост клеток
свойственны высокие значения ксиланазной, целлобиазной и целлюлазной активности. Таким образом, наличие активностей вышеперечисленных ферментов не дает преимущество микроорганизмам при данных условиях культивирования на исследуемой питательной среде.
и наименьшую концентрацию полисахарида,
Таблица 2.
Ферментативная активность дрожжей Lipomyces при 20 °С
Table 2.
Enzymatic activity of the yeast Lipomyces at 20 °C
|
Штаммы | Strains |
|||||||
|
КБП Y-6265 |
КБП Y-6258 |
КБП Y-6266 |
КБП Y-6268 |
КБП Y-6234 |
КБП Y-6264 |
КБП Y-6267 |
|
|
Ксиланазная, IU/mL Xylanase, IU/mL |
0,032±0,004 |
0,085±0,005 |
0,046±0,005 |
0,032±0,003 |
0,046±0,004 |
0,052±0,005 |
0,052±0,005 |
|
Целлюлазная, FPU/mL Cellulase, FPU/mL |
0,065±0,004 |
0,084±0,008 |
0,065±0,003 |
0,230±0,030 |
0,084±0,004 |
0,019±0,003 |
0,046±0,004 |
|
Целлобиазная, FPU/mL Cellobiase, FPU/mL |
0,084±0,004 |
0,260±0,030 |
0,160±0,011 |
0,100±0,006 |
0,093±0,002 |
0,093±0,002 |
0,084±0,004 |
Р 95
Культивирование при 25 °С.
Изменение численности клеток практически у всех штаммов начинается примерно с 48-го ч культивирования. При этом наибольшая концентрация клеток дрожжей отмечена у штамма КБП Y-6267 на 144-м ч культивирования. Штаммы КБП Y-6258, КБП Y-6266, КБП Y-6234 достигают максимума численности клеток на 120-м ч культивирования, а остальные – при
144-х ч. После 144-х ч культивирования численность клеток всех штаммов начинает снижаться (рисунок 4) .
При данной температуре культивирования наибольший прирост биомассы характерен для штамма КБП Y-6267. Однако наибольшее значение удельной скорости роста и наименьшее время генерации отмечено у штамма КБП Y-6265 (таблица 3) .
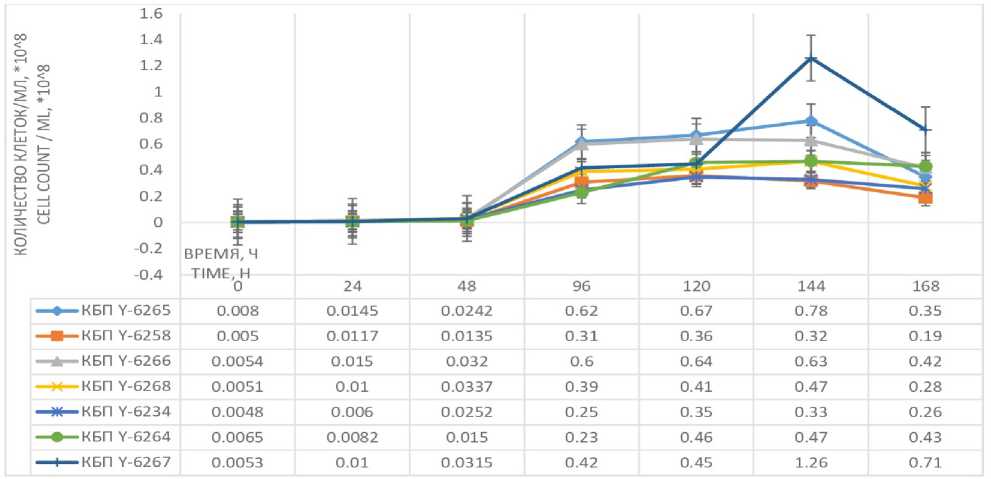
Рисунок 4. Влияние продолжительности культивирования на изменение количества клеток штаммов дрожжей
Lipomyces при 25 °С
Figure 4. The effect of the duration of cultivation on the change in the number of cells of the yeast Lipomyces strains at 25 °С
Таблица 3.
Кинетические характеристики роста и выход биомассы при 25 °С
Kinetic characteristics of growth and biomass yield at 25 °С
Table 3.
|
Показатели Indicators |
Штаммы | Strains |
||||||
|
КБП Y-6265 |
КБП Y-6258 |
КБП Y-6266 |
КБП Y-6268 |
КБП Y-6234 |
КБП Y-6264 |
КБП Y-6267 |
|
|
Удельная скорость роста, ч-1 | Specific growth rate, h-1 |
0,072±0,004 |
0,057±0,003 |
0,071±0,002 |
0,062±0,003 |
0,040±0,003 |
0,044±0,003 |
0,043±0,003 |
|
Время генерации, ч Generation time, h |
13,890±0,049 |
17,380±0,079 |
14,020±0,082 |
16,040±0,041 |
24,970±0,034 |
22,800±0,150 |
23,050±0,150 |
|
Выход биомассы, % Biomass yield, % |
35,000±0,392 |
17,270±0,269 |
32,300±1,037 |
16,090±0,115 |
26,000±0,248 |
33,070±0,234 |
50,710±1,039 |
Р 95
Наибольшее потребление РВ питательной среды на 168-м ч культивирования характерно для штаммов КБП Y-6268 и КБП Y-6267. Наибольшая остаточная концентрация РВ питательной среды характерна для штамма КБП Y-6258. Штаммы КБП Y-6265, КБП Y-6266, КБП Y-6264 и КБП Y-6234 по степени потребления РВ занимают промежуточное положение (рисунок 5).
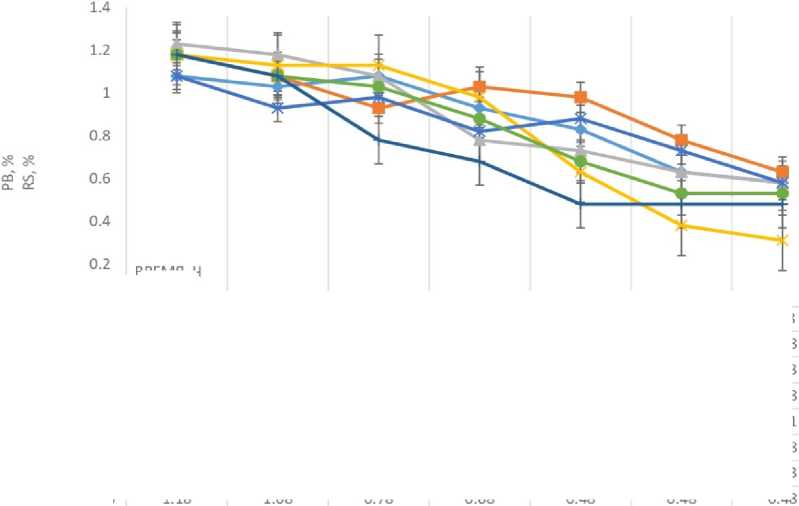
Рисунок 5. Изменение содержания редуцирующих веществ в питательной среде при культивировании дрожжей Lipomyces при температуре 25 °С
ВРЕМЯ, Ч
|
0 |
TIME, Н |
||||||
|
0 |
24 |
48 |
96 |
120 |
144 |
168 |
|
|
—*— КБП ¥-6265 |
1.08 |
1.03 |
1.08 |
0.93 |
0.83 |
0.63 |
0.58 |
|
—■—КБП ¥-6258 |
1.18 |
1.08 |
0.93 |
1.03 |
0.98 |
0.78 |
0.63 |
|
—*-КБП ¥-6266 |
1.23 |
1.18 |
1.08 |
0.78 |
0.73 |
0.63 |
0.58 |
|
|
1.18 |
1.13 |
1.13 |
0.98 |
0.63 |
0.38 |
0.31 |
|
—Ж— КБП ¥-6234 |
1.08 |
0.93 |
0.98 |
0.82 |
0.88 |
0.73 |
0.58 |
|
-♦ "КБП ¥-6264 |
1.18 |
1.08 |
1.03 |
0.88 |
0.68 |
0.53 |
0.53 |
|
—1—КБП ¥-6267 |
1.18 |
1.08 |
0.78 |
0.68 |
0.48 |
0.48 |
0.48 |
Figure 5. The change in the content of reducing substances in the substratum during the cultivation of Lipomyces yeast at a temperature of 25 °C
Штаммам КБП Y-6267 и КБП Y-6265, имеющим наибольший прирост клеток, характерны относительно невысокие значения ферментативной активности (таблица 4) . При этом штамму КБП
Ферментативная активность дрожжей Lipomyces при 25 °С
Y-6258, имеющему наименьший прирост клеток, свойственно высокое значение ксиланазной, целлобиазной и целлюлазной активности.
Таблица 4.
Table 4.
|
Штаммы Strains |
|||||||
|
КБП Y-6265 |
КБП Y-6258 |
КБП Y-6266 |
КБП Y-6268 |
КБП Y-6234 |
КБП Y-6264 |
КБП Y-6267 |
|
|
Ксиланазная, IU/mL Xylanase, IU/mL |
0,028±0,002 |
0,093±0,009 |
0,028±0,006 |
0,039±0,004 |
0,052±0,006 |
0,032±0,003 |
0,032±0,004 |
|
Целлюлазная, FPU/mL Cellulase, FPU/mL |
0,084±0,008 |
0,120±0,006 |
0,084±0,004 |
0,320±0,004 |
0,093±0,006 |
0,028±0,006 |
0,056±0,006 |
|
Целлобиазная, FPU/mL Cellobiase, FPU/mL |
0,056±0,005 |
0,280±0,045 |
0,032±0,004 |
0,180±0,020 |
0,032±0,004 |
0,032±0,004 |
0,032±0,004 |
Р 95
Enzymatic activity of the yeast Lipomyces at 25 °C
Культивирование при 30 °С.
Прирост численности клеток практически у всех штаммов за исключением КБП Y-6264 начинается примерно с 48-го ч культивирования. Численность клеток штамма КБП Y-6264 начинает расти с самого начала культивирования и достигает пика на 72-м ч культивирования, после чего их численность резко снижается и становится близкой к значениям численности клеток остальных штаммов к 144-му ч культивирования. Численность клеток КБП Y-6234 изменяется незначительно в течение всего исследуемого периода культивирования при данных условиях (рисунок 6).
Наибольшее значение удельной скорости роста и наименьшее время генерации также отмечено у штамма КБП Y-6264, однако наибольший прирост биомассы характерен для штамма КБП Y-6265 (таблица 5) .
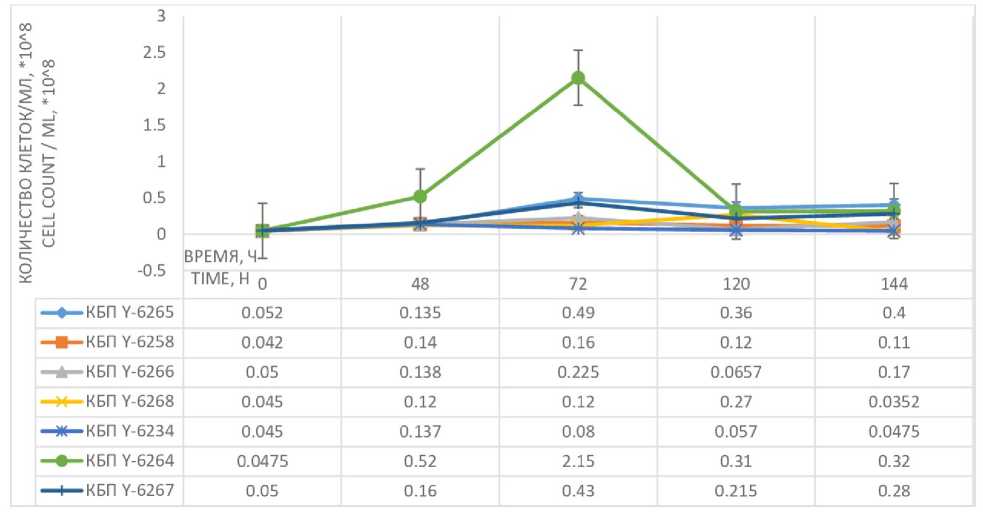
Рисунок 6. Влияние продолжительности культивирования на изменение количества клеток штаммов дрожжей
Lipomyces при 30 °С
Figure 6. The effect of the duration of cultivation on the change in the number of cells of the yeast Lipomyces strains at 30 °С
|
co о с;"* о 1— 5 о со и ZT с; |
3 2.5 со 5 2 5 15 I 1 8 0-5 8 0 -0.5 |
|||||||
|
Н ВРЕМЯ, Ч- |
——*=-— |
|||||||
|
5: |
TIME, Н 0 |
48 |
72 |
120 |
144 |
|||
|
—•—КБП Y-6265 |
0.052 |
0.135 |
0.49 |
0.36 |
0.4 |
|||
|
-•—КБП Y-6258 |
0.042 |
0.14 |
0.16 |
0.12 |
0.11 |
|||
|
—*— КБП Y-6266 |
0.05 |
0.138 |
0.225 |
0.0657 |
0.17 |
|||
|
—И—КБП Y-6268 |
0.045 |
0.12 |
0.12 |
0.27 |
0.0352 |
|||
|
—Ж—КБП Y-6234 |
0.045 |
0.137 |
0.08 |
0.057 |
0.0475 |
|||
|
—•—КБП Y-6264 |
0.0475 |
0.52 |
2.15 |
0.31 |
0.32 |
|||
|
—1—КБП Y-6267 |
0.05 |
0.16 |
0.43 |
0.215 |
0.28 |
|||
Таблица 5.
Кинетические характеристики роста и выход биомассы при 30 °С
Table 5.
Kinetic characteristics of growth and biomass yield at 30 °С
|
Показатели Indicators |
Штаммы | Strains |
||||||
|
КБП Y-6265 |
КБП Y-6258 |
КБП Y-6266 |
КБП Y-6268 |
КБП Y-6234 |
КБП Y-6264 |
КБП Y-6267 |
|
|
Удельная скорость роста, ч-1 | Specific growth rate, h-1 |
0,054±0,004 |
0,040±0,007 |
0,034±0,005 |
0,054±0,005 |
0,040±0,003 |
0,195±0,015 |
0,128±0,003 |
|
Время генерации, ч Generation time, h |
18,610±0,115 |
24,400±0,299 |
29,490±0,131 |
18,290±0,153 |
24,670±0,457 |
5,100±0,167 |
7,770±0,167 |
|
Выход биомассы, % Biomass yield, % |
33,330±0,265 |
5,140±0,056 |
10,000±0,707 |
3,200±0,050 |
6,780±0,148 |
20,780±0,324 |
24,560±0,667 |
Р 95
Наибольшее потребление РВ питательной среды на 144-м ч культивирования характерно для штаммов КБП Y-6258, КБП Y-6266. Наибольшая остаточная концентрация РВ питательной среды характерна для штамма КБП
Y-6234. Штаммы КБП Y-6265, КБП Y-6268, КБП Y-6264 и КБП Y-6267 по степени потребления РВ питательной среды занимают промежуточное положение (рисунок 7) .
|
1.6 1.4 1.2 1 S? ^ 0.8 m g 0.6 0.4 0.2 0 -0.2 |
Д |
||||
|
ВРЕМЯ, 4 TIME, H |
|||||
|
0 |
48 |
72 |
120 |
144 |
|
|
—♦—ВКПМ Y-1899 |
0.93 |
1.08 |
1.03 |
0.41 |
0.33 |
|
—■— ВКПМ Y-1013 |
1.23 |
1.13 |
0.48 |
0.18 |
0.16 |
|
—*—ВКПМ Y-1895 |
1.03 |
0.93 |
1.03 |
0.18 |
0.18 |
|
—X—ВКПМ Y-1997 |
1.13 |
1.18 |
1.23 |
0.73 |
0.58 |
|
1.13 |
0.98 |
1.13 |
0.83 |
0.78 |
|
|
—•—ВКПМ Y-1015 |
1.13 |
0.93 |
1.08 |
0.46 |
0.36 |
|
—1— ВКПМ Y-1877 |
0.93 |
1.03 |
1.28 |
0.43 |
0.36 |
Рисунок 7. Изменение содержания редуцирующих веществ в питательной среде при культивировании дрожжей Lipomyces при температуре 30 °С
Figure 7. The change in the content of reducing substances in the substratum during the cultivation of Lipomyces yeast at a temperature of 30 °C
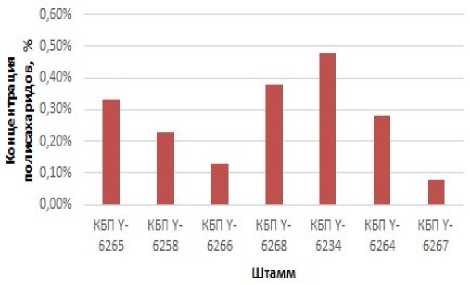
Рисунок 8. Концентрация внеклеточных полисахаридов при синтезе различными штаммами при 30 °С Figure 8. Concentration of extracellular polysaccharides in the synthesis of different strains at 30 °C
Штамм КБП Y-6234 имеет наибольшую концентрацию внеклеточного полисахарида, несмотря на наименьший прирост численности клеток (рисунок 8) . Также заметные концентрации внеклеточного полисахарида имеют штаммы КБП Y-6268, КБП Y-6265 и КБП Y-6264.
Штаммам КБП Y-6234 и КБП Y-6268, имеющим наибольшие концентрации внеклеточного полисахарида, свойственны наибольшие значения ксиланазной и целлюлазной активности, тогда как штаммам КБП Y-6264 и КБП Y-6265, имеющим наибольший прирост клеток и среднюю концентрацию полисахарида, характерны низкие значения ксиланазной и целлобиазной активности (таблица 6) .
Таблица 6.
Ферментативная активность дрожжей Lipomyces при 30 °С
Table 6.
Enzymatic activity of the yeast Lipomyces at 30 0 C
|
Штаммы | Strains |
|||||||
|
КБП Y-6265 |
КБП Y-6258 |
КБП Y-6266 |
КБП Y-6268 |
КБП Y-6234 |
КБП Y-6264 |
КБП Y-6267 |
|
|
Ксиланазная, IU/mL Xylanase, IU/mL |
0,013±0,003 |
0,013±0,002 |
0,013±0,002 |
0,039±0,005 |
0,065±0,012 |
0,013±0,002 |
0,013±0,002 |
|
Целлюлазная, FPU/mL Cellulase, FPU/mL |
0,018±0,002 |
0,046±0,003 |
0,028±0,006 |
0,100±0,010 |
0,240±0,011 |
0,074±0,005 |
0,074±0,006 |
|
Целлобиазная, FPU/mL Cellobiase, FPU/mL |
0,018±0,002 |
0,018±0,002 |
0,018±0,002 |
0,180±0,020 |
0,120±0,006 |
0,018±0,002 |
0,018±0,002 |
Р 95
Заключение
С точки зрения прироста биомассы на представленной питательной среде при исследуемых температурах наибольшее внимание привлекают штаммы дрожжей Lipomyces lipofer КБП Y-6267 и КБП Y-6265 (эффективный прирост при пониженных температурах). С повышением температуры прирост биомассы у этих дрожжей заметно снижается.
В качестве продуцентов внеклеточного полисахарида стоит отметить штаммы КБП Y-6267 и КБП Y-6264 при 20 °С и штаммы КБП Y-6268 и КБП Y-6234 при 30 °С, что указывает на возможность использования для этих целей разных видов рода Lipomyces .
При 30 °С штаммы Lipomyces lipofer КБП Y-6268 и Lipomyces kononenkoae КБП Y-6234 обладали наибольшими активностями ферментов,
Список литературы Эффективность синтеза внеклеточных полисахаридов штаммами дрожжей Lipomyces
- Singh R.S., Saini G.K., Kennedy J.F. Pullulan: Microbial sources, production and applications//Carbohydrate Polymers. 2008. V. 73. P. 515-531 DOI: 10.1016/j.carbpol.2008.01.003
- Holck P., Sletmoen M., Stokke B.T., Permin H. et al. Potentiation of histamine release by microfungal (1-3) and (1-6) -beta-D-glucans//Basic Clin Pharmacol Toxicol. 2007. V. 101. № 6. P. 455-458 DOI: 10.1111/j.1742-7843.2007.00140.x
- Ghoneum M., Wang L., Agrawal S., Gollapudi S. Yeast therapy for the treatment of breast cancer: a nude mice model//In Vivo. 2007. V. 21. P. 251-258.
- Yeast Biotechnology: Diversity and Applications; ed. T. Satyanarayana, G. Kunze. Springer, 2009. 746 p.
- Oguri E., Masaki K., Naganuma T., Iefuji H. Phylogenetic and biochemical characterization of the oil-producing yeast Lipomyces starkeyi//Antonie van Leeuwenhoek. 2012. V. 101. № 2. P. 359-368 DOI: 10.1007/s10482-011-9641-7
- Freitas F., Alves V.D., Reis M.A. Advances in bacterial exopolysaccharides: from production to biotechnological applications//Trends in Biotechnology. 2011. P. 388-398 DOI: 10.1016/j.tibtech.2011.03.008
- Liu H., Zhao X., Wang F., Jiang X. et al. The proteome analysis of oleaginous yeast Lipomyces starkeyi.//FEMS Yeast Research. 2011. V. 11. № 1. P. 42-51. doi:10.1111/j. 1567-1364.2010.00687.x
- Глушакова А.М., Качалкин А.В., Чернов И.Ю. Почвенные дрожжевые сообщества в условиях агрессивной инвазии борщевика Сосновского (Heracleum sosnowskyi)//Почвоведение. 2015. № 2. C. 221-227.


 —И— КБП ¥-6268
—И— КБП ¥-6268