Экскреция триптофана, лизина, триметиллизина, саркозина, холина и 4-пиридоксиновой кислоты с мочой при мочекаменной болезни
Автор: Голованов С.А., Синюхин В.Н., Ташлицкий В.А., Сивков А.В., Просянников М.Ю., Анохин Н.В., Войтко Д.А., Дрожжева В.В., Еремеева Д.А., Аполихин О.И., Каприн А.Д.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Мочекаменная болезнь
Статья в выпуске: 1 т.15, 2022 года.
Бесплатный доступ
Введение. Роль органического матрикса мочевых камней в литогенезе при мочекаменной болезни (МКБ) до сих пор остается неясной. Присутствие большого количества белка в матриксе мочевых камней дает основание предполагать участие белкового матрикса в литогенезе. Поскольку аминокислоты входят в состав матричных белков мочевого камня, большой интерес представляет исследование спектра аминокислот мочи при МКБ. Материал и методы. Проведен анализ экскреции с мочой при МКБ следующих аминокислот и низкомолекулярных соединений: триптофана, лизина, триметиллизина, саркозина, холина и 4-пиридоксиновой кислоты. Использовали метод ультраэффективной жидкостной хроматографии в сочетании с масс-спектрометром TQD. Результаты. Для пациентов с оксалатной формой МКБ свойственна более высокая активность экскреции холина и саркозина, по сравнению со здоровыми людьми. У пациентов с мочекислыми камнями, в отличие от здоровых лиц, отмечена более высокая экскреция холина и чрезвычайно повышенная концентрация в моче триметиллизина. Для оксалатного уролитиаза, в отличие от мочекислого (уратного), характерны весьма низкая концентрация триметиллизина, холина, саркозина и более высокий уровень экскреции триптофана. Выводы. Интенсивность экскреции с мочой аминокислот и низкомолекулярных соединений имеет характерные особенности у пациентов с различными типами МКБ и здоровых лиц. Наряду с известными метаболическими литогенными факторами мочи показатели экскреции этих аминокислот и низкомолекулярных веществ, по-видимому, могут служить критериями активности оксалатного или уратного литогенеза и быть использованы в качестве дополнительных целевых индикаторов для оценки успешности проводимого противорецидивного лечения.
Мочекаменная болезнь, уролитиаз, литогенез, метаболические литогенные нарушения, метафилактика, аминокислотный спектр мочи
Короткий адрес: https://sciup.org/142234567
IDR: 142234567
Текст научной статьи Экскреция триптофана, лизина, триметиллизина, саркозина, холина и 4-пиридоксиновой кислоты с мочой при мочекаменной болезни
Структура всех типов мочевых камней представлена кристаллическим минеральным компонентом и органическим матриксом, который составляет 2-3% от общего сухого веса камня и состоит в основном из белков (64%) липидов (7-12%), гликозаминогликанов (20%) и углеводов (8%) [1-6].
Роль матрикса мочевых камней в литогенезе до сих пор остается неясной. Ранее полагали, что формирование органического матрикса в мочевых камнях связано с тем что в процессе кристаллизации некоторые биомолекулы мочи оказываются пассивно захваченными внутренними неорганическими слоями камня. Ряд исследователей рассматривали матрикс и его повсеместное присутствие во всем объеме мочевого камня как результат простой физической адсорбции мукопротеинов мочи на кристаллических поверхностях [7-8].
Другие авторы указывают на важную роль матрикса как активного вещества в процессе построения структуры и формирования мочевых камней, способного контролировать кристаллизацию в пределах своих границ [2, 4, 9, 10].
Присутствие большого количества белка в матриксе уролитов дает основание предполагать участие белкового матрикса в литогенезе. Считают, что мочевые белки играют значительную роль в формировании конкрементов, способствуя росту кристаллов и их адгезии с клетками уротелия [7, 11]. Являясь необходимым компонентом мочевых камней, эти матричные белки играют роль скелета (матрицы) и обеспечивают дальнейший процесс биоминерализации [12].
Некоторые матриксные белки могут проявлять ан-тилитогенную активность, оказывая ингибиторный эффект на процессы роста мочевых конкрементов, а также снижать цитотоксическое действие кристаллов оксалата кальция на уротелий [6, 10, 13, 14].
Обнаружено, что кристаллы кальция оксалата моногидрата могут оказывать на клетки уротелия, цитотоксическое воздействие с активацией воспалительных и стрессовых биомаркеров. Однако этот цитотоксический эффект кристаллов оксалата кальция на клетки уротелия значительно ослабляется в присутствии белков матрикса мочевых камней и сопровождается снижением активности воспалительного ответа и апоптической гибели клеток, что указывает на способность матричных белков защищать клетки уротелия от повреждения кристаллами оксалата кальция [10].
Известно более 20 матриксных белков [1, 15]. Разные типы мочевых камней отличаются по составу матриксных белков. Уромодулин и альбумин обнаруживают во всех мочевых камнях и присутствие этих белков не зависит от типа минерального компонента. В то же время остеопон-тин, протромбин, белок S и белок Z идентифицированы исключительно в кальций-оксалатных камнях [16–20] Характерным для камней из мочевой кислоты является наличие в их матриксе фрагментов иммуноглобина G, которые, как полагают, играют важную роль в агрегации кристаллов мочевой кислоты [21, 22].
Большой интерес представляет исследование спектра аминокислот мочи при мочекаменной болезни (МКБ) поскольку они входят в состав матричных белков мочевого камня. Отмечены особенности экскреции аминокислот с мочой у здоровых людей и больных МКБ [23-25] Многие аминокислоты (аргинин, глицин, гистидин, аспартат, глютамат и другие) способны образовывать растворимые комплексы с кальцием, что дает основание предполагать важную роль аминокислот мочи в процессах камнеобразования [26-28]. Такие аминокислоты, как глицин, серин, гидроксипролин и триптофан участвуют в синтезе оксалатов, экскретируемых с мочой, и могут оказывать влияние на процесс оксалатного литогенеза [29].
Целью настоящей работы явилось исследование в моче пациентов с оксалатными и мочекислыми камнями некоторых аминокислот и низкомолекулярных метаболитов, участвующих в аминокислотном обмене.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовали содержание в моче некоторых аминокислот и низкомолекулярных соединений у пациентов

экспериментальная и клиническая урология № 1 2022

с МКБ и здоровых лиц. Обследовано 19 пациентов (15 мужчин и 4 женщины) с оксалатным уролитиазом и 14 пациентов (6 мужчин и 8 женщин) с мочекислой формой МКБ в возрасте от 33 до 56 лет. В качестве контрольной группы выступили 7 здоровых мужчин (33-49 лет). В исследование включали лиц, в клиническом анализе мочи которых не было выявлено признаков воспаления.Все пациенты находились на стандартной диете.
Проведен анализ экскреции с мочой при МКБ следующих аминокислот и низкомолекулярных соединений: триптофана, лизина, триметиллизина, саркозина холина и 4-пиридоксиновой кислоты. Использовали метод ультраэффективной жидкостной хроматографии (Ultra-performance liquid chromatography, UPLC) в сочетании с масс-спектрометром TQD (Waters ACQUITY UPLC, США).
РЕЗУЛЬТАТЫ
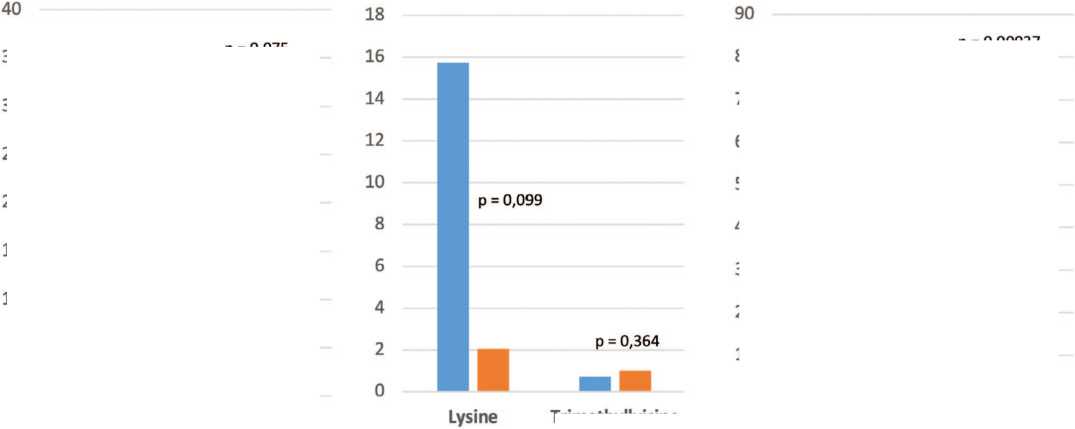
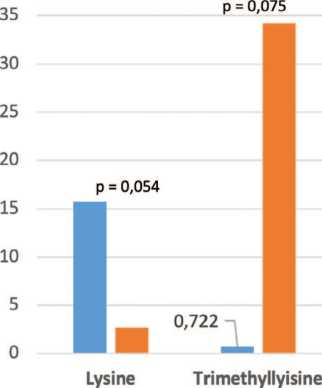
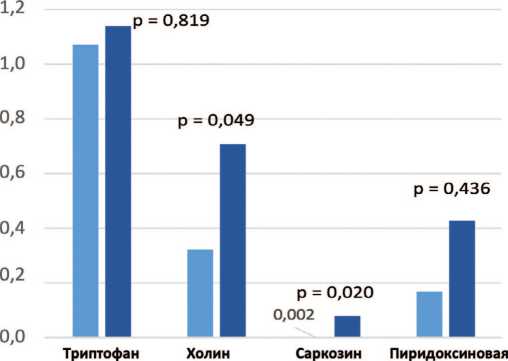
У всех пациентов с МКБ, в отличие от здоровых лиц, выявлено снижение в 5,85 раза ( p = 0,054) концентрации триметиллизина (рис.1A). Такая же тенденция отмечена у пациентов с оксалатными камнями ( р = 0,099), в отличие от мочекислого уролитиаза, что представлено на рисунках1B и 1C.
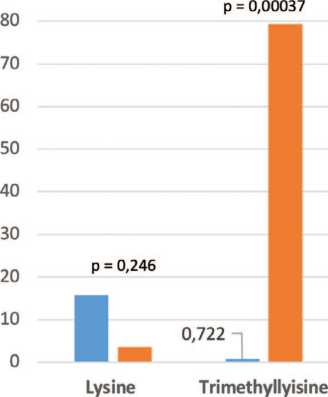
У всех больных МКБ в отличии от здоровых лиц отмечалась тенденция к повышению триметиллизина (рис. 1A, р = 0,075, U-критерий Манна-Уитни). Показательно значительное увеличение (в 109,7 раза) экскреции триметиллизина у пациентов с мочекислыми камнями (рис. 1C, р = 0,00037). Экскреция этой аминокислоты у пациентов с оксалатным уролитиазом не отличалась статистически значимо от этого показателя у здоровых лиц (рис. 1B).
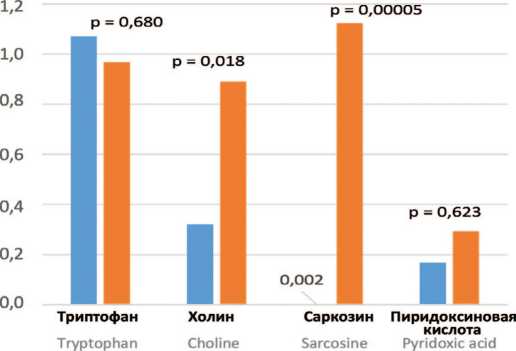
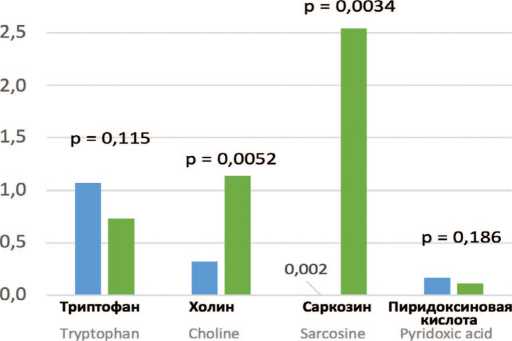
Обнаружено, что в моче пациентов с МКБ величина показателя саркозин/креатинин (в мг/ммоль креатинина) достигает чрезвычайно высокого уровня, превышая значение этого показателя у здоровых лиц в 472,0 раза (рис. 2A, р = 0,00005, U-критерий Манна-Уитни). Такое увеличение было обусловлено еще более значительным возрастанием концентрации саркозина в моче у пациентов с мочекислыми камнями – в 1067,4 раза, по сравнению со здоровыми лицами (рис. 2C, р = 0,0034). В то же время, у пациентов с кальций-оксалатным уролитиазом концентрация саркозина мочи была всего лишь в 33,3 раза выше, чем у здоровых людей (рис. 2B, р = 0,020).
Следует отметить, что в моче пациентов с МКБ уровень холина коррелировал с концентрацией саркозина. Так, наибольший уровень холина (в 3,5 раза выше, чем у здоровых людей)наблюдали в моче пациентов с уратным уролитиазом, при котором отмечена самая высокая концентрация саркозина (рис. 2C, р = 0,0052). И наоборот, по сравнению со здоровыми лицами самые низкие уровни холина и саркозина были обнаружены в моче пациентов с оксалатными камнями (рис. 2B, р = 0,049).
Показатели экскреции пиридоксиновой кислоты с мочой не имели существенных различий у здоровых лиц и у пациентов с оксалатным или уратным уролитиазом (рис. 2 и рис. 3).
A
B
C
Tnmethyllyisine
■ Здоровые лица ■ Больные Ох УЛ
Healthy subjects Oxalate Stone formers
■ Больные МКБ
Stone formers
■ Здоровые лица
Healthy subjects
■ Здоровые лица
Healthy subjects
■ Больные Ua УЛ
Uric acid Stone formers
Fig. 1 Urinary excretion of lysine and trimethyllysine (mg/mM urinary creatinine) A - Healthy subjects vs stone formers;
B - Healthy subjects vs oxalate stone formers (Ox-SF);
C - Healthy subjects vs uric acid stone formers (Ua-SF)
Рис 1. Экскреция лизина и триметиллизина с мочой (в мг/мМ креатинина мочи) А - у здоровых лиц и пациентов с МКБ;
В - у здоровых лиц и пациентов с оксалатным уролитиазом (Ох-УЛ);
С - у здоровых лиц и пациентов с мочекислым уролитиазом (Ua-УЛ)
экспериментальная и клиническая урология
2022 www ecuro ru
A
Choline кислота
Pyridoxic acid
■ Больные МКБ
Stone Formers
Лизин
Lysine ■ Больные Ox УЛ
Ox-Stone Formers
Триметиллизин Trimethyllysine ■ Больные Ua УЛ
UA-Stone Formers
Sarcosine
■ Больные Ox УЛ
Ox-Stone Formers
-
■ Здоровые лица Healthy Subjects
Tryptophan
B
-
■ Здоровые лица Healthy Subjects
■ Здоровые лица
Healthy Subjects
■ Больные Ua УЛ
Ua-Stone Formers
Рис. 2. Экскреция аминокислот и их метаболитов с мочой (в мг/мМ креатинина мочи)
А - у здоровых лиц и пациентов с МКБ;
В - у здоровых лиц и пациентов с оксалатным уролитиазом (Ох-УЛ);
С - у здоровых лиц и пациентов с мочекислым уролитиазом (Ua-УЛ)
Fig. 2. Urinary excretion of amino acids and their metabolites (mg/mM urinary creatinine)
А - Healthy subjects vs stone formers;
B - Healthy subjects vs oxalate stone formers (Ox-SF);
C - Healthy subjects vs uric acid stone formers (Ua-SF)
■ Больные Ox УЛ ■ Больные Ua УЛ
Ox-Stone Formers UA-Stone Formers
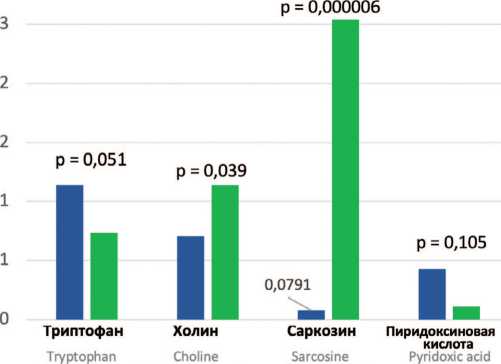
Рис. 3. Сравнение экскреции изучаемых веществ с мочой (в мг/мМ креатинина мочи) у пациентов с оксалатным (Ох-УЛ) и мочекислым уролитиазом (Ua-УЛ)
Fig. 3. Urinary excretion of amino acids and their metabolites (mg/mM urinary creatinine) in oxalate stone formers (Ox-Stone Formers) and uric acid stone formers (Ua-Stone Formers)
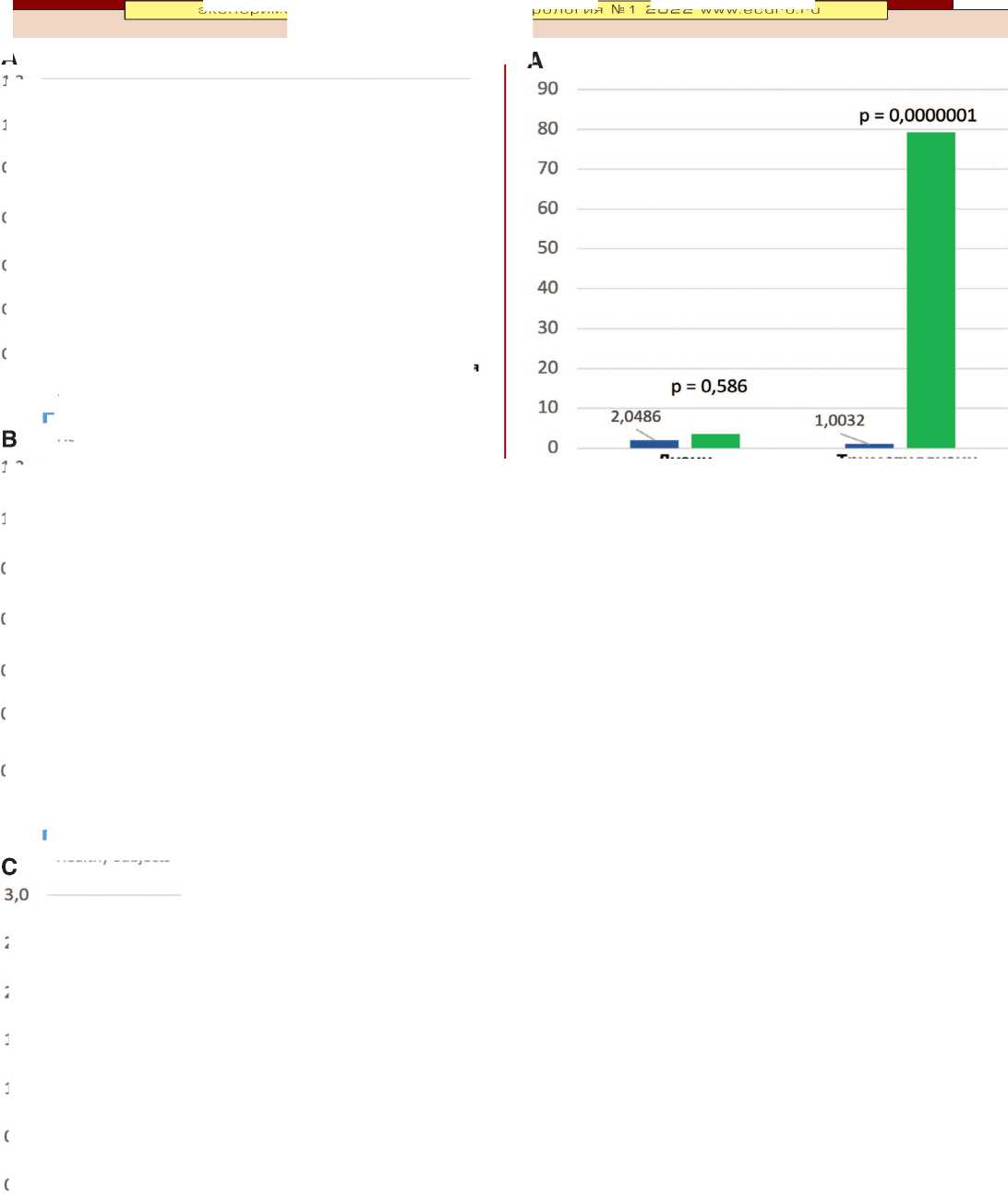
Сравнение показателей экскреции с мочой изучаемых аминокислот и низкомолекулярных соединений у больных МКБ позволило выявить, что для оксалатного уролитиаза, в отличие от мочекислого (уратного), характерна весьма низкая концентрация в моче триметил-лизина (снижена в 78,0 раз, р = 0,0000001), а также снижение экскреции холина (в 1,61 раза, р = 0,039) и саркозина (в 32,1 раза, р = 0,000006). В то же время, пациенты с оксалатными камнями отличались от больных уратным уролитиазом более высоким уровнем экскреции триптофана (в 1,56 раза, р = 0,051) и тенденцией к повышению экскреции пиридоксиновой кислоты (в 3,85 раза, р = 0,105, U-критерий Манна-Уитни). Эти зависимости отражены на рисунке 3.
ОБСУЖДЕНИЕ
Согласно ряду работ у больных МКБ наблюдали пониженную экскрецию с мочой глицина и значительное снижение экскреции треонина, аспарагиновой кислоты, лизина, цистина и гистидина, по сравнению со здоровыми лицами, хотя другие авторы не обнаруживали таких различий [23-25, 30].
В проведенном нами исследовании показано, что у всех пациентов с МКБ в отличие от здоровых лиц отмечена более низкая экскреция лизина с мочой, что соответствует указанным выше литературным данным причем у пациентов с оксалатными камнями наблюдали тенденцию к снижению экскреции этой аминокислоты по сравнению с мочекислым уролитиазом.
Известно, что лизин и еще четыре аминокислоты (аспарагиновая кислота, глютаминовая кислота, глицин аланин) являются основными аминокислотами белкового матрикса кальций-оксалатных мочевых камней [24]. Это особенно важно, если учесть, что лизин обладает способностью образовывать растворимые комплексы с кальцием, а его кальций-связывающая способность сильно зависит от значений рН мочи. Так, при сдвиге рН от 6,0 до 9,0 способность лизина, как аминокислоты, обладающей свойствами основания, возрастает в 2,6 раза [27].
Проведенный нами анализ 708 случаев МКБ косвенно согласуется с этими результатами. Отмечено, что при повышении рН мочи с 5,6-5,9 до 7,3-9,0 частота встречаемости кальций-оксалатных камней снижается почти в 5 раз с 51,4% до 10,5% ( p = 0,00002, по критерию Хи-квадрат Пирсона) [31]. Снижение частоты формирования кальций-оксалатных камней при повышении рН мочи, по-видимому, может быть связано также с увеличением способности лизина мочи хелатировать ионы кальция, сохраняя образующийся комплекс лизин+кальций в растворенном состоянии и препятствуя, тем самым, вовлечению кальция в процесс оксалатного литогенеза [27].
Еще одним фактором усиления активности кальций-оксалатного литогенеза можно считать наличие в матриксе кальций-содержащих камней большого количества лизина, доля которого среди аминокислот со щелочными свойствами является самой высокой и достигает 20% [32]. Известно также, что большая часть мат-риксных белков локализована в поверхностных слоях камня, где содержание их вдвое выше, чем во внутренних слоях. Этот градиент концентрации, как считают способствует вовлечению матрикса в «ростовой фронт» на поверхности камня с миграцией в наружные слои органического матриксного материала из «более старых» внутренних слоев [33].
Таким образом, низкая концентрация лизина в моче у пациентов с оксалатными камнями может указывать на его преимущественное включение в состав матриксного белка. По-видимому, возможная роль лизина в литогенезе заключается в том, что эта аминокислота в составе поверхностных матриксных белков способна связывать кальций мочи, вовлекая его в активный процесс формирования новых слоев оксалатного камня.
Тенденция к снижению лизина в моче при оксалатном уролитиазе, отмеченная в нашей работе, была обнаружена также К. Kohri и соавт. [28]. По мнению автора,процесс активного оксалатного литогенеза у таких пациентов может быть связан с включением комплексов лизин+кальций мочи в минеральную основу оксалатных камней.
Следует полагать, что низкая концентрация лизина в моче при оксалатном уролитиазе может также приводить к снижению способности мочи связывать кальций и образовывать растворимые комплексы лизин+кальций и, как следствие, служить дополнительным фактором увеличения мочевой концентрации кальция при оксалатном уролитиазе.
Как было установлено в настоящей работе, все больные МКБ имели тенденцию к повышению концентрации триметиллизина мочи по сравнению со здоровыми лицами. Это было обусловлено увеличенной более чем в 100 раз экскрецией триметиллизина у пациентов с мочекислыми камнями. Однако экскреция этой аминокислоты у пациентов с оксалатным уролитиазом не отличалась от величины этого показателя у здоровых лиц.
Известно,что триметиллизин является метилированным производным лизина и образуется путем посттрансляционного метилирования этой аминокислоты в ядерных белках (гистонах). В дальнейшем три-метиллизин высвобождается в результате протеолиза По сути, посттрансляционная модификация белков представляет собой «достройку» белка после его синтеза на рибосоме. Для многих белков посттрансляционная модификация оказывается завершающим этапом биосинтеза,который является частью процесса экспрессии генов [34].
Можно предполагать, что значительный рост концентрации в моче триметиллизина при уратном уролитиазе отражает процесс активного метилирования ядерных гистонов у этих больных. Поскольку деградация метилированных белков, таких как гистоны, является единственным источником триметиллизина, его уровень рассматривают в качестве маркера процесса глобального метилирования гистонов [35].
Кроме того, значительное увеличение концентрации триметиллизина в моче при уратном уролитиазе, по-видимому, может свидетельствовать о возрастании энергетических потребностей уротелия, поскольку известно, что триметиллизин является основным предшественником синтеза карнитина – метаболита, необходимого для транспорта и утилизации жирных кислот в митохондриях [36]. Другая причина возрастания уровня триметиллизина в моче пациентов с мочекислыми камнями может быть связана с нарушением биосинтеза карнитина и замедлением превращения триметиллизина в карнитин.
Как было установлено, у пациентов с МКБ величина экскреции саркозина с мочой достигает очень высокого уровня, в 472 раз превышая значение этого показателя у здоровых лиц. Такое увеличение экскреции было обусловлено еще более значительным (в 1067 раз) возрастанием концентрации саркозина в моче у пациентов с мочекислыми камнями по сравнению со здоровыми лицами. Хотя у пациентов с кальций-оксалатным уролитиазом интенсивность экскреции саркозина с мочой была всего лишь в 33 раза выше, чем у здоровых людей.
Саркозин образуется в результате метаболизма таких эссенциальных нутриентов, как холин и метионин [37-39]. Очевидно, высокие значения показателя сарко-зин/креатинин мочи у пациентов с оксалатным и особенно с уратным уролитиазом могут быть обусловлены высокой концентрацией в моче холина, уровень которого у всех больных с МКБ в 2,8 раза превышал концентрацию холина у здоровых лиц.
Уровень холина в моче пациентов с МКБ коррелировал с концентрацией саркозина. Так, наибольший уровень холина наблюдали в моче пациентов с уратным уролитиазом, при котором отметили самую высокую концентрацию саркозина. И наоборот, в отличие от здоровых лиц самые низкие уровни холина и саркозина были обнаружены в моче пациентов с оксалатными камнями.
Известно, что холин служит основным источником триметилглицина, метилированного производного глицина, являющегося донором метильных групп, которые необходимы для процессов метилирования аминокислотных остатков лизина и глицина в ядерных гистоновых белках. И, в конечном счете, метилирование гистонов является важнейшим этапом таких процессов, как экспрессия генов и эпигенетическая регуляция [40].
Саркозин, как метилированный глицин (N-метил-глицин), является промежуточным продуктом в метаболическом превращении холина в глицин [39]. Саркозин достаточно быстро может превращаться в глицин под действием саркозин-дегидрогеназы. Очевидно, накопление саркозина в моче может быть связано с угнетением процесса превращения саркозина в глицин. Однако более вероятным представляется обратный процесс: ускорение синтеза саркозина из глицина в реакции метилирования глицина в результате активации в целом процессов метилирования ядерных гистонов. Подобная зависимость была отмечена нами при анализе изменений показателей лизин/креатинин (в мг/мМ креатинина) и триметиллизин/креатинин (в мг/мМ креатинина) у здоровых лиц и больных МКБ.
Нами было отмечено, что для мочекислого уролитиаза, в отличие от оксалатного, характерна очень высокая концентрация в моче триметиллизина, повышенная экскреция с мочой холина и саркозина. Как уже обсуждалось, подобные изменения в обмене триметиллизина и соединений-доноров метильных групп (саркозина и холина), наблюдаемые у пациентов с мочекислым уролитиазом, могут свидетельствовать об активном процессе метилирования ядерных гистонных белков,что, по-видимому, можно считать характерной метаболической особенностью уратного литогенеза [35, 39, 40]. Следует отметить, что данных об экскреции с мочой при МКБ таких низкомолекулярных соединений, исследованных нами, как триметиллизин, саркозин, холин в доступной литературе не обнаружено.
Исследование уровня в моче пиридоксиновой кислоты (4-пиридоксиновой кислоты) является общепринятым критерием обеспеченности организма пиридоксином (витамином В6) [41]. Известно, что дефицит потребляемого с пищей пиридоксина может приводить к увеличению экскреции оксалатов с мочой и формированию оксалатных мочевых камней [42]. Проведенные нами исследования не выявили существенных различий в концентрации 4-пиридоксиновой кислоты в моче у здоровых лиц и пациентов с МКБ. Сходные результаты были получены также в работах других авторов [42, 43]
Пациенты с оксалатными камнями отличались от пациентов с уратным уролитиазом более высоким уровнем экскреции триптофана и тенденцией к повышению экскреции пиридоксиновой кислоты.Повышение экскреции триптофана при оксалатном уролитиазе может быть связано с тем, что предшественниками синтеза эндогенного оксалата, экскретируемого с мочой, является триптофан и другие аминокислоты (глицин, серин, гидроксипролин) вклад которых в экскрецию оксалата составляет от 40 до 65% [29].
ВЫВОДЫ
В результате проведенного исследования выявлено, что интенсивность экскреции аминокислот и низкомолекулярных соединений (триптофана, лизина, триметилли-зина, саркозина, холина, 4-пиридоксиновой кислоты) имеет характерные особенности у пациентов с оксалатными, мочекислыми камнями и здоровых лиц. Для пациентов с оксалатной формой МКБ свойственна более высокая активность экскреции холина и саркозина, по сравнению со здоровыми людьми. У пациентов с мочекислыми камнями, в отличие от здоровых лиц, отмечена более высокая экскреция холина и чрезвычайно повышенная концентрация в моче триметиллизина. Для оксалатного уролитиаза, в отличие от мочекислого (уратного), характерны весьма низкая концентрация триме-тиллизина, холина, саркозина и более высокий уровень экскреции триптофана.
Можно полагать, что характерные изменения показателей мочевой экскреции исследованных аминокислот и низкомолекулярных веществ свидетельствуют об участии этих соединений в процессах литогенеза оксалатных и уратных мочевых камней. Наряду с известными метаболическими литогенными факторами мочи показатели экскреции этих аминокислот и низкомолекулярных веществ, по-видимому, могут служить критериями активности оксалатного или уратного литогенеза и быть использованы в качестве дополнительных целевых индикаторов для оценки успешности проводимого противорецидивного лечения.
Список литературы Экскреция триптофана, лизина, триметиллизина, саркозина, холина и 4-пиридоксиновой кислоты с мочой при мочекаменной болезни
- Khan SR, Hackett RL. Role of organic matrix in urinary stone formation: an ultrastructural study of crystal matrix interface of calcium oxalate monohydrate stones. J Urol 1993;150(1):239-45. https://doi.org/10.1016/s0022-5347(17)35454-x.
- Boyce WH, Garvey FK. The amount and nature of the organic matrix in urinary calculi: a review. J Urol 1956;76(3):213-27. https://doi.org/10.1016/s0022-5347(17)66686-2.
- Morse RM, Resnick MI. Urinary stone matrix. J Urol 1988;139(3):602-6. https://doi.org/10.1016/s0022-5347(17)42541-9.
- Boyce, W. H. (1968). Organic matrix of human urinary concretions. Am J Med 45(4):673-683.
- Aggarwal KP, Narula S, Kakkar M, Tandon C. Nephrolithiasis: Molecular 414 mechanism of renal stone formation and the critical role played by modulators. Biomed Res Int 2013;292953. https://doi.org/10.1155/2013/292953.
- Narula S, Tandon S, Singh SK, Tandon C. Kidney stone matrix proteins ameliorate calcium oxalate monohydrate induced apoptotic injury to renal epithelial cells. Life Sci 2016(164):23-30. https://doi.org/10.1016/j.lfs.2016.08.026.
- Vermeulen CW, Lyon KS. Mechanisms of genesis and growth of calculi. Am J Med 1968;45(5):684-92. https://doi.org/10.1016/0002-9343(68)90204-0.
- Finlayson R, Vermeulen CW, Stewart KJ. Stone matrix and mucoprotein in urine. J Urol 1961(86):355-63. https://doi.org/10.1016/s0022-5347(17)65178-4.
- Boyce WH, King JS. Crystal matrix interrelations in calculi. J Urol 1959;81(3):351-65. https://doi.org/10.1016/s0022-5347(17)66024-5.
- Narula S, Tandon S, Baligar P, Singh SK, Tandon C. Human kidney stone matrix: Latent potential to restrain COM induced cytotoxicity and inflammatory response. Chem Biol Interact 2017(278):114-122. https://doi.org/10.1016/jxbi.2017.10.018.
- Finlayson B, Reid F. The expectation of free and fixed particles in urinary stone disease. Invest Urol 1978;15(6):442-448.
- Boyce WH, Sulkin NM. Biocolloids of urine in health and in calculous disease. III. The mucopro-tein matrix of urinary calculi. J Clin Invest 1956;35(10):1067-1079. https://doi.org/10.1172/JCI103361.
- Aggarwal KP, Tandon S, Naik PK, Singh SK, Tandon CD. Peeping into human renal calcium oxalate stone matrix: characterization of novel proteins involved in the intricate mechanism of urolithiasis. Plos One 2013;8(7):69916. https://doi.org/10.1371/ journal.pone.0069916.
- Pathak P, Singh SK,Tandon C. Mass spectrometric identification of human phosphate cytidyl-yltransferase 1 as a novel calcium oxalate crystal growth inhibitor purified from human renal stone matrix. Clin Chim Acta 2009;408(1-2):34-38. https://doi.org/10.1016/j.cca.2009.06.041.
- Khan SR, Kok DJ. Modulators of urinary stone formation. Front Biosci 2004(9):1450-82. https://doi.org/10.2741/1347.
- Kohri K, Nomura S, Kitamura Y, Nagata T, Yoshioka K, Iguchi M, et al. Structure and expression of the mRNA encoding urinary stone protein (Osteopontin). J Biol Chem 1993;268(20):15180-4.
- Yamate T, Umekawa T, Iguchi M, Kurita T, Kohri K. Detection of osteopontin as matrix protein in calcium-containing urinary stones. Hinyokika Kiyo 1997;43(9):623-7.
- Suzuki K, Tanaka T, Miyazawa K, Nakajima C, Moriyama M, Suga K, et al. Gene expression of prothrombin in human and rat kidneys: basic and clinical approach. J Am Soc Nephrol 1999;10(Suppl 14):S408-11.
- Kaneko K, Yamanobe T, Nakagomi K, Mawatari K, Onoda M, Fujimori S. Detection of protein Z in a renal calculus composed of calcium oxalate monohydrate with the use of liquid chromatographymass spectrometry/mass spectrometry following two-dimensional polyacrylamidegel electrophoresis separation. Anal Biochem 2004;324(2):191-6. https://doi.org/10.1016/j.ab.2003.09.018.
- Kaneko K, Yamanobe T, Onoda M, Mawatari K, Nakagomi K, Fujimori S. Analysis of urinary calculi obtained from a patient with idiopathic hypouricemia using micro area X-ray diffractometer and LC-MS. Urol Res 2005;33(6):415-21. https://doi.org/10.1007/s00240-005-0480-8.
- Shekarriz B, Stoller ML. Uric acid nephrolithiasis; current concepts and controversies. J Urol 2002;168(4Pt 2):1307-14. https://doi.org/10.1097/00005392-200210010-00003.
- Kaneko K, Kobayashi R, Yasuda M, Izumi Y, Yamanobe T, Shimizu T. Comparison of matrix proteins in different types of urinary stone by proteomic analysis using liquid chromatography-tandem mass spectrometry. Int J Urol 2012;19(8):765-72. https://doi.org/10.1111/j.1442-2042.2012.03005.x.
- McGeown MG. The urinary excretion of amino acids related to calculus disease. J Urol 1957;78(4):318-22. https://doi.org/10.1016/s0022-5347(17)66441-3.
- Nakano H, Yoshida H, Imamura K. Studies on free amino acid excretion patterns in upper urinary calculosis. 2. Urinary excretion levels of free amino acids in patients with upper urinary calculus. Nihon Hinyokika Gakkai Zasshi 1979;70(1):7-14. https://doi.org/10.5980/jpnjurol1928.70.1_7.
- Shaker YM, El-Hawary MFS, Zahran MM, Mostafa SO. Urine and calculus amino acids in the different types of urolithiasis. Urol lnt 1983;38(1):51-4. https://doi.org/10.1159/000280861.
- Lehmann H, Pollack L. The influence of amino acids on transfer of phosphate in muscle extract and on the solubility of magnesium and calcium salts. J Physiol 1942(100):17.
- Tang N, Skibsted LH. Calcium binding to amino acids and small glycine peptides in aqueous solu-tion: toward peptide design for better calcium bioavailability. J Agric Food Chem 2016;64(21):4376-89.
- Kohri K, Takada M, Katoh Y, Kataoka K, Iguchi M, Kurita T. Amino acids in urine and plasma of urolithiasis patients. Int Urol Nephrol 1989;21(1):9-16. https://doi.org/10.1007/BF02549896.
- Hodgkinson A. Oxalic Acid in Biology and Medicine. Academic Press, New York 1977;337 p.
- Thomas, WC Jr, Malagodi M H, Rennert OM. Amino acids in urine and blood of calculous patiens. Invest Urol 1981;19(2):115-8.
- Просянников М.Ю., Анохин Н.В., Голованов С.А., Сивков А.В., Аполихин О.И. Влияние рН мочи на процессы камнеобразования при уролитиазе. Экспериментальная и клиническая урология 2020(3):72-78. https://doi.org/10.29188/2222-8543-2020-12-3-72-78. [Prosyannikov M.Yu., Anokhin N.V., Golovanov S.A., Sivkov A.V., Apolikhin O.I. Influence of urine ph on stone formation processes in urolithiasis. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2020(3):72-78. (in Russian)]. https://doi.org/10.29188/2222-8543-2020-12-3-72-78.
- Srinivasan S, Kalaiselvi P, Varalakshmi P. Epitaxial deposition of calcium oxalate on uric acid rich stone matrix is induced by a 29 kDa protein. Clin Chim Acta 2006;364(1-2):267-74.
- Warpehoski MA, Buscemi PJ, Osborn DC, Finlayson B, Goldberg EP. Distribution of organic matrix in calcium oxalate renal calculi. Calcif Tissue Int 1981;33(3):211-22. https://doi.org/10.1007/BF02409440.
- Jensen ON. Interpreting the protein language using proteomics. Nat Rev Mol Cell Biol 2006;7(6):391-403. https://doi.org/10.1038/nrm1939.
- L0land KH, Bleie O, Borgeraas H, Strand E, Ueland PM, Svardal A, et al. The association between progression of atherosclerosis and the methylated amino acids asymmetric dimethylarginine and trime-thyllysine. PLoS One 2013;8(5):e64774. https://doi.org/10.1371/journal.pone.0064774.
- Servillo L, Giovane A, Cautela D, Castaldo D, Balestrieri ML. Where Does N(e)-trimethyllysine for the carnitine biosynthesis in mammals come from? PLoS One 2014;9(1):e84589. https://doi.org/10.1371/journal.pone.0084589.
- Zeisel SH, Corbin KD. Choline. Present Knowledge in Nutrition. 10th ed: John Wiley & Sons, Inc. 2012:405-418.
- Ueland PM. Choline and betaine in health and disease. J Inherit Metab Dis 2011;34(1):3-15. https://doi.org/10.1007/s10545-010-9088-4.
- Allen RH, Stabler SP, Lindenbaum J. Serum betaine, N,N-dimethylglycine and N-methyl-glycine levels in patients with cobalamin and folate deficiency and related inborn errors of metabolism. Metabolism 1993;42(11):1448-60. https://doi.org/10.1016/0026-0495(93)90198-w.
- Barth TK, Imhof A. Fast signals and slow marks: the dynamics of histone modifications. Trends Biochem Sci 2010;35(11):618-26. https://doi.org/10.1016/j.tibs.2010.05.006.
- Baggot PJ, Eliseo AJ, DeNicola NG, Kalamarides JA, Shoemaker JD. Pyridoxine-related metabolite concentrations in normal and Down syndrome amniotic fluid. Fetal Diagn Ther 2008;23(4):254-7. https://doi.org/10.1159/000123610.
- Kaelin A, Casez JP, Jaeger P. Vitamin B6 metabolites in idiopathic calcium stone formers: no evidence for a link to hyperoxaluria. Urol Res 2004;32(1):61-8. https://doi.org/10.1007/ s00240-003-0386-2.
- Tiselius HG. Excretion of 4-pyridoxic acid and oxalic acid in patients with urinary calculi. Invest Urol 1977l;15(1):5-8.


