Экспрессия молекулярных маркеров регуляторных лимфоцитов FOXP3 и TGF-?1 при вирусных инфекциях, аутоиммунных и онкологических заболеваниях
Автор: Олейник Е.К., Олейник В.М., Чуров А.В., Бахлаев И.Е., Ковчур П.И., Мясников А.А., Балашов А.Т.
Рубрика: Влияние экологии на внутренние болезни
Статья в выпуске: 1-5 т.11, 2009 года.
Бесплатный доступ
Проведено сравнительное исследование функциональной активности регуляторных CD4+CD25+ Т-клеток у пациентов с хронической вирусной инфекцией, онкологических больных и у лиц с аутоиммунной патологией. Изучен уровень экспресссии основных молекулярных маркеров лимфоцитов-супрессоров: транскрипционного фактора forkhead box P3 (FOXP3), трансформирующего фактора роста-?1 (TGF-1) и рецептора к TGF-?1 II-типа (TGF-?RII). Обнаружено существенное повышение экспрессии маркеров FOXP3 и TGF-?1 при онкологических заболеваниях и хронических вирусных инфекциях.
Молекулярные маркера, лимфоциты, инфекции
Короткий адрес: https://sciup.org/14899863
IDR: 14899863 | УДК: 612.017.1:616
Текст научной статьи Экспрессия молекулярных маркеров регуляторных лимфоцитов FOXP3 и TGF-?1 при вирусных инфекциях, аутоиммунных и онкологических заболеваниях
Регуляторные лимфоциты (Treg) обладают Предполагается, что есть разные пути ин-
супрессорными свойствами и участвуют в развитии иммунного ответа, обеспечивая поддержание иммунологической толерантности по отношению к аутоантигенам. Было показано изменение их функциональной активности при различных патологиях [2]. К основным свойствам Тге8-клеток человека относится способность подавлять функциональную активность лимфоцитов-эффекторов (CD4 + и CD8 + Т-лимфоцитов, NKT-клеток), снижая их пролиферативную активность и уровень секреции IL-2, IFN-y и других цитокинов [6]. Пока не найдены специфические маркерные молекулы Treg-лимфоцитов, что не позволяет определять их точное количество. Однако можно оценить степень активации супрессорных клеток по уровню секреции цитокинов-ингибиторов (TGF-e1, IL-10). Известен ряд молекул, которые чаще чем другие ассоциируются с Treg-лимфоцитами (CD25, FOXP3, GITR, CTLA-4) и определение уровня их экспрессии может указывать на текущий статус популяции регуляторных клеток [5].
Олейник Евгения Константиновна, доктор биологических наук, главный научный сотрудник.
Олейник Виктор Михайлович, доктор биологических наук, ведущий научный сотрудник
Чуров Алексей Викторович, аспирант
Бахлаев Иван Егорович, доктор медицинских наук, заведующий .курсом онкологии
Ковчур Павел Иванович, кандидат медицинских наук, ассистент
Мясников Александр Абрамович, кандидат медицинских наук, заведующий отделением
Балашов Александр Тимофеевич, доктор медицинских наук, профессор дукции и дифференцировки Treg, например из наивных CD4+-клеток, в результате конверсии CD4+CD25--лимфоцитов, а также из эффекторных Т-клеток вследствие хронической антигенной стимуляции. Последнее обстоятельство представляет особый интерес, так как для некоторых патологий характерно длительное присутствие антигена в организме. Это имеет место при аутоиммунных заболеваниях, хронических вирусных инфекциях и вероятно при развитии опухолей. Можно предположить, что в основе развития этих патологий лежит процесс формирования иммунной супрессии с участием антигенспецифических Treg-лимфоцитов.
Цель работы: определить функциональную активность T reg -клеток при аутоиммунных заболеваниях, хронических вирусных инфекциях и при опухолевом росте по уровню экспресссии цитокина TGF-P1, рецептора к TGF-в второго типа (TGF-eRII) и транскрипционного фактора FOXP3 в лимфоцитах периферии -ческой крови.
Материал и методы исследования. Материалом исследования служили лимфоциты периферической крови 33 онкологических больных в возрасте от 29 до 74 лет, 14 пациентов с хронической вирусной инфекцией (вирус папилломы человека 16 и 18 типов) в возрасте от 19 до 45 лет, 8 больных с аутоиммунными заболеваниями (ревматоидный артрит) в возрасте от 47 до 69 лет и 15 здоровых доноров в возрасте от 21 до 56 лет. Определение поверхностных маркеров лимфоцитов проводили методом проточной цито-флюориметрии. Лимфоциты выделяли из венозной крови центрифугированием на градиенте фиколл-верографин (плотностью 1,077 г/см3). Фенотипирование лимфоцитов прово-дили с использованием моноклональных антител CD3-ECD, CD4-PC7, CD25-PC5 (Beckman Coulter, США), FOXP3-PE (BD Pharmingen, США) и IgG2a-PC5, IgG1k-PE (BD Pharmingen, США) на проточном цитометре FC-500 (Beckman Coulter, США). Уровень экспрессии генов TGF-p1, TGF-eRII и FOXP3 определяли методом полимеразной цепной реакции в реальном времени, совмещенной с обратной транскрипцией (Real-Time RT-PCR). Суммарную РНК лимфоцитов выделяли из цельной крови с использованием набора реагентов «YellowSolve» («Клоноген»). Процедуру обратной транскрипции проводили с использованием случайных гексапраймеров и MMLV-обратной транскриптазы («Силекс»).
Амплификацию кДНК исследуемых генов, а также анализ продуктов амплификации в режиме реального времени проводили на приборе «iCycler Thermal Cycler» с использованием реакционной смеси с интеркалирующим красителем SYBR Green I («Синтол») и программного обеспечения «iQ5 Optical System
Software» версия 2.0 («Bio-Rad»). В качестве референсного гена использовали GAPDH. Итоговый уровень экспрессии генов TGF-ei, TGF-RII и FOXP3 рассчитывали относительно контроля, принимая величину экспрессии каждого исследуемого гена в контроле за единицу. Достоверность различий оценивали на основании критерия Манна-Уитни с использованием программного обеспечения Biostat 2007.
Результаты и обсуждение. Иммунофеноти-пирование лимфоцитов периферической крови показало, что у больных с опухолями отмечается увеличение численности CD4 + CD25 + клеток по сравнению со здоро-выми лицами (рис. 1). Содержание CD4 + CD25 + клеток в периферической крови здоровых лиц (n=5) варьировало в пределах от 1,5 до 4,7%, составляя в среднем 3,7±0,6%, а у больных (n=8) число периферических CD4 + CD25 + клеток изменялось в диапазоне от 2,1 до 8,9%, а в среднем составило 5,1 ±0,8%. Повышение количества циркулирующих на пе-риферии CD25 + Т-лимфоцитов при опухо-левом росте было отмечено и другими исследователями [7, 8].
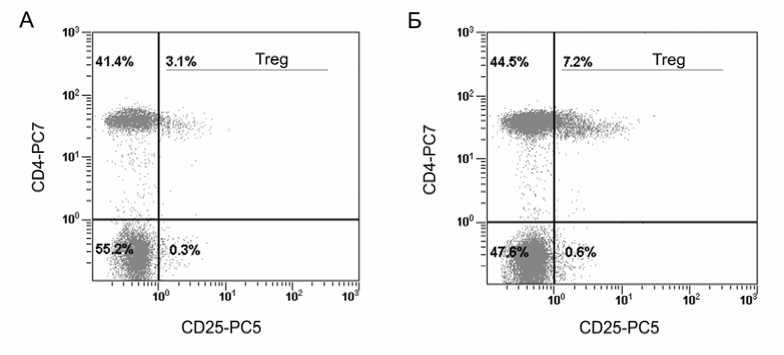
Рис. 1. Содержание CD4 + CD25 + Т-клеток (% от общего числа лимфоцитов) у здоровой женщины (А) и у больной раком молочной железы (Б).
Функциональную активность периферических T reg -клеток оценивали по уровню экспрессии генов TGF-p1, TGF-eRII и FOXP3. Известно, что CD4 + CD25 + клетки являются важными продуцентами TGF-вК а также в большом количестве экспрессируют мембранную форму этого цитокина [4]. TGF-e1 обладает супрессорной активностью, может ингибировать пролиферацию различных популяций лимфоцитов и блокировать дифференцировку CD8+ цитотоксических Т-клеток, CD4+ Т-хелперов [4]. Поэтому уровень экспрессии TGF-e1 был выбран нами в качестве основного показателя функционального состояния популяции T reg -клеток. Уровень относительной экспрессии TGF-e1 при опухолевом росте оказался значительно выше контрольного
(1,34±0,05, p<0,05) (рис. 2А). Величина экспрессии TGF-e1 у больных с хронической вирусной инфекцией была примерно на том же уровне (1,30±0,10; p<0,05), что и у онкологических больных. В то же время у пациентов с аутоиммунными патологиями отмечено лишь незначительное повышение количества мРНК TGF-e1 по сравнению со здоровыми лицами (1,11±0,15).
Показано [4], что CD4 + CD25 + клетки характеризуются конститутивной экспрессией мембранного сигнального рецептора TGF-eRII. Величина экспрессии TGF-eRII возрастает при активации нерегуляторных CD4 CD25 Т-лимфоцитов, что свидетельствует о важной роли этого рецептора в осуществлении функций Treg, так как взаимодействие TGF-e1
со своим рецептором на мембране клетки-мишени может представлять собой один из механизмов функционирования CD4+CD25+ супрессоров. В связи с тем, что экспрессия TGF-pRII в определенной степени связана с развитием иммунной супрессии, можно было ожидать, что содержание мРНК TGF-pRII окажется выше при хронических вирусных инфекциях и онкопатологиях. Однако анализ полученных нами данных не выявил статистически значимых отличий по величине экспрессии гена TGF-pRII во всех исследованных группах. Можно отметить, что наиболее высокий уровень мРНК TGF-pRII был в группе больных с опухолями (1,16+0,05).
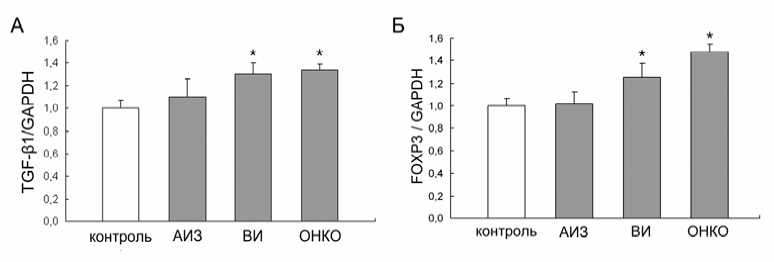
Рис. 2. Уровень экспрессии TGF-pi (А) и FoxP3 (Б) в лимфоцитах периферической крови (M+m).
АИЗ — больные с аутоиммунными заболеваниями; ВИ - лица с хронической вирусной инфекцией; ОНКО — пациенты с опухолями различной локализации. * - различия достоверны по сравнению с контролем, p<0,05.
Одним из основных показателей состояния популяции T reg -лимфоцитов является величии-на экспрессии FOXP3. Ген FOXP3 и его продукт Scurfin по-видимому имеют решающее значение в процессе дифференцировки Treg-клеток. Наличие продукта этого гена сопряжено с высоким уровнем экспрессии CD25. Но особое значение имеет тот факт, что экспресс -сия FOXP3 ассоциирована с проявлением супрессорной активности T reg -лимфоцитов. В связи с этим, в настоящее время большинство исследователей рассматривают FOXP3 в качестве основного маркера регуляторных лимфоцитов [2]. Изучение содержания мРНК транскрипционного фактора FOXP3 в лимфоцитах периферической крови онкологических больных показало, что уровень экспрессии гена FOXP3 у больных с опухолями оказался заметно выше, чем в контрольной группе (1,45+0,10; p<0,05) (рис. 2Б). В то же время у лиц с хронической вирусной инфекцией относительное содержание мРНК гена FOXP3 составило 1,25+0,12 (p<0,05), а при аутоиммунной патологии величина экспрессии FOXP3 оказалась на уровне контроля (1,02+0,10).
Изучение экспрессии TGF-p1, TGF-pRII, FOXP3, CD25 в лимфоцитах периферической крови больных с хронической вирусной инфекцией, аутоиммунными и опухолевыми заболеваниями показало, что наиболее высокая экспрессия молекулярных маркеров Treg (TGF-Р1, FOXP3) характерна для онкологических больных. В меньшей степени эта тенденция выражена при вирусных инфекциях.
Выводы: установлено, что наиболее значительная роль T reg -клеток в развитии иммунной супрессии проявляется при онкологических заболеваниях и хронических вирусных инфекциях.
Работа выполнена в рамках Программы Президиума РАН «Фундаментальные науки -медицине» и при финансовой поддержке РФФИ (грант № 08-04-98838).
Список литературы Экспрессия молекулярных маркеров регуляторных лимфоцитов FOXP3 и TGF-?1 при вирусных инфекциях, аутоиммунных и онкологических заболеваниях
- Воробьев, А.А. Роль клеток-регуляторов CD4+CD25+ в развитии хронических инфекционных заболеваний/А.А. Воробьев, С.Н. Быковская, Е.П. Пашков, А.С. Быков//Вестник Российской АМН. -2006. -№9-10. -С. 24-29.
- Ярилин, А.А. Естественные регуляторные Т-клетки и фактор FOXP3/А.А. Ярилин, А.Д. Донецкова//Иммунология. -2006. -№3. -С. 176.-188.
- Chatila, T.A. Role of regulatory T cells in human diseases//J. Allergy. Clin. Immunol. -2005. -V. 116. -P. 949-959.
- Chen, W. TGF-β: the missing link in CD4+CD25+ regulatory T cell-mediated immunosuppression/W. Chen, S.M. Wahl//Cytokine Growth Factor Rev. -2003. -V. 14. -P. 85-89.
- Knutson, K.L. CD4 regulatory T cells in human cancer pathogenesis/K.L. Knutson, M.L. Disis, L.G. Salazar//Cancer Immunol. Immunother. -2007. -V. 56. -P. 271-285.
- Li, M.O. Transforming growth factor-β regulation of immune responses/M.O. Li, Y.Y. Wan, S. Sanjabi et al.//Annu. Rev. Immunol. -2006. -V. 24. -P. 99-146.
- Ling, K.L. Increased frequency of regulatory T cells in peripheral blood and tumour infiltrating lymphocytes in colorectal cancer patients/K.L. Ling, S.E. Pratap, G.J. Bates et al.//Cancer Immunity. -2007. -V. 7. -P. 7.
- Okita, R. CD4+CD25+ regulatory T cells in the peripheral blood of patients with breast cancer and non-small cell lung cancer/R. Okita, T. Saeki, S. Takashima et al.//Oncol. Rep. -2005. -V. 14. -P. 1269-1273.


