Электрофоретические свойства белков при переработке семян в производстве растительных масел
Автор: Мирзоев А.М., Дмитриченко М.И.
Журнал: Технико-технологические проблемы сервиса @ttps
Рубрика: Методические основы совершенствования проектирования и производства технических систем
Статья в выпуске: 1 (27), 2014 года.
Бесплатный доступ
В статье исследуются электрофоретические свойства белков при переработке семян подсолнечника и сои в производстве растительных масел. Установлено, что наибольшие изменения этих свойств наблюдаются на этапе жарения мятки.
Белки, масличные семена, мезга, семена подсолнечника, полиакриламидный гель, производство, растительные масла, соя, электрофорез
Короткий адрес: https://sciup.org/148186147
IDR: 148186147 | УДК: 664.346
Текст научной статьи Электрофоретические свойства белков при переработке семян в производстве растительных масел
Объектами исследования служили чистосортные семена подсолнечника («ВНИИМК – 6540» и «Луч») и сои («Комсомолец» и «ВНИИМК – 8»), а также продукты переработки семян подсолнечника и сои в производстве растительных масел по схеме «форпрессова-ние-экстракция»: мятка (измельченное ядро семян с незначительным количеством лузги), мезга (обжаренная мятка), жмых форпрессо-вый, лепесток (материал, из которого извлекают масло экстракцией с использованием жирорастворителей : гексана или бензина), шрот после удаления растворителя (шрот – это почти полностью обезжиренный материал в результате экстрагирования масла).
Для аналитического разделения белков исследуемого материала применяли диск-электрофорез – метод разделения, при котором используется неоднородная разделяющая система с полиакриламидным гелем в качестве носителя. Электрофорез белков в полиакриламидном геле – метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью (функцией длины полипептидной цепочки, или молекулярной массы, а также укладки белковой молекулы, посттрансляционных модификаций и других факторов).
Электрофоретическая подвижность биополимеров в геле зависит от ряда параметров. Скорость миграции пропорциональна заряду молекулы, и в свободной жидкости молекулы с одинаковым удельным зарядом мигрируют с равной скоростью. В случае разделения в среде, имеющей жесткую пространственную матрицу, происходит сегрегация за счет трения о гель. Сила трения зависит от пространственной конфигурации молекулы, в том числе от ее размера. Разработано большое количество модификаций электрофореза белков в полиакриламидном геле для решения разных задач и для различных белков и пептидов [1]. Наиболее эффективным вариантом электрофореза в полиакриламидном геле является диск-электрофорез (от английского discontinuous -разрывный, т.е. используется гель, состоящий из двух частей), который и использовался в данной работе для аналитического разделения белков исследуемого материала.
При диск-электрофорезе используют пары буферов разного состава и с разными значениями рН, а носитель состоит из отдельных слоев геля, отличающихся друг от друга размерами пор. При разделении растворимых компонентов смесь сначала концентрируется в узкой полосе крупнопористого геля, а затем в мелкопористом геле ее компоненты разделяются по величине, форме и заряду молекул.
Электрофорез широко применяется в коллоидной химии, биохимии, биофизике, медицине и различных областях техники. Весьма широко пользуются электрофоретическими методами в различных областях пищевой промышленности для обнаружения фальсификации тех или иных пищевых продуктов , а также в кормопроизводстве для оценки качества белковых кормов. В частности, в нашей стране с 1 января 2010 года действуют национальные стандарты на определение содержания соевого и горохового белков с использованием капиллярного электрофореза в сухом молоке [2] и на определение массовой доли растительного белка методом электрофореза в мясных продуктах [3], а с 01 июля 2013 года ГОСТ 31480-2012 « Комбикорма, комбикормовое сырье. Определение содержания аминокислот методом капиллярного электрофореза [4].
В случае определения растительного белка в мясных продуктах/3/ метод основан на тепловой денатурации и экстракции белков из мясных фаршей, состоящих из смесей животных и растительных белков, с последующим электрофоретическим разделением экстрагированных белковых фракций в полиакриламидном геле. Массовая доля соевых белков в смеси определяется по сумме площадей пиков, соответствующих на денситограмме белковым зонам с молекулярными массами 65000-75000, которая пропорциональна содержанию соевой добавки в мясе и мясных продуктах
Цель настоящего исследования – характеристика изменений фракционного состава водорастворимых белков перерабатываемого материала в производстве растительных масел с тем, чтобы иметь определенное представление о характере качественных изменений электрофоретических свойств белков, что важно, в частности, для их переваривания (ферментативного гидролиза).
Изучение фракционного состава белков масличных семян в процессе их переработки в производстве растительных масел методами грубого фракционирования, которые прочно вошли в практику определения степени денатурации, при исследовании белков как объекта действия протеолитических ферментов, недостаточно. При этом необходимо знать, в каком состоянии находятся эти белки внутри каждой фракции - водной, щелочной, солевой. Электрофоретические свойства белков материала, в первую очередь, их заряд, величина, гетерогенность небезразличны для протеаз.
Известно, что электрофорез дает представление о степени возможной атакуемости протеолитическими ферментами белковых молекул. В частности, наряду с классическими методами оценки качества белков кормовых шротов по их растворимости в различных растворителях пользуются также и электрофоретическими методами . Уменьшение числа фракций в электрофореграммах свидетельствует об ухудшении питательных достоинств белковых кормов.
На рисунках 1 и 2 приведены электрофореграммы однотипных по растворимости белков семян подсолнечника сортов «ВНИИМК – 6540» и «Луч», семян сои сортов « Комсомолец» и «ВНИИМК – 8», а также белков из заводской смеси семян сои и подсолнечника на различных этапах переработки, начиная с мятки при поступлении в жаровни фор- прессов и завершая шротом после сушки в шнековых испарителях.
Наиболее выраженное изменение электрофоретических свойств белков в ходе переработки семян подсолнечника наблюдается при жарении мятки для приготовления мезги (рис. 1). Дальнейшие операции в совокупности дают меньшие изменения. Теряют подвижность почти все белки с наиболее высокой электрофоретической подвижностью, то есть белки, имеющие более низкую молекулярную массу. Согласно К.Грину и Г. Нейрату, наиболее устойчивы к влаготепловым воздействиям, т.е. к денатурации, белки, имеющие малую молекулярную массу. Иначе говоря, белки с высокими значениями электрофоретической подвижности денатурируются медленнее, чем белки с высокой молекулярной массой и низкой электрофоретической подвижностью. Согласно приведенным рисункам, степень такой устойчивости, по-видимому, более или менее выравнивается при воздействии высоких температур длительное время, что и имеет место в производстве растительных масел.
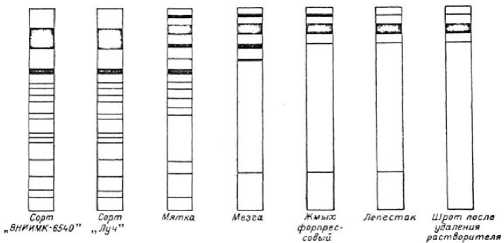
Рисунок 1. Электрофоретическое поведение белков при переработке семян подсолнечника по схеме форпрессование – экстракция
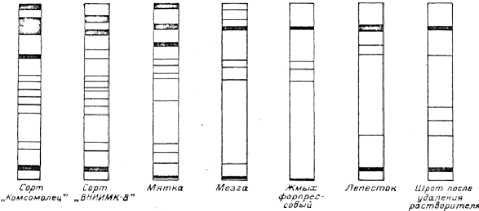
Рисунок 2. Электрофоретическое поведение белков в процессе переработки семян сои по схеме форпрессование – экстракция.
Представленные на рис. 1 электрофореграммы белков семян подсолнечника, подвергнутых механическим и влаготепловым воздействиям, показывают, что белки в основной массе сосредоточены в зоне с нулевой или относительно низкой электрофоретической подвижностью. По одной фракции с относительно высокой электрофоретической подвижностью остается в мезге, выходящей из жаровен форпрес-сов, форпрессовом жмыхе и лепестке. А в шроте наблюдается полное отсутствие. В целом, такая же картина наблюдается и для сои до операции удаления растворителя из шрота (рис.2).
Таким образом, процесс денатурации белков масличных семян в производстве растительных масел сопровождается уменьшением числа электрофоретических фракций. При денатурации относительная электрофоретическая подвижность белков фракций не изменяется; существуют различные механизмы «электрофоретической гомогенизации» для белков семян сои и подсолнечника.
Отдельные ученые объясняют механизм «электрофоретической гомогенизации» агрегацией белков отдельных фракций. При агрегации образуются растворимые комплексы, содержащие молекулы из отдельных агрегированных белковых фракций в пропорции, приближающейся к относительным количествам этих фракций в исходной вытяжке.
Е. Медведева отмечает, что по слиянию электрофоретических фракций обычно судят о присутствии в растворе денатурированных белков [5].
На наш взгляд, утверждения о слиянии фракций не имеют под собой достаточных оснований. Даже визуальное наблюдение показывает, что в нулевой (или очень близкой к ней) фракции при денатурации не замечается повышения концентраций белковых веществ.
В связи с этим, уменьшение числа фракций белков исследуемого материала может быть, на наш взгляд, объяснено следующим образом. Во-первых, возможно, что те фракции белков, которые полностью «исчезли» в ходе влаготепловых воздействий на материал, вследствие денатурации полностью потеряли свою растворимость в растворителе, применявшемся для их извлечения из перерабатываемого материала. Во-вторых, по той же причине они, возможно, не потеряв растворимости, лишились исходной электрофоретической подвижности из-за «изменений в движущихся молекулах» , т.е. величины заряда и молекулярной массы белковых молекул.
Как следует из рис.1, электрофореграммы белков семян подсолнечника коллекционных сортов «ВНИИМК – 6540» и «Луч» весьма близки. Почти равным является число электрофоретических фракций однотипных по растворимости белков чистосортных семян и заводской мятки, что может быть свидетельством того, что в процессе измельчения заводского ядра на вальцовых станках в продукте происходят незначительные денатурационные изменения под влиянием механических и вызван- ных ими температурных воздействий на перерабатываемый материал.
После операции жарения мятки существенных изменений в количестве электрофоретических фракций исследуемых белков не наблюдается; форпрессовый жмых и лепесток имеют одинаковую картину электрофореграмм. Однако в их фореграммах на одну фракцию меньше, чем в белке из мезги при выходе из жаровен форпрессов, и на одну больше в сравнении со шротом при выходе из шнековых испарителей.
Если сравнивать картины изменения электрофореграмм перерабатываемого материала и активности протеолитических ферментов того же материала [6], то следует отметить, что в обоих случаях наибольшие изменения наблюдаются на этапах приготовления мезги и сушки шрота, а наименьшие – на этапах приготовления мятки из заводского ядра и лепестка из форпрессового жмыха.
Выводы
-
1. В ходе переработки семян в производстве растительных масел происходит изменение электрофоретических свойств белков. Наиболее заметные изменения этих свойств наблюдаются в процессе жарения мятки.
-
2. По-видимому, главной причиной изменения электрофоретических свойств белков семян в производстве растительных масел является их тепловая денатурация


