Электрофорез белков биоконсервированной крови
Автор: Бубеев А.Т., Данилова Т.Е., Цыренов В.Ж.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 1 (32), 2011 года.
Бесплатный доступ
Методом электрофореза исследовано состояние белков крови убойных животных при обработке ее высококислотной молочной сывороткой. Показано, что в результате автолитических процессов и воздействия молочной кислоты наблюдается денатурация белков крови.
Биоконсервированная кровь убойных животных, молочная сыворотка, белки плазмы, lactobacillus acidophilus 20т
Короткий адрес: https://sciup.org/142142282
IDR: 142142282 | УДК: 637.661:66.099.4:543.545
Текст научной статьи Электрофорез белков биоконсервированной крови
Одним из интенсивных путей расходования компонентов аминокислотного пула организма является синтез белков плазмы крови, принимающих участие в поддержании рН, вязкости, коллоидноосмотического давления, уровня катионов крови, транспорте гормонов, липидов, жирных кислот, пигментов, жирорастворимых витаминов, свертывании крови, иммунных и других процессах.
Плазма крови содержит свыше 300 белков. Большинство белков плазмы - гликопротеины, количество углеводных компонентов в их составе варьирует от 1%, например, в альбуминах до 40% - а 1 -глобулинах. Белки плазмы содержат дисульфидные связи и небольшое количество свободных тиоловых (-SH) групп: предполагают, что это имеет большое значение для предотвращения денатурации белков в плазме, которая возможна вследствие высокого парциального давления кислорода.
Исследования белков плазмы организма, кроме специфической нозологической информации, дают определенное представление о состоянии белкового обмена в целом. Исследованию подлежат количественные и качественные характеристики белкового состава плазмы.
Концентрация белков плазмы определяется тремя основными факторами: скоростью синтеза, скоростью метаболизма и объемом жидкости, в котором распределены белки.
В настоящее время различными методами можно получить от 5 до 100 фракций белков плазмы [1].
С помощью электрофореза выделяют 6 стандартных фракций: альбумины и четыре фракции глобулинов (α 1 -, α 2 -, β 1 -, β 2 -, и γ- ). Соотношение этих основных белковых фракций в сыворотке крови следующее (%): альбумин – 56-60, α 1 -глобулин – 4-5, α 2 -глобулины - 8, β-глобулины – 12, фибриноген – 4, γ- глобулины – 16 [2].
Каждая фракция содержит многочисленные индивидуальные белки, среди которых имеются белки как свертывающей, так и противосвертывающей систем.
Цель работы: исследование влияния компонентов молочной сыворотки на белковую систему биоконсервированной крови.
Задачи эксперимента:
-
1. Провести электрофоретические исследования динамики состояния биоконсервированной крови в динамике хранения.
-
2. Установить наличие изменений в белковой системе биоконсервированной крови.
-
3. Сделать сравнительный анализ протеинограмм молочной сыворотки, биоконсервированной и стабилизированной крови.
Объекты исследования: Кровь, стабилизированная фосфатами (КСФ), биоконсервированная кровь (БК), высококислотная молочная сыворотка (МС), полученная в результате ферментирования обезжиренного молока культурой Lactobacillus acidophilus.
Методы исследования: электрофоретические исследования проводили на автоматическом анализаторе крови и ее компонентов фирмы Cormay [3].
Результаты эксперимента . БК получали путем смешивания изъятой из кровеносных сосудов крови убойных животных с ферментированной сывороткой. Стабилизированную таким образом кровь хранили в течение 20 суток при температуре плюс 4 – плюс 60С. Результаты электрофоретических исследований белковой системы биоконсервированной крови представлены в таблице 1 и на рисунках 1-6.
Из таблицы 1 и рисунков 1,2,3,4,5 видно, что фракции альбуминов, α 1 -, α 2 -, β 2 -, γ- глобулинов имеют тенденцию к уменьшению. В данном случае возможен протеолиз белков собственными ферментами. Вероятно, и молочная кислота оказывает определенное влияние на распределение белковых фракций.
В норме альбумин синтезируется в печени и его период полураспада составляет около 20 суток. Следовательно, постепенное уменьшение фракции альбуминов в изучаемой системе связано с отсутствием процессов пополнения их пула (процессов синтеза) и воздействием молочной кислоты, что существенно влияет на скорость их естественного распада.
Таблица 1
Изучение белковых фракций БК в процессе хранения при 4 - 6ºС
|
Наименование фракции |
Содержание белковых фракций, г/л |
||||||
|
МС |
КСФ |
БК, сроки хранения, сут |
|||||
|
0 |
6 |
13 |
17 |
20 |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
альбумины |
1,25±0,21 |
5,6±0,55 |
12,36± 0,91 |
11,40± 1,10 |
3,51± 0,59* |
2,78± 0,55* |
0,02± 0,01* |
|
α1-глобулины |
0,52±0,020 |
0,08±0,01 |
5,61± 0,78 |
1,11± 0,18* |
0,10± 0,02* |
0,13± 0,02* |
0,66± 0,07* |
|
α2-глобулины |
0,25±0,050 |
0,44±0,06 |
6,67± 0,32 |
1,79± 0,06* |
11,7± 0,64* |
0,65± 0,07* |
0,29± 0,075* |
|
β1-глобулины |
0,38± 0,040 |
15,97±2,72 |
5,3± 1,05 |
2,02± 0,016* |
14,2± 0,38* |
29,2± 5,40* |
38,13± 0,88* |
|
β2-глобулины |
1,07± 0,025 |
68,90±8,90 |
21,9± 3,89 |
2,36± 0,36* |
1,27± 0,09* |
1,56± 0,16* |
1,10± 0,13* |
|
γ- глобулины |
1,86±0,56 |
6,35±2,30 |
10,6± 10,36 |
9,66± 1,62 |
1,70± 0,25* |
2,70± 0,09* |
2,77± 0,29* |
|
белок |
5,3±0,18 |
97,40±11,12 |
62,1± 11,9 |
28,40± 1,50* |
32,5± 2,90* |
37,0± 1,17* |
46,20± 1,80* |
Обозначение: * - достоверно при р ≤ 0,05
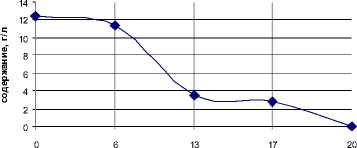
время, сут ал ьбумины
Рис. 1. Изменения содержания альбуминов в БК в процессе хранения при t =4 - 6˚С
Анализируя данные таблицы 1, можно обнаружить наличие в процессе хранения белковой системы БК локального увеличения α 1 -глобулинов (рис. 3) и стабильного возрастания - β 1 -глобулинов (рис. 4). Вместе с тем параллельно наблюдается общая тенденция изменения фракций α 1 -, α 2 -глобулинов в сторону уменьшения.
Учитывая тот факт, что кровь в присутствии молочной сыворотки не свертывается, можно предположить образование комплексов между белками фракций α 1 -, α 2 -глобулинов, а именно α 1 -антитрипсином и α 2 -макроглобулином, с плазминогеном.
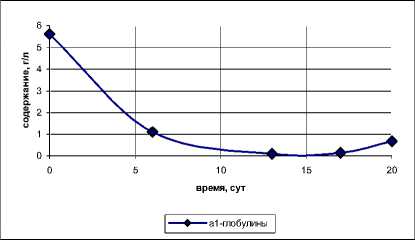
Рис. 2. Изменения содержания α 1 -глобулинов в БК в процессе хранения при t =4 - 6˚С
Кроме того, известно, что в состав а 1 -глобулинов входят гаптоглобины, которые составляют 25% от всего их содержания. Эта группа белков плазмы крови связывает свободный гемоглобин с образованием комплексов. В живых организмах данный комплекс метаболизируется в ретикуло-эндотелиальной системе, что необходимо для предотвращения потерь железа и повреждения почек гемоглобином [1]. Следовательно, низкие уровни α 1 -глобулинов могут быть обусловлены также снижением в их составе гаптоглобинов, которые при гемолизе связывают гемоглобин. Наличие гемолиза в изучаемой системе обнаружено на 4-е сутки.
Резкое увеличение α 2 -глобулинов (рис. 3) на 13-е сутки хранения, возможно, связано и с автолизом клеток Lactobacillus acidophilus. Снижение клеток Lactobacillus acidophilus установлено на 5-е сутки.
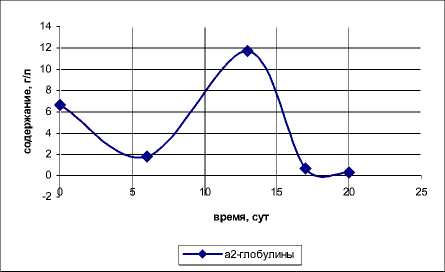
Рис. 3. Изменения содержания α 2 -глобулинов в БК в процессе хранения при t =4-6˚С
Как уже указывалось выше, в процессе хранения имеет место стабильное увеличение содержания только фракции β 1 - глобулинов (рис. 4).
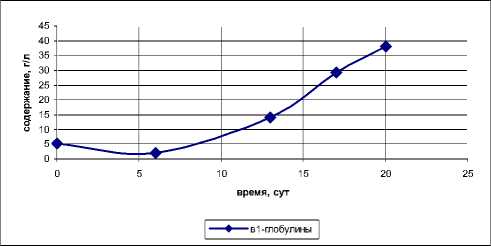
Рис.4. Изменения содержания β 1 -глобулинов в БК в процессе хранения при t =4 - 6˚С
К фракциям β 1 -глобулинов относятся трансферрин, гемопексин [4], которые характеризуют интенсивность процессов распада гемоглобина. Так, in vivo гемопексин (β-глобулин) связывает гем и предотвращает его выделение почками. Сродство гемопексина к гему значительно выше, чем у альбумина. Комплекс гем-гемопексин поступает из крови в печень, где освобождается Fe3+ для образования гемоглобина [1]. Трансферрин, связывая свободный гем, также поступает на деструкцию или ресинтез гемоглобина. То есть накопление и устойчивость гем- β-глобулиновых комплексов также способствует высокому уровню данной фракции (β 1 -глобулинов) к 20 суткам хранения БК.
Снижение фракции β 2 - глобулинов (рис. 5) согласуется с результатами проведенных исследований коагуляционной и фибринолитической систем БК [5], которые показали достоверное уменьшение содержания основного белка свертывания крови - фибриногена. Данный белок имеет заряд и молекулярную массу, позволяющие отнести его к фракциям β 2 - глобулинов.
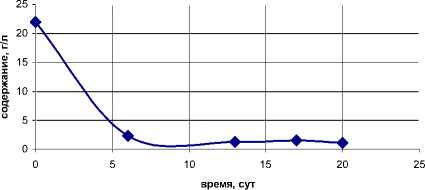
в2-глобулины
Рис. 5. Изменения содержания β 2 -глобулинов в БК в процессе хранения при t=4-6˚С
Наиболее значительная в количественном отношении фракция белков молочной сыворотки – это фракция иммуноглобулинов. Снижение исходного содержания γ- глобулинов молочной сыворотки и БК в процессе хранения свидетельствует, вероятно, об их связывании с антигенными детерминантами клеток крови и последующей биодеградации комплексов (рис. 6).
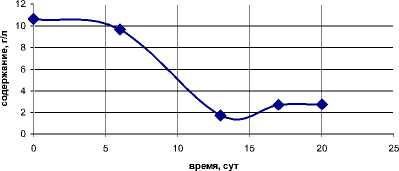
y-глобулины
Рис. 6. Изменения содержания γ -глобулинов в БК в процессе хранения при t =4 - 6˚С
Таким образом, исследования электрофоретической подвижности белков БК показали следующие изменения белкового профиля: уменьшение альбуминов и большинства глобулиновых фракций, за исключением фракции β 1 -глобулинов, которая претерпевает резкое избирательное увеличение.
Выводы
-
1. Определена динамика распределения общего белка биоконсервированной крови по отдельным белковым фракциям.
-
2. Установлено изменение профиля электрофореграмм биоконсервированной крови под действием компонентов высококислотной сыворотки.
-
3. Показано наличие процессов комплексообразования и денатурации белков биоконсервирован-ной крови.


