Электронно-микроскопические особенности изменений в надпочечниках и щитовидной железе при хронической гипоксии
Автор: Ягубова С.М.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 5 (53), 2021 года.
Бесплатный доступ
Целью исследования было изучение характерных свойств ультраструктурных изменений в клеточном и внеклеточном матриксе надпочечников и щитовидной железы при хронической гипоксии.Материалы и методы. В ходе исследования использовали щитовидную и надпочечную железу здоровых взрослых самцов белых крыс массой 180-200 г. Применялись анатомические, гистологические, гистохимические, электронно-микроскопические и морфометрические методы исследования.Результаты. Мы обнаружили, что реакция клеток щитовидной железы и надпочечников на гипоксию различна. Так, поскольку процессы пролиферации в клетках щитовидной железы происходят быстрее и раньше, все ткани в щитовидной железе восстанавливаются на 15-й день эксперимента, а в надпочечнике - только на 30-й день. Это можно расценивать как более высокую степень чувствительности надпочечников к гипоксии, которая является более сильным стрессовым фактором, чем для щитовидной железы.Выводы. Структуры щитовидной железы более быстро адаптируются к длительной гипоксии и отвечают на это ультраструктурной перестройкой - гиперплазией, гипертрофией и пролиферацией тироцитов.
Электронная микроскопия, хроническая гипоксия, корковое и мозговое вещество надпочечников, фолликулы и тиреоциты щитовидной железы
Короткий адрес: https://sciup.org/143177471
IDR: 143177471 | УДК: 636.2.053.055-620.187.2 | DOI: 10.20340/vmi-rvz.2021.5.MORPH.1
Текст научной статьи Электронно-микроскопические особенности изменений в надпочечниках и щитовидной железе при хронической гипоксии
УДК 636.2.053.055-620.187.2
Возможность адаптации (приспособления) к гипоксии известна с давних времен [1, 2]. В отличие от острого, краткосрочного гипоксического воздействия, когда в компенсации недостатка кислорода основную роль играют усиление дыхания, кровообращения, выброс эритроцитов из их депо в кровь, т.е. физиологические механизмы, ответственные за поддержание скорости поэтапной доставки кислорода к местам его утилизации и парциального давления кислорода в артериальной крови и на тканевых уровнях выше их критических значений [3–6]. При длительном гипоксическом воздействии адаптацию к недостатку кислорода осуществляют как системные, органные, так и тканевые механизмы, действующие на клеточном, субклеточном, мембранном и молекулярном уровнях и на уровне генного аппарата. Все эти механизмы ответственны за адаптацию к гипоксии целостного организма [7–9].
Адаптация к гипоксии на уровне субклеточных структур, клеток, молекулярных механизмов происходит за счет [10]:
-
а) увеличения количества митохондрий и крист в митохондриях;
-
б) синтеза дыхательных белков и активации ферментов дыхательной цепочки митохондрий, способствующих повышению аэробной производительности организма и повышению порога аэробного обмена;
-
в) изменения кислородтранспортных свойств гемоглобина, повышения его содержания в крови, появления новых фракций гемоглобина в крови, изменяющих способность гемоглобина переносить кислород от легких к тканям, появления форм фетально-
- го гемоглобина, обладающего большей способностью связывать кислород в легких и отдавать его к тканям, одним из следствий чего является экономизация работы сердца;
-
г) увеличения содержания миоглобина в сердечной и скелетных мышцах.
Подытоживая результаты, имеющиеся в литературе, а также анализируя механизмы адаптации к гипоксии в целом, можно прийти в заключению, что защита организма организуется на системном, органном, тканевом, клеточном, субклеточном, мембранном и молекулярных уровнях, а также на уровне генного аппарата [11]. Усиливается функция эндокринных желез, увеличивается содержание гормонов в крови [12].
Целью исследования было изучение характерных свойств ультраструктурных изменений в клеточном и внеклеточном матриксе надпочечников и щитовидной железы при хронической гипоксии.
Материалы и методы исследования
На основании этических правил комиссии по этическим правилам и Комитета по биоэтике при МЗ Азербайджанской Республики (протокол № 31 от 21.04.2008 г.) в отделах фармакологии, экспериментальной хирургии и в лаборатории электронной микроскопии АМУ проведены исследования на здоровых самцах лабораторных белых крыс весом 180–200 грамм. Выращенных в особых условиях животных содержали под контролем в стандартных условиях вивария.
Подопытные животные были разделены на две группы – контрольные и подопытные. На подопытных животных была создана модель хронической гипоксии. С этой целью подопытные животные помещались в специальную барокамеру с вентиляцией (Ca(OH)2 81 % + NaOH 3,4 % + H2O 15,6 %) 5 раз в неделю, каждый день, через каждые 2 часа при температуре 19–20 °C, атмосферном давлении, соответствующем давлению на высоте 2000–3000 метров над уровнем моря. Эксперименты проводились в самое светлое время дня, около 10:00– 15:00. Животные, входящие в контрольную группу, содержались в стандартных условиях вивария.
На 15-й и 30-й день эксперимента как анестетик в брюшную полость вводили 2–2,5 % тиопентал-натрий и животные были декапитированы. С помощью специальных инструментов (ланцет, пинцет, ножницы, стереоскопический микроскоп MBS-2, бинокулярная лупа и т.д.) выполняли тотальный срединний разрез, щитовидная железа и надпочечники животных были извлечены. После макроскопической оценки материалов исследования был проведен гистологический и электронно-микроскопический осмотр, полученные морфометрические показатели вычисляли с помощью компьютерной программы статистика 10 (StatSoft.Inc.) (статистически изучали W-Wilcoxon test (paired samples) и сравнивали с контрольной группой).
Материалы исследования были разделены на мелкие фрагменты и постфиксиро-ваны в течение двух часов (эти растворы были изготовлены в фосфатном буфере (pH = 7,4)) на 2 % глютаральдегида, 2 % параформальдегида и 0,1 % растворе пикриновой кислоты, 1 % растворе осмиевой кислоты. Затем обезвоживание фрагментов проводилось в растворах этилового спирта 50°, 70°, 80°, 90° (30 минут в каждом), 96° и 100° (1 час в каждом), и изготовлялись специальные кусочки. Для изготовления блоков использовались смолы Araldit-Epon и spur.
Из соответствующих блоков были изготовлены полутонкие стезы толщиной 1–2 мкм и ультратонкие срезы толщиной 70–100 нм (в ультртоме LCB-III, Leica EM
UC7) и перенесены на стекло. На полутон-кие срезы добавляли по 1 капле раствора натриевой соли, 1 % борной кислоты и 1 % раствор метиленового синего, несколько раз проводили над спиртовой лампой. Препараты промывали дистиллированной водой и сушили после окрашивания 0,5 % раствором метиленового синего.
На высушенные образцы добавляли 1–2 капли раствора энтеллана, исследовали после того, как они были покрыты покровными стеклами с помощью Канадского бальзама. После окрашивания метиленовым синим полутонкие срезы были окрашены 1 % раствором Азура II, а затем 0,1 % раствором щелочного фуксина, растворимого в 5 % этиловом спирте, таким образом получены ультратонкие срезы. Препараты были исследованы микроскопом «Олимпус BH-41», сняты микрофотографии с помощью цифровой фотокамеры микроскопа под разными увеличениями.
С целью проведения электронного микроскопического обследования серебристые и золотистые ультратонкие срезы (70–100 hм) окрашивали последовательно на 2 % уранил-ацетате, 0,6 % чистого свинцового цитрата, изготовленного в растворе 0,1 n NaOH. Затем были сняты электроно-граммы в трансмиссионном электронном микроскопе JEM-1400 (JEOL-Japan) (под напряжением 80–120 кВ).
Результаты и обсуждение
При электронно-микроскопическом исследовании препаратов, полученных от животных контрольной группы, ясно видны ад-реноциты надпочечников, фолликулы щитовидной железы, тироциты фолликулов, базальная мембрана, охватывающие клетки мембранные складки. Привлекает внимание тесная связь многочисленных микроворсинок, покрытых тонкой капсулой на тироци-тах, и друг с другом, а также микроворсинками соседних триоцитов (рис. 1).
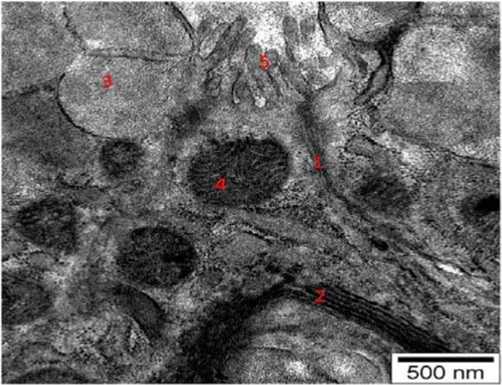
Рисунок 1. Электронная микрофотография структурных элементов нормальной щитовидной железы. ТЭМ. Окраска: уранил ацетат и чистый свинцовый цитрат. Масштаб: 500 nm. 1 – базальная мембрана тироцита; 2 – комплекс Голджи; 3 – лизосом; 4 – митохондрия; 5 – микроворсинки триоцитов
Figure 1. Electron micrograph of the structural elements of the normal thyroid gland. TEM. Coloring: uranyl acetate and pure lead citrate. Scale: 500 nm. 1 – basement membrane of thyrocyte; 2 – Golgi complex; 3 – lysosomes; 4 – mitochondrion; 5 – microvilli of thyrocytes
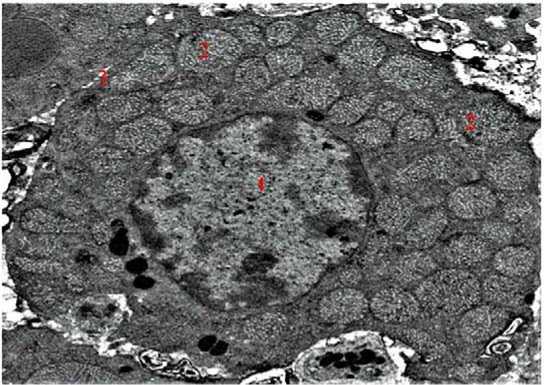
Рисунок 2. Электронная микрофотография нормальной структуры сетчатой зоны коркового вещества надпочечников. ТЭМ. Окраска: уранил ацетат и чистый свинцовый цитрат. Масштаб: 500 nm. 1 – ядро; 2 – лизосомы; 3 – базальная мембрана
Figure 2. Electron micrograph of the normal structure of the mesh zone of the adrenal cortex. TEM. Coloring: uranyl acetate and pure lead citrate. Scale: 500 nm. 1 – core; 2 – lysosomes; 3 – basal membrane
Кроме того, тироциты связываются с соседними клетками пальцевидными отростками и вдавлениями овальной формы, имеющимися на их боковых поверхностях. Визуально выделяются адреноциты мозговых и корковых веществ надпочечников, а также плотные контакты между клетками клубочковой, пучковой и сетчатой зон коры (рис. 2).
Хорошо заметны круглое ядро в центре цитоплазмы адреноцитов и тироцитов, небольшое ядрышко по периферии ядра, мембрана ядра и органеллы, рассеянные вокруг ядра.
Так, эндоплазматическая сеть, состоящая из микропузырьков, комплекс Голджи, в основном состоящий из цистерн и вакуолей, митохондрий тубулярного вида, неравномер- но распределены в цитоплазме. Края крист митохондрий клеток в основном гладкие. Но в некоторых случаях чаще всего в цитоплазме надпочечников встречаются и митохондрии с зубчатыми кристами. Небольшое количество лизосом и рибосом, расположенных вокруг комплекса Голджи, привлекает внимание четкими контурами. Лизосомы в основном визуализируются под капсулой в цитоплазме надпочечников. В некоторых клетках, в частности в сетчатой зоне надпочечников, не обнаруживаются жировые капли, а в некоторых – в тироцитах центральной части щитовидной железы – лизосомы. В электронограммах, полученных из ультра-тонких срезов, четко прослеживаются контуры соединительной ткани и синусоидальных капилляров, а также эндотелиоциты.
На 15-й день эксперимента в ходе электронно-микроскопического исследования препаратов, полученных из тканей щитовидной железы и надпочечников подопытных животных, проявляются характерные изменения внутриклеточных органелл на ультраструктурном уровне в связи со снижением кислородного обеспечение. Несмотря на то, что контуры базальной мембраны в клетках желез на электроно- граммах четко видны, в некоторых местах обращает внимание расслоение базальной мембраны. Контуры ядер гладкие, расположены в центре цитоплазмы, ядерный хроматин равномерно распределен в большинстве клеток. Можно ясно видеть гипертрофию и гиперплазию внутриклеточных органелл – увеличение числа и размеров митохондрий. Митохондрии меняют свои удлиненные формы, в основном наблюдаются округлые формы, а кристы с неровными контурами визуально хорошо заметны в ультратонких срезах (рис. 3).
Из других органелл привлекают внимание лизосомы, рибосомы, эндоплазматическая сеть и слабая гипертрофия комплекса Голджи.
При электронно-микроскопическом сравнении адреноцитов с тироцитами бледность ядерного хроматина в клетках надпочечников, слабая гиперплазия эпителиальных клеток, редкость кубовидного эпителия объясняется тем, что адреноциты более чувствительны к воздействию гипоксии. Хотя в тироцитах щитовидной железы обнаруживаются те же изменения, но эти изменения слабо заметны (рис. 4).
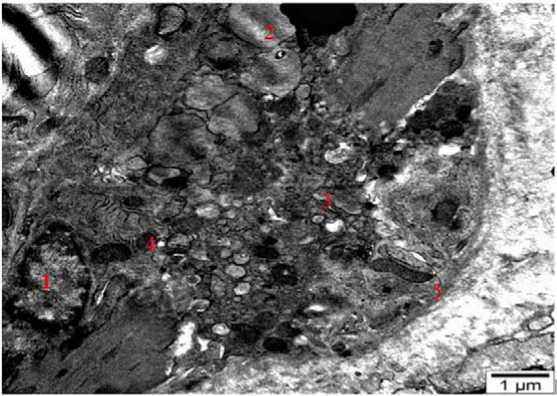
Рисунок 3 . 15-е сутки гипоксии. Электронная микрофотография структуры сетчатой зоны коркового вещества надпочечников. ТЭМ. Окраска: уранил ацетат и чистый свинцовый цитрат. Масштаб: 1 мкм. 1 – ядро; 2 – жировые капли; 3 – разрушенная лизосома; 4 – разрушенная митохондрия; 5 – плазмолемма Figure 3. 15th day of hypoxia. Electron micrograph of the structure of the reticular zone of the adrenal cortex. TEM. Coloring: uranyl acetate and pure lead citrate. Scale: 1 μ m. 1 – core; 2 – fat drops; 3 – destroyed lysosome; 4 – destroyed mitochondria; 5 – plasmolemma
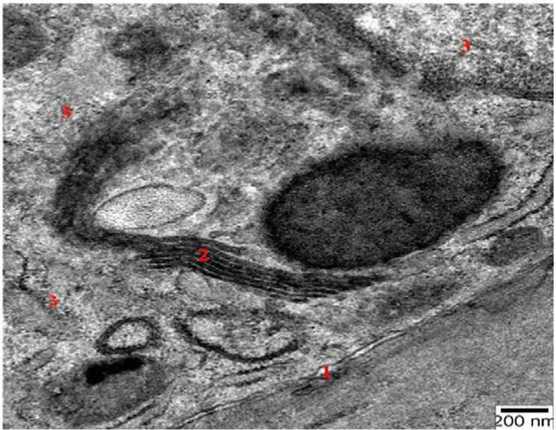
Рисунок 4. 15-е сутки гипоксии. Электронная микрофотография митохондрия в клетке щитовидной железы. ТЭМ. Краска: уранил ацетат и чистый свинцовый цитрат. Масштаб: 200 nm. 1 – базальная мембрана тироцита; 2 – комплекс Голджи; 3 – гликогеновые зерна
Figure 4. 15th day of hypoxia. Electron micrograph of mitochondria in a thyroid cell. TEM. Coloring: uranyl acetate and pure lead citrate. Scale: 200 nm. 1 – basement membrane of thyrocyte; 2 – Golgi complex; 3 – glycogen grains
Очень малое количество гранул гликогена в цитоплазме клеток на электроно-граммах и выраженная степень жировых капель подтверждает истощение энергии клетки во время длительной гипоксии.
Из электронограмм видно, что синусоидные капилляры не отличаются от обычных капилляров по диаметру и структуре стенок. Но в некоторых препаратах ясно видно, что границы базальной мембраны капилляров не выделяются четко, вспениваются клетки эндотелия, расширяются его просветы.
Кроме того, в связи с гипоксией наблюдается увеличение числа фибробластов вокруг капилляров, заполнение промежуточного вещества коллагеном и фиброзной тканью. Это, в свою очередь, приводит к сужению просвета капилляров и углублению гипоксии. Накопление небольшого количества жировых капель в цитоплазме клеток, в основном адреноцитов, а также отсутствие зерен гликогена – главный фактор, подтверждающий наличие жировой дистрофии под влиянием гипоксии. В электронограммах между сетчатой зоной и мозговым веществом надпочечников нахо- дится внутренний соединительнотканный слой, состоящий из коллагеновых волокон, фибробластов и фиброцитов.
Электронно-микроскопическая картина архитектоники надпочечников и щитовидных желез на 30-й день эксперимента характерна для нормального строения желез, практически не отличается от желез животных, входящих в контрольную группу. Так, при сравнении препаратов, изготовленных из обеих желез, отмечается полное восстановление нормального строения и размеров клеток, адаптированных к длительной гипоксии железистых клеток, реконструкция тканей, составляющих их паренхиму и строму. При обследовании не наблюдаются повреждения железистых клеток, ядра округлые и светло-серые, расположены в центре цитоплазмы. Однако следует отметить, что ядра эпинефроцитов надпочечников расположены в центре, ядра норэпинефроцитов – вне центра – в периферии, при этом характерно наличие более плотных секреторных гранул для нора-дреноцитов (рис. 5).
По сравнению с клетками надпочечников тироциты щитовидной железы полно- стью восстановили структуру, коллоид прозрачен и плотен, равномерно заполняет полость фолликулов (рис. 6).
В ходе проведенных электронномикроскопических исследований тканей обеих желез, было выявлено их полное восстановление структуры и размеров в результате пролиферации. Но в некоторых электронограммах под влиянием гипоксии обнаруживаются слабые ультраструктур-ные изменения. Особенно утолщена плаз-малемма надпочечников, ядро и хроматин побледнели, уменьшилось количество органелл, уменьшена эндоплазматическая сеть, а комплекс Голджи не заметен.
Кристы митохондрий, которые наиболее подвержены воздействию гипоксии, относительно гладкие. По сравнению с ад-реноцитами в ультратонких препаратах ти-роцитов можно наблюдать базальную мембрану, многочисленные связи тироцитов, расположенных в один слой на мембране, нормальное строение внутриклеточных органелл, в основном кристы митохондрий с зубчатыми краями, а также капиллярные петли, слои эндотелиальных клеток.
Таким образом, щитовидная и надпочечниковые железы, являющиеся основными органами эндокринной системы, регулирующими метаболизм организма, играют важную роль в формировании компенсаторно-адаптационных процессов против факторов «стресса», в том числе гипоксий различного происхождения, а также в повышении устойчивости организма к этим факторам. С другой стороны, известно, что для нормальной жизнедеятельности организма к митохондриям должно постоянно поступать требуемое количество кислорода и непрерывно синтезироваться АТФ (аденозинтрифосфат). А при необеспечение потребности в АТФ происходят различные функциональные и морфологические изменения во всех системах и органах организма, в основном в органах эндокринной системы [10]. Эти морфофункциональные изменения обусловлены особенностями тканей органов, резистентностью к кислородной недостаточности, длительностью гипоксии, в том числе интенсивностью обмена веществ, что проявляется своеобразной тканевой реакцией в каждом органе.
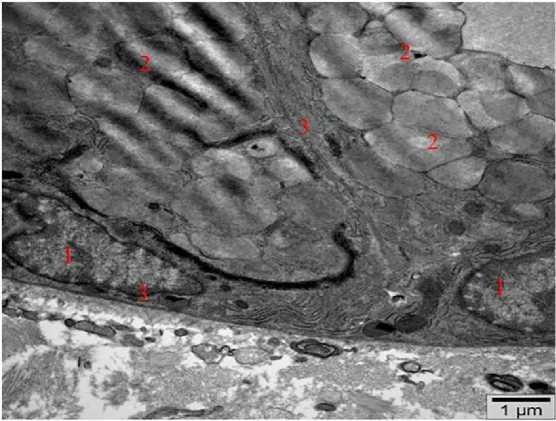
Рисунок 5. 30-е сутки гипоксии. Электронная микрофотография структурных элементов надпочечников. ТЭМ. Окраска: уранил ацетат и чистый свинцовый цитрат. Масштаб: 1 мкм. 1 – ядро; 2 – жировые капли; 3 – плазмолемма
Figure 5. 30th day of hypoxia. Electron micrograph of the structural elements of the adrenal glands. TEM. Coloring: uranyl acetate and pure lead citrate. Scale: 1 μ m. 1 – core; 2 – fat drops; 3 – plasmolemma

Рисунок 6. 30-е сутки гипоксии. Электронная микрофотография митохондрии в клетке щитовидной железы. ТЭМ. Окраска: уранил ацетат и чистый свинцовый цитрат. Масштаб: 200 nm. 1 – базальная мембрана тироцита; 2 – лизосомы; 3 – гликогена зерна
Figure 6. 30th day of hypoxia. Electron micrograph of mitochondria in a thyroid cell. TEM. Coloring: uranyl acetate and pure lead citrate. Scale: 200 nm. 1 – basal membrane of thyrocyte; 2 – lysosomes; 3 – glycogen grains
В результате исследования мы обнаружили, что реакция клеток щитовидной железы и надпочечников на гипоксию различна. Так, поскольку процессы пролиферации в клетках щитовидной железы происходят быстрее и раньше, все ткани в щитовидной железе восстанавливаются на 15-й день эксперимента, а в надпочечнике – только на 30-й день. Это можно расценивать как более высокую степень чувствительности надпочечников к гипоксии, которая является более сильным стрессовым фактором, чем для щитовидной железы. С целью профилактики различных заболеваний эндокринных органов, особенно щитовидной железы и надпочечников с гипоксическим компонентом, на основе определенных схем могут проводиться тренировки с помощью дозированного дефицита кислорода. Тем самым перспективой может быть долгосрочная адаптация органов, подвергшихся патологическому процессу, против гипоксии.
Список литературы Электронно-микроскопические особенности изменений в надпочечниках и щитовидной железе при хронической гипоксии
- Ivanov K.P. Sovremennye fundamental'nye problemy kislorodnogo transporta i gipoksii. Farmakoterapiya gipoksii i ee posledstviy pri kriticheskikh sostoyaniyakh. St. Petersburg. 2004:29-30. (In Russ).
- Erik R.Swenson, Peter Bartsch, High Altitude/Human Adaptation to Hypoxia, Springer, New York. 2014:495.
- Adaptatsiya k gipobaricheskoy i normobaricheskoy gipoksii, lechebnoe i treniruyushchee deystvie k gipobaricheskoy gipoksii / pod red. A.Z. Kolchinskoy. M. Nal'chik: izd-vo KBNTS RAN. 2001:75. (In Russ).
- Sadykova G.S., Dzhunusova G.S. Funktsional'nye osobennosti ehndokrinnykh sistem u zhiteley vysokogor'ya. Mezhdunarodnyy zhurnal prikladnykh i fundamental'nykh issledovaniy. 2016;4-5:943-947. (In Russ).
- Stadnik N.A., Botasheva V.S. Morfologiya shchitovidnoy zhelezy pri ehksperimental'nom tireotoksikoze. Kubanskiy nauchnyy meditsinskiy vestnik. 2014;3(145):102-108. (In Russ).
- Burrows N, Resch J, Cowen RL, von Wasielewski R, Hoang-Vu C, West CM, et al. Expression of hypoxia-inducible factor 1a in thyroid carcinomas. Endocrine-related Cancer. 2010;17(1):61-72.
- Woods DR., Davison A., Stacey M., Smith C., Hooper T., Neely D., Turner S., Peaston R., Mellor A. The cortisol response to hypobaric hypoxia at rest and post-exercise. Hormone and Metabolic Research. 2012;44:302-305.
- Jozwiak P, Ciesielski P, Zaczek A, Lipinska A, Pomorski L, Wieczorek M, et al. Expression of hypoxia inducible factor 1a and 2a and its association with vitamin C level in thyroid lesions. Journal of Biomedical Science. 2017;24(1):83.
- Mohammed Assi, Samia Elewil, Ahmed Al-Imam, Basem Ahmed The significance of hypoxia as a molecular and cellular event in patients with toxic and non-toxic goitre: A statistical inference based on cross-sectional analytic of Iraqi patients. Asian Journal of Medical Sciences. 2018;9(5):44-49.
- Ahundov R.A. Hipoksiya i antihipoksanti. Baku, «Aspoliqraf». 2010:328s. (In Russ).
- Zarechnova N.N., Slynko E. N. Influence of mountain hypoxia on endocrine system organs at insufficiency of adrenal and pancreatic hormones. Bulletin of new medical technologies, electronic journal. 2018;4:3-10.
- Zarechnova N.N., Raytsen V.A., Raytsen I.V. Morfofunktsional'nye izmeneniya adenogipofiza, nadpochechnikov i podzheludochnoy zhelezy v usloviyakh adaptatsii k vysokogor'yu. Evraziyskiy soyuz uchenykh. 2014;6-4:80-81. (In Russ).


