Элементы лабораторного регламента производства микробиопрепаратов в препаративной форме "смачивающийся порошок" на основе смеси перспективных штаммов-продуцентов из родов Penicillium и Bacillus
Автор: Маслиенко Л.В., Воронкова А.Х.
Рубрика: Защита растений и иммунология
Статья в выпуске: 3 (175), 2018 года.
Бесплатный доступ
С целью расширения спектра действия микробиопрепаратов устанавливали возможность получения смесевых препаратов в препаративной форме «смачивающийся порошок» (СП) на основе перспективных бактериального (Б-12 Bacillus licheniformis ) и грибного (PK-1-3 Penicillium vermiculatum ) штаммов-продуцентов. Определена совместимость штаммов-продуцентов смесевого микробиопрепарата на агаризированных и жидких питательных средах. На нейтральной агаризированной питательной среде (картофельно-сахароз-ном агаре) гриб и бактерия росли, не мешая друг другу, тогда как на специализированной для бактерии среде (Тайлона-3) бактерия занимала большую часть поверхности питательной среды и подавляла рост гриба-продуцента. Установлена нецелесообразность совместного поверхностного культивирования исследованных грибного и бактериального штаммов-продуцентов микробиопрепарата на жидких питательных средах, так как бактерия занимала всю поверхность питательной среды и подавляла рост колонии гриба, даже на специализированной для него среде Рудакова...
Микробиопрепараты, штаммы-продуценты pk-1-3 penicillium vermiculatum и б-12 bacillus licheniformis, препаративная форма, смачивающийся порошок, strains-producers pk-1-3 penicillium vermiculatum and б-12 bacillus licheniformis
Короткий адрес: https://sciup.org/142216719
IDR: 142216719 | УДК: 633.854.78:632.444.2:632.953.1 | DOI: 10.25230/2412-608X-2018-3-175-110-116
Текст научной статьи Элементы лабораторного регламента производства микробиопрепаратов в препаративной форме "смачивающийся порошок" на основе смеси перспективных штаммов-продуцентов из родов Penicillium и Bacillus
Введение. В лаборатории биометода ФГБНУ ФНЦ ВНИИМК многие годы ведутся исследования по разработке микробиологических средств защиты масличных и других сельскохозяйственных культур от болезней. Создана уникальная коллекция штаммов грибов и бактерий продуцентов микробиопрепаратов – биофунгицидов. Разрабатываются технологии производства и применения разных препаративных форм микробиопрепаратов [1]. Разработаны препаративные формы микробиопрепаратов «жидкая культура», «паста» и «порошок» на основе твёрдых носителей – питательных сред (семянки, лузга, отходы от очистки семян подсолнечника) и перлита [2]. В последние годы нами решается задача по увеличению срока хранения микробиопрепаратов без снижения титра, с минимальной нормой расхода, образующих в воде однородные суспензии. Разрабатывается препаративная форма «смачивающийся порошок» (СП) при поверхностном культивировании отдельных штаммов-продуцентов на жидких питательных средах.
Ранее нами проведены исследования по отработке элементов лабораторного регламента производства микробиопрепаратов в препаративной форме СП при поверхностном культивировании на жидких питательных средах перспективных грибных штаммов-продуцентов из рода Penicillium [3], бактерий из рода Bacillus [4] и Pseudomonas [5].
С целью расширения спектра действия микробиопрепаратов устанавливали возможность получения смесевых препаратов в препаративной форме СП на основе нескольких штаммов-продуцентов. В данной работе приведены результаты исследований по разработке элементов лабораторного регламента производства и хранения лабораторных образцов смесе-вого микробиопрепарата в препаративной форме СП на основе перспективных бактериального (Б-12 Bacillus licheniformis ) и грибного (PK-1-3 Penicillium vermicu-latum ) штаммов-продуцентов.
Материалы и методы. Определение совместимости штаммов-продуцентов микробиопрепарата PK-1-3 Penicillium vermiculatum и Б-12 Bacillus licheniformis проводили методом двойных (встречных) культур на агаризированных средах – картофельно-сахарозном агаре (КСА) и Тайлона-3 [6]. В чашки Петри (ЧП) высевали агаровые блоки с мицелием гриба и бактериальной плёнкой на расстоянии 6 см друг от друга. Культуры инкубировали в течение 15 дней при температуре +25,0 °С. Контрольные варианты – чистые культуры гриба и бактерии, посеянные отдельно. Учеты проводили ежедневно. Отмечался характер взаимоотношений гриба и бактерии: наличие или отсутствие зон, их размер, изменение цвета, плотности, толщины и направления роста мицелия гриба и бактериальной плёнки бактерии.
Штаммы-продуценты PK-1-3 Penicil-lium vermiculatum и Б-12 Bacillus licheniformis выращивали поверхностным способом на жидких питательных средах (Рудакова [7] и Тайлона-3 соответственно) отдельно и совместно на каждой среде, при оптимальных температурах (27 и 30 оС соответственно) в трёхлитровых стеклянных баллонах, с объёмом питательной среды 500 мл. Выросшую биомассу, как отдельно каждого штамма-продуцента, так и при совместном выращивании, отделяли сливом культуральной жидкости. Затем к биомассе добавляли прилипатель, растекатель и наполнитель. Всё перемешивали, распределяли тонким слоем на гладкой поверхности, высушивали под вытяжкой при температуре 25–28 оС до влажности 6–7 % и размалывали на мельнице с охлаждением. Влажность образцов определяли стандартным методом, высушиванием до постоянной массы (ГОСТ 5180-2015) [8]. Второй вариант получения смесевого препарата заключался в смешивании СП, полученных из отдельно выращенных штаммов-продуцентов, в соотношении 1 : 1.
Для установления оптимальных сроков поверхностного культивирования на жидкой питательной среде грибной и бактериальный штаммы-продуценты выращивали в течение 10 и 15 суток, с предварительным добавлением 2 % глубинной культуры продуцентов к объёму питательной среды. Определяли вес порошка и титр.
Сроки хранения лабораторных образцов в препаративной форме СП определяли в зависимости от температуры. Лабораторные образцы хранили в пакетах из крафт бумаги с доступом воздуха, при постоянных (+30 и -18 оС) и переменной (+24…+26 оС) температурах. Через 3, 6, 9 и 12 месяцев хранения микробиопрепарата определяли титр микробиологическим способом [9]. Титр гриба-продуцента определяли на среде КСА, бактерии – на среде Тайлона-3. Определение числа колониеобразующих единиц этим методом включало три этапа: приготовление разведений, посев на питательную среду в ЧП и подсчет выросших колоний. Затем 1,0 г исследуемого порошка переносили в колбу с 99,0 мл стерильной воды и встряхивали на качалке 20 минут. Для приготовления разведений стерильную водопроводную воду разливали по 9,0 мл в стерильные сухие пробирки. Затем отбирали 1,0 мл суспензии и переносили в пробирку с 9,0 мл стерильной воды. Полученное разведение тщательно перемешивали, несколько раз вбирая в дозатор и выпуская из него полученную суспензию клеток. Таким же образом готовили все последующие разведения. Высев исследуемой суспензии осуществляли поверхностным (для гриба) и глубинным (для бактерии) способом. При поверхностном способе по 0,1 мл из соответствующего разведения переносили в три стерильные ЧП на агаризированную питательную среду (КСА) и тщательно растирали шпателем. При глубинном способе по 1,0 мл из соответствующего разведения переносили в три стерильные ЧП. Затем заливали в чашки по 15,0–20,0 мл среды, расплавленной и остуженной до +45,0…+50,0 °С, и смешивали питательную среду с посевным материалом легкими вращательными движениями, после чего чашки оставляли на горизонтальной поверхности до застывания среды. Колонии антагонистов подсчитывали через 5– 7 суток инкубации. Количество колониеобразующих единиц в 1,0 г исследуемого порошка вычисляли по формуле:
„ ax · 10n Т = ,
, где Т – количество колониеобразующих единиц (КОЕ) в 1,0 г;
a – среднее число колоний, выросших после посева из данного разведения;
V – объем суспензии, взятый для посева;
10n – коэффициент разведения.
Результаты и обсуждение. Определена совместимость штаммов-продуцентов микробиопрепарата PK-1-3 Penicillium vermiculatum и Б-12 Bacillus licheniformis методом двойных (встречных) культур на агаризированных средах. Установлено, что на нейтральной питательной среде КСА гриб и бактерия росли, не мешая друг другу. Тогда как на специализированной для бактерии среде Тайлона-3 бактерия занимала бóльшую часть поверхности питательной среды и подавляла рост гриба-продуцента (рис. 1).
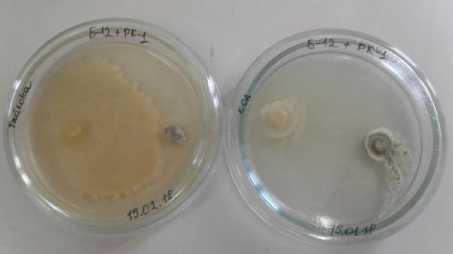
а б
Рисунок 1 – Совместное культивирование грибного PK-1-3 Penicillium vermiculatum и бактериального Б-12 Bacillus licheniformis штаммов-продуцентов микробиопрепарата на агаризированных питательных средах:
а – Тайлона-3; б – КСА (ориг.)
При раздельном поверхностном культивировании на жидких питательных средах (Рудакова и Тайлона-3) каждый штамм образовывал сплошную толстую мицелиальную и бактериальную плёнки. Лабораторные образцы микробиопрепаратов в препаративной форме СП, полученные при поверхностном культивировании каждого штамма на жидкой питательной среде, образовывали в воде стойкую суспензию, исходный титр препаратов на основе гриба составил 1010 КОЕ/г, а на основе бактерии – 1012 КОЕ/г. Влажность лабораторных образцов СП микробиопрепаратов составляла 6,0–7,1 %.
Установлен оптимальный срок поверхностного культивирования на жидких питательных средах отдельно для грибного и бактериального штаммов-продуцентов (табл. 1).
При поверхностном культивировании PK-1-3 Penicillium vermiculatum на жидкой питательной среде Рудакова максимальная масса СП получена через 15 суток. Титр СП не зависел от сроков культивирования грибного штамма-продуцента и был одного порядка в обоих вариантах выращивания (5,8–6,1 × 109 КОЕ/г).
Таблица 1
Влияние срока поверхностного культивирования на жидких питательных средах грибного PK-1-3 Penicillium vermiculatum и бактериального Б-12 Bacillus licheniformis штаммов-продуцентов на массу смачивающегося порошка и титр лабораторных образцов микробиопрепаратов г. Краснодар, ВНИИМК, 2018 г.
|
Вариант |
Объём посевной суспензии, % |
Срок культивирования, сутки |
|||
|
10 |
15 |
||||
|
Масса СП, г |
Титр, КОЕ/г |
Масса СП, г |
Титр, КОЕ/г |
||
|
PK-1-3 |
2,0 |
8,1 |
6,1 × 109 |
11,3 |
5,8 ×109 |
|
Б-12 |
2,0 |
3,7 |
3,7 ×1012 |
3,7 |
2,9 × 1012 |
Оптимальный срок поверхностного культивирования бактериального штамма-продуцента Б-12 Bacillus licheniformis составил 10 суток, так как с увеличением срока культивирования масса СП не увеличивалась, а титр был одного порядка в обоих вариантах выращивания (2,9–3,7 × 1012 КОЕ/г).
Таким образом, оптимальный срок поверхностного культивирования грибного штамма РК-1-3 Penicillium vermiculatum на жидкой среде Рудакова составил 15 суток. Для бактериального штамма Б-12 Bacillus licheniformis -3 оптимальный срок поверхностного культивирования на жидкой среде Тайлона-3 составил 10 суток.
При совместном поверхностном культивировании на обеих жидких питательных средах бактерия занимала всю поверхность питательной среды, образовывала толстую бактериальную плёнку и подавляла рост колонии гриба, даже на специализированной для гриба среде Рудакова (рис. 2).
Изготовленные лабораторные образцы микробиопрепарата в препаративной форме СП, полученные при совместном поверхностном культивировании грибного и бактериального штаммов на обеих 113
жидких питательных средах образовывали в воде стойкую суспензию, но имели исходный титр препарата только на основе бактерии 1010 КОЕ/г, который был на два порядка меньше, чем в лабораторном образце СП, полученном на основе отдельного бактериального штамма.

а б
Рисунок 2 – Совместное поверхностное культивирование грибного PK-1-3 Penicillium vermiculatum и бактериального Б-12 Bacillus licheniformis штаммов-продуцентов микробиопрепарата на жидких питательных средах: а – Тайлона-3; б – Рудакова (ориг.)
Таким образом, установлена нецелесообразность совместного поверхностного культивирования исследованных грибного и бактериального штаммов-продуцентов микробиопрепарата на жидких питательных средах.
Определяли сроки хранения лабораторных образцов микробиопрепаратов, полученных из отдельно выращенных штаммов-продуцентов в условиях переменной температуры (+24…+26 оС) в бу- мажных пакетах с доступом воздуха (табл. 2), а также смесевого препарата, полученного при смешивании СП на основе отдельных штаммов в соотношении 1 : 1, в зависимости от температуры (табл. 3).
Установлено, что при хранении лабораторных образцов СП микробиопрепаратов, полученных из отдельно выращенных штаммов-продуцентов, в условиях переменной температуры +24…+26 оС, титр бактериального препарата через 12 месяцев сохранился на исходном уровне, тогда как у грибного – снизился на порядок, но сохранялся высоким (1,5 × 1012 и 2,5 × 109 КОЕ/г соответственно).
Таблица 2
Влияние сроков хранения лабораторных образцов микробиопрепаратов в препаративной форме «смачивающийся порошок» на основе отдельно выращенных грибного PK-1-3 Penicillium vermiculatum и бактериального Б-12 Bacillus licheniformis штаммов-продуцентов на титр г. Краснодар, ВНИИМК, 2018 г.
|
Вариант |
Титр, КОЕ/г, через, месяцев |
||||
|
1 |
3 |
6 |
9 |
12 |
|
|
PK-1-3 |
2,8 × 1010 |
1,5 × 1010 |
8,5 × 109 |
6,8 × 109 |
2,5 × 109 |
|
Б-12 |
3,7 × 1012 |
6,5 × 1012 |
4,3 × 1012 |
2,8 × 1012 |
1,5 × 1012 |
Таблица 3
Влияние температуры на титр лабораторного образца смесевого микробиопрепарата в препаративной форме «смачивающийся порошок» на основе смеси грибного PK-1-3 Penicillium vermiculatum и бактериального Б-12 Bacillus licheniformis штаммов-продуцентов в процессе хранения г. Краснодар, ВНИИМК, 2018 г.
|
Срок хранения, через месяц |
Штамм |
Титр, КОЕ/г |
||
|
При температуре, оС |
||||
|
+24…+26 оС |
+30 оС |
- 18 оС |
||
|
3 |
РК-1-3 |
1,5 × 1010 |
4,3 × 109 |
4,5 × 1010 |
|
Б-12 |
6,5 × 1012 |
6,8 × 1012 |
7,5 × 1012 |
|
|
6 |
РК-1-3 |
8,5 × 109 |
8,6 × 105 |
4,8 × 1010 |
|
Б-12 |
4,3 × 1012 |
3,6 × 1012 |
6,5 × 1012 |
|
|
9 |
РК-1-3 |
6,8 × 109 |
4,3 × 104 |
5,5 × 1010 |
|
Б-12 |
2,8 × 1012 |
1,3 × 1012 |
7,0 × 1012 |
|
|
12 |
РК-1-3 |
2,5 × 109 |
2,1 × 103 |
3,8 × 1010 |
|
Б-12 |
1,5 × 1012 |
1,1 × 1012 |
4,8 × 1012 |
|
Примечание: исходный титр СП смесевого микробиопрепарата: РК-1-3 – 3,5 × 1010 КОЕ/г; Б-12 – 7,1 × 1012 КОЕ/г
При хранении лабораторных образцов смесевого микробиопрепарата при переменной температуре (+24…+26 °С), также как и для СП на основе отдельных штаммов-продуцентов, титр бактериального штамма-продуцента сохранялся через двенадцать месяцев на исходном уровне (1,5 × 1012 КОЕ/г), а у грибного – снизился на порядок (2,5 × 109 КОЕ/г).
При постоянной высокой температуре (+30 °С) титр лабораторных образцов СП смесевого микробиопрепарата через двенадцать месяцев для бактериального штамма сохранился на первоначальном уровне, а для грибного – снизился до 103 КОЕ/г, поэтому хранить смесевой препарат в этих условиях нецелесообразно.
При хранении лабораторных образцов СП смесевого микробиопрепарата при постоянной низкой температуре (-18 °С) через двенадцать месяцев титр сохранялся на первоначальном уровне как у грибного, так и у бактериального штаммов-продуцентов (3.8 × 1010 КОЕ/г и 4,8 × 1012 КОЕ/г соответственно).
Выводы. 1. Определена совместимость штаммов-продуцентов смесевого микробиопрепарата на агаризированных питательных средах. На нейтральной питательной среде (КСА) гриб и бактерия росли, не мешая друг другу, тогда как на специализированной для бактерии среде (Тайлона-3) бактерия занимала большую часть поверхности питательной среды и подавляла рост гриба-продуцента.
-
2. Оптимальный срок поверхностного культивирования грибного штамма РК-1-3 Penicillium vermiculatum на жидкой среде Рудакова составил 15 суток, а для бактериального штамма Б-12 Bacillus licheniformis -3 на жидкой среде Тайлона-3 – 10 суток.
-
3. Установлена нецелесообразность совместного поверхностного культивирования исследованных грибного и бактериального штаммов-продуцентов микробиопрепарата, так как на обеих
-
4. При переменной температуре (+24…+26 °С) через двенадцать месяцев хранения лабораторных образцов СП сме-севого микробиопрепарата также, как и на основе отдельных штаммов-продуцентов, титр бактериального штамма сохранялся на исходном уровне (1,5 × 1012 КОЕ/г), а у грибного – снизился на порядок, но оставался высоким (2,5 × 109 КОЕ/г).
-
5. При постоянно высокой температуре (+30 °С) хранение смесевого препарата не целесообразно, так как титр грибного штамма-продуцента резко снижался – до 103 КОЕ/г.
-
6. При постоянной низкой температуре (-18 °С) через двенадцать месяцев хранения лабораторных образцов СП смесевого микробиопрепарата титр сохранялся на первоначальном уровне как у грибного, так и у бактериального штаммов-продуцентов.
жидких питательных средах бактерия занимала всю поверхность питательной среды и подавляла рост колонии гриба, даже на специализированной для гриба среде Рудакова.
Список литературы Элементы лабораторного регламента производства микробиопрепаратов в препаративной форме "смачивающийся порошок" на основе смеси перспективных штаммов-продуцентов из родов Penicillium и Bacillus
- Маслиенко Л.В. Обоснование и разработка микробиологического метода борьбы с болезнями подсолнечника: дис. … д-р. биол. наук: защищена 03.06.05; утв. 07.10.05. -Краснодар, 2005. -377 с.
- Маслиенко Л.В. Лаборатория биологических средств защиты растений (вчера, сегодня, завтра)//История научных исследований во ВНИИМКе за 90 лет. -Краснодар, 2003. -С. 273-281.
- Маслиенко Л.В., Воронкова А.Х. Элементы лабораторного регламента производства микробиопрепаратов на основе грибных штаммов-продуцентов в препаративной форме «смачивающийся порошок»//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2016. -Вып. 4 (168). -С. 100-107.
- Маслиенко Л.В., Воронкова А.Х. Элементы лабораторного регламента производства микробиопрепарата в препаративной форме «смачивающийся порошок» на основе бактерий-антагонистов из рода Bacillus//Масличные культуры: Науч.-тех. бюл. ВНИИМК. -2017.-Вып. 3 (171). -С. 93-96.
- Маслиенко Л.В., Воронкова А.Х. Элементы лабораторного регламента производства микробиопрепарата в препаративной форме «смачивающийся порошок» на основе перспективного бактериального штамма-продуцента Sgrc-1 Pseudomonas fluorescens при поверхностном культивировании на жидкой питательной среде//Масличные культуры: Науч.-тех. бюл. ВНИИМК. -2018. -Вып. 1 (173). -С. 87-93.
- Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. -М.: Изд-во МоскЛВского ун-та, 1957. -78 с.
- Рудаков О.Л. Микофильные грибы, их биология и практическое значение.-М.: Наука, 1981. -160 с.
- ГОСТ 5180-2015 Грунты. Методы лабораторного определения физических характеристик. -М.: Изд-во ФГУП «Стандартинформ», 2016. -23 с.
- Егоров Н.С. Основы учения об антибиотиках. -М.: Наука, 2004. -525 с.


