Энергетические трансформации в пищевых технологиях
Автор: Чагайда А.О.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Техника и технологии
Статья в выпуске: 3 (112), 2016 года.
Бесплатный доступ
Дана информация про особенности энергетических трансформаций газожидкостных систем в пищевых технологиях, которые создаются в результате принудительного введения в жидкостные среды газовой фазы или за счет возникновения последней в процессах брожения. Отмечены особенности энергетических трансформаций с возникновением внут-ренних циркуляционных контуров и градиентов концентраций растворенного СО2. Также представлены соотношения между массовыми концентрациями сбражеваемых сахаров и объемами синтезированой газовой фазы и оценка прогнозированных потерь спирта.
Газожидкостная система, циркуляция, растворимость, трансфор-мация, концентрация
Короткий адрес: https://sciup.org/140204873
IDR: 140204873 | УДК: 663.1:
Текст научной статьи Энергетические трансформации в пищевых технологиях
Введение чительного количества технологий в пище
Газожидкостные системы касаются зна- вой, микробиологической, фармацевтической и химической отраслях промышленности. Существование таких систем иногда является результатом протекания химических, биохимических или комбинированных преобразований материальных потоков, или искусственное превращение и создание газожидкостных систем связывается с массообменом для обеспечения трансформаций энергетических и материальных потоков из них.
В значительном количестве случаев газожидкостные системы создаются в объемах специальных аппаратов или в форме газожидкостных потоков, однако, как правило, газовая фаза в них диспергирована и подлежит действию физических законов (Архимеда, Рейнольдса, Стокса, Бернулли, закона неразрывности потоков и т.д.).
Объект исследований
Технологии и гидродинамика газожидкостных систем в условиях анаэробных процессов сбраживания сахаросодержащих растворов.
Предметом исследований
Избраны закономерности энергетических и материальных трансформаций в газожидкостных системах.
Методы исследований
Закономерности материальных и энергетических трансформаций устанавливались на основе классических положений термодинамики, теории растворимости газов, законов Генри, Архимеда и на феноменологических умозаключениях.
Результаты и их обсуждение
Причиной и следствием создания газожидкостных систем является организация массообмена, теплообмена, механического перемешивания в интересах течения технологических процессов. Образование газожидкостной системы сопровождается энергетическими трансформациями на уровне синтеза поверхности раздела фаз, преодолением гидростатических давлений, образованием циркуляционных газожидкостных контуров и т.п. Само по себе существование газожидкостных систем означает присутствие в них энергетических потенциалов. Однако это присутствие связывается с синтезом диспергированной газовой фазы или введением ее в жидкостные среды. При таких условиях движущим фактором системы выступают силы, которые отвечают закону Архимеда.
Вместе с тем существует несколько скрытый потенциал растворенных газов, закономерности которого отображаются законом
Генри.
При этом важно, что существование потенциала растворенных газов поддерживается за счет таких термодинамических параметров, как давление и температура.
Рассмотрим некоторые особенности создания газожидкостных систем в пищевых и микробиологических технологиях. Они могут создаваться искусственно для обеспечения аэробных условий существования микроорганизмов и синтеза, например, хлебопекарных дрожжей или для аэрации сточных вод предприятий и создание условий симбиоза микроорганизмов активного ила. В указанных случаях задачами аэрации являются введение в среду растворенного кислорода и выведение диоксида углерода. Создание диспергированной газовой фазы в жидкостной означает создание определенного энергетического потенциала в форме кинетической и потенциальной энергий и энергии синтеза поверхности раздела фаз.
Наращивание потенциала сред имеет место в бродильных технологиях, однако в данном случае речь идет о потенциале давления растворенных газов. Известно, что процессы брожения, которые происходят с участием дрожжевых культур, сопровождаются образованием диоксида углерода. Если в производстве алкоголя синтезированный СО2 в большинстве случаев существует как выходной материальный поток, который на последующих этапах технологии не используется, то в производстве хлеба, пива и шампанских вин он является составной частью названной продукции. Первичное виноделие хотя и сопровождается синтезом СО2, но последний также применения не находит.
Оценивая тот факт, что сбраживание сахаросодержащих сред может осуществляться при высоких давлениях, следует прийти к выводу о, как минимум, тройном вреде, если создаваемый СО2 просто сбрасывается в окружающую среду. Во-первых, энергетический потенциал растворенного газа не используется для активации массообмена, во-вторых, диоксид углерода не отбирается для дальнейшего использования, и в-третьих -имеет место отрицательное экологическое воздействие. Между тем указанные негативные последствия в значительной степени могли бы быть локализованными и даже ликвидированными.
С этой точки зрения почти идеальное решение достигнуто производителями шам- панских вин. Оно касается как классической технологии производства шампанского бутылочным методом, так и технологий непрерывного брожения в акратофорах. Позитив двух названных технологий связан с тем, что концентрация сахара в виноматериалах, подлежащих сбраживанию, обеспечивает необходимую концентрацию СО2 около 10 г/л. Именно поэтому сбраживание таких сред завершается полной трансформацией сахаров в алкоголь и диоксид углерода. Создаваемый в результате таких процессов брожения продукт есть абсолютно сухим шампанским с технологическим названием "брют". В дальнейшем необходимые (и разные) концентрации сахара и алкоголя достигаются за счет их дозирования в форме приготовленных растворов-ликеров, а брют с его технологическими параметрами обеспечивает возможность создания ряда сухих, полусухих, полусладких и сладких шампанских вин.
Номинальная концентрация растворенного СО 2 10 г/л обеспечивается за счет двух термодинамических параметров, к числу которых относятся давление и температура. Этому положению соответствует закон Генри в форме:
С н = kP , (1)
где: c – максимальное насыщение
н среды газовой фазой в растворенном виде; k – константа Генри, которая учитывает физикохимические свойства сред, в том числе температуру; Р – парциальное давление газовой фазы в системе.
В соответствии с приведенным соотно шением и для обеспечения c = 10 г/л в
н акратофорах обеспечиваются давление газовой фазы около 0,6 МПа и температура около 6 °С. Количество растворенного СО2 в единице объема жидкостной фазы и давление определяют его энергетический потенциал
Есо2= PV=MRT. (2)
Расчет выполним для единицы объема среды 1 м3, которому соответствует 10 кг растворенного газа, получим:
Е = 10·188,9·279 = 527031 Дж =
527,031 кДж.
Для возможности сравнительной оценки указанной величины c перейдем к мощности, которая может развиваться за счет десатурации. Если время такого срабатывания
|
составит 10 |
с, то мощность |
|
N CO |
ECO 2 527,031 кВт |
|
ш ~ 52,7 ’ Т (к) 10 |
|
|
а при |
Т (к) = 20 с: |
|
N CO |
527,031 кВт. " 20 26,4 |
Названные показатели хотя и имеют приближенную оценку, однако мощности воздействия на среды на порядок и более превышают показатели энерговведения в классических технологиях.
Хотя присутствие энергетических потенциалов растворенных газов не требует дальнейших доказательств, однако их использование в интересах технологических процессов практически не достигается. Между тем существует два варианта такого использования.
Вариант первый . Он касается возможности того, что жидкостная фаза с растворенным СО 2 за счет нарушения условия термодинамического равновесия трансформируется в газожидкостной среде с диспергированной в ней газовой фазой. Очевидно, что эта часть влияния означает частичную десатурацию. Однако такой процесс легко прекратить повторным увеличением давления в системе. Последнее сопровождается повторным скоротечным растворением СО2 из пузырьков, которые прекращают свое существование в результате коллапса в процессе кавитации.
Очевидно, что резкое прекращение десатурации в таких системах по своим последствиям близко к кавитации и может использоваться для интенсификации массообменных процессов и энергомассообменных трансформаций. Учитывая значительное количество предприятий бродильной промышленности и самогенерировання в технологических аппаратах СО 2 , следует прийти к выводу о перспективности использования этих явлений.
Второй вариант использования потенциалов растворенных газов в жидкостных средах касается случаев использования технологических аппаратов со значительными гидростатическими давлениями сред. В соответствии с законом Генри гидростатические давления должны сопровождаться концентрационными градиентами СО 2 по высоте аппаратов. Это означает возможность дополнительных энергоматериальних трансформаций в их энергетическом обеспечении.
Увеличение физических и гидростатических давлений в технологических аппаратах, в которых осуществляется синтез диоксида углерода или его принудительная подача и диспергирование в жидкостной фазе, означает повышение растворимости в соответствии с законом Генри. В бродильных средах, поскольку в них генерируется СО 2 , парциальное давление равно общему давлению. Последнее исчисляется суммой давления в газовой фазе аппарата и гидростатического давления. Это означает, что, например, в таких аппаратах значительной высоты как ЦКТ пивоваренной отрасли, растворимость диоксида углерода по высоте будет разной, что приводит к существованию концентрационного градиента, особенно в условиях ограниченной вертикальной циркуляции. Однако даже при существовании такой ситуации достигалось бы определенное приближение к выравниванию концентрации СО2, однако физическое основание неравномерности растворимости не исчезает. Это означает, что образование диспергированной газовой фазы по высоте аппаратов будет разным. Следствием такой ситуации будет разная скорость передачи СО 2 в газовую фазу по высоте среды и разная плотность диспергированной газовой фазы. С учетом феноменологических соображений следует прийти к выводу о том, что плотность диспергированной газовой фазы определяет гидродинамические показатели газожидкостных систем, в том числе удерживающую способность по газовой фазе, абсолютную скорость всплывания газовых пузырьков как проявление действия Архимедовой силы и интенсивности циркуляционных контуров. Дополнительное влияние на последние имеют режимы охлаждения сред.
Процесс образования диспергированной газовой фазы следует рассматривать трехступенчатым. На первом этапе происходит синтез СО 2 в дрожжевых клетках, второй этап касается массопередачи через клеточные оболочки в среду, и на третьем
- образование газовых пузырьков, увеличение их размеров и всплытие под действием Архимедовой сил. Выполненный анализ приводит к выводу о неоднородности гидродинамики в средах и целесообразности влияния на нее за счет использования потенциалов растворенных газов и диспергированной газовой фазы.
Проявления таких потенциалов достигаются за счет изменения давления в газожидкостных средах, которые можно программировать. При этом изменения давления касаются трансформаций обоих потенциалов и сопровождаются механическими, гидродинамическими, кавитационными воздействиями, гидравлическими ударами и т.п. Возможно также влияние на среды в форме организации циркуляционных контуров [1] или за счет резких снижений давления в системах [2].
Технологии, связанные с насыщением жидкостных сред диоксидом углерода с последующим скоротечным режимом десатурации, также могут найти широкое применение в отраслях пищевой промышленности, например, в системах для получения диффузионного сока [3], соков овощей, фруктов, ягод и т.п.
Создание энергетических потенциалов растворенных газов, как было показано, связано с их физическими и химическими характеристиками непосредственно, в том числе относительно свойств сред. К таким выводам приходим на основе анализа литературных источников, хотя полнота их заметно ограничена по воздействиям растворенных в средах веществ [4, 5]. В табл. 1 приведены данные, относящиеся к растворимости СО 2 в сухом вине. Последнее означает, что сахарá в среде отсутствуют, а концентрация алкоголя близка к 8…9 %. Однако информация о присутствии других сухих веществ в растворенном состоянии также отсутствует. Однако даже при таких условиях представленная динамика воздействий давлений и температур для анализа ситуации является полезной.
Таблица 1 - Растворимость диоксида углерода в вине в зависимости от давления и температуры, г/л
|
Температура, °С |
Давление, бар |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
0 |
3,62 |
7,25 |
10,87 |
14,50 |
18,12 |
21,75 |
25,37 |
|
2 |
3,39 |
6,78 |
10,17 |
13,56 |
16,94 |
20,33 |
23,72 |
|
4 |
3,17 |
6,34 |
9,52 |
12,69 |
15,86 |
19,03 |
22,21 |
|
6 |
2,97 |
5,95 |
8,92 |
11,90 |
14,57 |
17,84 |
20,82 |
|
8 |
2,79 |
5,58 |
8,37 |
11,16 |
13,97 |
16,75 |
19,54 |
|
10 |
2,62 |
5,25 |
7,84 |
10,49 |
13,11 |
15,74 |
18,36 |
|
12 |
2,47 |
4,94 |
7,40 |
9,87 |
12,34 |
14,81 |
17,27 |
|
14 |
2,32 |
4,65 |
6,97 |
9,30 |
11,62 |
13,95 |
16,27 |
|
16 |
2,19 |
4,38 |
6,58 |
8,77 |
10,96 |
13,15 |
15,34 |
|
18 |
2,07 |
4,14 |
6,21 |
8,28 |
10,35 |
12,42 |
14,49 |
Зависимость растворимости (константы Генри) от давления является линейной, что собственно соответствует закону Генри.
Влияние температур на растворимость газа представлено на рис. 1 и 2.
В бродильных технологиях количества и концентрации СО 2 вполне программируемы, поскольку известны характеристики сброженных сред.
Так, начальная концентрация сахаров в сброженном пивном сусле 13 %, а биохимическим превращениям соответствует известное уравнение Гей-Люссака:
ОДД ^ 2С7НОН + 2СО7 + 115 кДж. 6 12 6 2 5 2
Количественный подсчет синтезированных продуктов осуществляется с учетом атомных масс:
|
С : 72 Н : 12 О : 92 |
48 24 12 32 64 |
|
180 |
92 88 |
При указанных соотношениях сахаров и диоксида углерода рассчитываются концентрации СО2 в средах (табл. 2).
Таблица 2 - Концентрации СО 2 , образующиеся в средах за счет сбраживания различных концентраций сахаров, кг/м3
|
Массовые концентрации сахаров, кг / м3 |
||||||||||||||
|
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
|
3,91 |
4,40 |
4,89 |
5,28 |
5,87 |
6,35 |
6,84 |
7,33 |
7,82 |
8,31 |
8,80 |
9,29 |
9,78 |
10,27 |
10,76 |
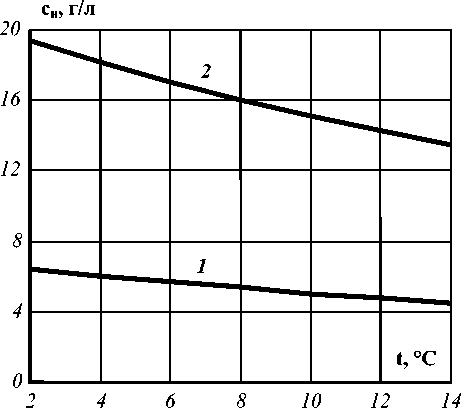
Рис. 1. График зависимости насыщения СО2 от температуры для пива при: 1 – Р = 2 бар; 2 – Р = 6 бар
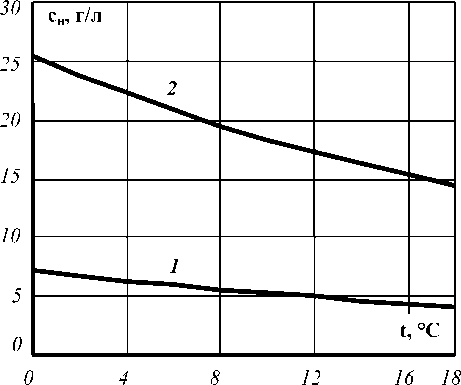
Рис. 2. График зависимости насыщения СО2 от температуры для сухого вина при: 1 – Р = 2 бар;
2 – Р = 7 бар
Если технологию брожения пива осуществлять с ориентиром на концентрацию СО2 4 г/л, как это соответствует стандарту, то начальная концентрация экстрактивных веществ должна составлять 8,18 г/л. Отсюда следует, что в процессе брожения с каждого кубического метра среды выводится СО2 в количестве:
Мсо = 6,36 - 4,0 = 2,36 кг.
Очевидно, что такие потери материального потока СО 2 являются программируемыми. В отличие от производства шампанского в этом случае контролируемой величиной в целевом продукте есть концентрация алкоголя, которая при отсутствии потерь должна была бы составлять:
13-92 ,з
Мг н он = ЮА = 6,64 кг/м .
С2Н5ОН 180
Напоминание о потерях алкоголя связаны с тем, что они действительно имеют место в периоды вывода из среды "лишнего" диоксида углерода, концентрация которого превышает уровень насыщения. Последний определяется давлением в системе, стабилизация которого означает достижение определенного значения СО2. Если сбраживание пива осуществляется в открытых аппаратах, то это означает постепенные потери диоксида углерода в режимах ламинарных перемещений диспергированной газовой фазы. В герметизированных аппаратах снижение давления является откликом на срабатывание предохранительных клапанов и сопровождается скоротечным изменением гидродинамики среды. По современным рекомендациям доб-раживание сусла должно продолжаться 6…7 суток при температуре от нуля до -1 °С. Это должно обеспечить концентрацию СО 2 около 5 г/л, что на 1 г/л превышает нормативный показатель. Однако это превышение создает резерв, который теряется в следующих технологических операциях.
Технологии сбраживания пивного сусла в классическом представлении делятся на два этапа: собственно брожение и дображивание. Первому этапу соответствуют температуры около 6°С (в современных ускоренных технологиях -12…14°С). Это означает, что состояние насыщения на СО2 будет достигаться только через определенное время, тем более, что на пути этого процесса стоят осмотические и температурные шоковые воздействия на дрожжевые клетки. Таким образом, динамика накопления СО2 напрямую связана со скоростью сбраживания сахаров, которая в свою очередь зависит от температуры среды, присутствия соответствующих концентраций сахаров, компонентов азотного и фосфорного питания, биостимуляторов, растворенного кислорода в период лаг-фазы и т.п. Перечень при- веденных факторов влияния приводит к тому, что в классических технологиях на операцию брожения отводится 6…7 суток с соответствующим достижением на какой-то момент времени состояния насыщения среды СО2.
В аэробных условиях синтеза микроорганизмов, которые создаются непрерывной подачей воздуха, достигается полное по термодинамическим условиям насыщение среды азотом, динамическими уровнями растворенных кислорода и диоксида углерода. Если при таких условиях осуществлять изменение давления, то по составляющей азота реакция системы будет присутствовать обязательно, а реагирование со стороны растворенного диоксида углерода и кислорода будет иметь место только при условии выхода за показатели термодинамического равновесия. При этом важно, что с точки зрения интересов обеспечения аэробных условий процесс может происходить при различных средних давлениях, поскольку диапазон возможных рабочих давлений в средах достаточно широк. Возможно с уверенностью утверждать, что единственным лимитирующим показателем в этих условиях являются энергетические затраты, которые возрастают с увеличением давления воздуха, подаваемого на аэрацию.
Важной задачей газожидкостных систем в условиях культивирования аэробных микроорганизмов является создание интенсивного массообмена по всем составляющим.
К ним относятся гомогенизация среды по питательным компонентам, температурам, растворенным газам, микроорганизмам [6, 7]. При этом должны достигаться некоторые дополнительные условия. Например, для повышения выхода хлебопекарных дрожжей концентрация растворенных сахаров должна укладываться в некоторые минимальные границы, а концентрация растворенного кислорода должна составлять около 0,25 от состояния насыщения [8, 9]. Все это означает, что состояние газожидкостной среды должно быть достаточно динамичным. Обеспечение последнего достигается введением в жидкостную культуральную среду энергоматериального потока сжатого воздуха.
При анаэробном брожении газовая фаза и энергетический потенциал создаются в процессе сбраживания сахаров, поэтому динамика накопления газовой фазы и возможности влияния через нее на гидродинамику и массообмен в средах отличаются.
Выводы
-
1. Уровень дисперсности газовой фазы в жидкостной среде зависит от скорости, с которой происходит взаимодействие фаз. Такое взаимодействие следует организовывать в режиме противотока.
-
2. Опрокидывание циркуляции газожидкостных контуров означает возможность пребывания сред в режимах переходных процессов с повышением показателей газосо-держания и удерживающей способности по газовой фазе.
-
3. Генерирование пульсационных воздействий на газожидкостные среды в локальных зонах значительных объемов мало перспективно в связи с их диссипативными свойствами. Рациональным следует считать изменение давления газовой фазы над культуральной средой. В связи с разработанной теорией определения частотных характеристик внешние воздействия следует приближать к ним по показателю частоты.
Список литературы Энергетические трансформации в пищевых технологиях
- Чагайда А.О., Пiддубний В.А., Соколенко А.I. Бродильний апарат. Патент № 75184 UA, МПК C12F 3/08. Опубл. 26.11.2012, Бюл. № 22, 2012 р.
- Чагайда А.О., Пiддубний В.А., Соколенко А.I., Пiмiнова Г.А. Бродильний апарат. Патент №107407 UA, МПК C12F 3/08. Опубл. 25.12.2014, Бюл. № 24, 2014 р.
- Соколенко А.I., Пiддубний В.А., Шевченко О.Ю. та iн. Система для одержання дифузiйного соку. Патент № 85414 UA, МПК С13D1/00. Опубл. 26.01.2010. Бюл. № 2, 2009 р.
- Чагайда А.О. Енергонакопичувальнi сис-теми в харчових технологiях//Харчова промис-ловiсть. -2013. -№ 14. -С. 159-162.
- Чагайда А.О. Iнтенсифiкацiя зброджування цукровмiстких середовищ//Науковi працi НУХТ. -2014. -№ 51.-С.77-83.
- Пiддубний В.А., Чагайда А.О. Фазовi переходи в технологiях створення замкнутих контурiв енергокористування//Харчова промисловiсть. -2012. -№ 13. -С. 194-197.
- Чагайда А.О. Пристрiй для оброблення рiдинних або комбiнованих середовищ в режимах дискретно-iмпульсних технологiй. Патент №84066 UA, МПК C12C 13/00. Опубл. 10.10.2013, Бюл. № 19, 2013 р.
- Шиян П.Л., Сосницький В.В., Олiйничук С.Т. Iнновацiйнi технологiї спиртової промисловостi. Теорiя i практика. -К.: Видавничий дiм "Асканiя", 2009. -424 с.
- Маринченко В.О., Домарецький В.А., Шиян П.Л. та iн. Технологiя спирту. -Вiнниця: "Подiлля-2000", 2009. -496 с.


