Энергетический обмен в мышечной ткани при статических и динамических нагрузках (экспериментальное исследование)
Автор: Захарова Анна Николаевна, Милованова Ксения Геннадьевна, Коллонтай Олеся Вадимовна, Орлова Анна Алексеевна, Капилевич Леонид Владимирович
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Физиология
Статья в выпуске: 2 т.23, 2023 года.
Бесплатный доступ
Цель: оценить влияние физической активности на энергетический обмен в скелетных мышцах нетренированных и предварительно тренированных экспериментальных животных (мышей). Материалы и методы. В качестве экспериментальных животных использовали половозрелых (8-12 недель) мышей-самцов линии С57Вl/6 массой 25-30 г. Для исследования были сформированы группы для острого (нетренированные мыши) и хронического (тренированные мыши) эксперимента. Использовали динамическую нагрузку в виде принудительного плавания и статическую нагрузку в виде виса на горизонтальной сетке. Содержание лактата и гликогена в скелетных мышцах определяли колориметрическим методом. Определение цитратсинтазы, общего ОКСФОС и концентрации изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани выполняли методом вестерн блотинга. Результаты. Показано, что динамические и статические нагрузки по-разному влияют на показатели, характеризующие энергетический обмен в мышцах нетренированных и предварительно тренированных экспериментальных животных. Если эффекты однократных нагрузок статического и динамического характера различались не столь существенно, то влияние ежедневных тренирующих воздействий различалось значительно. Тренировки статического характера приводили к существенно более выраженным перестройкам в энергетическом метаболизме мышечных клеток. На показатели энергетического метаболизма у предварительно тренированных животных влияние однократной статической нагрузки было менее выражено, чем динамической. Заключение. Модификация этих механизмов под влиянием физических нагрузок различного характера и интенсивности представляет значительный интерес, так как является перспективным способом воздействия на метаболические процессы как на клеточном, так и на системном уровнях, что очень важно для улучшения спортивной работоспособности и для коррекции метаболических нарушений при ряде социально-значимых заболеваний.
Физическая активность, тренировка, скелетные мышцы, энергетический обмен, na+/k+-атф-аза
Короткий адрес: https://sciup.org/147240967
IDR: 147240967 | УДК: 577.1(075.8):796.015.6 | DOI: 10.14529/hsm230210
Текст научной статьи Энергетический обмен в мышечной ткани при статических и динамических нагрузках (экспериментальное исследование)
Введение. Успех в современной системе спортивной тренировки во многом связан с учетом физиологических перестроек в скелетных мышцах. Имеющиеся данные об особенностях метаболизма и композиции мышечных волокон у спортсменов различных специализаций свидетельствуют о том, что физиологические особенности мышечной ткани в значительной мере обусловливает достижения спортсменов в том или ином виде спорта [3]. Эти свойства мышц частично генетически детерминированы, однако под воздействием тренировок определенной направленности происходит существенное изменение экспрессии генов и, соответственно, морфологических, физиологических и биохимических свойств мышечной ткани [1, 18, 25].
В последние годы представления о метаболических процессах в скелетных мышцах существенно расширились. Внимание исследователей привлекает способность скелетных мышц продуцировать биологически активные вещества [13, 20]. В настоящее время сформировалось представление об эндокринной функции скелетных мышц. Вещества, вырабатываемые мышечными клетками при сокращении, называются «миокинами» [14, 24].
Физические нагрузки способствуют увеличению содержания Na+ в скелетных мышцах в 3–4 раза и снижению К+ до 50 %. Это связано с активацией ионных каналов, а также с частичным ингибированием Na+/K+-АТФ-азы [17, 19]. Повышение внутриклеточного отношения Na+/K+ является достаточным условием для изменения транскрипции десятков универсальных и сотен тканеспецифичных генов и может служить регулятором процессов энергетического обмена [23].
В литературе представлены многочисленные работы, содержащие рекомендации по построению тренировочного процесса в различных видах спорта, основанные на отдельных биохимических характеристиках, однако они во многом противоречат друг другу [1, 7]. Одна из причин этого – при исследованиях на спортсменах объектом анализа, как правило, является кровь, что позволяет лишь косвенно судить о процессах, протекающих в мышечной ткани.
Целью данного исследования было оценить влияние физической активности на энергетический обмен в скелетных мышцах нетренированных и предварительно тренированных экспериментальных животных (мышей).
Материалы и методы исследования. В качестве экспериментальных животных использовали половозрелых (8–12 недель) мышей-самцов линии С57Вl/6 массой 25–30 г (виварий НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга, Томский национальный исследовательский медицинский центр Российской академии наук, Томск, Россия). Для исследования были сформированы группы для острого (нетренированные мыши) и хронического (тренированные мыши) эксперимента.
В первой части исследования использовали динамическую нагрузку в виде принудительного плавания [2, 15] с утяжелением 5; 7,5 и 10 % от массы тела (n = 130). Во второй части исследования использовалась статическая нагрузка в виде виса на горизонтальной сетке [2] с аналогичными утяжелениями (n = 130). Утяжеление представляло собой груз в виде свинцовых шариков, который фиксировался на спине животного с помощью специально изготовленного рюкзака, в лямки которого продевались передние лапы и который крепился под брюшком. Наиболее оптимальной модификацией теста Портсольта для оценки физической выносливости является плавание животного с нагрузкой 10 % от веса тела. Использование нагрузки более 15 % приводит к быстрому утомлению, а плавание с нагрузкой менее 5 % способствует обучению животных.
В каждой части исследования в остром эксперименте мыши контрольной группы (n = 5) не подвергались физической нагрузке. Мыши опытной группы (n = 60) подвергались однократной (тестовой) физической нагрузке.
В хроническом эксперименте все мыши подвергались регулярной физической нагруз- ке (тренировке) ежедневно в течение 4 недель по 1 часу в день без утяжеления. После этого мышей разделяли на две группы: контрольную (n = 5) и опытную (n = 60). Исследование проводилось по той же схеме, что и в первом (остром) опыте. В этом случае тестовую нагрузку мыши проводили через сутки после завершения последней тренировочной нагрузки. Динамические упражнения выполнялись максимум 1 час. Статические упражнения прекращали, когда мышь падала с сетки 3 раза.
Забой животных (методом декапитации) проводили сразу после пробной нагрузки, а также через 1, 5 и 24 часа. Материалом для исследования служили мышцы, извлеченные сразу после декапитации. В зависимости от физической нагрузки извлекали 2 типа мышц: камбаловидную мышцу (musculus soleus) у мышей, которые плавали, и двуглавую мышцу (musculus biceps) у мышей, которые висели на сетке.
Содержание лактата в скелетных мышцах определяли колориметрическим методом. Использовали набор для анализа лактата (колориметрический) производства Cell Biolabs (США).
Определение концентрации гликогена в мышечной ткани проводили с использованием набора для анализа гликогена (кат. № ab65620, ABCAM, Великобритания) с использованием фотометра для микропланшетов Anthos 2010 с программным обеспечением (Biochrom Ltd, Великобритания). Определение концентрации общего белка в образце проводили по методу Брэдфорда. Концентрация гликогена представлена в пересчете на общий белок.
Определение цитратсинтазы, общего ОКСФОС и концентрации изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани выполняли методом вестерн-блоттинга. Электрофорез в полиакриламидном геле проводили в денатурирующих условиях с 5%-ным концентрирующим и 7%-ным разделяющим гелями с использованием электрофоретической системы (электрофоретическая ячейка (Mini-PROTEAN Tetra Bio-Rad, США), блок питания (PowerPacBasic, США)). Данные вестерн-блоттинга представлены в относительных единицах по сравнению с контролем. Контрольные значения приняты за 100 %.
Данные представлены как среднее ± ошибка среднего. После проверки нормального распределения данных с помощью критерия Колмогорова – Смирнова характеристики
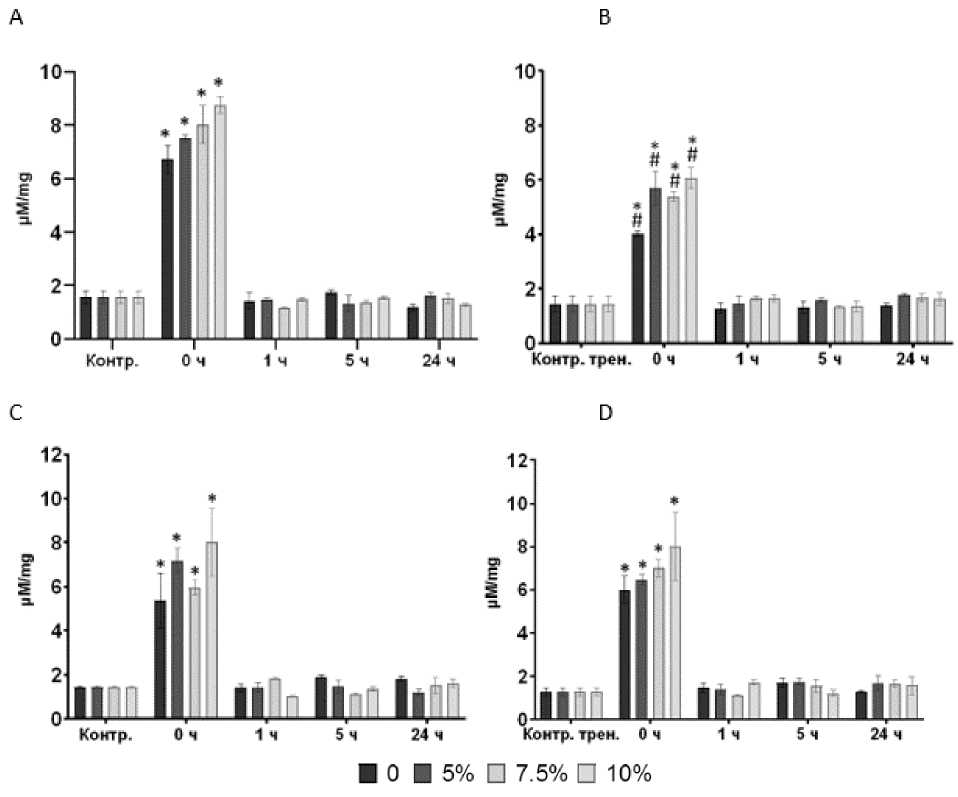
Рис. 1. Концентрация лактата в гомогенате скелетных мышц:
А – группа нетренированных животных после однократной динамической нагрузки; В – группа тренированных животных после однократной динамической нагрузки; C – группа нетренированных животных после однократной статической нагрузки; D – группа тренированных животных после однократной статической нагрузки. * – достоверность различий соответствующего показателя с концентрацией до нагрузки, р < 0,05; # – достоверность различий между тренированными и нетренированными животными одинаковой нагрузки, р < 0,05
Fig. 1. Concentration of lactate in the skeletal muscle homogenate:
A – group of untrained animals after a single dynamic exercise; B – group of trained animals after a single dynamic exercise; C – group of untrained animals after a single static exercise; D – group of trained animals after a single static exercise. * – significance of differences compared to baseline concentration (pre-exercise), р < 0.05; # – significance of differences between trained and untrained animals for the same exercise, p < 0.05
анализировали с помощью двухфакторного дисперсионного анализа Краскела – Уоллиса. Статистическую обработку результатов проводили с помощью пакета приложений GraphPad Prism Version 9.3.1.
Исследования были рассмотрены и одобрены комитетом по биоэтике Биологического института Национального исследовательского Томского государственного университета; протокол № 32 от 02.12.2019.
Результаты исследования. Концентрация лактата в мышечной ткани. У нетренированных животных концентрация лактата в мышцах увеличивается относительно ис- ходного уровня сразу после однократной динамической нагрузки (рис. 1А). Существует прямая связь между степенью применяемого утяжеления и увеличением концентрации лактата. Через час после физической нагрузки концентрация лактата возвращается к исходному уровню и уже не меняется в течение суток.
После 5 недель тренировок в виде ежедневного принудительного плавания мы также наблюдали увеличение концентрации лактата в мышцах в ответ на однократную нагрузку, но прирост был ниже, чем у нетренированных животных (рис. 1В).

Рис. 2. Концентрация гликогена в гомогенате скелетных мышц:
А – группа нетренированных животных после однократной динамической нагрузки. В – группа тренированных животных после однократной динамической нагрузки. C – группа нетренированных животных после однократной статической нагрузки. D – группа тренированных животных после однократной статической нагрузки. * – достоверность различий соответствующего показателя с концентрацией до нагрузки, р < 0,05. # – достоверность различий между тренированными и нетренированными животными одинаковой нагрузки, р < 0,05
Fig. 2. Concentration of glycogen in the skeletal muscle homogenate:
A – group of untrained animals after a single dynamic exercise; B – group of trained animals after a single dynamic exercise; C – group of untrained animals after a single static exercise; D – group of trained animals after a single static exercise. * – significance of differences compared to baseline concentration (pre-exercise), р < 0.05; # - significance of differences between trained and untrained animals for the same exercise, p < 0.05
Повышение концентрации лактата было особенно низким у животных, плававших без отягощений. По-видимому, регулярные динамические нагрузки оказывают тренировочный эффект за счет повышения аэробной производительности [4].
У нетренированных животных концентрация лактата в мышцах увеличивалась при однократной статической нагрузке по сравнению с исходным уровнем сразу после тренировки (рис. 1С). В этом случае также наблюдается четкая взаимосвязь между применяемой степенью утяжеления и увеличением концентрации лактата. Через час после стати- ческой нагрузки концентрация лактата возвращается к исходному уровню и уже не меняется в течение суток. У животных, подвергавшихся ежедневным статическим нагрузкам в виде подвешивания на сетке в течение месяца (рис. 1D), прирост концентрации лактата не отличался от значений, полученных нами в группе нетренированных животных.
Содержание гликогена в скелетной мышечной ткани. У нетренированных животных концентрация гликогена в мышцах при однократной динамической нагрузке снижается относительно исходного уровня сразу после выполнения физической работы (рис. 2А), независимо от утяжеления. Через час после нагрузки концентрация гликогена увеличивается у животных, плавающих с утяжелением 5 и 7,5 % от массы тела. Через пять часов концентрация гликогена во всех группах возвращается к исходному уровню.
После 5 недель тренировок в виде ежедневного принудительного плавания мы наблюдали увеличение концентрации мышечного гликогена в ответ на однократное упражнение, особенно у животных, плавающих с утяжелением 5 и 7,5 % от массы тела (рис. 2В). Этот эффект сохранялся в течение 5 часов (за исключением животных, плавающих без утяжеления). Отсутствие падения мышечного гликогена и повышение уровня лактата может быть связано с потреблением глюкозы из крови или источников гликогена (например, печени).
У нетренированных животных концентрация гликогена в мышцах при однократной статической нагрузке снижается относительно исходного уровня сразу после выполнения физической работы (рис. 2С) пропорционально степени утяжеления. Через час после нагрузки увеличивается концентрация гликогена у животных, выполнявших вис с отягощением 7,5 и 10 % от массы тела. Через пять часов концентрация гликогена возвращается к исходному уровню, и только у животных, выполнявших вис без утяжеления, остается сниженной.
Через месяц занятий в виде ежедневного висения на сетке мы наблюдали снижение концентрации мышечного гликогена в ответ на одно упражнение, за исключением случаев выполнения упражнений без утяжеления (рис. 2D).
Общее содержание белков OXPHOS в ткани скелетных мышц. Для оценки энергетического обмена использовали коктейль с антителами Total OXPHOS Rodent WB, определили пять маркеров: NDUFB8, SDHB, UQCRC2, MTCO1, ATP5F1A.
У нетренированных животных повышенное содержание всех перечисленных маркеров в мышцах отмечалось через час после однократной динамической нагрузки, если она выполнялась с утяжелением 10 % (рис. 3А). При выполнении нагрузки с утяжелением 5 % содержание указанных белков увеличилось на 24-й час. После месяца ежедневных тренировок по принудительному плаванию мы наблюдали увеличение исходного количества SDHB (рис. 3H) и NDUFB8 (рис. 3В). После однократной динамической нагрузки отмечено увеличение содержания всех перечисленных маркеров, если нагрузку выполняли с утяжелением 5 %.
После однократной статической нагрузки у нетренированных животных повышенная концентрация всех перечисленных маркеров в мышцах отмечалась уже через час и сохранялась в течение 24 часов. Выраженной зависимости от степени утяжеления мы не наблюдали (рис. 4А). Через месяц тренировок в виде ежедневного принудительного висения на сетке мы наблюдали увеличение исходной концентрации всех маркеров (рис. 4В). После однократной статической нагрузки концентрация всех перечисленных маркеров не изменилась.
Содержание цитратсинтазы в мышечной ткани. У нетренированных животных повышенное содержание цитратсинтазы в мышцах отмечалось через час после однократной динамической нагрузки, если она выполнялась с утяжелением 10 % (рис. 5А). При выполнении нагрузки с утяжелением 5%-ная концентрация цитратсинтазы возрастала на 24-й час. Через месяц тренировок в виде ежедневного принудительного плавания мы наблюдали незначительное повышение концентрации цитратсинтазы в мышцах в ответ на однократное физическое упражнение через час только у животных, выполнявших нагрузку с 5%-ным утяжелением (рис. 5В).
У нетренированных животных через час после однократной статической нагрузки концентрация цитратсинтазы в мышцах удваивалась независимо от степени утяжеления (рис. 5С). Через 24 часа этот показатель несколько снизился, но остался выше исходных значений. Через месяц тренировок в виде ежедневных принудительных висов на сетке мы наблюдали двукратное увеличение концентрации цитратсинтазы в мышцах в состоянии покоя. В ответ на одиночное упражнение через час наблюдалось некоторое снижение только у животных, выполнявших нагрузку с 10%-ным утяжелением (рис. 5D).
Содержание изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани. У нетренированных животных повышение содержания изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани выявлялось через час после однократной динамической нагрузки независимо от утяжеления и сохранялось на повышенном уровне в течение 24 часов (рис. 6А).
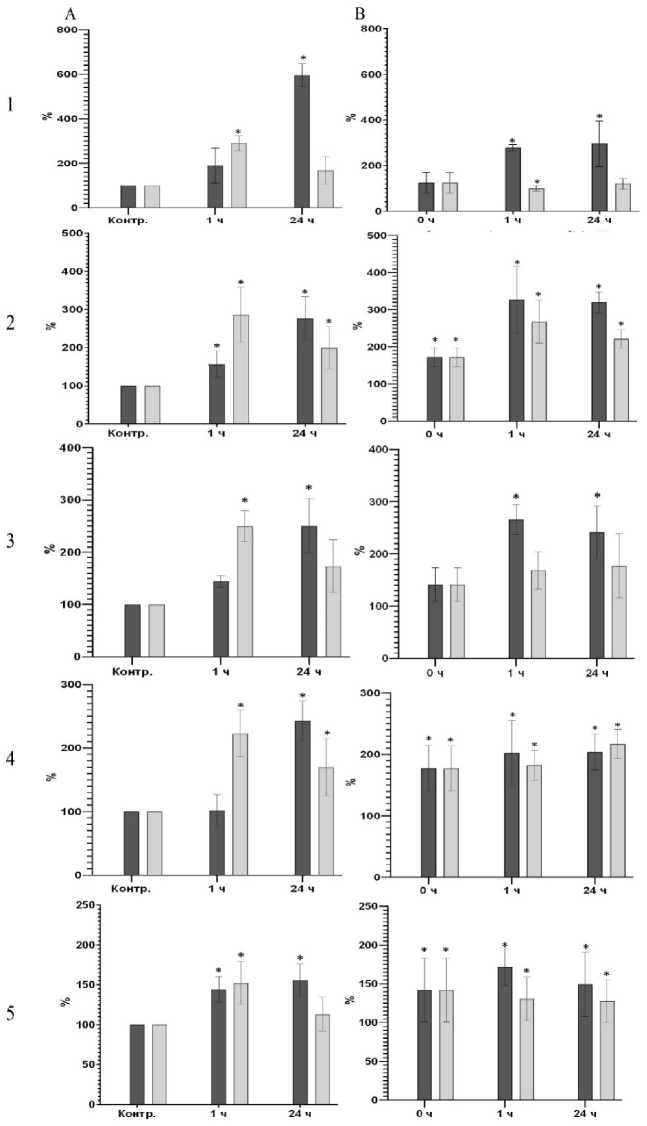
Рис. 3. Концентрация в гомогенате скелетных мышц после динамической нагрузки, % относительно контрольной группы:
А – группа нетренированных животных после однократной динамической нагрузки; В – группа тренированных животных после однократной динамической нагрузки. 1 – ATP5A; 2 – UQCRC2; 3 – MTCO1; 4 – SD HB; 5 – NDUFB8. Темные столбики – утяжеление 5 %, светлые столбики – 10 %. * – достоверность различий соответствующего показателя с концентрацией до нагрузки, р < 0,05
Fig. 3. Concentration in the skeletal muscle homogenate after dynamic exercise, % relative to the control group:
A – group of untrained animals after a single dynamic exercise; B – group of trained animals after a single dynamic exercise. 1 – ATP5A; 2 – UQCRC2; 3 – MTCO1; 4 – SD HB; 5 – NDUFB8. Dark bars – weighting 5%, light bars – 10%. * – significance of differences compared to baseline concentration (pre-exercise), р < 0.05
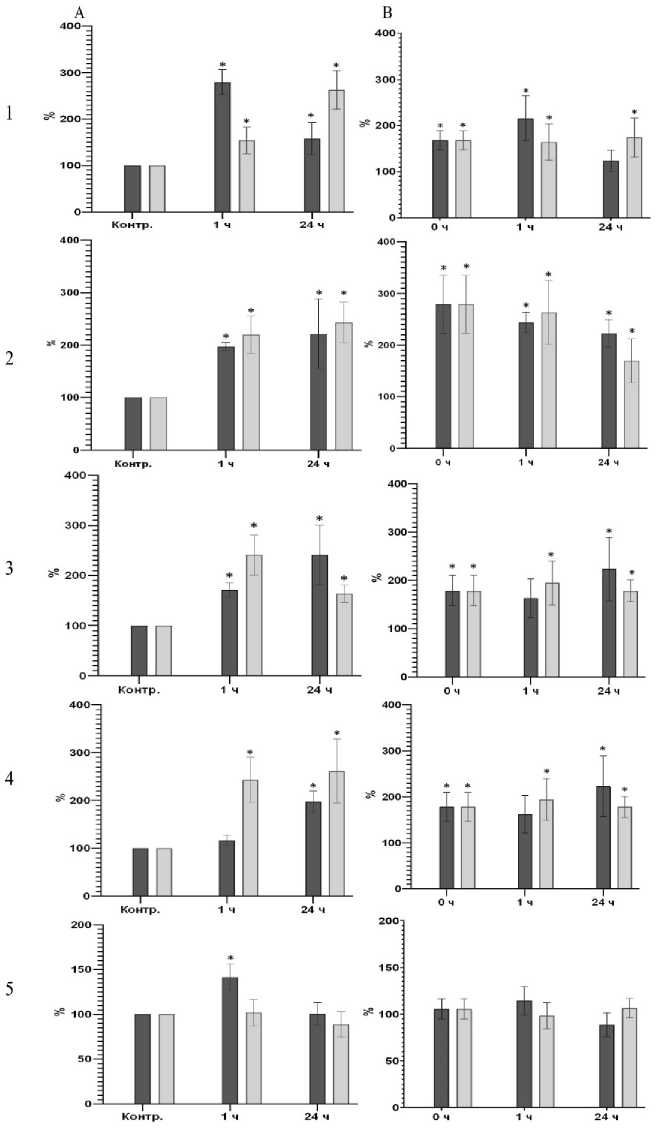
Рис. 4. Концентрация в гомогенате скелетных мышц после статической нагрузки, % относительно контрольной группы:
А – группа нетренированных животных после однократной динамической нагрузки. В – группа тренированных животных после однократной динамической нагрузки. 1 – ATP5A; 2 – UQCRC2; 3 – MTCO1; 4 – SD HB; 5 – NDUFB8. Темные столбики – утяжеление 5 %, светлые столбики – 10 %. * – достоверность различий соответствующего показателя с концентрацией до нагрузки, р < 0,05
Fig. 4. Concentration in the skeletal muscle homogenate after static exercise, % relative to the control group:
A – group of untrained animals after a single dynamic exercise; B – group of trained animals after a single dynamic exercise. 1 – ATP5A; 2 – UQCRC2; 3 – MTCO1; 4 – SD HB; 5 – NDUFB8. Dark bars – weighting 5%, light bars – 10%. * – significance of differences compared to baseline concentration (pre-exercise), р < 0.05
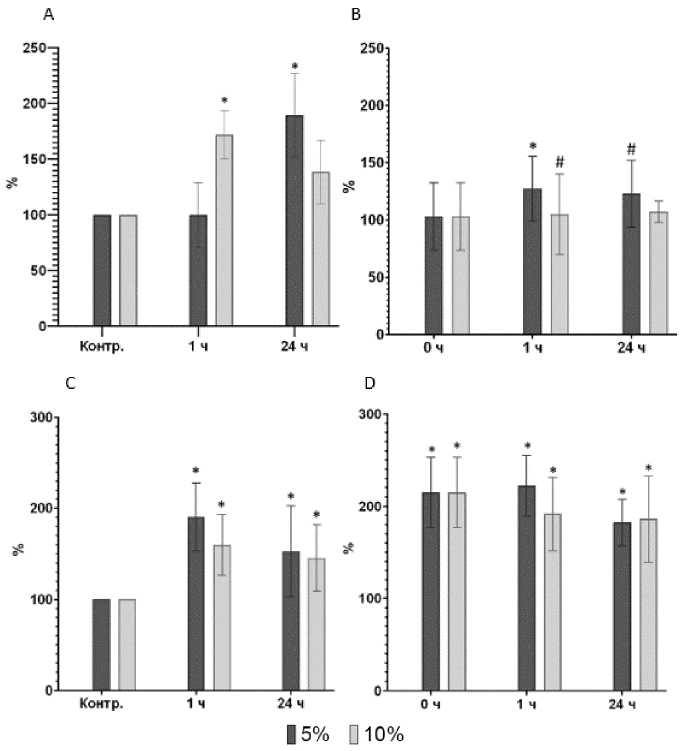
Рис. 5. Концентрация цитратсинтазы в гомогенате скелетных мышц после физической нагрузки, % относительно контрольной группы:
А – группа нетренированных животных после однократной динамической нагрузки; В – группа тренированных животных после однократной динамической нагрузки; C – группа нетренированных животных после однократной статической нагрузки; D – группа тренированных животных после однократной статической нагрузки. * – достоверность различий соответствующего показателя с концентрацией до нагрузки, р < 0,05; # – достоверность различий между тренированными и нетренированными животными, р < 0,05
Fig. 5. Concentration of citrasynthase in the skeletal muscle homogenate after exercise, % relative to the control group:
A – group of untrained animals after a single dynamic exercise; B – group of trained animals after a single dynamic exercise; C – group of untrained animals after a single static exercise; D – group of trained animals after a single static exercise. * – significance of differences compared to baseline concentration (pre-exercise), р < 0.05; # – significance of differences between trained and untrained animals, р < 0.05
Через месяц тренировок в виде ежедневного принудительного плавания мы наблюдали двукратное увеличение концентрации изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани перед нагрузкой. В ответ на однократное упражнение через час концентрация фермента не изменилась, незначительное повышение отмечено через 24 часа только при утяжелении 5 % (рис. 6В).
У нетренированных животных повышение концентрации изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани выявлялось через час после однократной статической нагрузки и сохранялось на повышенном уровне в течение 24 часов (рис. 6С). Увеличение было несколько более выраженным с 5%-ным утяжелением, чем с 10%-ным.
После месяца тренировок в виде ежедневных принудительных висов на сетке мы наблюдали более чем трехкратное увеличение концентрации изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани перед нагрузкой (рис. 6D). В ответ на однократное статическое упражнение через час концентрация
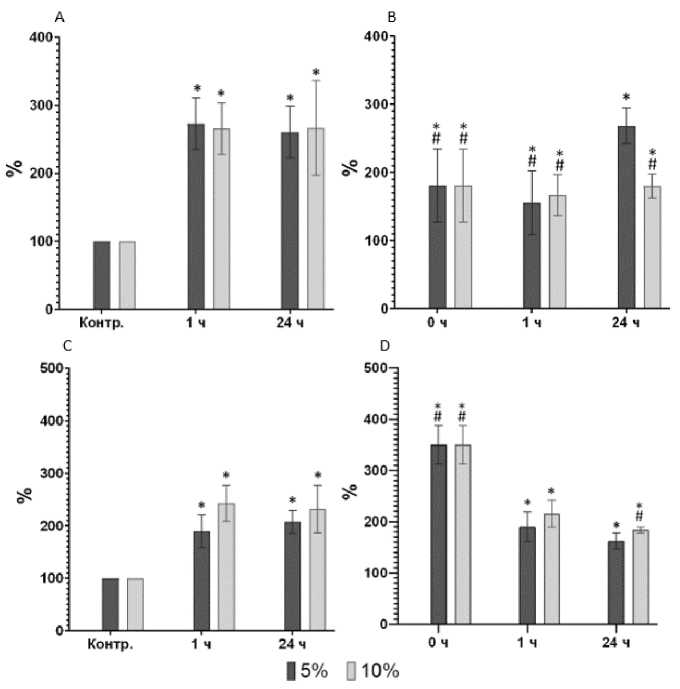
Рис. 6. Концентрация α2 Na+/K+-AТФ-азы в гомогенате скелетных мышц после динамической нагрузки:
А – группа нетренированных животных после однократной динамической нагрузки; В – группа тренированных животных после однократной динамической нагрузки; C – группа нетренированных животных после однократной статической нагрузки; D – группа тренированных животных после однократной статической нагрузки. * – достоверность различий соответствующего показателя с концентрацией до нагрузки, р < 0,05; # – достоверность различий между тренированными и нетренированными животными, р < 0,05
Fig. 6. Concentration of α2 Na+/K+-ATP-ase in the skeletal muscle homogenate after dynamic exercise:
A – group of untrained animals after a single dynamic exercise; B – group of trained animals after a single dynamic exercise; C – group of untrained animals after a single static exercise; D – group of trained animals after a single static exercise. * – significance of differences compared to baseline concentration (pre-exercise); р < 0.05; # – significance of differences between trained and untrained animals, р < 0.05
фермента снижалась, к 24 часам отмечалось дополнительное снижение. При утяжелении 5 % снижение было более выраженным.
Обсуждение. Концентрация лактата в мышцах - объективный показатель, позволяющий интегрально оценить реакцию организма на физическую нагрузку, степень напряжения адаптационных механизмов и активацию метаболических процессов [4]. Во всех группах наблюдалась сходная динамика изменения концентрации лактата в мышечной ткани. После физической нагрузки отмечено значительное увеличение лактата с последующим возвращением к базальному уровню в течение 24 часов.
Гликоген представляют собой энергетический субстрат, который может использоваться для ресинтеза энергии АТФ при мышечной работе. В настоящее время также признано, что гликоген является мощным регулятором сигнальных путей в мышечной клетке [6]. Концентрация гликогена увеличивалась позже - через час и более - и у предварительно тренированных животных дольше оставалась на повышенном уровне. Также предварительная тренировка, как динамическая, так и статическая, повышала показатели мышечного энергетического обмена (увеличение уровня гликогена). Однако у предтре-нированных животных реакция на однократ- ную нагрузку была менее выражена, чем у нетренированных.
В результате исследования изменения цитратсинтазы и ферментов системы OXPHOS на фоне однократной физической нагрузки было выявлено увеличение данных ферментов после однократной физической нагрузки. Содержание этих ферментов характеризует общий энергетический потенциал клетки [21, 25]. В то же время регулярные тренировочные нагрузки статического и динамического характера по-разному влияли на содержание этих ферментов. Прирост содержания цитратсинтазы и ферментов системы OXPHOS был существенно более выражен под влиянием упражнений статического характера, чем динамического. В то же время, если у тренированных животных в ответ на однократную динамическую нагрузку отмечался дополнительный прирост данного фермента, то на статическую реакция отсутствовала, а со стороны цитратсинтазы даже наблюдалось снижение.
Как динамические, так и статические нагрузки влияют на содержание одновалентных катионов в клетках скелетных мышц, вызывая увеличение внутриклеточного соотношения Na+/K+. Как было показано в предыдущей нашей работе [9], отчетливо видна связь между степенью применяемого утяжеления и изменением диссипации одновалентных катионов. Через месяц тренировок в мышцах отмечается повышенное содержание Na+ и K+, но соотношение Na+/K+ остается неизменным. После физических нагрузок у тренированных животных отмечена корреляция между изменением концентрации изоформы Na+/K+-АТФ-азы альфа 2 в мышечной ткани и содержанием в ткани одновалентных катионов.
Возбуждение миоцитов сопровождается изменением трансмембранного градиента одновалентных катионов за счет притока Na+ и оттока K+ через потенциалзависимые и Са2+-чувствительные ионные каналы. Ранее, чтобы оценить относительный вклад Ca2+ i -опосре-дованного и Ca2+ i -независимого сигнальных путей, мы сравнили транскриптомные изменения с увеличением отношения Na+/K+ в клетках, истощенных по Ca2+, и обнаружили увеличение числа специфические Na+/K+-чувствительные гены [10, 11].
Однако молекулярная природа сенсоров, посредством которых осуществляется внут- риклеточная Na+ и K+ регуляция процессов транскрипции и трансляции, до сих пор остается предметом дискуссий [5, 22]. В этом аспекте интересен тот факт, что увеличение отношения Na+/K+ в цитоплазме клеток скелетных мышц при сокращении сопровождается повышением активности α2Na+/K+-АТФ-азы, которая способен частично нейтрализовать этот эффект благодаря высокому сродству этой изоформы фермента к внутриклеточному Na+ [12, 16].
Заключение. Подводя итог изложенному, можно отметить, что динамические и статические нагрузки по-разному влияют на показатели, характеризующие энергетический обмен в мышцах нетренированных и предварительно тренированных экспериментальных животных. Если эффекты однократных нагрузок статического и динамического характера различались не столь существенно, то влияние ежедневных тренирующих воздействий различалось значительно. Тренировки статического характера приводили к существенно более выраженным перестройкам в энергетическом метаболизме мышечных клеток. На показатели энергетического метаболизма у предварительно тренированных животных влияние однократной статической нагрузки было менее выражено, чем динамической.
Традиционно полагают, что клеточный состав скелетных мышц и фенотипические характеристики мышечных волокон, изменяясь в результате регулярных тренировок, могут модифицировать процессы энергетического метаболизма. Однако влияние физической нагрузки на диссипацию трансмембранных градиентов одновалентных катионов и обнаруженная в данной работе взаимосвязь соотношения одновалентных катионов и содержания α2Na+/K+-АТФ-азы позволяет предположить, что определенную роль в этом могут играть Na+/K+-зависимые механизмы запуска транскрипции генов.
Модификация этих механизмов под влиянием физических нагрузок различного характера и интенсивности представляет значительный интерес, так как является перспективным способом воздействия на метаболические процессы как на клеточном, так и на системном уровнях, что очень важно для улучшения спортивной работоспособности и для коррекции метаболических нарушений при ряде социально-значимых заболеваний.
Список литературы Энергетический обмен в мышечной ткани при статических и динамических нагрузках (экспериментальное исследование)
- Мякотных В.В. О трансформации мышечных волокон в процессе спортивной тренировки // Вестник спортивной науки. 2019. № 2. С. 14–20. [Myakotnykh V.V. [On the Transformation of Muscle Fibers in the Process of Sports Training (Literature Review)]. Vestnik sporivnoy nauki [Journal Sport Science], 2019, no. 2, pp. 14–20. (in Russ.)]
- Bagmetova V.V., Krivitskaya A.N., Tyurenkov I.N. et al. The Influence of Fenibut and its Salt with Succinic Acid on Animals’ Resistance to Forced Dynamic and Static Physical Loads. Fundamental Research, 2012, no. 4, pt. 2, pp. 243–246. DOI: 10.1007/s10517-015-2887-8
- Fitts R.H., Widrick J.J. Muscle Mechanics: Adaptations with Exercise-Training. Exercise and Sport Sciences Reviews, 1996, vol. 24, pp. 427–473. PMID: 8744258 DOI: 10.1249/00003677-199600240-00016
- Graham D., Lamb D., Stephenson G. Point: Counterpoint: Lactic Acid Accumulation is an Advantage/ Disadvantage During Muscle Activity. Journal of Applied Physiology: Respiratory, Environmental and Exercise Physiology, 2006, vol. 100 (4), pp. 1410–1412. DOI: 10.1152/japplphysiol.00023.2006
- Gundersen K. Excitation-Transcription Coupling in Skeletal Muscle: the Molecular Pathways of Exercise. Biological Reviews of the Cambridge Philosophical Society, 2011, vol. 86, pp. 564–600. DOI: 10.1111/j.1469-185X.2010.00161.x
- Hearris M., Hammond K., Fell J., Morton J. Regulation of Muscle Glycogen Metabolism during Exercise: Implications for Endurance Performance and Training Adaptations. Nutrients, 2018, vol. 10 (3), pp. 298–320. DOI: 10.3390/nu10030298
- Juel C., Klarskov C., Nielsen J.J. et al. The Effect of High-Intensity Periodic Training on Lactate and H+ Release from Human Skeletal Muscle. American Journal of Phisiologi, 2004, vol. 286 (2), pp. 245–251. DOI: 10.1152/ajpendo.00303.2003
- Karkischenko V.N., Kapanadze G.D., Dengina S.E., Stankova N.V. Working out of a Technique for Physical Endurance of Small Laboratory Animals for Studying of Different Medicine. Biomedicine, 2011, vol. 1, pp. 72–74.
- Kironenko T.A., Milovanova K.G., Zakharova A.N. et al. Effect of Dynamic and Static Load on the Concentration of Myokines in the Blood Plasma and Content of Sodium and Potassium in Mouse Skeletal Muscles. Biochemistry, 2021, vol. 86, no. 3, pp. 370–381. DOI: 10.1134/S0006297921030123
- Koltsova S.V., Shilov B., Burulina J.G. et al. Transcriptomic Changes Triggered by Hypoxia: Evidence for HIF-1α -Independent, [Na+]i/[K+]i-Mediated Excitation-Transcription Coupling. PLoS One, 2014, vol. 9, e110597. DOI: 10.1371/journal.pone.0110597
- Koltsova S.V., Tremblay J., Hamet P., Orlov S.N. Transcriptomic Changes in Ca2+-Depleted Cells: Role of Elevated Intracellular [Na+]/[K+] Ratio. Cell Calcium, 2015, vol. 58, pp. 317–324. DOI: 10.1016/j.ceca.2015.06.009
- Kravtsova V.V., Petrov A.M., Matchkov V.V. et al. Distinct α2 Na, K-ATPase Membrane Pool are Differently Involved in Early Skeletal Muscle Remodeling During Disuse. The Journal of General Physiology, 2016, vol. 147, pp. 175–188. DOI: 10.1085/jgp.201511494
- Laurens C., Bergouignan A., Moro C. Exercise-Released Myokines in the Control of Energy Metabolism. Frontiers in Physiology, 2020, vol. 11, p. 91. DOI: 10.3389/fphys.2020.00091
- Little H.C., Tan S.Y., Cali F.M. et al. Multiplex Quantification Identifies Novel Exerciseregulated Myokines/Cytokines in Plasma and in Glycolytic and Oxidative Skeletal Muscle. Molecular & Cellular Proteomics, 2018, vol. 17, pp. 1546–1563. DOI: 10.1074/mcp.RA118.000794/
- Lukaszuk B., Bialuk I., Górski J. et al. A Single Bout of Exercise Increases the Expression of Glucose but not Fatty Acid Transporters in Skeletal Muscle of IL-6 KO Mice. Lipids, 2012, vol. 47, pp. 763–772. DOI: 10.1017/S00439339140005
- Matchkov V.V., Krivoi I.I. Specialized Functional Diversity and Interactions of Na,K-ATPase. Frontiers in Physiology, 2016, vol. 7, p. 179. DOI: 10.3389/fphys.2016.00179
- McKenna M.J., Bangsbo J., Renaud J.M. Muscle K+, Na+, and Cl– Disturbances and Na+-K+ Pump Inactivation: Implications for Fatigue. The Journal of Applied Physiology, 2008, vol. 104, pp. 288–295. DOI: 10.1152/japplphysiol.01037.2007
- Mika A., Macaluso F., Barone R. et al. Effect of Exercise on Fatty Acid Metabolism and Adipokine Secretion in Adipose Tissue. Frontiers in Physiology, 2019, vol. 10, p. 26. DOI: 10.3389/fphys.2019.00026
- Orlov S.N., Hamet P. Salt and Gene Expression: Evidence for [Na+]i/[K+]i-Mediated Signaling Pathways. Pflugers Archiv, 2015, vol. 467, pp. 489–498. DOI: 10.1007/s00424-014-1650-8
- Peake J.M., Gatta P.D., Suzuki K., Nieman D.C. Cytokine Expression and Secretion by Skeletal Muscle Cells: Regulatory Mechanisms and Exercise Effects. Exercise Immunology Review, 2015, vol. 21, pp. 8–25. PMID: 25826432
- Perry Ch.G.R., Lally J., Holloway G.P. et al. Repeated Transient mRNA Bursts Precede Increases in Transcriptional and Mitochondrial Proteins During Training in Human Skeletal Muscle. The Journal of Physiology, 2010, vol. 588, no. 23, pp. 4795–4810. DOI: 10.1113/jphysiol.2010.199448
- Popov D.V., Lysenko E.A., Bokov R.O. et al. Effect of Aerobic Training on Baseline Expression of Signaling and Respiratory Proteins in Human Skeletal Muscle. Physiological Reports, 2018, vol. 6, e13868. DOI: 10.14814/phy2.13868
- Smolyaninova L.V., Koltsova S.V., Sidorenko S.V., Orlov S.N. Augmented Gene Expression Triggered by Na+, K+ -ATPase Inhibition: Role of Cai 2+-Mediated and -Independent Excitation- Transcription Coupling. Cell Calcium, 2017, vol. 68, pp. 5–13. DOI: 10.1016/j.ceca.2017.10.002
- Supruniuk E., Maciejczyk M., Zalewska A. et al. Blood Profile of Cytokines, Chemokines, Growth Factors, and Redox Biomarkers in Response to Different Protocols of Treadmill Running in Rats. International Journal of Molecular Sciences, 2020, vol. 21 (21), 8071. DOI: 10.3390/ijms21218071
- Suzuki K., Tominaga T., Ruhee R.T., Ma S. Characterization and Modulation of Systemic Inflammatory Response to Exhaustive Exercise in Relation to Oxidative Stress. Antioxidants (Basel), 2020, vol. 9 (5), p. 401. DOI: 10.3390/antiox9050401


