Эпидемиологические аспекты нозокомиальной синегнойной инфекции в многопрофильном хирургическом стационаре
Автор: Карпунина Т.И., Кузнецова М.В., Николаева Н.В., Демаков В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Организация здравоохранения и общественное здоровье
Статья в выпуске: 4-1 т.24, 2009 года.
Бесплатный доступ
Проанализированы роль и место ОРИТ в развитии нозокомиальной синегнойной инфекции на основе изучения 58 культур Pseudomonas aeruginosa, изолированных в январе-марте 2009 г. в различных отделениях многопрофильного хирургического стационара. Наряду с бактериологическими тестами (определение антибиотикочувствительности, пленкообразования, гемолитической и фосфолипазной активности) проведено генетическое типирование штаммов посредством полимеразной цепной реакции (DAF-ПЦР). Установлено, что 86,2% изолятов оказались полирезистентными в отношении взятого спектра препаратов с антисинегнойной активностью. Совокупностью всех изучаемых признаков чаще характеризовались штаммы из ОРИТ. Молекулярногенетическое исследование выявило, что большинство из них представляет один геновариант P. aeruginosa. Идентичный генетический профиль был обнаружен у ряда культур, изолированных от пациентов из других отделений. Полагаем, что ОРИТ явилось местом формирования и источником распространения госпитального штамма. Значительная доля среди внебольничных штаммов высокорезистентных вариантов свидетельствует о том, что традиционный маркер госпитальности - антибиотикоустойчивость не является основополагающим применительно к P. aeruginosa.
Госпитальная инфекция, орит, генотипирование
Короткий адрес: https://sciup.org/14919149
IDR: 14919149 | УДК: 617
Текст научной статьи Эпидемиологические аспекты нозокомиальной синегнойной инфекции в многопрофильном хирургическом стационаре
E-mail: mar@iegm.ru
ЭПИДЕМИОЛОГИЧЕСКИЕ АСПЕКТЫ НОЗОКОМИАЛЬНОЙ СИНЕГНОЙНОЙ ИНФЕКЦИИ В МНОГОПРОФИЛЬНОМ ХИРУРГИЧЕСКОМ СТАЦИОНАРЕ
* ГОУ ВПО «ПГМА им. ак. Е.А. Вагнера Росздрава», г. Пермь;
** Институт экологии и генетики микроорганизмов УрО РАН
Внутрибольничные инфекции вообще и в частности, обусловленные Pseudomonas aeruginosa, на протяжении длительного времени остаются серьезной проблемой клинической медицины и микробиологии. В последнее время она привлекает внимание все большего числа эпидемиологов, что связано не только с обсуждением новых направлений в эпидемиологии, затрагивающих такие понятия, как «фи-тонозы», «донозологические формы» той или иной инфекции, и другие. Достаточно противоречивы мнения исследователей, касающиеся таких устоявшихся понятий, как резервуар, источник, пути и механизмы передачи, критерии госпитальности, когда речь заходит о возбудителях нозокомиальной синегнойной инфекции. Подобные разночтения возникают не только по поводу заболеваний, связанных с P. aeruginosa, но и с большинством других внутрибольничных инфекционных осложнений, в этиологии которых установлено участие условно патогенных микроорганизмов (УПМ). Как правило, внутрибольничные инфекции, вызванные УПМ, развиваются на фоне основного заболевания у иммуноком-промитированных пациентов. Зачастую гнойно-септические инфекции (ГСИ) регистрируют после оперативных вмешательств, инвазивных лечебных и диагностических процедур. В подобных случаях самостоятельный интерес представляет оценка принадлежности изолируемого штамма к внутрибольничному, а в случае заноса – мониторинг возможной 70
трансформации внебольничных возбудителей в нозокомиальные. Как отмечают многие исследователи, особое место в развитии эпидпроцесса внутрибольничной инфекции в многопрофильном хирургическом стационаре отводится отделениям реанимации и интенсивной терапии (ОРИТ), характеризующимся чрезвычайно высоким риском возникновения ГСИ, превышающим таковой в других отделениях в 5-10 раз [1, 2, 3].
Ранее нами были показаны фенотипическая гетерогенность популяций P. aeruginosa в различных отделениях крупного хирургического стационара и определенное своеобразие фенотипов циркулирующих в них штаммов [4]. Однако в связи с высокой частотой встречаемости в различных отделениях сходных по свойствам вариантов закономерно возникал вопрос: не становятся ли госпитализированные в ОРИТ пациенты причиной распространения высоковирулентных штаммов при переводе их в другие отделения? Фенотипические характеристики изолируемых культур с учетом зависимости проявления определяемых свойств от внешних условий не позволяют дать однозначного ответа на поставленный вопрос.
В этой связи цель исследования – проанализировать роль и место ОРИТ в развитии нозокомиальной синегнойной инфекции в крупном хирургическом стационаре с применением молекулярно-генетических методов анализа.
МАТЕРИАЛ И МЕТОДЫ
Проведен ретроспективный анализ историй болезни 58 пациентов, находившихся на лечении в многопрофильном хирургическом стационаре в период январь–апрель 2009 г., инфицированных P. aeruginosa. Исследовано 58 штаммов, выделенных, в том числе, из отделения экстренной хирургии (ЭХО) – 20, торакального хирургического отделения (ТХО) – 18, отделения острой сердечно-сосудистой хирургии (ОССХ) – 4 и отделения реанимации и интенсивной терапии (ОРИТ) – 16. Источниками выделения P. aeruginosa в большинстве случаев были раневое отделяемое, мокрота и бронхиальный лаваж, содержимое кишечника, то есть выделенные микроорганизмы могли быть как этиологическими агентами инфекции, так и представителями транзиторной микрофлоры. Штаммы, выделенные повторно от од- ного больного, из проводимого анализа исключались. Оценка ингибирования роста бактерий антибактериальными препаратами осуществлялась диско-диффузионным методом в соответствии с МУК 4.2.1890-04. Образование биопленок изучали на поверхности 96-луночного полистиролового планшета согласно И.А. Шагиняну [5]. Гемолитическую активность (ГА) оценивали на кровяном агаре по величине зоны просветления вокруг колоний исследуемых штаммов. Фосфолипазную активность (ФА) изучали на желточном агаре. Генетическое типиро-вание штаммов осуществляли посредством полимеразной цепной реакции (DAF-ПЦР), как описано J. Versalovic et al. [6].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установлено, что на определенном этапе стационарного лечения 38 (65,52%) человек из 58 госпитализированных и инфицированных P. aeruginosa являлись пациентами ОРИТ. В 6 случаях P. aeruginosa была выделена от больных до пребывания в ОРИТ, в 16 – после перевода в профилированное отделение, от остальных 16 человек – во время их лечения в ОРИТ.
Из 58 изученных культур 50 (86,2%) были поли-резистентными. Из оставшихся 8 изолятов 6 штаммов были выделены до поступления больных в ОРИТ (4 резистентны к цефтазидиму и цефепиму, 2 – только к цефтазидиму), и 2 выделены от пациентов, не проходивших лечение в ОРИТ (чувствительны ко всем исследованным антибиотикам). Чувствительные штаммы P. aeruginosa выделяли от больных в ранние сроки госпитализации (до 4 суток).
На основании антибиотикограмм штаммов P. aeruginosa выявлены наиболее распространенные анти-биотикофенотипы (табл. 1).
Все культуры образовывали пигмент и обладали гемолитической активностью, пленкообразование и фосфолипазная активность отмечены у 72,4% и 79,3%, соответственно. Чаще всего совокупность всех изучаемых признаков была обнаружена у штаммов синегнойной палочки, изолированных из мокроты и трахеобронхиального отделяемого. Учитывая, что подавляющее большинство штаммов образовывало пигмент и проявляло гемолитическую активность, тогда как выраженность фосфолипазной активности и способность к пленкообразованию варьировали, именно последние два признака были выбраны для популяционной характеристики штаммов (табл. 2).
Штаммы с полным набором свойств были изолированы во всех отделениях, но наибольшее их число было получено из ОРИТ. На основании фенотипических характеристик можно предположить, что в отделениях многопрофильного стационара циркулирует один (16 изолятов) ведущий штамм P. aeruginosa, для которого характерна устойчивость ко всем исследованным антисинегнойным антибиоти-
Таблица 1
Наиболее распространенные фенотипы изученных штаммов P. aeruginosa
|
Антибиотикофенотип |
Число штаммов |
% |
|
Цефтазидим+цефепим+имипенем +гентамицин+амикацин +ципрофлоксацин (фенотип А) |
22 |
37,93 |
|
Цефтазидим+цефепим+имипенем +гентамицин+ципрофлоксацин (фенотип В) |
4 |
6,90 |
|
Цефепим+имипенем+гентамицин+ ципрофлоксацин (фенотип С) |
10 |
17,24 |
|
Цефтазидим+цефепим (фенотип D) |
4 |
6,90 |
|
Другие фенотипы (встречаются не более чем у 3 штаммов) |
16 |
27,58 |
|
Чувствительные штаммы |
2 |
3,45 |
Таблица 2
Встречаемость сочетания высокой степени антибиотикорезистентности и изучаемых факторов патогенности среди штаммов P. aeruginosa
До последнего времени не сложилось единого мнения о преобладании экзо- либо эндогенного происхождения синегнойной инфекции в ОРИТ. Ряд исследователей пришли к заключению, что по мере нахождения пациентов в ОРИТ важную роль приобретает экзогенное инфицирование больных P. aeruginosa (до 50% случаев) [2, 7, 8]. Однако точно установить сроки, в течение которых происходит колонизация нестерильных локусов пациента госпитальной микрофлорой, достаточно сложно, так как это определяется многими факторами [9].
Для выявления эпидемиологических связей проведен ретроспективный анализ историй болезней пациентов, в материале которых были обнаружены штаммы P. aeruginosa с ведущим фенотипом. Оказа- лось, что все они были изолированы от больных, проходивших лечение в ОРИТ: в 10 случаях – во время их пребывания в отделении, в 2 – через сутки после перевода в профильное отделение и в 4 отмечена поздняя манифестация ГСИ (9, 11, дважды 12 дней, соответственно). Период пребывания в ОРИТ составлял от 1 до 4 дней, а время от перевода в хирургические отделения из ОРИТ до выделения возбудителя варьировало от 1 до 12 (!) дней. Впервые штамм с такими свойствами был изолирован из содержимого кишечника больного М. 30.01.09 в ТХО, откуда в связи с ухудшением состояния он был переведен в ОРИТ. На протяжении всего периода исследования штаммы с подобным фенотипом периодически выделяли от пациентов всех отделений, в то время как из ОРИТ – с заметным постоянством. Учитывая полирезистентность и большой набор факторов патогенности у выделенного варианта, продолжительность его персистирования в ОРИТ (3 месяца), можно говорить о том, что именно в этом отделении складываются наиболее благоприятные условия для селекции и закрепления штаммов, отличающихся высоким патогенным потенциалом. По-ви-димому, изоляты из ЭХО, ТХО и ОССХ со схожими свойствами также имеют «реанимационное» происхождение. Принимая во внимание, что доля пациентов, проходящих через ОРИТ, во всех отделениях достаточно высока (табл. 3), можно полагать, что колонизация/инфицирование пациентов внутрибольничными штаммами происходит именно в ОРИТ с последующим распространением по отделениям.
Нужно отметить, что в то же самое время в хирургических отделениях стационара, включая ОРИТ, были изолированы штаммы P. aeruginosa, фенотипы которых не совпадали с ведущим, причем временной интервал их циркуляции в отделениях не превышал 1 месяца. Так, штамм P. aeruginosa 1-6 антибиотикофенотипа С с пленкообразующей способностью и продуцирующий фосфолипазу впервые изолирован в ОРИТ 13.02.09, и в течение месяца идентичные культуры выделяли из материала пациентов ТХО (P. aeruginosa 1-8; 1-9; 1-12; 2-1). По-видимому, одновременно в многопрофильном стационаре могут циркулировать несколько штаммов, формируя «длинные» или «короткие» эпидемиологические цепочки. 9 штаммов имели собственные индивидуальные ха-
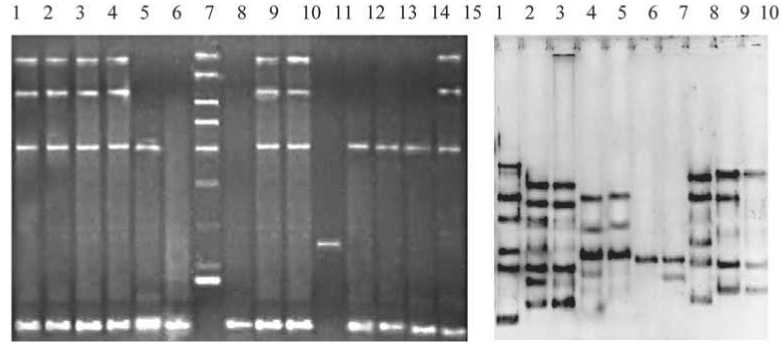
А
В
Рис. 1. Пример электрофоретического анализа продуктов DAF-ПЦР клинических изолятов P. aeruginosa. А: 1-15 – штаммы, изолированные в ОРИТ; В: 1-5 – штаммы, изолированные в ТХО; 6-10 – штаммы, изолированные в ЭХО
Таблица 3
Динамика пребывания пациентов в многопрофильном хирургическом стационаре (данные за год)
С учетом того факта, что в зависимости от условий внутрибольничной среды, характера биотопа/ материала, иммунологической реактивности макроорганизма, один и тот же штамм в процессе циркуляции может по-разному проявлять свои свойства, и наоборот, разные штаммы могут иметь одинаковые профили резистентности, продуцировать одни и те же факторы патогенности, было проведено генотипирование выделенных культур (рис. 1). Молекулярногенетическое исследование выявило, что большинство штаммов P. aeruginosa, изолированных в ОРИТ, представляют один геновариант (рис. 1, А). Идентичный генетический профиль был обнаружен у ряда культур, изолированных от пациентов других отделений: ЭХО – 6 (30%) штаммов, ТХО – 4 (22,2%) штамма, ОССХ – 2 штамма (все пациенты прошли лечение в ОРИТ). Установлено, что некоторые изо-ляты имели сходный DAF-профиль с основным («модальным») вариантом, но отличались на 1-2 генетических события и, по-видимому, являлись близкородственными. Наблюдалось некоторое несоответст- вие между данными фенотипического и генетического анализа: не все штаммы, принадлежащие к одному геноварианту, были фенотипически идентичны. При использовании только бактериологического метода эти культуры были нами приняты за разные.
Выявлено значительное количество геновариан-тов штаммов P. aeruginosa, не имеющих отношения к основному штамму. Наибольшее число таких культур обнаружено в ТХО – 7 и ЭХО – 6, причем среди них встречались идентичные изоляты (рис. 1, В). Гетерогенность DAF-профилей возбудителей, изолированных в этих отделениях, может свидетельствовать о внебольничном происхождении большинства штаммов.
ЗАКЛЮЧЕНИЕ
Наше предположение о циркуляции в многопрофильном ЛПУ госпитального штамма, сделанное на основе фенотипических характеристик культур, подтвердилось методом молекулярно-генетического анализа. Идентичные и/или схожие геноварианты штаммов P. aeruginosa были обнаружены во всех отделениях, причем на протяжении всего периода исследования. Полагаем, что ОРИТ явилось местом формирования и источником распространения госпитального штамма. Тот факт, что внебольничные варианты зачастую оказывались полирезистентными, свидетельствует о том, что традиционный маркер госпи-тальности – антибиотикоустойчивость не является основополагающим применительно к P. aeruginosa.
С учетом высокой гетерогенности популяций УПМ, в том числе и по признаку резистентности к антибактериальным препаратам, биологическим свойствам, использование молекулярно-генетических методов исследования для подтверждения госпитальной природы таких бактериальных культур может быть приоритетным. С помощью методов генотипирования штаммов, выделенных из разных экологических ниш и очагов инфекции, можно установить родство изолятов, подтвердить или исключить природу внутрибольничного заражения [10].
Список литературы Эпидемиологические аспекты нозокомиальной синегнойной инфекции в многопрофильном хирургическом стационаре
- Решедько Г.К., Рябкова Е.Л., Кречикова О.И. и др. Резистентность к антибиотикам грамотрицательных возбудителей нозокомиальных инфекций в ОРИТ многопрофильных стационаров России//Клин. микробиол. антимикроб. химиотер. -2008. -Т. 10, №2. -С. 163-179.
- Руднов В.А. Современное клиническое значение синегнойной инфекции и возможности ее терапии у пациентов отделений реанимации//Инф. и антимикроб. тер. -2002. -Т. 4. -№6. -С. 170-177.
- Сидоренко С.В., Резван С.П., Еремина С.В. и др. Этиология тяжелых госпитальных инфекций в отделениях реанимации и антибиотикорезистентность среди их возбудителей//Антиб. химиотер. -2005. -Т. 50. -№2-3. -С. 33-41.
- Кузнецова М.В., Николаева Н.В., Касатов А.В., Карпунина Т.И. Фенотипические характеристики штаммов Pseudomonas aeruginosa, изолированных в стационарах хирургического профиля//Уральский медицинский журнал. -2009. -Т. 9.
- Шагинян И.А., Данилина Г.А., Чернуха М.Ю. и др. Формирование биопленок клиническими штаммами бактерий комплекса Burkholderia cepacia в зависимости от их фенотипических и генотипических характеристик//Журн. микробиол. -2007. -№1. -С. 3-9.
- Versalovic J. Schneider M., De Bruijn F.J. et al. Genomic fingerprinting of bacteria using repetitive sequencebased polymerase chain reaction//Meth. Cell. Mol. Biol. -1994. -V. 5. -P. 25-40.
- Васина Т.А., Свирская Л.М., Белопольский А.А. и др. Гнойновоспалительные осложнения у больных с сочетанной травмой в период лечения их в отделениях реанимации и интенсивной терапии (ОРИТ)//Профилактика и лечение. -2008. -№2 (8). -С. 33-41.
- Bertrand X., Thouverez M., Talon D. et al.//Intensive Care Med. -2001. -V. 27. -P. 1263-1268.
- Яковлев С.В., Шахова Т.В., Рамишвили В.Ш. и др. Антибиотикорезистентность в стационаре: контролируем ли мы ситуацию?//Стерил. госпит. инфек. -2007. 0Т. 2 (4). -С. 24-32.
- Шагинян И.А. Роль и место молекулярногенетических методов в эпидемиологическом анализе внутрибольничной инфекции//Клинич. микробиол. антимикроб. химиотер. -2000. -Т. 2, №3. -С. 82-95.


