Эспериментальная оценка дрожжевых экстрактов при Т-2 микотоксикозе
Автор: Мишина Н.Н., Семнов Э.И., Хасиятуллин А.Ф., Канарский А.В., Канарская З.А., Гематдинова В.М.
Статья в выпуске: 3 т.243, 2020 года.
Бесплатный доступ
В статье представлены результаты скрининговой оценки различных вариантов дрожжевых экстрактов в модели Т-2 токсикоза белых крыс в течение 30 дней. Микотоксикоз моделировали введением в рацион Т-2 токсина в дозе 0,4 мг/кг корма. Исследовали эффективность применения на фоне микотоксикоза и нетоксичного рациона следующих препаратов (в дозах): дрожжевые стенки (0,25 % от массы корма), раствор дрожжевых Р-глюканов (вводили ежедневно животным внутрижелудочно по 0,05 мл); жидкая фракция дрожжевого экстракта (вводили ежедневно животным внутрижелудочно по 0,05 мл), твердая фракция дрожжевого экстракта (вводили ежедневно животным внутрижелудочно по 0,05 мл). В результате проведённых исследований было установлено, что практически все испытанные препараты, полученные из дрожжей, оказали защитное действие. Самым эффективным при Т-2 токсикозе животных оказалось использование твердой фазы дрожжевого экстракта и раствора Р-глюканов обеспечивающих 100 % выживание, предотвращение снижения массы тела, нормализацию показателей клинического и иммунного статусов. При их применении на фоне скармливания нетоксичного рациона также наблюдался более высокий прирост массы тела.
Т-2 токсикоз, энтеросорбенты, дрожжи, глюкомананны, профилактика
Короткий адрес: https://sciup.org/142225997
IDR: 142225997 | УДК: 619:615.9:636.087.24 | DOI: 10.31588/2413-4201-1883-243-3-164-170
Текст научной статьи Эспериментальная оценка дрожжевых экстрактов при Т-2 микотоксикозе
Микотоксины причинияют значительный экономический вред животноводству и птицеводству по всему миру. В процессе роста, плесневелые грибы снижают питательную ценность корма, что приводит к снижению его потребления и падению продуктивности животных [2, 6].
Наиболее распространенными ми- энтеросорбенты, дрожжи, глюкомананны, yeast, β-glucans, glyukomananna, prevention котоксинами в России являются фузарио-токсины, в частности – Т-2 токсин, зеара-ленон и дезоксиниваленол. В Дальневосточном, Уральском, Сибирском, Поволжском и центральных регионах России широко распространен продуцент Т-2 токсина и НТ-2 токсина микромицет Fusarium sporotrichioides. Грибами этого вида зара- жено от 40 до 100 % кормов [10, 15]. Основным способом обезвреживания является применение сорбентов [5, 7]. История применения адсорбентов микотоксинов включает в себя использование двух основных направлений сорбентов. Первое, более раннее, это применение минеральных сорбентов, но они требовали введения большой дозы сорбента в рацион – от 2 до 5 кг/т корма. Второе направление – использование органических сорбентов, которые получают из биомасс дрожжей и бактерий, а в роли активного компонента выступает клеточная стенка. Преимуществом данных сорбентов является то, что их сорбционная способность выше минеральных сорбентов в 2-2,5 раза, а сами сорбенты не наносят вреда кишечнику [8, 13, 14]. В работах отечественных и зарубежных ученых, есть данные о применении дрожжей в качестве адсорбентов микотоксинов, способных к метаболизации микотоксинов, что снижает их токсическое действие на организм [11]. Изучив отечественную и зарубежную литературу, а также проведя ряд опытов, мы пришли к мнению, что наиболее качественным и действенным адсорбентом микотоксинов может стать клеточная стенка дрожжей Saccharomyces cerevisiae. Она представляет собой жесткую структуру и занимает около 25 % сухой массы клетки. Клеточная стенка содержит в себе неперевариваемые полисахариды, объем последних может достигать до 90 % от массы стенки. Состоит она из глюкана и маннана, хитина и белка.
Основной структурной частью Saccharomyces cerevisiae, являются β-1,3 глюканы и β-1,6 глюканы, которые занимают 30-45 % и 5-10 % массы соответственно. Последние выступают в роли рецепторов киллер-токсинов [1]. Помимо адсорбционных способностей, клеточная стенка является иммунным активатором [12]. Из-за всех вышеописанных качеств бета-глюканы привлекают большое внимание не только в ветеринарии и медицине, но также в биотехнологии, косметологии и других сферах.
Целью наших исследований стало скрининговое исследование по оценке различных вариантов применения дрожжевых экстрактов при Т-2 токсикозе.
Материал и методы исследований. Экспериментальная работа выполнялась в отделе токсикологии ФГБНУ «ФЦТРБ-ВНИВИ».
В качестве исследуемых препаратов использовали образцы, полученные из дрожжей профессором Канарским А.В. в лаборатории ФГБОУ ВО «Казанский национальный исследовательский технологический университет».
Таблица 1 – Схема проведения эксперимента на белых крысах (n=12)
|
Групп |
Характеристика кормления |
|
1 |
Основной рацион (ОР) – биологический контроль |
|
2 |
Токсичный рацион (ТР), содержащий микотоксин Т-2 в концентрации в дозе 0,4 мг/кг корма |
|
3 |
ТР + в корм вводили дрожжевые стенки в дозе 0,25% от массы |
|
4 |
ТР + крысам вводили по 0,05 мл раствора дрожжевых бетта-глюканов внутрижелу-дочно ежедневно |
|
5 |
ТР + крысам вводили по 0,05 мл жидкой фракции дрожжевого экстракта внутриже-лудочно ежедневно |
|
6 |
ТР + крысам вводили внутрижелудочно 0,05 мл твердой фракции дрожжевого экстракта ежедневно |
|
7 |
ОР + крысам вводили внутрижелудочно 0,05 мл раствора β-глюканов ежедневно |
|
8 |
ОР + крысам вводили внутрижелудочно 0,05 мл жидкой фракции дрожжевого экстракта ежедневно |
|
9 |
ОР + крысам вводили внутрижелудочно 0,05 мл твердой фракции дрожжевого экстракта ежедневно |
Для экспериментальных исследований использовали, кристаллический Т-2 токсин с чистотой 99,8 %, синтезированный в лаборатории микотоксинов ФГБНУ ФЦТРБ-ВНИВИ». Эксперимент проводили на самцах нелинейных белых крыс, которых разделили по принципу аналогов на 9 групп по 12 голов в каждой, массой 160195 г. Схема эксперимента представлена в таблице 1. Токсин и сорбенты вводили в корм путем последовательного и поэтапного тщательного смешивания. Продолжительность эксперимента составила 30 суток, в ходе которого фиксировали выживаемость, потребление корма и воды, клинические признаки, динамику массы тела, гематологические и биохимические параметры.
Количество эритроцитов, лейкоцитов, гемоглобина, моноцитов, лимфоцитов, тромбоцитов определяли с помощью гематологического анализатора «Mythic 18», содержание общего белка в сыворотке крови – с помощью биохимического анализатора «Microlab 300». Определение бактерицидной активности сыворотки крови (БАСК) проводили по методике Смирновой О.В., Кузьминовой Т.А. (1966) [9]. Активность лизоцима в сыворотке крови устанавливали нефелометрическим методом по В.Г Дорофейчуку (1968) [3], а нейтрофилов – по методике С.А. Кост и М.И. Стенко (1968) [4]. Обработку цифрового материала проводили методом вариационной статистики с применением критерия достоверности по Стъюденту.
Результаты исследований. У всех крыс, получавших токсин без сорбентов, были выраженные клинические признаки токсикоза: снижение аппетита, угнетение, диарея. К концу эксперимента выживаемость животных во второй, пятой и восьмой группах составила 66,7 %, при значении 100% в остальных группах. Гибель животных второй группы закономерна, обусловлена потреблением высокой дозы токсина, а падеж в пятой группе связываем с вероятной токсичностью жидкой фракции дрожжевого экстракта. Это доказывает гибель животных восьмой группы. Вероятно, жидкая фракция дрожжевого экстракта токсична в связи с повышенным содержанием сернокислого аммония, используемого для разделения дрожжевых фракций. Результаты динамики массы тела подопытных животных на первые и 30 сутки эксперимента представлены на рисунке 1.
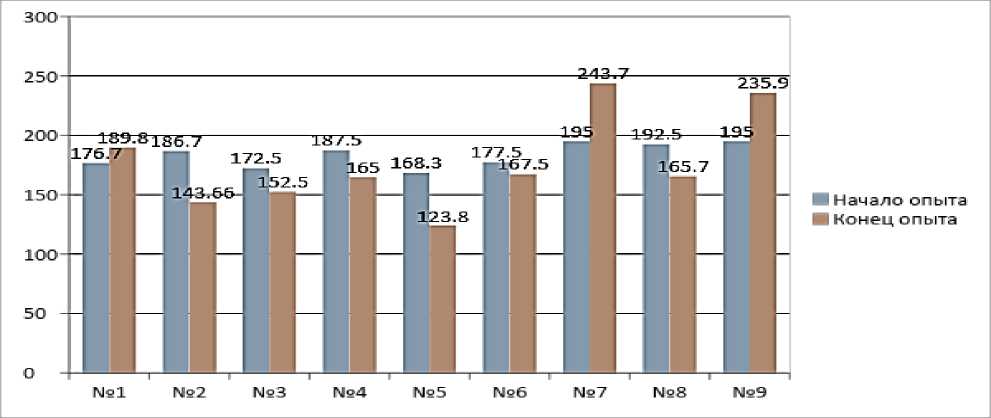
Рисунок 1 – Масса тела подопытных животных в модели Т-2 токсикоза на фоне применения дрожжевых препаратов (n=12)
В ходе исследований были установлены существенные межгрупповые различия по показателям живой массы. Крысы, потреблявшие токсичный корм по сравнению с данными биологического контроля значительно отставали в росте: во второй группе масса тела к концу опыта достоверно снизилась от первоначальной на 23,05 %. Токсичность жидкой фракции дрожжевого экстракта подтверждают дан- ные динамики массы тела, так ее введение на фоне токсического рациона привело к снижению массы крыс на 26,4 %, относительно исходных данных, на фоне основного рациона – на 13,9 %. Применение дрожжевых препаратов оказывало профилактическое действие при микотоксикозе и стимулировало рост при потреблении основного рациона. Наилучший результат наблюдался в группах, получавших внут-рижелудочно твердую фракцию дрожжевого экстракта: в шестой группе у крыс на фоне токсического рациона зафиксировали наименьшее снижение массы тела, составившее 5,63 % от первоначальной массы тела, на фоне основного рациона (в девятой группе) прирост живой массы составил 21 %, против 7,45 % в группе биологического контроля.
Группы, получавшие β-глюканы показали следующие результаты – в сочетании с токсическим рационом произошло снижение массы тела на 12,0 % от исходной массы тела, а в сочетании с основным рационом было выявлено увеличение массы на 25 %, что говорит о защитном и стимулирующем рост действии .
Результаты изучения гематологических показателей животных представлены в таблице 2.
Таблица 2 – Гематологические показатели подопытных животных в модели Т-2 токсикоза на фоне применения дрожжевых препаратов (n=12)
|
Показатель |
||||
|
эритроциты, х1012/л |
гемоглобин, г/л |
лейкоциты, х109/л |
лимфоциты, % |
гранулоциты, % |
|
7,31±0,12 |
151,00±3,6 |
9,00±1,86 |
69,20±0,92 |
26,40±1,18 |
|
6,30±0,14*** |
122,00±3,4*** |
4,70±1,75* |
40,10±1,84*** |
60,10±1,2*** |
|
6,37±0,13*** |
131,00±3,2*** |
7,10±1,76 |
51,80±1,08*** |
43,20±1,4*** |
|
7,76±0,14* |
137,11±3,6* |
7,49±1,54 |
48,30±1,75*** |
62,60±1,3*** |
|
6,46±0,16*** |
125,00±3,4*** |
4,90±1,76* |
42,10±1,56*** |
60,00±1,2*** |
|
6,78±0,12** |
139,00±3,0** |
6,85±1,84 |
62,15±1,68*** |
33,30±1,1*** |
|
7,03±0,14*** |
160,97±2,8* |
10,15±1,64 |
64,90±1,48* |
30,40±1,1* |
|
6,80±0,11 |
148,28±3,0 |
11,60±1,43 |
61,90±1,36*** |
32,90±1,2*** |
|
7,14±0,12 |
154,47±3,2 |
12,60±1,64 |
63,80±1,26** |
30,00±1,2* |
Примечание: * – р<0,05** р<0,01*** р<0,001
Во второй опытной группе (ТР) отмечалось ожидаемое достоверное ухудшение всех показателей, так содержание эритроцитов уменьшилось на 13,8 % (p<0,001), гемоглобина на 19,2 % (p<0,001), лейкоцитов на 47,8 % (р<0,05), лимфоцитов на 42,1 % (р<0,001), а содержание гранулоцитов увеличилось на 127,7 % (р<0,001). В профилактируемых группах тенденции были различны. Снижение количества эритроцитов у крыс в 7 группе составило 3,8 % (р<0,001), в 8 – 7,0 % и в 9 – 2,3 %, в последних двух группах данные были недостоверны. При анализе результатов применения сорбентов на фоне токсикологического рациона наблюдали аналогичную картину. Однако следует отметить, что при применении сорбентов на фоне основного рациона наблюдалось увеличение количества лейкоцитов на 12,8,
28,9 и 40,0 % в 7, 8 и 9 группах соответственно, однако данные также являлись недостоверными. При исследовании содержания гемоглобина в крови наблюдали аналогичную тенденцию.
Результаты исследования белкового обмена у белых крыс при постановке эксперимента представлены в таблице 3. Исходя из данных таблицы 3 можно сделать вывод, что у крыс второй группы (ТР) наблюдалось наибольшее снижение показателей общего белка и альбуминов на 24,3 % (р<0,001) и 22,8 % ( р<0,001) соответственно. У крыс 7 и 9 группы наблюдалось увеличение показателей общего белка на 12,6 % (р<0,001) и 10,6 % (р<0,01) соответственно, а альбуминов на 11,8 % (р<0,001) и 11,2 % (р<0,05) соответственно. Содержание общего белка в сыворотке крови крыс в 3 группе было ниже контроля на
15,6 % (р<0,001), в 4 – на 14,6 % (р<0,001), в 5– на 20,6 % (р<0,001), в 6– на 10,8 % (р<0,001) и в восьмой – на 8,6 % (р<0,01). Снижение количества альбуминов в этих группах, связано с увеличением интенсивности окислительно-восстановительных процессов в организме.
Таблица 3 – Содержание общего белка и альбумина в сыворотке белых крыс в модели Т-2 токсикоза на фоне применения дрожжевых препаратов (n=12)
|
Группа |
Общий белок, г/л |
Альбумины, г/л |
|
1 |
68,4±1,33 |
40,5±0,71 |
|
2 |
51,7±1,24*** |
31,2±0,88*** |
|
3 |
57,7±1,21*** |
34,5±1,1*** |
|
4 |
58,4±1,31*** |
35,3±1,4** |
|
5 |
54,3±1,61*** |
33,2±1,1*** |
|
6 |
61,0±1,42*** |
36,7±1,2* |
|
7 |
77,0±1,18*** |
45,2±1,3** |
|
8 |
62,5±1,28** |
37,7±0,9* |
|
9 |
75,6±1,3*** |
45,0±1,1* |
Примечание: * – р<0,05** р<0,01*** р<0,001
Таблица 4 – Показатели иммунологического статуса белых крыс в модели Т-2 токсикоза на фоне применения дрожжевых препаратов
|
Группа |
Лизоцимная активность, % |
Бактерицидная активность, % |
Фагоцитарная активность, % |
Фагоцитарный индекс |
|
1 |
46,80±2,4 |
22,80±1,2 |
50,60±2,1 |
4,16±0,22 |
|
2 |
37,07±1,88** |
17,69±0,98** |
44,63±2,36* |
3,96±0,18 |
|
3 |
42,63±2,4 |
20,25±1,6 |
45,24±1,88* |
3,99±0,19 |
|
4 |
42,78±2,3 |
20,75±1,4 |
45,94±1,9* |
4,01±0,22 |
|
5 |
39,31±2,1* |
18,70±1,3* |
45,24±1,8* |
3,98±0,24 |
|
6 |
43,90±2,0 |
20,73±1,4 |
38,51±1,7*** |
4,06±0,32 |
|
7 |
48,48±1,8 |
25,26±1,6 |
52,02±1,9 |
4,25±0,32 |
|
8 |
42,59±2,3 |
21,25±1,5 |
54,34±2,0 |
4,19±0,28 |
|
9 |
51,57±2,0* |
25,35±1,3 |
55,96±2,4* |
4,32±0,18 |
Примечание: * – р<0,05** р<0,01*** р<0,001
Из данных таблицы 4 следует, что у животных второй группы (ТР) лизоцимная активность была ниже по сравнению с контролем на 20,8 % (р<0,01), бактерицидная активность – на 22,4 % (р<0,01), фагоцитарная – на 11,8 % (р<0,05), а фагоцитарный индекс – на 4,8 %. Данная группа имела наибольшее ухудшение по всем показателям, кроме фагоцитарной активности, снижение которой больше всего наблюдалось у шестой группы, получавшей ТР и животным которой ежедневно вводили внтрижелудочно по 0,05 мл твердой фракции дрожжевого экстракта, оно составляло 23,9 % (р<0,001). В седьмой и девятой группах, получавших сорбенты на фоне основного рациона, наблюдалось увеличение всех показателей относительно первой контрольной группы.
Заключение. Анализируя данные динамики массы тела, гематологические, биохимические показатели и данные иммунологического статуса, можно заключить, что практически все испытанные препараты из дрожжей, кроме жидкой фракции дрожжевого экстракта, оказали защитное действие.
Самым эффективным при Т-2 токсикозе животных оказалось использование твердой фазы дрожжевого экстракта и раствора β-глюканов обеспечивающих 100% выживание, предотвращение снижения массы тела, нормализацию показателей клинического и иммунного статусов. При их применении на фоне скармливания нетоксичного, основного рациона также наблюдался более высокий прирост массы тела.
Резюме
В статье представлены результаты скрининговой оценки различных вариантов дрожжевых экстрактов в модели Т-2 токсикоза белых крыс в течение 30 дней. Микотоксикоз моделировали введением в рацион Т-2 токсина в дозе 0,4 мг/кг корма. Исследовали эффективность применения на фоне микотоксикоза и нетоксичного рациона следующих препаратов (в дозах): дрожжевые стенки (0,25 % от массы корма), раствор дрожжевых β-глюканов (вводили ежедневно животным внутрижелудочно по 0,05 мл); жидкая фракция дрожжевого экстракта (вводили ежедневно животным внутрижелудочно по 0,05 мл), твердая фракция дрожжевого экстракта (вводили ежедневно животным внутрижелудочно по 0,05 мл).
В результате проведённых исследований было установлено, что практически все испытанные препараты, полученные из дрожжей, оказали защитное действие. Самым эффективным при Т-2 токсикозе животных оказалось использование твердой фазы дрожжевого экстракта и раствора β-глюканов обеспечивающих 100 % выживание, предотвращение снижения массы тела, нормализацию показателей клинического и иммунного статусов. При их применении на фоне скармливания нетоксичного рациона также наблюдался более высокий прирост массы тела.
Список литературы Эспериментальная оценка дрожжевых экстрактов при Т-2 микотоксикозе
- Ахмадышин, Р.А. Адсорбция микотоксина Т-2 клеточной стенкой дрожжей Saccharomyces cerevisiae / Р.А. Ахмадышин, А.В. Канарский, З.А. Канарская [и др.] // Хранение и переработка сельскохозяйственного сырья. - 2007. - №8. - С. 4648.
- Губеева, Е.Г. Изучение гистоструктуры печени цыплят-бройлеров при хронической интоксикации имидаклопридом на фоне применения сорбентов / Е.Г. Губеева, К.Ф. Халикова, Д.В. Алеев [и др.] // Ветеринарный врач. - Казань. - 2019. -№ 1. - С. 8-13.
- Дорофейчук, В.Г. Определение активности лизоцима нефелометрическим методом / В.Г Дорофейчук // Лаб. дело. -1968. - №1. - С. 28-30.
- Кост, С.А. Определение фагоцитарной активности лейкоцитов / С.А. Кост, М.И. Стенко // Клиническая гематология животных. - М.: Колос, 1974. - С. 99-100.
- Мишина, Н.Н. Влияние комплекса цеолита и шунгита на резистентность и продуктивность цыплят-бройлеров при смешанном микотоксикозе / Н.Н. Мишина, Э.И. Семенов, К.Х. Папуниди [и др.] // Ветеринарный врач. - Казань. - 2018. - № 6. - С. 3-9.
- Папуниди, К.Х. Микотоксины (в пищевой цепочке): монография / К.Х. Папуниди, М.Я. Тремасов, В.И. Фисинин [и др.]. - Казань: ФГБНУ "ФЦТРБ-ВНИВИ", 2017. - 158 с.
- Папуниди, К.Х. Применение сорбентов для профилактики нарушения обмена веществ и токсикозов животных: монография / К.Х. Папуниди, Э.И. Семёнов, И.Р. Кадиков [и др.]. - Казань: ФГБНУ "ФЦТРБ-ВНИВИ", 2018. - 207 с.
- Семенов, Э.И. Сравнительная оценка адсорбирующей активности дрожжей по отношению к микотоксинам / Э. И. Семенов, Л. Е. Матросова, Е. Ю. Тарасова [и др.] // Вестник Казанского технологического университета. - Казань. - 2013. - № 10. - С. 195-197.
- Смирнова, О.В. Определение бактерицидной активности сыворотки крови методом фотонефелометрии / О.В. Смирнова, Т.А. Кузьмина // ЖМЭИ. -1966. - № 4. - С. 8-11.
- Тремасов, М.Я. Профилактика микотоксикозов животных в России / М.Я. Тремасов // Ветеринария. - 2002. - № 9. - С. 3-8.
- Cardner, P. Use of Saccharomyces cerevisiae to suppress aflatoxin effects in broiler chick ration / P. Cardner, V.G. Stanley, D.M. Hutchincjn // Poultry Science. -1992. - V. 71. - P. 49.
- Catalli, A. Chitin and P-glucan polysaccharides as immunomodulators of airway inflammation and atopic disease / A. Catalli, M. Kulka // Metabolic & Immune Drug Discovery. - 2010. - Vol. 4. - P. 175189.
- Raju, M.V. Esterified glucomonnan in broiler chicken's diets contaminated with aflatoxin, ochratoxin and T-2 toxin: evaluation of its binding ability (in vitro) and efficacy as immunomodulatory / M.V. Raju, G. Devegowda // Asian-Aust. J. Anim. Sci. -2002. - V. 15(7) - P. 1051-1056.
- Schatzmayr, G. Mycotoxin deactivating feed additives in animal nutrition / G. Schatzmayr, W. Moll, U. Hofstetter, [et al.] // BOKU-Symposium Tiererhahrung, 02 Nov. - 2006. - P. 47-53.
- Semenov, E.I. Screening drugs-potential immunomodulators for T-2 mycotoxicosis / E.I. Semenov, N.N. Mishina, I.R. Kadikov [et al.] // (2017). Bali Medical Journal. - V. 6(2). - P. 110-114.
- DOI: 10.15562/bmj.v6i2.516


