К вопросу о модификации способа хирургической тромбэктомии из бедренно-подколенного венозного сегмента
Автор: Цыплящук А.В., Кайдорин А.Г., Кайдорина Ю.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ангиология и сосудистая хирургия
Статья в выпуске: 2 т.12, 2008 года.
Бесплатный доступ
Статья посвящена экспериментальным и морфологическим исследованиям, связанным с хирургической тромбэктомией у больных, страдающих флебемфраксией глубоких вен нижних конечностей. Описана экспериментальная модель выполнения хирургической тромбэктомии из глубоких вен по традиционной методике. Данные исследований подтверждают мнение о повреждающем влиянии циркулярного воздействия сегментов вен на интрамуральное кровообращение последних. Также дана количественная оценка степени нарушения интрамурального кровообращения в зависимости от размера обнаженного венозного сегмента. Также описаны результаты макроморфометрического исследования бедренной вены, взаимоотношения ее клапанов и вторичных притоков. Обоснована возможность функционального восстановления и дальнейшей поддержки проксимального клапана бедренной вены. Это может быть достигнуто за счет обеспечения вторичных притоков протокового флебоциркуляторного русла через указанный сегмент после тромбэктомии, когда полное восстановление антеградного кровотока невозможно.
Острый флеботромбоз, тромбэктомия, посттромбофлебитическая болезнь
Короткий адрес: https://sciup.org/142233468
IDR: 142233468
Текст научной статьи К вопросу о модификации способа хирургической тромбэктомии из бедренно-подколенного венозного сегмента
Известно, что в общей популяции частота тромбоза глубоких вен составляет около 160 случаев на 100 000 населения с частотой фатальной тромбоэмболии легочной артерии 60 на 100 000 населения [1,2].
В России венозным тромбозом ежегодно заболевают 240 000 человек, а эмболия легочных артерий, в том числе фатальная, развивается у 100000 из них, что значительно превышает показатели заболеваемости туберкулезом, вирусным гепатитом, а также ВИЧ-инфекцией [3].
Посттромбофлебитическая болезнь, как следствие повреждения венозной стенки и, в особенности, клапанов глубоких вен, в ходе течения острого флеботромбоза глубоких вен является на данный момент серьезной проблемой флебологии. Тяжелое течение и развитие в отдаленном периоде посттромбофлебитической болезни (ПТФБ) нижних конечностей создает значительные социальные и экономические проблемы.
В настоящее время не существует радикального лечения больных ПТФБ и остается актуальным, как и прежде, поиск путей его улучшения. В то же время одна из возможностей минимизации клинических проявлений ПТФБ заключается в максимально возможном извлечении тромбомасс из венозных сегментов и восстановлении замыкательной функции глубоких клапанов в процессе лечения острых глубоких флеботромбозов [4]. К тому же острые флеботромбозы представляют серьезную угрозу развития тромбоэмболии в систему легочной артерии (ТЭЛА) и сами по себе требуют от врача активных действий по ее профилактике. К этой группе относятся глубокие флеботромбозы с флотирующей верхушкой.
Доступная в большинстве стационаров операция тромбэктомии не решает проблемы реабилитации больных: развитие ПТФБ с полной или частичной утратой замыкательной функции клапанов глубоких вен составляет до 82% в различные сроки отдаленного периода [5-7].
Кроме того, тромбэктомия из глубоких вен нижних конечностей сопряжена с опасностью ретромбоза. Одной из причин этого, возможно, является травматизация венозной стенки, непосредственное повреждение эндотелия, а также нарушение трофики из-за особенностей иннервации и васкуляризации мышечного и адвентициального слоев стенки вены. Это может стать основанием для последующего распространенного склероза венозной стенки со сморщиванием клапанов, утрата функции которых - один из основных патогенетических механизмов развития посттромботической болезни [10].
По нашему предположению, циркулярное выделение реконструируемого сегмента вены с последующим наложением провизорных турникетов неизбежно должно негативно отразиться на состоянии интрамурального кровообращения в этом сегменте, что естественным образом повлечет за собой трофические изменения с последующей фиброзной трансформацией стенки вены и, что особенно важно, створок вовлеченных клапанов. Очевидно, что подобные негативные изменения должны проходить пропорционально тяжести таких вероятных нарушений. Известно, что степень снижения интрамурального кровообращения в сосуде прямо пропорциональна снижению так называемого капиллярного индекса или количества функционирующих в стенке сосуда капилляров на единицу площади [9]. Для количественной оценки скорости снижения капиллярного индекса при различных длинах выделенного сегмента нами использована экспериментальная модель этапа выделения вены при классической тромбэктомии на уровне глубоких вен бедренного треугольника.
Хирургическое вмешательство при флеботромбозах в системе глубоких вен нижних конечностей не всегда может быть завершено полной тромбэктомией с восстановлением всего просвета венозной магистрали. Поэтому одной из целей мы видим не только устранение непосредственной эмбологенной опасности, но и вероятное восстановление замыкательной функции одного или большего количества клапанов в глубокой вене в расчете на развитие состояний, более близких к физиологическим в процессе дальнейшей реканализации и развитии посттромботических изменений [3, 10]. Известно, что наличие даже одного функционирующего клапана в бедренной вене встречается при абсолютно нормальных состояниях венозного оттока [12]. Между тем, какое-либо восстановление функции клапана или венозного сегмента теряет всякий смысл, если в этом сегменте не сохранить или не восстановить проточную циркуляцию венозной крови. Например, для успешного функционирования реплантированных клапаносодержащих сегментов часто применяются методики создания путей притока за счет коллатеральных венозных ветвей [11]. В этой связи представляет интерес топическое распределение коллатеральных притоков (перфорантных, сателлитных и других) и их количества в подклапанных сегментах бедренной вены. Для изучения этих взаимоотношений методом секционной препаровки и макроморфометрии нами предпринято морфологическое исследование вен нижних конечностей трупов без признаков и катамнестических указаний на патологию вен бассейна нижней полой вены.
МАТЕРИАЛ И МЕТОДЫ
На первом этапе исследования объектом экспериментального изучения была выбрана бедренная вена как основной орган хирургического вмешательства при глубоких флеботромбозах. Всего проведено 10 экспериментов на нижних конечностях 7 трупов больных, умерших от причин, не связанных с патологией системы нижней полой вены, не имевших катамнестических указаний на такую патологию. Использовано 5 мужских и 2 женских трупа. Возраст умерших варьировал от 36 до 88 лет и составил в среднем 60,9±6,8 года.
На втором этапе для исследования частоты обнаружения клапанов в собственно бедренной вене, согласно основным топографическим ориентирам исследования плотности второстепенных притоков, был произведен отбор 31 образца бедренной вены от 17 трупов больных, умерших от причин, не связанных с патологией бассейна нижней полой вены, не имевших катамнестических указаний на такую патологию. При обнаружении патологии в ходе исследования образец не регистрировался. Всего исследовано 7 мужских и 10 женских трупов.
Возраст больных варьировал от 43 до 76 лет, составив в среднем 63,3±3,2 года.
В ходе первого этапа производилось моделирование на трупе оперативных приемов, применяемых при использовании классической методики хирургической тромбэктомии из общей и собственно бедренной вен. При этом применялись идентичные манипуляции (за исключением электрокоагуляции тканей), использовался инструментарий, идентичный хирургическому. В начале эксперимента проводился стандартный доступ к венам бедра. Из окружающих тканей циркулярно выделялись: собственно бедренная вена на участке 2-3 см до устья, устьевой сегмент глубокой вены бедра, общая бедренная вена на всем протяжении на 2-3 см ниже пупартовой связки и устьевой сегмент большой подкожной вены. Длина выделенного сегмента составляла 10-14 см. Турникеты не накладывались во избежание искажения результатов временными влияниями. Из имеющегося или дополнительного доступа, в предварительно пересеченную наружную подвздошную артерию, с этой же стороны вводилась канюля с подсоединенной к ней инфузионной системой. Из дополнительного доступа отдельно перевязывалась собственно бедренная артерия на уровне Гюнтерова канала (с целью уменьшения расхода красителя). Имитация кровообращения в исследуемой вене и паравеноз-ных тканях выполнялась инфузией красителя -микродисперсионного раствора черной туши.
Предварительно сосудистое русло конечности промывалось 400 мл физиологического раствора под давлением 120-130 мм рт. ст. Искомое давление в системе поддерживалось высотой системы на 1,6-1,7 м выше уровня заполняемых сосудов. Далее под тем же давлением в канюлированную артерию вливалось 200 мл черной туши для чертежных, графических и оформительских работ производства химического завода «ЛУЧ» г. Ярославль, ТУ 2389023-02954519-2002. Визуальным критерием адекватности наполнения циркуляторного русла тканей бедра служило появление темного диффузного прокрашивания кожи и мышц, которое мы отмечали уже после 50-70 мл препарата. При этом наблюдалось излияние красителя и в операционную рану, вероятно, за счет поврежденного микроциркуляторного русла тканей раны. В результате этого краситель затекал на макропрепарат. Таким образом, включения туши в адвентициальные сосуды могло происходить в результате неизбежного в таких условиях загрязнения макропрепарата. Поэтому количе- ственным критерием интрамурального кровоснабжения венозной стенки был избран факт обнаружения туши только в среднем (мышечном) слое. Вероятно, это же обстоятельство в отдельных образцах послужило фактором обнаружения частиц туши в сосудах среднего слоя, граничащих с загрязненными сосудами адвентициального слоя.
По окончании моделирования производился отбор фрагментов выделенной бедренной вены с различных ее сегментов: на расстоянии 1-2, 3-4 и 5-6 см от интактной стенки, а также контрольные образцы, взятые из центрального и дистального участков исследуемой вены, вне области имитации хирургического вмешательства. Полученные таким образом препараты фиксировали в 10% формалине в течение одних суток, далее производилась трехчасовая промывка проточной водой. После гистологической проводки осуществлялась заливка в парафин. Для удобства оценки гистологические срезы толщиной 5-6 и 7-9 мкм проводились параллельно оси сегмента, так как известно, что в средней оболочке вены ее сосуды имеют преимущественно циркулярное направление [8]. После обратной гистологической проводки микропрепараты окрашивались гематокси-лин-эозином.
При светооптической микроскопии на увеличении 250 проводился подсчет сосудов средней оболочки в 20 полях зрения по каждому образцу с последующим усреднением результатов. Полученный таким образом индекс регистрировался как результат эксперимента. Оценка функциональной способности интрамуральных сосудов мышечного слоя проводилась путем сравнения среднего количества прокрашенных сосудов в поле зрения.
На втором этапе для оценки топографических взаимоотношений клапанов в собственно бедренной вене и исследования индекса плотности второстепенных притоков как на всем протяжении, так и в отдельных сегментах использован метод послойной препаровки тканей нижней конечности трупа. Вскрытие бедренной вены проводилось послойно с ориентацией кожного разреза по линии Кена.
После удаления из ложа сосудистого пучка бедра собственно бедренной артерии получали возможность прямой визуальной оценки вены. Без удаления макропрепарата из его анатомического ложа проводилось измерение гибкой сантиметровой лентой длины собственно бедренной вены, длин ее сегментов, расположенных в проекции бедренного треугольника и
Гюнтерова канала. После продольного вскрытия просвета вены на всем протяжении регистрировали обнаруженные клапаны согласно анатомическим ориентирам. При этом обозначение обнаруженных клапанов приводилось в соответствие с терминами, используемыми в наших учреждениях и принятыми в научных публикациях [12].
После пересечения вены на уровне устья глубокой вены бедра, при ее выделении в дистальном направлении регистрировали количество второстепенных притоков (без их идентификации) посегментно. Удаленный макропрепарат собственно бедренной вены использовали для повторной визуальной оценки с целью контроля общего количества обнаруженных клапанов и второстепенных притоков.
В исследовании проводились: определение наличия венозных клапанов, согласно принятым анатомическим ориентирам, измерение длин интересующих сегментов, подсчет плотности второстепенных притоков под различными клапанами бедренной вены, а также в ее основных сегментах. Сегмент исследуемой вены было принято рассматривать как подклапанный на протяжении не более 1,0-1,5 см ниже основания створок заинтересованного клапана.
РЕЗУЛЬТАТЫ
На первом этапе, в условиях экспериментальной модели, методом подсчета капиллярных индексов функционально способных сосудов средней (мышечной) оболочки стенок бедренных вен мы получили данные о негативном влиянии циркулярного выделения протяженных сегментов (3-6 см) вены, используемого при классической методике хирургической тромбэктомии из данного сегмента (табл.).
В контрольных образцах количество прокрашенных и отмытых от эритроцитов сосудов составляло от 4 до 9 в поле зрения. На рис. 1 видны заполненные тушью vasa vasorum, располагающиеся преимущественно в мышечной оболочке вены. По мере удаления от границы выделения вены их количество уменьшалось от единичных в поле зрения до нуля.
При этом начинали преобладать сосуды, содержащие эритроциты. Подобное явление можно наблюдать только на микропрепаратах с толщиной среза около 9 мкм, т. е. соразмерного диаметру эритроцита. На микропрепаратах с меньшей толщиной среза такие сосуды выглядели как пустые, без каких-либо клеточных и иных включений. Следовательно, в ходе
Зависимость количества функционально способных vasa vasorum от позиции в зоне выделения
На втором этапе, при исследовании клапанов бедренной вены и венозных притоков в секционном материале получены следующие результаты: проксимальный клапан бедренной вены (ПКБВ) встречался в 100% случаев; второй клапан бедренной вены - 45,2% (14); третий клапан бедренной вены - 51,6% (16); четвертый клапан бедренной вены - 29% (9); пятый клапан бедренной вены - 32,3% (10); шестой клапан бедренной вены - 12,9% (4); дистальный клапан бедренной вены - 51,6% (16). Среднее количество обнаруженных в бедренной вене клапанов составило 3,2±0,2.
Длина бедренной вены в среднем составила 21,7±0,48, количество второстепенных притоков 13,0±0,7, плотность притоков на 1 см длины бедренной вены составила 0,6±0,025. Длина сегмента в бедренном треугольнике 6,9±0,27, количество притоков 4,4±0,26, плотность их на 1 см в данном сегменте 0,35±0,02. Длина бедренной вены в Гюнтеровом канале 6,10±0,27, количество притоков 6,10±0,36, плотность на 1 см - 1,00±0,05.
В данном исследовании при одновременном обнаружении ПКБВ и 2КБВ расстояние между основанием створок первого и уровнем комиссуральных возвышений второго ни в одном из случаев не превышало 1,5 см или расстояния, определенного ранее как подклапанный сегмент. В указанном сегменте во всех случаях
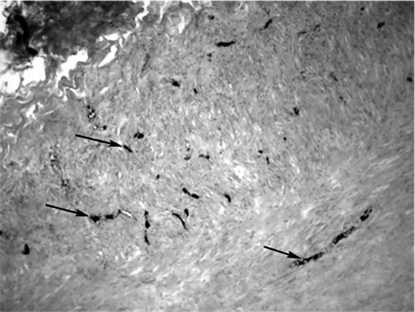
Рис. 1. Контрольный фрагмент невыделенной вены. Заполненные тушью сосуды средней оболочки (увеличение х 100).
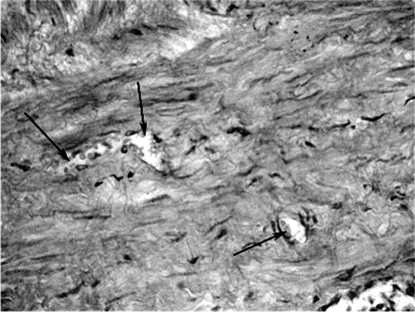
Рис. 2. Опытный образец. Сосуды не имеют включений туши, заполнены эритроцитами (увеличение х400).
нами было обнаружено от 1 до 4 второстепенных притоков. Таким образом, подсчет плотности второстепенных притоков на подклапанный участок ПКБВ по 14 наблюдениям составил 2,00±0,26 или ±1,3 притока на 1 см длины сегмента вены.
Из представленных данных можно отметить, что при средней плотности второстепенных притоков 0,6±0,025 бедренной вены, аналогичный показатель для подклапанного участка ПКБВ в два с лишним раза больше и составляет ±1,3. Проведенные аналогичные измерения в других сегментах не позволили выявить более высокой плотности притоков.
ОБСУЖДЕНИЕ
Таким образом, в завершении секционного и экспериментального этапов данного исследования удалось установить, что сегментарное циркулярное выделение бедренной вены из окружающих тканей сопровождается резким снижением интрамурального кровообращения в ней начиная с 10-15-кратного на участке в 1-2 см и до полного прекращения на расстоянии более 3 см от обеих границ выделения. Это подтверждает наше предположение о негативном воздействии классической технологии тромбэктомии из бедренноподколенного венозного сегмента на сохранность венозной стенки и ее клапанов, что в контексте одного из этиологических факторов венозного тромбообразования триады Вирхова должно рассматриваться как отягощающий момент в лечении таких пациентов.
Полученные данные позволяют заключить, что наибольшая относительная плотность второстепенных притоков собственно бедренной вены характерна для подклапанного участка проксимального клапана бедренной вены, являющегося ее единственным постоянным клапаном, располагающимся в терминальной части. Это позволило нам акцентировать внимание на потенциальной возможности поддержания его функции при парциальном восстановлении флебогемодинамики в сегменте за счет возможности обеспечения проточной флебоциркуляции из второстепенных притоков вены. Кроме того, аналогичный механизм был обнаружен и на уровне Гюнтерова канала. Параллельно с этим нами были получены собственные данные о частоте обнаружения других клапанов этой вены, формирующих каскад защиты дистального венозного русла от вертикальных рефлюксов. Вышеописанные результаты позволили сделать предположение о том, что парциальная тром бэктомия из бедренно-подколенного венозного сегмента может завершаться сохранением структуры и функции одного или большего количества клапанов бедренной вены даже в условиях невосстановленной магистральной флебоциркуляции. Это указывает на целесообразность и необходимость восстановления функции венозных клапанов как основное условие профилактики естественного исхода острого флеботромбоза в ПТФБ.
Заключения, сделанные по результатам экспериментального и секционного этапов исследования, позволяют определить основные направления совершенствования технологии хирургической тромбэктомии из бедренно-подколенного венозного сегмента. Во-первых, усовершенствованная технология должна исключать циркулярное выделение бедренной вены на протяжении, большем чем 2 см. Во-вторых, необходимо использовать дифференцированный подход к вопросу завершения хирургического этапа, исходя из потенциальной возможности сохранения проксимального клапана бедренной вены даже в условиях парциальной тромбэктомии из магистральных вен.
ВЫВОДЫ
-
1. При циркулярном выделении бедренной вены на участке 1-2 см от границ выделения резко, в 10-15 раз нарушается интрамуральное кровообращение в ее стенке.
-
2. При циркулярном выделении бедренной вены на участках 3-6 см и более интрамуральное кровообращение в ней прекращается полностью.
-
3. Проксимальный клапан бедренной вены является единственным постоянно встречающимся и характеризуется дополнительным механизмом обеспечения проточной флебоциркуляции в нем за счет максимальной для данной вены плотности второстепенных притоков под ним. Второй уровень вспомогательной флебогемодинамики расположен на уровне Гюнтерова канала в 14-22 см от устья бедренной вены.
-
4. В бедренной вене в нормальном состоянии может определяться от 2 до 6 клапанов различной локализации. Среднее их количество составляет 3,2±0,2.
Список литературы К вопросу о модификации способа хирургической тромбэктомии из бедренно-подколенного венозного сегмента
- Nicolaides A.N. //Circulation. 2000. V. 102. P. 126.
- Лазебкин Л.Б. Тромбоэмболия легочной артерии. Современные подходы к диагностике и лечению. М., Медицина. 2002.
- Флебология: рук-во для врачей /Под ред. B.C. Савельева. М.: Медицина, 2001. С. 664.
- Черненко В.Ф. Флеботромбоз (патогенез, стадии, лечение). Барнаул, 2002. 307 с.
- Bauman G..//Chirurg. 1976. Bd. 47 №3. S. 112-117.


