К вопросу об иммунологической оценке сорта картофеля Аскольд
Автор: Мацишина Н.В., Ермак М.В., Фисенко П.В., Ким И.В.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 5 (85), 2025 года.
Бесплатный доступ
Актуальность. Селекция на устойчивость к вредителям – наиболее радикальный и эффективный метод снижения огромных потерь, наносимых листогрызущими, сосущими и минирующими насекомыми. Паспортизация сортов картофеля является востребованным инструментом для усовершенствования системы регистрации и сертификации, защиты прав селекционеров и контроля генетической однородности сортов. Описание сорта должно содержать сведения о его молекулярно-генетической и иммунологической оценке. Цель работы – составление иммунологического паспорта перспективного сорта картофеля Аскольд. Материалы и методы. Объектом исследования является сорт картофеля Аскольд. В работе по изучению содержания гликоалкалоидов в свежей ткани листьев картофеля, содержанию гормонов стресса, выражаемых в мг% адреналина в теле насекомых и активности собственных протеаз вредителя и ингибиторов протеиназ в картофеле использовали методы по Шпирной с соавт. (2006), Ибрагимову с соавт. (2006), Тукало и Царик (1970). В молекулярно-генетических исследованиях использовали методы по Сайнаковой с соавт. (2018), Стрыгиной с соавт. (2019). Результаты. Генотип по вариантам гена StAN1, в котором отсутствует основной функциональный вариант r1, при наличии всех остальных можно рассматривать как вариант паспортизации сорта Аскольд. По данным молекулярно-генетической оценки, сорт Аскольд имеет маркеры генов устойчивости к золотистой цистообразующей нематоде, раку картофеля (патотип 1) и фитофторозу. Сорт Аскольд обладает высокой степенью проявления иммунитета, о чем свидетельствует его биохимический профиль, а также наличие репарационных свойств клубней и реакция сверхчувствительности у листьев. Заключение. Сорт Аскольд является высокоустойчивым к воздействию патогенами и вредителями, что делает его ценным образцом как для селекции, так и для хозяйственной деятельности. Возделывание устойчивых сортов нередко позволяет отказаться от применения пестицидов, что имеет важное значение для уменьшения опасности загрязнения урожая остаточными количествами и обеспечения безопасности для свободноживущих организмов, и естественных экосистем.
Сорт, картофель, паспортизация, селекция, устойчивость
Короткий адрес: https://sciup.org/140312683
IDR: 140312683 | УДК: 635.21:631.526.32:632.938 | DOI: 10.18619/2072-9146-2025-5-114-120
Текст научной статьи К вопросу об иммунологической оценке сорта картофеля Аскольд
Оригинальная статья / Original article УДК:635.21:631.526.32:632.938
Селекция на устойчивость к вредителям – наиболее радикальный и эффективный метод снижения огром- ных потерь, наносимых листогрызущими, сосущими и минирующими насекомыми. Иммунитет растений к вредоносным организмам – это неповреждаемость их фитофагами и невосприимчивость к возбудителям инфекционных заболеваний. В его основе – иммуногенетические барьеры растений, особенности пищевой специализации консументов и характер их взаимоотношений друг с другом [1, 2, 3]. Степень выраженности иммунитета у растений в большей степени, чем у животных, может проявляться в виде разных градаций – от абсолютного или полного до самых слабых проявлений иммунитета [4,5,6].
Паспортизация сортов картофеля является востребованным инструментом для усовершенствования системы регистрации и сертификации, защиты прав селекционеров и контроля генетической однородности сортов [7]. По нашему мнению, описание сорта должно содержать сведения о его молекулярно-генетической и иммунологической оценке, тем более, что в настоящее время стало очевидным, что один из важнейших рычагов регулирования численности популяций вредных организмов и управление их адаптивной изменчивостью в агроэкосистемах является использование сельскохозяйственных культур, устойчивых к абиотическим и биотическим стрессам [8,9]. В условиях адаптивной интенсификации растениеводства особое значение придается фитоцено-тическому направлению в селекции сельскохозяйственных культур, предполагающему конструирование генотипов, которые помимо высокой потенциальной продуктивности характеризуются конституциональной устойчивостью к абиотическим и биотическим стрессам и обладают высокой средообразующей производительностью [10]. Это и определило цель данного исследования.
Целью данного исследования является составление паспорта перспективного сорта картофеля Аскольд.
Материалы и методы
Объектом исследования является сорт картофеля Аскольд. Создан методом межсортовой гибридизации. Относится к роду Паслён Solanum tuberosum L. Селекционный номер При-15-7-16 Ирбитский × Аврора. Среднеранний (вегетационный период 98-100 дней), накопление ранней продуктивности (на 60-й день после посадки) – 500-600 г/куст. Назначение по использованию продукции – столовое. Средняя урожайность – 46,8-55,6 т/га. Товарный клубень – 120-150 г, содержание крахмала – 12,0-17,6%. Дегустационная оценка: вкус – 8,2-9,0 баллов; разваримость – умеренная; склонность к потемнению мякоти после варки – 7,0-8,0 баллов. Лежкость клубней во время длительного хранения (9 месяцев): 85,0-91,8%. Световые ростки: расположены одиночно по всему клубню. Куст: полупрямостоя-чий, компактный, средней высоты. Стебли: слабоветвистые; количество – среднее. В поперечном разрезе – угловатые. Цветение: обильное, продолжительное. Соцветие: компактное, многоцветковое. Ягодообразование: редкое. Клубни удлиненно-овальные, глубина глазков от мелкой до среднемелкой. Кожура красная и мякоть желтая. Оптимальный срок посадки III декада апреля – I декада мая; густота посадки: на продовольственные цели – 50-55 тыс. кл./га, на семенные – 60-65 тыс. кл./га. При механизированной уборке обязательно заблаговременное удаление ботвы. Для получения ранней продуктивности рекомендуется уборка в I декаде августа, так как сорт способен накапливать на 70-й день после посадки 800-900 г/куст товарных клубней. Сорт предложен для использования по Дальневосточному региону.
Активность метаболитов. В работе по изучению содержания гликоалкалоидов в свежей ткани листьев картофеля, содержанию гормонов стресса, выражаемых в мг% адреналина в теле насекомых и активности собственных протеаз вредителя и ингибиторов протеиназ в картофеле использовали личинок первого летнего поколения картофельной коровки, собранных в полевых условиях на посадках культурного картофеля [11,12]. Отобранных особей, группами по 6-8 шт. подсаживали на листья четырех – пяти верхних ярусов индивидуальных растений картофеля. В качестве позитивного контроля использовали растения устойчивого сорта Belmonda и Solanum demissum [13]. В качестве негативного – растения неустойчивого сорта Смак [14].
Для того, чтобы избежать свободного перемещения коровок, их заключали в садки из марли, укрепленные у основания листа. За подсаженными коровками периодически наблюдали и удаляли их с растения после того, как коровки уничтожали приблизительно 1/3 часть всей площади листовой пластинки [11,12,15]. Сразу же после этого коровок умерщвляли и использовали для количественного определения адреналина. Часть поврежденного коровками листа срезали ножницами через 1, 3 и 5 суток после начала эксперимента. Контролем, отобранным одновременно с поврежденными листьями, служили: а) неповрежденные листья индивидуальных растений (интактные); б) листья с неповрежденных растений. Для чистоты эксперимента на всех контрольных листьях и листьях в опыте также были укреплены капроновые садки (без коровок). Собранные листья помещали в чашки Петри на влажную фильтровальную бумагу для транспортировки в лабораторию, и не позднее чем через 2 часа приступали к фиксации собранного материала и выделению из него экстрактов белков и гликоалкалоидов [12].
Для определения суммарного содержания гликоалкалоидов в листьях растений картофеля пользовались ускоренным методом, предложенным Тукало и др. [16]. Навеску свежих тканей (0,2-1,0 г) растирали до гомогенного состояния в фарфоровой ступке и переносили в коническую колбу, снабженную обратным шариковым холодильником с водяной рубашкой. В колбу прибавляли 100 мл 2%-ного раствора уксусной кислоты и экстрагировали гликоалкалоиды при постоянном помешивании и нагревании на водяной бане до 65°С в течение 1 часа. Затем раствор фильтровали через бумажный фильтр в мерную колбу на 100 мл; объем полученного раствора доводили до метки (охладив его до 20°С) 2%-ной уксусной кислотой, используемой для ополаскивания конической колбы и промывания осадка растительной массы, оставшейся на фильтре. Аликвоту фильтрата (от 10 до 50 мл в зависимости от величины навески) гидролизовали 30 мин с 1 мл концентрированной соляной кислоты на кипящей водяной бане с обратным холодильником. Затем рН раствора доводили до 4,0 сначала 50%-ным, а затем (после достижения рН, равного 3,8) 1%-ным раствором натриевой щелочи [17]. Полученный раствор количественно переносили в делительную воронку, прибавляли 2 мл 0,05%-ного водного раствора метилового оранжевого и образовавшееся окрашенное соединение экстрагировали хлороформом отдельными порциями по 5 мл, которые затем собирали в мерную колбу (суммарный объем хлороформа, требуемый для полной экстракции – 25 мл). Оптическую плотность окрашенных растворов определяли против чистого хлороформа на спектрофотометре СФ-26 в стандартных кварцевых кюветах (длина оптического пути – 1 см) при 420 нм. Концентрацию соланидина (агликон, оставшийся после гидролиза гликоалкалоидов соляной кислотой) в хлороформных экстрактах определяли с помощью калибровочного графика. При составлении калибровочного графика 0,1000 г соланидина растворяли в воде в мерной колбе на 100 мл, а далее поступали также как при определении гликоалкалоидов, используя для экстракции хлороформом от 0,1 до 0,6 мл приготовленного раствора соланидина. Полученный калибровочный график имеет форму прямой в пределах концентрации соланидина от 0,004 до 0,024 мкг/мл, соответствующих величинам оптической плотности от 0,07 до 0,4. Именно этого диапазона величин оптической плотности мы старались придерживаться для получения достоверных и строго воспроизводимых результатов о содержании гликоалкалоидов в растительных тканях [17].
амплифицирующих третий экзон обладающий полиморфными совершенными r-повторами [18]. ПЦР проводили в двух повторностях в 10 мкл 2Х реакционной смеси БиоМастер HS-Taq ПЦР-Color (без содержания Mg2+) (Биолабмикс) с добавлением хлорида магния до оптимальной концентрации (таб-лица1) для каждого маркера индивидуально в термоциклере Т100 (Bio-Rad). В реакцию использовали 10-50 нг. ДНК матрицы. Для контроля неспецифической гибридизации праймеров использовали холостую пробу, содержащую полную реакционную смесь без добавления ДНК матрицы. Для выявления маркеров генов устойчивости был применен температурный протокол мультиплексной реакции по Сайнакова и др. [19], реакции при этом ставили индивидуально. Для выявления вариантов StAN1 использовали следующий температурный профиль: 95° – 5 мин.; (95° – 30 сек., 55° – 30 сек., 72° – 1 мин.) – 35 циклов; постэлонгация 72° – 5 мин. Продукты ПЦР разделяли электрофорезом в 2% агарозном геле, окрашенном бромистым этидием. Визуализацию фрагментов ДНК проводили облучением УФ с помощью гель-документирую-щей системы Gel-Doc GO (Bio-Rad). Для сравнения использовался маркеры длин фрагментов Step 50 plus (Биолабмикс).
Таблица 1. Характеристика ДНК маркеров, используемых в исследовании Table 1. Characteristics of the DNA markers used in the research
|
Ген |
Маркер |
Последовательности праймеров |
Фрагмент |
MgCl 2 (mM) |
ДНК маркеры устойчивости к вирусу Y
|
Rysto |
YES3-3A (STS) |
TAACTCAAGCGGAATAACCC AATTCACCTGTTTACATGCTTCTTGTG |
341 |
0,8 |
ДНК маркер устойчивости к Globodera rostochiensis
|
H1 |
N195 (SCAR) |
TGGAAATGGCACCCACTA CATCATGGTTTCACTTGTCAC |
337 |
0,8 |
|
57 R (SCAR) |
TGCCTGCCTCTCCGATTTCT GGTTCAGCAAAAGCAAGGACGTG |
450 |
0,7 |
ДНК маркер устойчивости к Globodera pallida
|
Gpa2 |
Gpa2-2 (STS) |
GCACTTAGAGACTCATTCCA ACAGATTGTTGGCAGCGAAA |
452 |
2 |
ДНК маркер устойчивости к вирусу X
|
Rx1 |
PVX (STS) |
ATCTTGGTTTGAATACATGG CACAATATTGGAAGGATTCA |
1230 |
2,5 |
|
ДНК маркеры устойчивости к Phytophthora infestans |
||||
|
Rpi-blb1/Rpi-sto1 |
Rpi-blb 1-820 |
AACCTGTATGGCAGTG GCATG GTCAGAAAAGGGCACT CGTG |
820 |
0,75 |
|
Rpi-sto 1-890 |
ACCAAGGCCACAAGAT TCTC CCTGCGGTTCGGTTAAT ACA |
890 |
0,75 |
|
|
ДНК маркер устойчивости к раку картофеля |
||||
|
Sen1 |
NL 25 (SCAR) |
TATTGTTAATCGTTACTCCCTC AGAGTCGTTTTACCGACTCC |
1400 |
1 |
Молекулярно-генетические исследования. Тотальную ДНК выделяли из зеленых листьев растений с использованием процессора магнитных частиц KingFisher Duo Prime (Thermo Scientific) и коммерческого набора реактивов MagMAX Plant DNA Kit (Applied biosystems).
Для исследования использовали маркеры генов устойчивости к патогенам и вредителям (таблица). В качестве стандарта для сравнения был выбран сорт Метеор, имеющий пять генов устойчивости (Rysto, Rx1, Sen1, Gpa2, H1). Для выявления аллельных вариантов гена StAN1 (ANTHOCYANIN1) использовали пару праймеров (таблица)
Результаты и обсуждение
Сорт картофеля Аскольд (Ирбитский × Аврора) передан в ФГБУ «Госсорткомиссия» в 2023 году. Среднеустойчив к парше, устойчив к альтернариозу, ризоктониозу, раку картофеля, картофельной нематоде, высокоустойчив к фитофторозу, двадцативосьмипятнистой картофельной коровке. Ценность сорта: высокая урожайность, хорошая товарность, привлекательный внешний вид, подходит для механизированной очистки клубней, отличные вкусовые качества, пригоден для хранения в вакуумной упаковке (рис. 1).

Рис. 1. Внешний вид растения и клубней картофеля сорта Аскольд Fig. 1. Potato variety Askol'd – plant and tubers
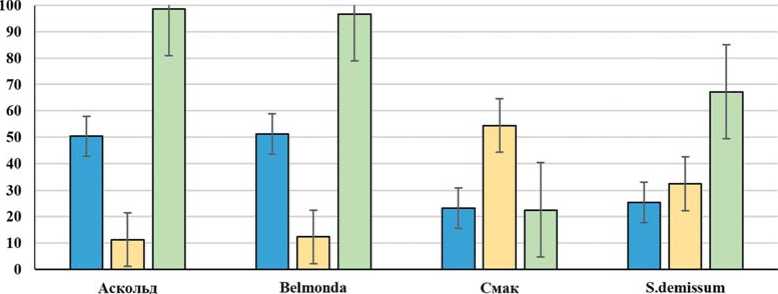
В наших исследованиях сорт Аскольд являлся высокоиммунным. Как видно из рисунка 2, при питании личинок картофельной коровки на листьях сорта Аскольд, наблюдается смертность экспериментальных особей, сопоставимая с позитивным стандартом, сортом Belmonda [13].
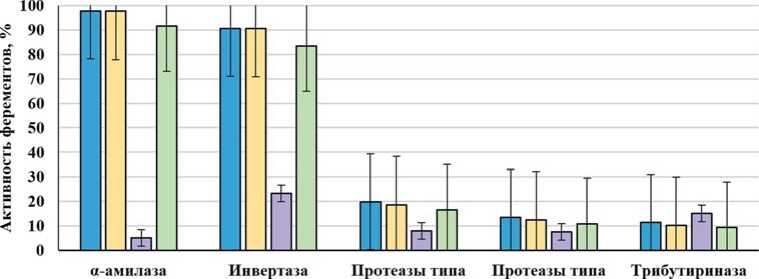
Питание на сорте Аскольд приводило к удлинению онтогенетических сроков у личинок и вызывало синдром неполного голодания, при котором происходят гетерохронии в развитии, что сопровождается устойчивым дисбалансом активности собственных ферментов картофельной коровки (рис. 3).
Наибольшая активность липолитического фермента трибутириназы отмечена на сорте Смак, что превышает показатели остальных сортов в 1,3-1,8 раза (рис. 3). По-видимому, при питании на сорте Смак наблюдается нормальный липидный обмен, что позволяет личинкам эффективно
■ Продолжительность онтогенеза, сутки
□ Вес куколки, мт □Смертность, %
Рис. 2. Продолжительность онтогенеза, вес куколки и смертность особей картофельной коровки при питании листьями картофеля сорта Аскольд
Fig. 2. Duration of the ontogeny, the pupal weight, and the mortality rate of potato ladybird beetles feeding on leaves of potato variety Askol'd
пепсина трипсина
■ Аскольд □Belmonda ПС-мак DS-demissum
Рис. 3. Активность собственных ферментов картофельной коровки при питании на различных сортах картофеля
Fig. 3. Activity of the enzymes of potato ladybird beetle feeding on different potato varieties
использовать своё жировое тело. В то же время, происходит уменьшение эффективности использования запасных жиров у личинок, кормящихся на отличных от Смака сортах, что приводит к недоразвитию жирового тела [14]. На устойчивых сортах резко замедляется акт питания картофельной коровки (рис. 3). Активность пищеварительных ферментов, гидролизирующих белки, углеводы и жиры, повышается. Реакция гиперфункции пищеварительной системы указывает на резкое возрастание энергетических затрат на усвоение пищи при питании на относительно устойчивых сортах и свидетельствует о снижении коэффициента её полезного действия. Физиологически, это свидетельствует о слабом окислении жирных кислот, что затрудняет вхождение углеводов в цикл Креббса, затем в организме ослабляется действие глюкозы на липолиз, происходит гиперактивация липолиза в результате выделения катехоламинов [14].
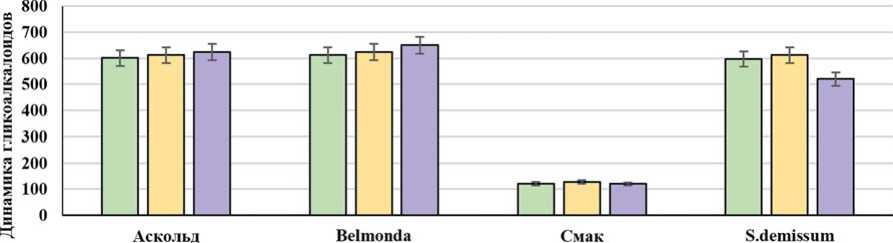
Этот этап можно характеризовать как фазу тревоги или напряженности обмена веществ в организме. Дальнейшее воздействие физиологически активных соединений вызывает состояние относительной стабилизации энергообмена, о чем свидетельствует включение в него жирных кислот. Происходит стабилизация физиологического состояния организма, которая может либо сохраниться, либо перейти в фазу истощения. В этот период возрастает уровень гормонов стресса, что является свидетельством глубоких нарушений синтеза стеролов, поскольку октапомин и дофамин, являющиеся основными гормонами стресса насекомых, блокируют выработку холестерина (рис. 4). Уровень гормонов стресса у личинок, питающихся на сорте Аскольд был сопоставимо высоким и превышал негативный контроль более чем в 10 раз. Содержание гликоалкалоидов у растений сорта Аскольд оставались стабильно высокими на всем протяжении эксперимента (рис. 5).
Установлено, что гликоалкалоиды картофеля способны ингибировать ацетилхолинэстеразу, что затрудняет проведение нервного импульса и блокирует координирующую деятельность центральной нервной системы, в том числе и у насекомых [20]. Рядом авторов установлено, что гормоны стресса проявляют специфическое воздействие на нервную систему насекомых и таким образом вызывают смену периодов гиперактивности состоянием прострации. Кроме того, гормоны стресса влияют на такие физиологические состояния организма насекомого, как регуляция углеводного обмена, контроль распада гликогена через образование циклического аденозин-3',5'-фосфата в мышцах, жировом теле, а также уровень свободной трегалозы в гемолимфе насекомого [20]. Гормоны стресса также ингибируют секрецию в гемолимфу проторакотропного гормона, вследствие чего снижается титр гормона линьки, происходит задержка развития, возникают проблемы при прохождении линек [20].
Лабораторная и полевая оценка на устойчивость к фитофторозу показала, что в ответ на заражение, сорт Аскольд демонстрирует реакцию сверхчувствительности. На месте
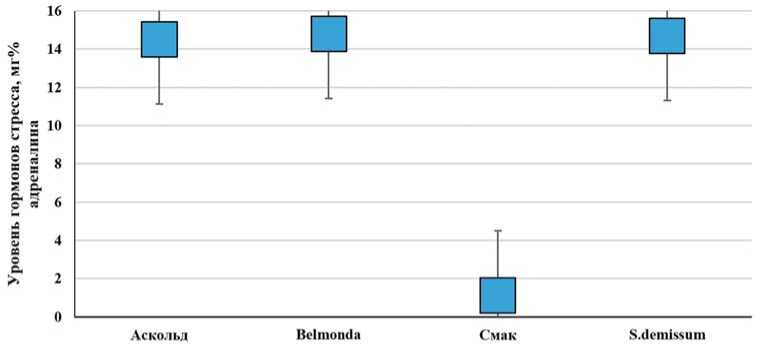
Рис. 4. Уровень гормонов стресса (мг% адреналина) в теле личинок картофельной коровки, питающихся на сорте Аскольд Fig. 4. Level of stress hormones (mg% of adrenaline) in larvae of the potato ladybird beetle feeding on potato variety Askol'd
□ 1 сутки 03 сутки 05 сутки
Рис. 5. Содержание и динамика гликоалкалоидов (мг/100 г свежей ткани) в листьях поврежденной картофельной коровкой растений картофеля Fig. 5. Content and dynamics of glycoalkaloids (mg/100 g of fresh tissue) in the potato leaves damaged by the potato ladybird beetle
Таблица 2. Генетическая характеристика сорта Аскольд Table 2. Genetic characteristics of potato variety Askol'd.
|
H1 |
Rx1 |
Gpa2 |
Rysto |
Sen1 |
Rpi-blb1/Rpi-sto1 |
StAN1 |
||||||
|
N195 |
57R |
PVX |
Gpa2-2 |
Yes 3A |
NL25 |
Rpi-blb1-820 |
Rpi-sto1-890 |
r0 |
r1 |
r2 |
r3 |
|
|
Асколь д |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |


