К вопросу оценки основных кинетических параметров реакций протеолиза при получении зерновых гидролизатов
Автор: Витол И. С., Мелешкина Е. П.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология продуктов питания и биологически активных веществ. Пищевые системы
Статья в выпуске: 3 т.28, 2025 года.
Бесплатный доступ
Оценка основных кинетических параметров и определение оптимальных условий проведения ферментативных реакций, выбор ферментных препаратов (ФП) и мультэнзимных композиций (МЭК) представляет актуальную задачу, решение которой направлено на оптимизацию процесса модификации разных видов зерновых отрубей. Это связано, в первую очередь, с поиском путей повышения эффективности ферментативного катализа, возможности получать зерновые гидролизаты заданного состава для их дальнейшего использования с целью создания новых сбалансированных кормовых и пищевых продуктов повышенной пищевой и биологической ценности. Приведены экспериментальные данные по основным кинетическим параметрам ферментативного гидролиза при действии на природный субстрат (разные виды отрубей) ФП трипсина, пепсина, папаина. По результатам экспериментальных и расчетно-графических работ с учетом принятых допущений определены "кажущиеся" константы Михаэлиса и Vmax, которые косвенно свидетельствуют о различном сродстве изучаемых ферментных препаратов к субстрату (отруби). Установлена ингибирующая активность ароматических аминокислот (тирозина и триптофана) по отношению к ФП папаин и пепсин: в концентрации 0,6 мг/мл ингибирование в диапазоне 90–100 % для разных видов отрубей. Исключение составляет ФП трипсин, по отношению к которому ингибирующая активность выражена слабо в обоих случаях. На примере ФП папаин установлен конкурентный характер ингибирования. Выявлена высокая эффективность МЭК (Агросил Премиум + Папаин + Агрофит) при действии на разные виды отрубей. Использование МЭК позволяет увеличить количество водорастворимого белка в среднем для пшеничных отрубей в 3,5 раза; ржаных – в 3,1; овсяных – в 2,5; кукурузных – в 2,2; гречневых отрубей – в 3 раза. Методом гель-хроматографии установлено соотношение высоко-, средне- и низкомолекулярных фракций продуктов протеолиза.
Ферментативная кинетика, ферментные препараты, мультэнзимные композиции, зерновые отруби, гидролизаты, enzymatic kinetics, enzyme preparations, multienzyme compositions, grain bran, hydrolysates
Короткий адрес: https://sciup.org/142245682
IDR: 142245682 | УДК: 664.76/577.15 | DOI: 10.21443/1560-9278-2025-28-3-329-341
Текст статьи К вопросу оценки основных кинетических параметров реакций протеолиза при получении зерновых гидролизатов
DOI:
е-mail: , ORCID:
е-mail: , ORCID:
Гидролизаты растительного сырья, в том числе и зернового, получаемые с использованием ферментных препаратов (ФП) разной специфичности, широко изучаются с целью их применения при производстве новых обогащенных видов кормов и пищевых продуктов ( Серба и др., 2022; Болтовский, 2021 ). Как показывает анализ научных публикаций, акцент делается на вторичные продукты переработки сырья, содержащих ценные ингредиенты, необходимые для создания сбалансированных продуктов, таких как белки, нерастворимые и растворимые пищевые волокна, витамины, макро- и микроэлементы, минорные биологически активные соединения ( Витол и др., 2025а ). Это связано с тем, что ферментативный гидролиз имеет ряд преимуществ ( Свириденко и др., 2017а ), позволяющих получать гидролизаты заданного состава с определенными молекулярно-массовыми характеристиками и функционально-технологическими свойствами. В некоторых случаях в них обнаружены биологически активные пептиды, что свидетельствует о возможности их использования в качестве функциональных компонентов, обладающих значительным фармакологическим потенциалом ( Колпакова и др., 2024; Куликов и др., 2025а, б ).
Однако использование ферментативных гидролизатов может быть существенно ограничено из-за появления горького вкуса при использовании некоторых ФП микробного происхождения, которое связывают с образованием так называемых "горьких пептидов" с определенной молекулярной массой (Мм), длиной пептида, наличием и количеством в них остатков пролина и гидрофобных аминокислот ( Семенова и др., 2023 ). С целью снижения или полного устранения горечи возможно применение различных мер: проведение ограниченного протеолиза с участием пролин-специфичных экзо- и эндопептидаз ( Балабан и др., 2011; FitzGerald et al., 2006 ); поиск ферментных препаратов, использование которых не приводит к появлению горького вкуса или его проявление столь незначительно, что маскируются другими компонентами и не оказывают отрицательного воздействия на органолептические показатели готовых изделий ( Свириденко и др., 2017б; Liu et al., 2022 ); использование ультрафильтрации гидролизатов для удаления пептидов определенной Мм, обусловливающих горький вкус ( Свириденко и др., 2017б ); создание комплексов, например, с β-циклодекстринами ( Головач и др., 2024 ) и/или хитозаном ( Курченко и др., 2023 ), нивелирующих горечь; применение физических (ультразвуковое воздействие) или биохимических (специфическое ингибирование протеиназ) методов с целью предотвращения появления нежелательных вкусов и запахов при воздействии высоких температур ( Свириденко и др., 2017б; Семенова и др., 2023 ).
Известно, что ферментативный катализ существенно отличается от неферментативного. В связи с этим ферментативная кинетика выделена в самостоятельный раздел и ее изучение наряду с важным теоретическим значением имеет и практические аспекты, поскольку только на основе изучения кинетики действия того или иного фермента можно подобрать оптимальные условия для его работы и регулировать ферментативный процесс в заданном направлении ( Seibert et al., 2021 ).
Основные положения ферментативной кинетики разработаны В. Анри (1902 г.), Л. Михаэлисом и М. Ментон (1913 г.), а также их последователями ( Кретович, 1986; Rogers и др., 2009 ). Ученые постулировали 2-стадийное протекание ферментативной реакции – фермент (Е) взаимодействует с субстратом (S) с образованием фермент-субстратного комплекса (ES), который может распадаться в двух направлениях. Прямая реакция приводит к образованию продуктов реакции (Р); фермент, как и любой катализатор, в процессе реакции не претерпевает изменений и может реагировать с новой молекулой субстрата k + 1 k + 2
E = S^ES ^P + E, k-i где k+1 – константа скорости реакции образования фермент-субстратного комплекса ES; k–1, k+2 – константы скорости реакции распада комплекса ES в двух направлениях.
K S – константа диссоциации комплекса ES – равна отношению констант скоростей обратной и прямой реакции
K = —
S k + 1
.
Фермент во время ферментативной реакции находится как в свободной, так и связанной форме. При концентрации субстрата, когда весь фермент находится в комплексе ES, скорость реакции будет максимальной (Vmax). Уравнение Михаэлиса – Ментен выражает зависимость действия ферментов от концентрации субстрата v = V A S ] 0 = Ks +[S].
При его выводе не учитывалась вторая стадия ферментативной реакции – образование Е и Р.
Учет влияния образовавшихся продуктов реакции отражен в уравнении Холдейна – Бриггса
VaAS]
0 = Km +[S] .
В этом уравнении вместо KS используется Кm – константа Михаэлиса, которая отражает распад комплекса ES в двух направлениях
_ k - 1 + k + 2 m = k . 1
.
Поскольку Ks = ^1, то K = Ks + — + 2 , т. е. Кт всегда больше К$ .
S k . 1 m S k . I
Уравнение Холдейна – Бриггса было преобразовано Лайнуивером и Берком по методу двойных обратных величин
1 K 1 1
= — х + (уравнение Лайнуивера - Берка).
V o V [ S ] V
Значение К m можно получить графическим способом (рис. 1, а ); более точное определение величины К m возможно при обработке данных по методу двойных обратных величин (прямолинейная зависимость) (рис. 1, б ).
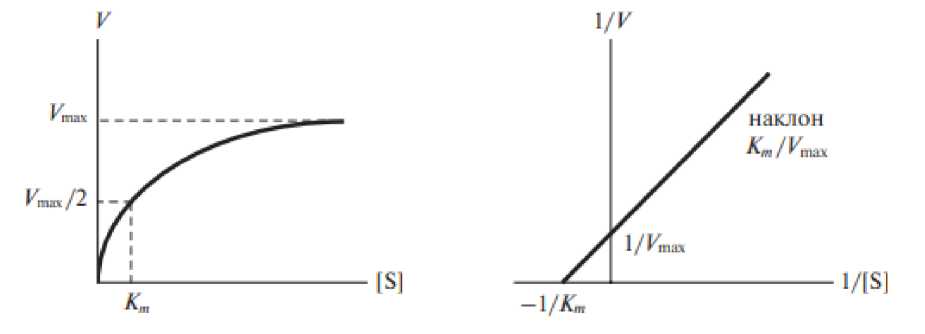
Рис. 1. Влияние концентрации субстрата на начальную скорость ферментативной реакции ( а – по методу Михаэлиса – Ментен, б – по методу Лайнуивера – Берка)
Fig. 1. Effect of substrate concentration on the initial rate of enzymatic reaction
( а – according to the Michaelis – Menten method, б – according to the Lineweaver – Burk method)
Величина Кm , численно равная концентрации субстрата (в молях на литр), при которой скорость реакции равна половине максимальной, является ключевым кинетическим параметром, характеризующим сродство фермента к субстрату.
Вопросы кинетики при проведении ферментативной модификации растительного сырья – сложного многокомпонентного (гетерогенного) субстрата с использованием ФП разной специфичности действия и их композиций – в настоящее время заслуживают особого внимания.
Актуальность исследований по оптимизации ферментативной модификации разных видов зерновых отрубей (выбор ФП, изучение кинетики и определение оптимальных условий проведения ферментативных реакций) связана, в первую очередь, с поиском путей повышения эффективности ферментативного катализа, возможности получать зерновые гидролизаты заданного состава для их дальнейшего использования с целью создания новых кормовых и пищевых продуктов сбалансированного состава, повышенной пищевой и биологической ценности.
Цель исследования – на основании изучения кинетики ферментативных реакций гидролиза белков с использованием ферментных препаратов (ФП) трипсин, пепсин и папаин научно обосновать и оптимизировать проведение ферментативной модификации разных видов отрубей для получения гидролизатов разного состава и свойств.
Материалы и методы
В качестве объектов исследования использовали товарные партии пшеничных, ржаных, овсяных, кукурузных и гречневых отрубей отечественного производства. Химический состав (табл. 1), особенности белково-протеиназного и углеводно-амилазного комплексов исходных отрубей представлены в работе ( Витол и др., 2025б )
Таблица 1. Химических состав исходных отрубей ( Витол и др., 2025б )
Table 1. Chemical composition of the original bran ( Vitol et al., 2025b )
|
Отруби |
Влажность, % |
Белок, % |
Жир, % |
Крахмал, % |
Клетчатка, % |
|
Пшеничные |
12,5 |
13,8 |
3,5 |
26,1 |
24,8 |
|
Ржаные |
11,0 |
11,8 |
3,2 |
20,3 |
28,2 |
|
Овсяные |
11,7 |
12,6 |
6,8 |
22,4 |
23,6 |
|
Кукурузные |
11,8 |
9,4 |
1,1 |
28,8 |
16,8 |
|
Гречневые |
4,3 |
18,0 |
4,2 |
18,5 |
21,0 |
Общее содержание белка определяли по методу Кьельдаля ( N ×6,25) (ГОСТ 10846-911); жира – по методу Сокслета (ГОСТ 29033-912); клетчатки – по ГОСТ 31675-20123; крахмала – по методу Эверса (ГОСТ 10845-984).
В качестве ФП использовали ФП протеолитического действия – Трипсин, CAS 9002-07-7, 250 N.F.U/мг; Пепсин 1:3000, CAS 9001-75-6; Папаин CAS 9001-73-4, 200 000 МЕ/г (Servicebio, Китай), а также ФП целлюлолитического действия – Агросил Премиум и фитазного действия – Агрофит (ОАО Агрофермент, Россия), характеристика которых представлена в работе ( Krikunova et al., 2023 ). Выбор ферментных препаратов обусловлен различной субстратной специфичностью и эффективностью ферментативного гидролиза, а также их доступностью на российском рынке. Активность протеаз определяли по модифицированному методу Ансона и выражали в ед. ПС/г отрубей или в процентах к исходной активности5.
В качестве субстрата использовали водный экстракт из отрубей (отруби подвергались дополнительному размолу с выделением фракции отрубей 335 мкм), гидромодуль 1 : 10 (вес/объем) при комнатной температуре при интенсивном перемешивании (3 000 об/мин) в течение 3 мин. Для выявления оптимумов рН и температуры активность ФП протеиназ изучали в диапазоне рН от 1,5 до 10,0 (с использованием фосфатно-цитратного буфера) и температуры от 30 до 70°.
Ферментативную реакцию проводили при оптимальных значениях рН и температуры для каждого вида отрубей в течение 2 ч с отбором проб каждые 10 мин в течение первого часа и через 20 мин в течение второго часа; полученные данные использовали для расчета начальной скорости V 0 ферментативных реакций, построения зависимостей V 0 от [E] и [S], дальнейшего определения константы Михаэлиса ( Кm ) согласно уравнению Михаэлиса – Ментон и его математического преобразования (линеаризация) по методу Лайнуивера – Берка ( Кретович, 1986; Seibert et al., 2021; Rogers et al., 2009 ).
Эффективность действия ФП целлюлолитического действия оценивали по накоплению редуцирующих веществ (по методу Бертрана), ФП протеиназ – по накоплению водорастворимого белка (по методу Лоури), ФП фитазы – по накоплению фосфат-ионов, содержание которых определяли колориметрическим методом при длине волны 670 нм на спектрофотометре СФ-2000 (ООО "ОКБ Спектр", Россия) с использованием градуировочной кривой (ГОСТ 31487-20126).
Молекулярную массу продуктов протеолиза определяли методом гель-хроматографии7 ( Остерман, 1985 ) на колонке с TSK gel Toyopearl HW-55F (Tosoh, Япония).
Для обработки результатов исследований определяли средние арифметические значения величин из трех измерений для каждого образца, среднеквадратичное отклонение не превышало 3 % при доверительной вероятности Р = 0,95. С этой целью использовали методы математической статистики с применением программного обеспечения Microsoft Excel, версия 2018 г.8
Результаты и обсуждение
Основные кинетические параметры ферментативных реакций гидролиза белков разных видов отрубей с использованием ФП трипсин, пепсин и папаин
Изучение кинетики ферментативных реакций – определение основных кинетических параметров: V 0, оптимумы Т° и рН, V max; Ks и Km ; [S] и [E] – необходимо для выявления сродства фермента к субстрату, оптимизации условий проведения ферментативного катализа и сравнении эффективности различных ферментов при действии на один и тот же субстрат.
Начальную скорость ферментативной реакции V 0 определяли графическим методом и рассчитывали, как тангенс угла наклона касательной к кривой хода ферментативной реакции во времени ( Кретович, 1986 ). Получены следующие величины V 0 : при действии ФП трипсин на пшеничные и гречневые – 2,0; на овсяные и кукурузные – 1,9; на ржаные – 2,5; при действии ФП пепсин на пшеничные отруби – 0,75; на ржаные и кукурузные – 0,9; на овсяные – 1,0 и на гречневые 1,2; при действии ФП папаин на пшеничные и овсяные отруби – 1,5; на ржаные и гречневые – 1,75; на кукурузные – 1,3. На практике за V 0 принимали время (мин), соответствующее прямолинейному отрезку кривой ферментативной реакции (реакция 0-порядка). Во всех вариантах реакция идет по 0-порядку (когда наблюдается прямая пропорциональная зависимость между продуктами реакции и временем действия фермента) в течение первых 15 мин.
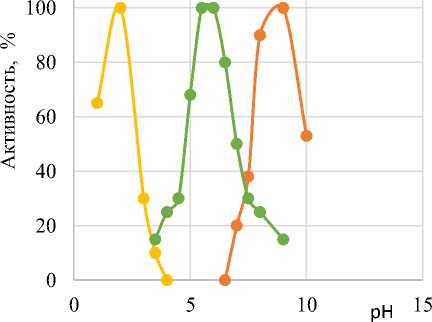
Температурные оптимумы для всех вариантов находятся в диапазоне 40–50°, для некоторых он выражен более определенно: 40° при действии трипсина на гречневые отруби и 50° при действии на овсяные отруби.
Оптимумы рН для трипсина при действии на разные виды отрубей составляют 8,0–9,0; пепсина – 1,5–2,0; папаина – 5,0–5,5, для гречневых отрубей – 5,5–6,0 и практически не отличаются от оптимумов рН при действии на стандартный субстрат (бычий сывороточный альбумин).
Учитывая, что водные экстракты из разных видов отрубей представляют собой многокомпонентный (гетерогенный) субстрат, а используемые ФП не являются высокоочищенными и содержат минорные активности и балластные вещества необходимо принять ряд допущений и в дальнейшем оперировать такими понятиями, как "кажущиеся" K m – K m (каж) и V max – V max(каж) .
В качестве примера на рис. 2 представлены зависимость активности исследуемых ферментов от температуры и рН при действии на гречневые отруби.
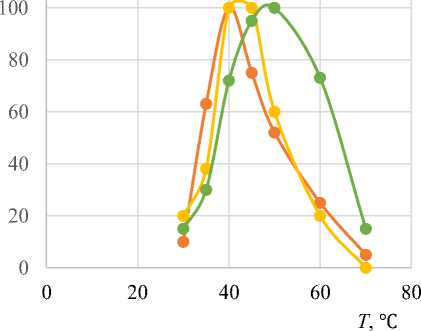
Трипсин Пепсин Папаин
а
Трипсин Пепсин Папаин
б
Рис. 2. Влияние температуры ( а ) и рН ( б ) на активность исследуемых ферментов Fig. 2. Effect of temperature ( a ) and pH ( б ) on the activity of the studied enzymes
Сравнение эффективности действия ФП на одинаковый субстрат с применением уравнения Михаэлиса – Ментен и его линейного преобразования по Лайнуиверу – Берку с учетом принятых допущений
Для построения субстратных кривых и определения К m (каж) в качестве субстрата использовали водные экстракты из отрубей с гидромодулем 1 : 4 (вес/объем) и его дальнейшим разведением в 2, 3, 4, 5 и 10 раз. Определяли количество водорастворимого белка (в мг/на мл) по методу Лоури. Это еще одно допущение, поскольку выразить концентрацию субстрата в м/л для определения К m не представляется возможным ввиду его гетерогенности.
На основании проведения кинетических исследований были установлены оптимальные условия действия ФП: концентрации ФП – трипсин 0,8 ед. ПС/г отрубей; пепсин – 1,0 ед. ПС /г отрубей; папаин – 0,8 ед. ПС/г отрубей; насыщающая концентрация субстрата для всех ФП – 0,150 мг/мл. На рис. 3 представлены субстратные кривые для исследуемых ферментных препаратов, где в качестве субстрата использовали водный экстракт из гречневых отрубей.
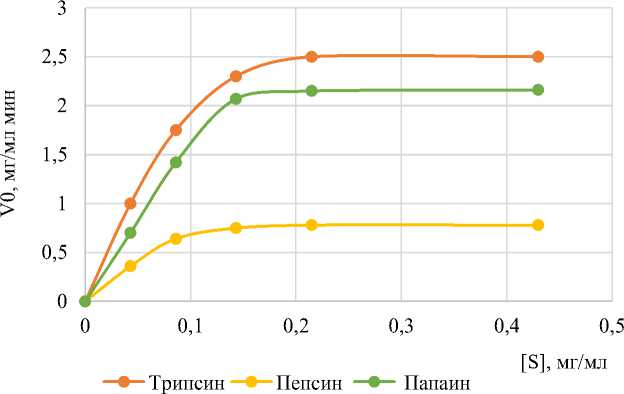
Рис. 3. Влияние концентрации субстрата (экстракт из гречневых отрубей) на активность исследуемых ФП Fig. 3. Effect of substrate concentration (buckwheat bran extract) on the activity of the studied EPs
Из графика следует, что при гидролизе белков гречневых отрубей трипсином V max(каж) – 2,50 и К m (каж) – 0,086; пепсином: V max(каж) – 0,78 и К m (каж) – 0,040; папаином: V max(каж) – 2,15 (мг/мл мин) и К m (каж) – 0,075 (мг/мл).
Обработка полученных данных по методу двойных обратных величин Лайнуивера – Берка дала следующие результаты (табл. 2).
Таблица 2. Значения V max ( каж ) и Km ( каж ) для ферментативных реакций гидролиза белков гречневых отрубей исследуемыми ФП, полученные графически-расчетным методом Table 2. Values of V max(app) and K m (app) for enzymatic reactions of hydrolysis of proteins of buckwheat bran by the studied FPs obtained by the graphical-calculation method
|
Ферментные препараты |
По методу Михаэлис – Ментон |
По методу Лайнуивера – Берка |
||
|
V max(каж) , мг/мл мин |
Km ( каж ) , мг/мл |
V max(каж) , мг/мл мин |
Km ( каж ) , мг/мл |
|
|
Трипсин |
2,50 |
0,086 |
2,60 |
0,083 |
|
Пепсин |
0,78 |
0,040 |
0,83 |
0,050 |
|
Папаин |
2,15 |
0,075 |
2,00 |
0,077 |
Таким образом, несмотря на принятые допущения, полученные значения "кажущихся" констант Михаэлиса и V max (табл. 3) могут косвенно свидетельствовать о различном сродстве изучаемых ферментных препаратов к субстрату (разные виды отрубей).
Влияние ароматических аминокислот на активность ФП трипсина, пепсина, папаина
В научных публикациях имеются данные об ингибировании протеолитических ферментов ароматическими аминокислотами ( Мосолов, 1971 ). Для изучения влияния ароматических аминокислот (тирозина и триптофана) в инкубационную смесь вносили аминокислоты до конечной концентрации от 0,1 до 0,8 мг/мл. Предынкубацию ФП, соответствующего буфера и аминокислот проводили в течение 20 мин, затем вносили субстрат.
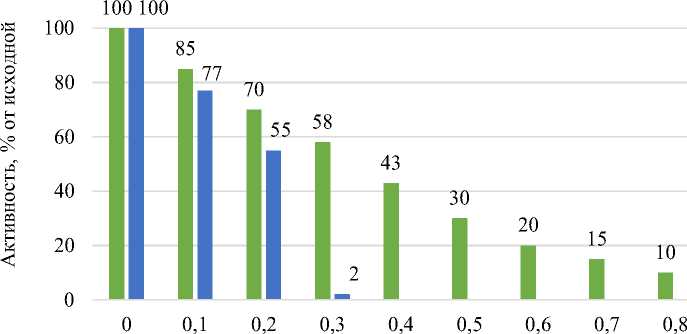
Из представленных данных (рис. 4, табл. 3) следует, что ингибирующая активность триптофана по отношению к исследуемым ФП (пепсин и папаин) значительно превышает ингибирующую активность тирозина во всех вариантах; исключение составляет ФП трипсин, по отношению к которому ингибирующая активность выражена слабо в обоих случаях.
Известно, что папаин и пепсин гидролизуют пептидные связи, образованные ароматическими аминокислотами: папаин преимущественно – пептидную связь, образованную СООН-группой фенилаланина и тирозина, а пепсин – пептидную связь, образованную NH 2 -группой фенилаланина и тирозина.
■ тирозин ■ триптофан
Концентрация аминокислот, мг/мл
Рис. 4. Влияние ароматических аминокислот на ФП папаин при гидролизе белков водного экстракта из гречневых отрубей
Fig. 4. Effect of aromatic amino acids on the EP papain during hydrolysis of proteins of aqueous extract from buckwheat bran
Таблица 3. Сводная таблица по влиянию ароматических аминокислот на активность исследуемых ФП при гидролизе разных видов отрубей Table 3. Summary table of the effect of aromatic amino acids on the activity of the studied EP during hydrolysis of different types of bran
|
Отруби |
Ингибирование ароматическими аминокислотами, % |
|||
|
тирозин, мг/мл |
триптофан, мг/мл |
|||
|
0,3 |
0,6 |
0,3 |
0,6 |
|
|
трипсин |
||||
|
Пшеничные |
12 |
15 |
15 |
20 |
|
Ржаные |
10 |
13 |
10 |
15 |
|
Овсяные |
5 |
10 |
10 |
10 |
|
Кукурузные |
5 |
8 |
8 |
8 |
|
Гречневые |
10 |
15 |
10 |
20 |
|
пепсин |
||||
|
Пшеничные |
20 |
75 |
25 |
90 |
|
Ржаные |
22 |
80 |
32 |
100 |
|
Овсяные |
25 |
70 |
30 |
90 |
|
Кукурузные |
25 |
70 |
27 |
95 |
|
Гречневые |
40 |
80 |
80 |
100 |
|
папаин |
||||
|
Пшеничные |
32 |
75 |
55 |
95 |
|
Ржаные |
37 |
80 |
60 |
100 |
|
Овсяные |
35 |
80 |
50 |
95 |
|
Кукурузные |
30 |
70 |
52 |
98 |
|
Гречневые |
42 |
80 |
98 |
100 |
При выяснении характера ингибирования было установлено, что ферментативная реакция (на примере гидролиза водорастворимых белков гречневых отрубей ФП папаин) имеет одинаковую максимальную скорость в отсутствии ингибиторов и при двух различных концентрациях триптофана 0,1 и 0,2 мг/мл. При обработке полученных данных по методу двойных обратных величин Лайнуивера – Берка отрезок, отсекаемый от оси 1/V, остается постоянным. Это свидетельствует о конкурентном характере ингибирования (Мосолов, 1971) и позволяет предположить, что расщепление белка происходит по связям, образованным с участием триптофана.
Полученные данные позволят использовать ароматические аминокислоты в качестве ингибиторов ФП папаин и пепсин для остановки ферментативной реакции протеолиза. Это дает возможность исключить стадию теплового воздействия и, таким образом, избежать появления нежелательных вкусов и запахов при получении гидролизатов ( Свириденко и др., 2017б; Семенова и др., 2023 ).
Фракционирование продуктов протеолиза методом гель-хроматографии
Методом гель-хроматографии было установлено соотношение высоко-, средне- и низкомолекулярных фракций продуктов протеолиза: гидролизат 1 получен с использованием ФП трипсин; гидролизат 2 – с использованием ФП пепсин и гидролизат 3 – с использованием ФП папаин. Каждый вид гидролизата имеет свои особенности, которые зависят как от природы субстрата (вида отрубей), так и от специфичности действия ФП протеиназ. В табл. 4 в качестве примера приведено соотношение фракций с различной молекулярной массой, полученное при фракционировании продуктов протеолиза белков водных экстрактов из гречневых отрубей исследуемыми ферментными препаратами. В качестве контроля использовали водный экстракт из гречневых отрубей (гидромодуль 1 : 10) без проведения реакций ферментативного гидролиза.
Таблица 4. Фракционирование продуктов протеолиза белков водных экстрактов из гречневых отрубей методом гель-хроматографии
Table 4. Fractionation of proteolysis products of proteins of aqueous extracts from buckwheat bran by gel chromatography
|
Фракция |
Молекулярная масса, кДа |
% от общего количества |
|||
|
Контроль |
Гидролизат 1 |
Гидролизат 2 |
Гидролизат 3 |
||
|
6–13 |
≥ 700 |
32,80 |
16,70 |
23,08 |
21,20 |
|
14–15 |
450 ÷ 350 |
20,24 |
10,76 |
15,47 |
13,15 |
|
16–19 |
300 ÷ 100 |
10,30 |
8,40 |
10,22 |
13,10 |
|
20–22 |
100 ÷ 50 |
5,8 |
0 |
6,28 |
10,79 |
|
23–26 |
50 ÷ 25 |
13,70 |
15,00 |
13,60 |
11,38 |
|
27–30 |
25 ÷ 1,5 |
6,00 |
18,88 |
10,25 |
7,14 |
|
31–36 |
≤ 1,0 |
11,16 |
30,26 |
21,10 |
23,24 |
Эффективность разработанной мультэнзимной композиции (МЭК) при ферментативной модификации разных видов отрубей
Для интенсификации процесса ферментативной модификации разных видов отрубей была разработана МЭК, в состав которой наряду с ФП папаин были включены ФП целлюлолитического (Агросил Премиум) и фитолитического (Агрофит) действия. Использование ФП целлюлолитического и фитазного действия позволяет высвободить белки из связанного состояния (комплексы белков и некрахмальных полисахаридов; белков и фитина), что повышает доступность субстрата для действия протеолитических ферментов и обеспечивает интенсификацию процесса протеолиза за счет синергетического эффекта ФП разной специфичности ( Krikunova и др., 2023; Витол и др., 2023 ).
Основными критериями при создании МЭК являлись:
– эффективность действия отдельных ФП на зерновой субстрат ( Krikunova и др., 2023 );
– близкие по значениям оптимумы температуры и рН ( Витол и др., 2023 );
-
– наименьшая степень горечи при использовании ФП папаин ( Meinlschmidt et al., 2015; Витол и др., 2025в );
-
– возможность коррекции горького вкуса за счет инактивации ФП папаин и остановки ферментативной реакции гидролиза белков ароматическими аминокислотами (исключая стадию кратковременного температурного воздействия, вызывающую негативные изменения органолептических свойств (вкус и запах) гидролизатов ( Семенова и др., 2023 ).
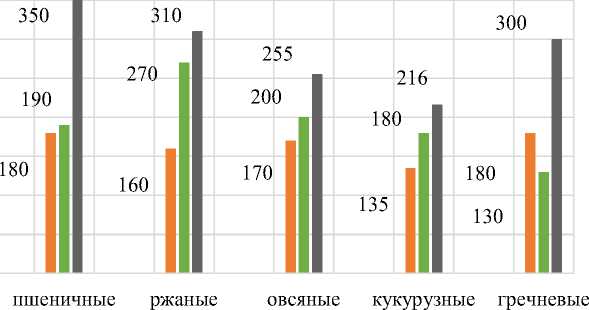
На рис. 5 представлена диаграмма эффективности исследуемых ФП, входящих в состав МЭК, при действии на разные виды отрубей. ФП Агросил Премиум наиболее активно гидролизует некрахмальные полисахариды пшеничных и гречневых отрубей; ФП Агрофит наибольшую активность проявляет по отношению к ржаным отрубям, наименьшую – к гречневым, что, вероятно, связано с различным содержанием в них фитина. ФП папаин активно гидролизует белки во всех исследуемых вариантах, его эффективность по отношению к различным субстратам (разные виды отрубей) снижается в ряду: пшеничные – ржаные – гречневые – овсяные – кукурузные отруби.
>к s 350
о
Й 300
к о 250
\О
н
§ 150
5 100
НА
<
■ ФП Агросил Премиум ■ ФП Агрофит ■ ФП Папаин
Рис. 5. Диаграмма эффективности ФП при действии разных видов отрубей Fig. 5. Diagram of the EP effectiveness when different types of bran are used
Ферментативную модификацию отрубей с использованием МЭК осуществляли следующим образом: инкубационная смесь состояла из 10 г размолотых зерновых отрубей, 100 мл дистиллированной воды (20 % от объема фосфатно-цитратного буфера с рН 5,0). Предынкубация фермента и субстрата происходила при заданной температуре (40 °C) в течение 10 мин. Ферментативную модификацию проводили в 2 этапа, продолжительность каждого этапа 2 ч: на 1-м этапе вносили ФП Агроксил Премиум + Агрофит, на 2-м этапе – ФП папаин в дозировках, обеспечивающих оптимальное значение в инкубационной смеси. Надосадочную жидкость отделяли центрифугированием при 6 000 об/мин и полученный гидролизат использовали для дальнейших исследований.
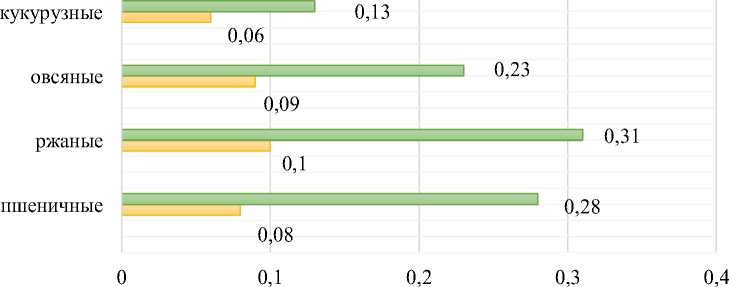
На рис. 6 представлена эффективность МЭК по сравнению с действием ФП папаин при ферментативной модификации разных видов отрубей.
гречневые
0,36
0,12
Белок, мг/мл
□ МЭК □ ФП Папаин
Рис. 6. Эффективность МЭК при ферментативной модификации разных видов отрубей
Fig. 6. Efficiency of MEC in enzymatic modification of different types of bran
Использование МЭК позволяет увеличить количество водорастворимого белка в среднем для пшеничных отрубей в 3,5 раза; ржаных отрубей в 3,1 раза; овсяных отрубей в 2,5 раза; кукурузных отрубей в 2,2 раза; гречневых отрубей в 3 раза. Полученные данные подтверждают синергетический эффект ФП целлюлолитического, протеолитического и фитазного действий и позволяют рекомендовать разработанную МЭК для получения ферментативных гидролизатов из разных видов отрубей ( Krikunova и др., 2023; Витол и др., 2023 ).
Заключение
Изучены основные кинетические параметры ферментативных реакций гидролиза водорастворимых белков разных видов отрубей с использованием ФП протеиназ животного (трипсин, пепсин) и растительного (папаин) происхождения: установлены оптимальные значения температуры и рН; начальная скорость ферментативной реакции V 0 . По результатам экспериментальных и расчетно-графических работ определены насыщающая концентрация субстрата, оптимальное количество ФП, "кажущиеся" константы Михаэлиса и Vmax, которые косвенно свидетельствуют о различном сродстве изучаемых ферментных препаратов к субстрату (отруби). Показано, что эффективность исследуемых ФП при действии на водные экстракты из разных видов отрубей снижается в ряду: трипсин – папаин – пепсин.
Выявлена ингибирующая активность ароматических аминокислот (тирозина и триптофана) по отношению к ФП папаин и пепсин: в концентрации 0,6 мг/мл ингибирование в диапазоне 90–100 % для разных видов отрубей. Исключение составляет ФП трипсин, по отношению к которому ингибирующая активность выражена слабо в обоих случаях. На примере ФП папаин установлен конкурентный характер ингибирования.
Методом гель-хроматографии установлено соотношение высоко-, средне- и низкомолекулярных фракций продуктов протеолиза в гидролизатах, полученных с использованием ФП трипсин, папаин и пепсин. Показано, что их использование позволяет получать гидролизаты с различными молекулярномассовыми характеристиками.
Выявлена высокая эффективность МЭК (Агросил Премиум + Папаин + Агрофит) при действии на разные виды отрубей. Использование МЭК позволяет увеличить количество водорастворимого белка в среднем для пшеничных отрубей в 3,5 раза; ржаных отрубей в 3,1 раза; овсяных отрубей в 2,5 раза; кукурузных отрубей в 2,2 раза; гречневых отрубей в 3 раза по сравнению с действием ФП папаин.
Результаты исследования будут использованы в дальнейшей экспериментальной работе – ферментативной модификации смесей из разных видов отрубей, при разработке способов ферментативной модификации зерновых отрубей и получения гидролизатов с разными молекулярно-массовыми характеристиками и функционально-технологическими свойствами с целью их применения для создания сбалансированных кормов и пищевых продуктов, а также в качестве обогащающего компонента при производстве разных видов пищевой продукции, в том числе и специализированного назначения.
Статья подготовлена в рамках выполнения исследований по государственному заданию № FGUS-2025-0002 Федерального научного центра пищевых систем им. В. М. Горбатова Российской академии наук.


