Качество жизни больных хроническим миелолейкозом с глубоким молекулярным ответом до и после отмены терапии ингибиторами тирозинкиназ
Автор: Петрова А. Н., Ионова Т. И., Челышева Е. Ю., Шухов О. А., Быкова А. В., Немченко И. С., Никитина Т. П., Порфирьева Н. М., Зинковская А. В., Цыба Н. Н., Туркина А. Г.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Изучить качество жизни (КЖ) больных хроническим миелолейкозом (ХМЛ) с глубоким молекулярным ответом (МО) до отмены терапии ингибиторами тирозинкиназ (ИТК) и проанализировать динамику показателей КЖ после прекращения терапии.
Хронический миелолейкоз, ингибиторы тирозинкиназ, глубокий молекулярный ответ, ремиссия без лечения, качество жизни
Короткий адрес: https://sciup.org/170175041
IDR: 170175041
Текст научной статьи Качество жизни больных хроническим миелолейкозом с глубоким молекулярным ответом до и после отмены терапии ингибиторами тирозинкиназ
Введение. В настоящее время в результате применения высокоэффективной терапии ингибиторами тирозинкиназ (ИТК) продолжительность жизни больных хроническим миелолейкозом (ХМЛ) сравнима с общей популяцией. На фоне постоянной терапии у 40–60 % больных возможно достижение глубокого молекулярного ответа (МО), определяемого как уровень химерного транскритпа BCR-ABL < 0,01 % [1, 2]. Современные исследования показывают, что при условии длительного стабильного глубокого МО, часть больных ХМЛ могут безопасно прекратить терапию без возникновения рецидива [3].
Комплексная оценка состояния больных ХМЛ после прекращения лечения должна also signi^icantly lower in group with acute comorbidity. The signi^icant positive changes by general health, energy/vitality, mental health and QoL were observed at 3 months after TK stop in patients with acute comorbidity status. QoL in patients with 2-nd grade TK toxicity at baseline (n = 18) was signi^icantly worse by role limitations physical and energy/vitality compared with patients with 1-st grade TK toxicity and with no toxicity. There was a signi^icant improvement by these scales as well as by general health at 3 months after TK stop.
Conclusion . The QoL in CML patients with MR on TK treatment is slightly worse as compared to general population. Negative effects on CML patients QoL before TK therapy discontinuation were acute comorbidity status and 2-nd grade TK toxicity. Patients with acute comorbidity and TK toxicity had more pronounced positive QoL changes after treatment cessation than other patients. n general, the TK therapy discontinuation had a positive effect on the QOL of CML patients.
включать, наряду с клиническими и лабораторными показателями, информацию о качестве жизни пациентов [4], которое является интегральной характеристикой физического, психологического, эмоционального и социального функционирования больного, основанной на его субъективном восприятии [5]. Базовым инструментом исследования КЖ служат специально разработанные для каждого раздела клинической медицины опросники.
Предполагается, что прекращение терапии ИТК может улучшить качество жизни больных ХМЛ, однако следует отметить, что исследования, посвященные оценке качества жизни у больных ХМЛ после прекращения те- рапии ИТК, в настоящее время немногочисленны, а имеющиеся данные противоречивы.
По данным исследования SAV по прекращению терапии иматинибом зарегистрировано значительное уменьшение выраженности таких симптомов, как тошнота, диарея, слабость, бессонница, и улучшение показателя общего благополучия (well-being) через 1 месяц наблюдения без лечения [6]. В корейском исследовании K было отмечено снижение выраженности иматиниб-связанных симптомов через 6 месяцев наблюдения без терапии по сравнению с исходной оценкой на скрининге, однако не отмечено значительного улучшения показателей физического и психического здоровья [7]. В двух международных исследованиях ENESTop и ENESTfreedom (прекращение лечения нилотинибом в 1 и 2 линии) были зарегистрированы минимальные изменения показателей качества жизни больных через 12 мес. после прерывания терапии [8, 9].
Результаты исследований, опубликованные к настоящему времени, не отражают влияния отдельных факторов, таких как возраст, коморбидность и нежелательные явления терапии ИТК, на показатели качества жизни больных ХМЛ как до прекращения терапии, так и в течение периода отмены ИТК.
Цель данного исследования — изучить качество жизни больных ХМЛ с длительным глубоким МО до отмены терапии в сравнении с условно здоровыми респондентами, в зависимости от наличия сопутствующей патологии и токсичности ИТК, а также проанализировать динамику показателей качества жизни после отмены терапии ИТК.
Материалы и методы исследования. Исследование проводилось в ФГБУ «НМИЦ гематологии» МЗ РФ в рамках протокола клинической апробации, одобренного министерством здравоохранения РФ «Метод наблюдения больных хроническим миелолейкозом с глубокой молекулярной ремиссией без воздействия ингибиторов тирозинкиназ под контролем молекулярно-генетических методов исследования».
Критерии включения в исследование: больные ХМЛ старше 18 лет в хронической фазе; терапия любыми ИТК в качестве первой или второй линии длительностью не менее 3 лет; глубокий МО (МО4) длительностью не менее 2 лет; не менее 3 молекулярных исследований за последний год наблюдения, подтверждающих глубокий МО (МО4), в том числе в сертифицированной лаборатории (НМИЦ Гематологии).
Сбор информации осуществлялся проспективно. Молекулярный ответ после прекращения терапии ИТК оценивался методом количественной ПЦР 1 раз в месяц в течение первых 6 месяцев наблюдения, 1 раз в 2 месяца в течение 6–12 месяцев, далее 1 раз в 3 месяца. Глубокий МО определялся как уровень транскрипта BCR-ABL≤0,01 % S либо как отрицательный результат — при чувствительности количественной ПЦР 4lg. Терапию тем же ИТК возобновляли при потере большого молекулярного ответа (БМО) — уровне транскрипта BCR-ABL > 0,1 % (однократное подтверждение). ПЦР-контроль после возобновления лечения осуществлялся 1 раз в 3 месяца до восстановления глубокого МО4, далее в течение еще 6-ти месяцев.
Пациенты наблюдались в НКО химиотерапии миелопролиферативных заболеваний ФГБУ «НМИЦ Гематологии» МЗ РФ. На каждом визите фиксировались жалобы и оценивался клинический статус больных.
Оценку качества жизни проводили с помощью опросника RAN SF-36, который заполнялся пациентами в следующие контрольные точки:до отмены терапии ИТК, через 1, 3, 6 и 12 месяцев после отмены терапии.
Опросник RAN SF-36 является общим опросником оценки качества жизни, который может использоваться как у здоровых людей, так и у пациентов с хроническими заболеваниями, в том числе и онкогематологи-ческого профиля. Производится оценка показателей качества жизни за последний месяц. Опросник состоит из 36 вопросов, которые формируют 8 шкал: физическое функционирование (ФФ), ролевое физическое функционирование (РФФ), боль (Б), общее здоровье (ОЗ), жизнеспособность (Ж), социальное функционирование (СФ), ролевое эмоциональное функционирование (РЭФ), психическое здоровье (ПЗ). После проведения шкалирования (перевода необработанных данных в баллы) результаты исследования выражают в баллах от 0 до 100 по каждой из восьми шкал. Чем выше балл по шкале опросника, тем лучше показатель качества жизни. На основе шкал опросника RAN SF-36 методом интегральных профилей определяется интегральный показатель качества жизни (ИПКЖ) [10].
Статистический анализ. Характер распределения данных анализировали с помощью теста Шапиро-Уилка. В каждой группе представлена описательная статистика для шкал опросника RAN SF-36 в виде количества наблюдений, средних арифметических значений и стандартных отклонений. Для сравнительного анализа качества жизни у больных и условно здоровых применяли тест Манна-Уитни. Группу сравнения составили условноздоровые респонденты, соответствующие по полу и возрасту группе больных ХМЛ (n = 97). Для сравнения показателей более чем в двух группах применяли дисперсионный анализ (ANOVA) или его непараметрический аналог — критерий Крускалла-Уоллиса. Для апо- стериорных множественных сравнений применяли тест Бонферрони. Качество жизни больных в динамике анализировали с помощью дисперсионного анализа для повторных измерений (ANOVA) или его непараметрического аналога — анализа Фридмана, также проводили парные сравнения показателей с помощью парного t-критерия Стьюдента или парного t-критерия Вилкоксона. Для сравнения распределения пациентов в группах в зависимости от пола и возраста использовали критерий χ2. Все тесты двусторонние; уровень статистической значимости p < 0,05.
Результаты. В анализ включено 97 больных ХМЛ с глубоким МО. Характеристика пациентов представлена в табл. 1 .
Таблица 1.
Клинико-демографические характеристики 97 больных ХМЛ с глубоким МО на момент отмены терапии
|
Всего больных, n ( %) |
97 (100) |
|
Пол м: ж, % |
49:51 |
|
Возраст, лет, Ме (min-max) |
46 (22–80) |
|
Наличие сопутствующих заболеваний, n больных, ( %): |
81 (83,5) |
|
В обострении перед отменой ИТК, n больных |
42 |
|
Вне обострения перед отменой ИТК, n больных |
39 |
|
ИТК на момент отмены терапии: |
|
|
Иматиниб, n больных ( %) |
67 (69) |
|
ИТК 2-го поколения, n больных ( %) |
30 (31) |
|
Наличие токсичности терапии ИТК, n больных ( %): |
60 (62) |
|
1 степени, n больных |
42 |
|
2 степени, n больных |
18 |
|
Сочетание сопутствующих заболеваний и токсичности на момент отмены терапии, n больных ( %) |
54 (67 %) |
Выживаемость без потери БМО составила 53 % и 52 % через 12 мес и 24 мес, соответственно, при Ме наблюдения за всей группой 25 мес (12–42 мес). Из 97 больных у 51 (53 %) сохранялся БМО после отмены терапии ИТК, у 46 (47 %) больных развился молекулярный рецидив и терапия была возобновлена.
Для изучения качества жизни больных ХМЛ до отмены терапии ИТК на первом этапе проведен анализ показателей качества жизни у больных ХМЛ в сравнении с соответствующими показателями условно здоровых респондентов. Профили качества жизни больных ХМЛ и условно-здоровых респондентов представлены на рис.1, из которого видно, что в группе больных ХМЛ перед отменой ИТК показатели несущественно ниже, чем в группе сравнения по большинству шкал. Статистически значимые различия выявлены лишь по шкале физического функционирования (p < 0,05).
Далее были проанализированы показатели качества жизни у больных ХМЛ трех групп:больных без сопутствующих заболеваний (n = 16); больных, с наличием сопутствующих заболеваний вне обострения (n = 39) и больных, имеющих сопутствующие заболевания в стадии обострения на момент включения в исследование (n = 42). Различий по полу и возрасту между больными 3-х групп не было (p > 0,05).
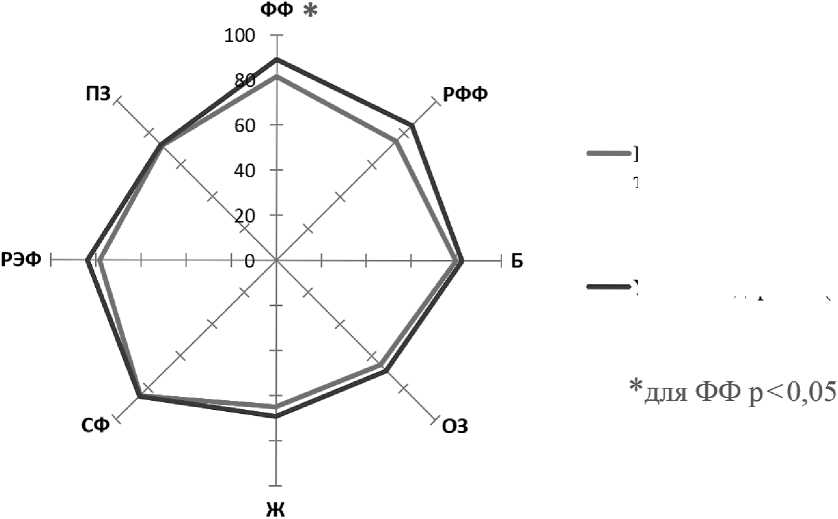
Рисунок 1. Профили качества жизни больных ХМЛ до отмены терапии ИТК и условно-здоровых респондентов (по данным SF-36)
Больные ХМЛ ХФ до отмены терапии ИТК (п=97)
Условно-здоровые (n=97)
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье.
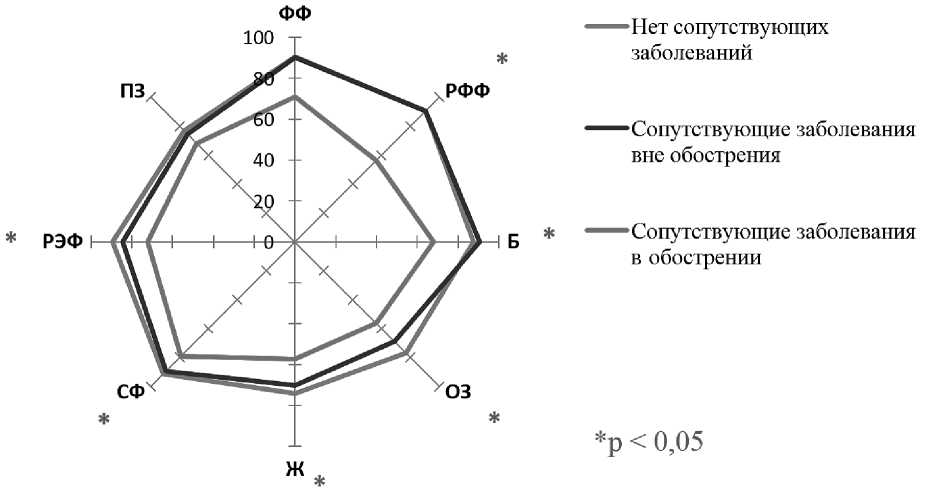
Рисунок 2. Профили качества жизни больных ХМЛ до отмены терапии ИТК в трех группах в зависимости от наличия сопутствующих заболеваний и их обострения (по данным SF-36)
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье.
Как показано на рисунке 2 , по большинству шкал SF-36 средние показатели качества жизни ниже в группе больных с сопутствующими заболеваниями в стадии обострения; статистически значимые различия между группами выявлены по всем шкалам SF-36, кроме психического здоровья (p = 0,078). ИПКЖ также статистически значимо ниже (р < 0,001) в группе пациентов с обострением сопутствующих заболеваний (0,477) по сравнению как с группой пациентов без сопутствующих заболеваний (0,596) так и с сопутствующими заболеваниями вне обострения (0,582).
Был проведен анализ показателей качества жизни у больных ХМЛ до отмены лечения в зависимости от проявлений токсичности терапии ИТК на момент включения в исследование (рис 3) . Качество жизни исследовалось в трех группах пациентов: с отсутствием токсичности терапии ИТК (n = 37), с наличием токсичности 1 степени (n = 42) и с наличием токсичности 2 степени (n = 18). Различия по полу и возрасту между группами не установлены ( p > 0,05).
Статистически значимые различия выявлены по двум шкалам опросника SF-36: ролевое физическое функционирование и жизнеспособность — в группе больных с токсичностью 2 степени эти показатели оказались существенно ниже, чем в других группах ( p < 0,05).
На следующем этапе исследования была проанализирована динамика показателей качества жизни до и в разные сроки после отмены терапии ИТК. В анализ включили пациентов, имеющих данные о качестве жизни до отмены терапии ИТК и через 1, 3, 6 и 12 мес после отмены терапии (n = 30).
Как видно на рис 4, в течение года после отмены терапии ИТК у больных ХМЛ по большинству шкал опросника SF-36 выявлена тенденция к улучшению показателей; статистически значимые изменения установлены для шкал физического функционирования, общего здоровья и ролевого эмоционального функционирования (p < 0,05). ИПКЖ через 12 мес наблюдения без терапии увеличился до 0,716 против 0,619до отмены ИТК; однако различия статистически не значимы (p > 0,05).
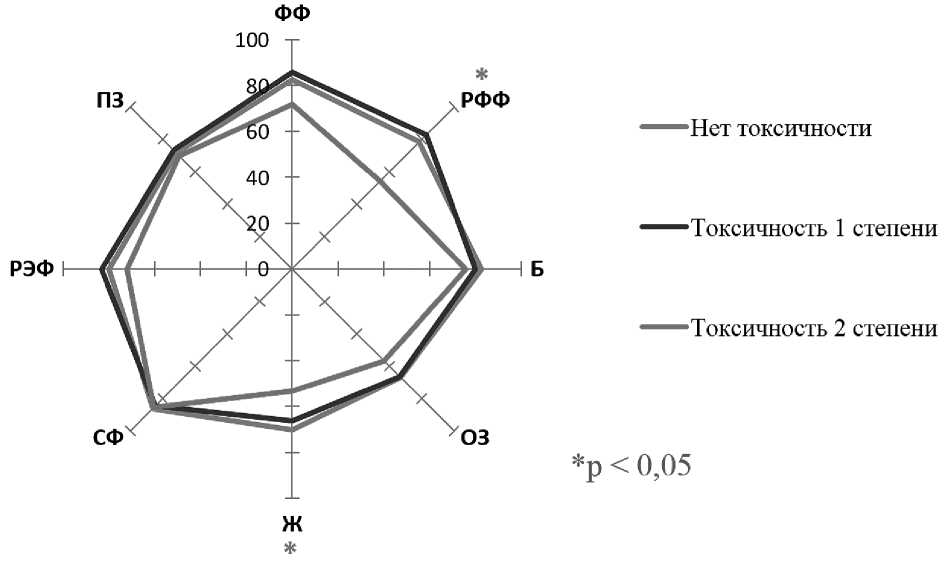
Рисунок 3. Профили качества жизни больных ХМЛ до отмены терапии ИТК в трех группах в зависимости от наличия токсичности ИТК перед отменой терапии (по данным SF-36)
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье.
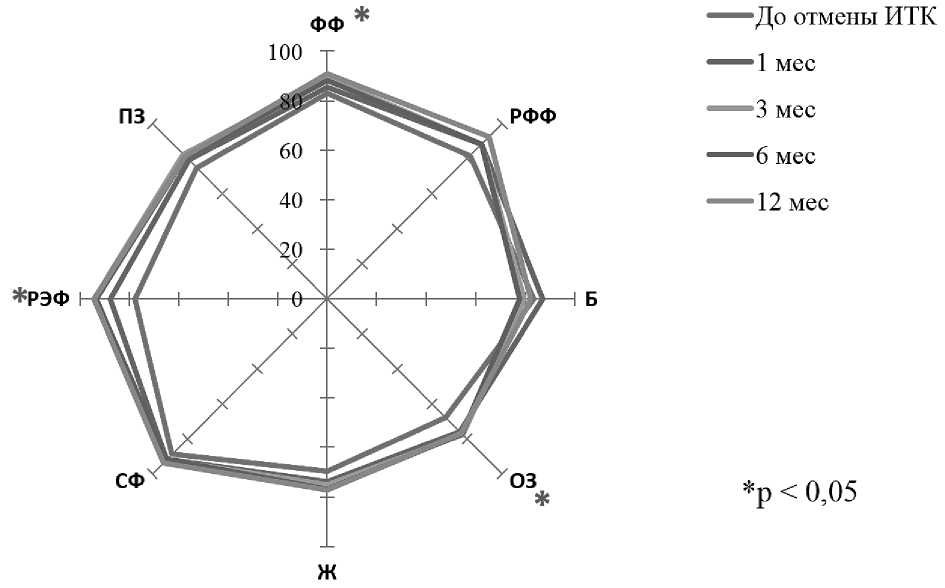
Рисунок 4 . Профили качества жизни у больных ХМЛ до отмены терапии ИТК и в разные сроки в течение 12 мес после отмены терапии (по данным SF-36)
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье.
Отдельно проведен анализ динамики показателей качества жизни у больных ХМЛ через 3 мес наблюдения без терапии ИТК в зависимости от наличия сопутствующих заболеваний и их обострения в указанной контрольной точке. Из анализа исключались пациенты, у которых отсутствовал опросник качества жизни в контрольной точке 3 мес без терапии (выбывшие из исследования вследствие развития молекулярного рецидива или не заполнявшие опросник по другой причине).
На первом этапе были проанализированы средние изменения шкал опросника SF-36 через 3 мес наблюдения без терапии по сравнению с данными, полученными перед отменой, в трех группах: больных без сопутствующих заболеваний (n = 11), больных с наличием сопутствующих заболеваний вне обострения (n = 31) и больных с сопутствующими заболеваниями в стадии обострения как перед отменой, так и через 3 мес наблюдения после отмены ИТК (n = 30).
Наибольшие изменения наблюдались в группе больных с сохраняющимся обострением сопутствующих заболеваний. Через 3 мес наблюдения без терапии по всем шкалам, кроме социального функционирования выявлена тенденция к улучшению показателей, статистически значимое улучшение выявлено по шкалам общего здоровья, жизнеспособности, психического здоровья (рис. 5) . ИПКЖ также статистически значимо выше через 3 мес без терапии по сравнению с исходным: 0,448 до отмены ИТК против 0,552 через 3 мес (р = 0,017).
В группах больных без сопутствующих заболеваний и больных с сопутствующими заболеваниями вне обострения через 3 мес наблюдения без терапии не выявлено статистически значимых изменений показателей КЖ, за исключением шкалы боли. У больных с сопутствующими заболеваниями вне обострения этот показатель значимо ниже через 3 мес после отмены ИТК (р = 0,022).
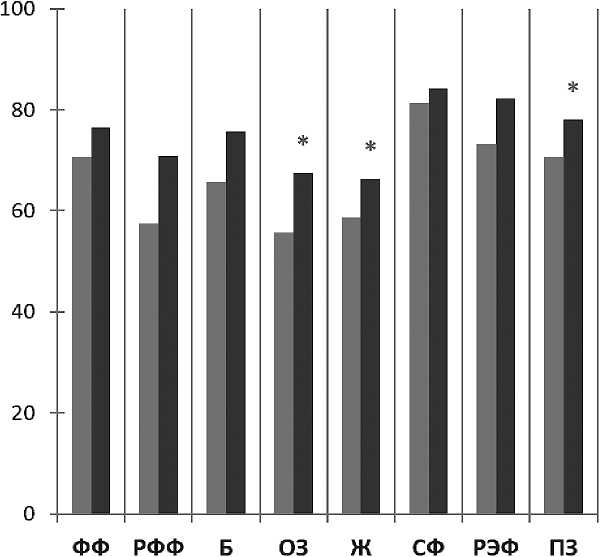
-
■ Показатели КЖ до отмены терапии ИТК у больных с обострением сопутствующей патологии
-
■ Показатели КЖ через 3 мес наблюдения без терапии ИТК у больных с обострением сопутствующей патологии
*р < 0,05
Рисунок 5. Средние показатели качества жизни больных ХМЛ с сопутствующими заболеваниями в обострении при отмене ИТК и через 3 мес наблюдения без терапии ИТК (по данным SF-36, n = 30)
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье.
Далее сравнили соотношение больных с улучшением, стабилизацией и ухудшением показателей качества жизни через 3 мес наблюдения без терапии по каждой шкале опросника SF-36 в двух группах — в группе больных без сопутствующих заболеваний/с сопутствующими заболеваниями вне обострения (n = 42) и в группе больных с сопутствующими заболеваниями в стадии обострения (n = 30). Число больных с ухудшением качества жизни по всем шкалам опросника сопоставимо в данных группах (p > 0,05) и составляет не более трети от общего числа больных в каждой группе.
Число больных с улучшением качества жизни статистически значимо больше в группе с сопутствующими заболеваниями в стадии обострения, по сравнению с группой без сопутствующих заболеваний/с сопутствую- щими заболеваниями вне обострения по шкалам физического функционирования, ролевого физического функционирования, боли и социального функционирования (табл. 2).
Кроме этого, оценивался вклад токсичности ИТК в динамику показателей КЖ. Сравнивали группы больных без признаков токсичности (n = 29), с токсичностью 1-й (n = 36) и 2-й (n = 15) степеней. Пациенты, у которых отсутствовал опросник КЖ в контрольной точке 3 мес без терапии, не были включены в анализ (n = 17).
На основании проведенного анализа установлены статистически значимые изменения в группе с токсичностью 2 степени по шкалам ролевого физического функционирования, общего здоровья, и жизнеспособности (p < 0,05; рисунок 6 ). После отмены ИТК эти показатели повысились.
Таблица 2.
Соотношение числа пациентов согласно улучшению, стабилизации или ухудшению показателей качества жизни через 3 мес наб блюдения без терапии в группе больных без сопутствующих заболеваний / с сопутствующими заболеваниями вне обострения и в группе больных с сопутствующими заболеваниями в обострении
|
^ го 3 |
Отсутствие сопутствующих заболеваний или сопутствующие заболевания вне обострения |
Сопутствующие заболевания в обострении |
о. ф X ф го X m |
||||||||||
|
Улуч. |
Стаб. |
Ухудш. |
Улуч. |
Стаб. |
Ухудш. |
||||||||
|
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
||
|
ФФ |
12 |
28,6 |
21 |
50,0 |
9 |
21,4 |
17 |
56,7 |
6 |
20,0 |
7 |
23,3 |
0.022 |
|
РФФ |
2 |
4,8 |
36 |
85,7 |
4 |
9,5 |
9 |
30,0 |
15 |
50,0 |
6 |
20,0 |
0.003 |
|
Б |
7 |
16,7 |
18 |
42,9 |
17 |
40,5 |
14 |
46,7 |
8 |
26,7 |
8 |
26,7 |
0.023 |
|
ОЗ |
24 |
57,1 |
5 |
11,9 |
13 |
31,0 |
20 |
66,7 |
5 |
16,7 |
5 |
16,7 |
0.373 |
|
Ж |
22 |
52,4 |
4 |
9,5 |
16 |
38,1 |
14 |
46,7 |
7 |
23,3 |
9 |
30,0 |
0.269 |
|
СФ |
10 |
23,8 |
26 |
61,9 |
6 |
14,3 |
12 |
40,0 |
9 |
30,0 |
9 |
30,0 |
0.027 |
|
РЭФ |
6 |
14,3 |
34 |
81,0 |
2 |
4,8 |
7 |
23,3 |
19 |
63,3 |
4 |
13,3 |
0.215 |
|
ПЗ |
22 |
52,4 |
7 |
16,7 |
13 |
31,0 |
21 |
70,0 |
3 |
10,0 |
6 |
20,0 |
0.323 |
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье; ИПКЖ — интегральный показатель качества жизни.
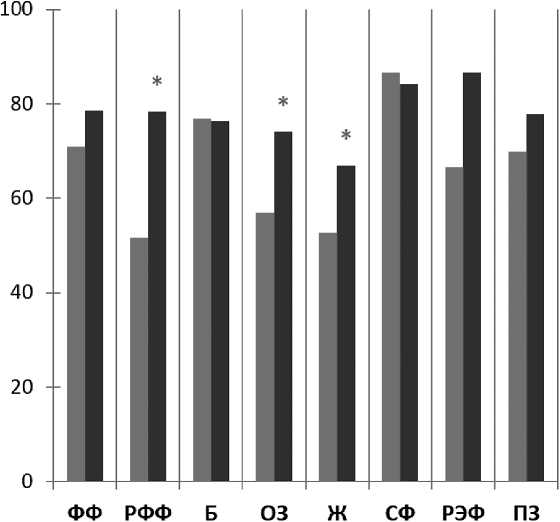
-
■ Показатели КЖ до отмены терапии ИТК у больных с токсичностью 2 степени
-
■ Показатели КЖ через 3 мес наблюдения без терапии ИТК у больных, имевших токсичность 2 степени на скрининге
*р < 0,05
Рисунок 6. Средние показатели качества жизни больных ХМЛ с токсичностью ИТК 2 степени через 3 мес наблюдения без терапии по сравнению с показателями качества жизни до отмены ИТК (по данным SF-36, n = 15)
Примечание. ФФ — физическое функционирование; РФФ — ролевое физическое функционирование; Б — боль; ОЗ — общее здоровье; Ж — жизнеспособность; СФ — социальное функционирование; РЭФ — ролевое эмоциональное функционирование; ПЗ — психическое здоровье.
В двух других группах больных статистически значимое улучшение выявлено лишь по одной шкале в каждой группе: ролевого эмоционального функционирования — у пациентов, не имевших токсичности перед прекращением лечения (n = 29), общего здоровья — у пациентов с токсичностью 1 степени (n = 36). Необходимо отметить, что у 95 % больных токсичность, наблюдавшаяся перед отменой терапии ИТК, разрешилась к 3 мес наблюдения без лечения.
Обсуждение. Основными характеристиками показателей качества жизни являются многомерность, изменяемость во времени и участие самого больного в оценке его состояния. Многомерность понятия качества жизни при использовании адекватных методов ее оценки позволяет получить объективную информацию о состоянии больного, дополняющую данные клинических и лабораторных методов исследования. В медицинской практике отдельные параметры качества жизни и его интегральный показатель используются для оценки тяжести состояния больного, динамического наблюдения за пациентами, а также оценки эффективности проводимой терапии. Наиболее демонстративными являются результаты исследования качества жизни на разных этапах лечения больных.
В настоящем исследовании проведена оценка качества жизни у 97 больных ХМЛ со стабильным глубоким МО как на фоне терапии ИТК, так и после ее отмены. Следует отметить, что показатели качества жизни у больных ХМЛ с глубоким МО на терапии ИТК оказались незначительно снижены в сравнении с показателями условно-здоровых лиц. В группе больных ХМЛ значимо снижен лишь показатель физического функционирования. При этом пред отменой терапии наиболее выраженное отрицательное влияние на качество жизни было обусловлено наличием сопутствующих заболеваний в стадии обострения.
В течение года после отмены терапии ИТК у больных ХМЛ выявлена положительная динамика физического функционирования, ролевого эмоционального функционирования и общего здоровья, а также тенденция к увеличению ИПКЖ. В исследовании SAV [6] также было зарегистрировано улучшение общего благополучия, наряду с уменьшением выраженности нескольких симптомов, однако по данным двух исследований ENESTop и ENESTfreedom [8, 9] значительных изменений показателей качества жизни после отмены лечения не было выявлено. Предположительно, такой результат связан с исходно высоким качеством жизни пациентов перед прекращением терапии в данных исследованиях, которые не имели значительных нежелательных явлений на терапии нилотинибом в течение минимум 3х лет перед остановкой лечения.
У большинства больных с симптомами обострения сопутствующих заболеваний они сохранялись и через 3 мес после прекращения терапии, однако именно в этой группе пациентов положительная динамика показателей качества жизни наиболее выражена. Можно предположить взаимосвязь такого результата с прекращением воздействия побочных эффектов ИТК после отмены терапии, что подтверждается статистически значимым улучшением после прекращения лечения нескольких показателей качества жизни у пациентов с токсичностью 2 степени.
В целом, отмена терапии ИТК оказала положительное влияние на показатели качества жизни больных ХМЛ. Такой терапевтический подход, в первую очередь, актуален для больных с нежелательными явлениями терапии ИТК или обострением симптомов, связанных с сопутствующими заболеваниями, и дает возможность сохранения удовлетворительного качества жизни.
Конфликты интересов
Челышева Е. Ю. предоставление консультаций Фьюжн Фарма, проведение лекций для Новартис;
Шухов О. А. предоставление консультаций и проведение лекций для Новартис, Пфайзер;
Туркина А. Г. предоставление консультаций Новартис, Пфайзер, Фьюжн Фарма;
Петрова А. Н. Быкова А. В., Немченко И. С., Никитина Т. П., Порфирьева Н. М., Зинковская А. В., Цыба Н. Н. заявляют об отсутствии конфликта интересов.
Источник финансирования:Исследование КЖ проводилось в ФГБУ «НМИЦ гематологии» МЗ РФ в качестве субпроекта протокола клинической апробации Министерства здравоохранения РФ «Метод наблюдения больных хроническим миелолейкозом с глубокой молекулярной ремиссией без воздействия ингибиторов тирозинкиназ под контролем молекулярно-генетических методов исследования». Дополнительных финансовых средств не привлекалось.
Вклад авторов
Концепция и дизайн: Все авторы
Сбор и обработка данных: Петрова А. Н., Челышева Е. Ю., Шухов О. А., Быкова А. В., Немченко И. С., Никитина Т. П., Порфирьева Н. М., Зинковская А. В., Цыба Н. Н.
Представление материалов исследования: Петрова А. Н., Челышева Е. Ю., Шухов О. А., Быкова А. В., Немченко И. С., Никитина Т. П., Порфирьева Н. М., Зинковская А. В., Цыба Н. Н.
Подготовка рукописи: Челышева Е. Ю., Шухов О. А., Быкова А. В., Немченко И. С., Никитина Т. П., Порфирьева Н. М., Зинковская А. В., Цыба Н. Н.
Окончательное одобрение рукописи: Туркина А. Г., Ионова Т. И.
Список литературы Качество жизни больных хроническим миелолейкозом с глубоким молекулярным ответом до и после отмены терапии ингибиторами тирозинкиназ
- Hochhaus A., Larson R. A, Guilhot F. et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. // N Engl J Med. — 2017. — Vol. 376, № 10. — P. 917–927. DOI: 10.1056/NEJMoa1609324. PMID: 2827302
- Hochhaus A., Saglio G., Hughes T. P. et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. // Leukemia. — 2016. — Vol. 30, № 5. — P. 1044–54. DOI: 10.1038/leu.2016.5. PMID: 26837842
- Saubele S., Richter J., Hochhaus A. et al. The concept of treatment-free remission in chronic myeloid leukemia. // Leukemia. — 2016. — Vol. 30, № 8. — P. 1638–1647. DOI: 10.1038/leu.2016.115
- Ионова Т. И., Никитина Т. П., Ломаиа Е. Г. и др. Показатели качества жизни, профиль симптомов и клинический эффект терапии второй линии дазатинибом у больных хроническим миелолейкозом при резистентности или непереносимости предшествующей терапии иматинибом: результаты 2-летнего мониторинга. // Онкогематология. — 2015. — T. 10, № 3. — C. 18–27. DOI: 10.17650/1818–8346–2015–10–3–18–27
- Новик А. А., Ионова Т. И. Исследование качества жизни в клинической медицине. // Вестник национального медико-хирургического центра им. НИ Пирогова. — 2006. — T. 1. — № . 1. — C. 91–100
- Mori S., le Coutre P., Abruzzese E., et al. Imatinib Suspension and Validation (ISAV) study: final results at 79 months [abstract]. // Blood. — 2018. — Vol. 132 (Supplement 1). — P. 461 . DOI: 10.1182/ blood-2018–99–112982
- Park J., Lee S., Jeong S., et al. Change of health-related profiles after imatinib cessation in chronic phase chronic myeloid leukemia patients. // Leuk Lymphoma. — 2016. — Vol. 57, N2. — P. 341–347. DOI: 10.3109/10428194.2015.1049166.
- Hochhaus A., Gomez Casares M. T., Stentoft J., et al. Patient-reported quality of life before and after stopping treatment in the ENESTfreedom trial of treatment-free remission for patients with chronic myeloid leukemia in chronic phase [abstract]. // Blood. — 2016. — Vol. 128, N22. — P. 3066. DOI:10.1182/blood. V128.22.3066.3066
- Mahon F., Boquimpani C. M., Takahashi N., et al. Patient-reported quality of life before and after stopping treatment in the ENESTop trial of treatment-free remission for patients with chronic myeloid leukemia in chronic phase [abstract]. // Blood. — 2016. — Vol. 128, N22. — P. 1891. DOI.10.1182/blood. V128.22.1891.1891
- Novik A., Ionova T., Kishtovich A., Tsepkova A., Mylnikov S. Stratification of patients using QoL parameters by the method of integral profiles. // Quality of Life Research. — 2003. — Vol. 12, N7. — P. 770


