Калориметрическое и спектрофотометрическое исследование комплексных липосом содержащих кальций
Автор: Мдзинарашвили Т.Д., Хведелидзе М.М., Шекиладзе Э.Р., Чинчаладзе С.В., Мдзинарашвили М.Т.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 2 (104) т.28, 2024 года.
Бесплатный доступ
Проведено калориметрическое и спектрофотометрическое исследование липосом с добавлением кальция и без него, полученных с помощью двух фосфолипидов (дипальмитоилфосфатидилхолин ( DPPC ) и 1-пальмитоил-2-линолеоил-фосфатид ( DPPA )). Липосомы размером 200 нм были приготовлены по новой технологии. В качестве кальцийсодержащих молекул был использован CaCO3, который в медицине применяется как кальциевая добавка или как препарат от повышенной кислотности желудка. Липосомы были приготовлены в воде и в 20%-ном глицериновом растворе. Как калориметрические, так и спектрофотометрические эксперименты показали, что приготовленные по новой технологии кальцийсодержащие молекулы инкорпорируются в структурах липосом, что предоставляет возможность их использования в лечебных целях. Также необходимо отметить, что в таких липосомах кальций размещается в больших количествах и его попадание в кровоток не вызывает побочных эффектов. В работе была показана структура и термостабильность комплексных липосом. Полученные в ходе экспериментов кальцийсодержащие наночастицы могут быть как униламеллярными, так и мультиламеллярными. Их состояние зависит от типа фосфолипида и от среды, в которой липосомы получены. Липосомы, приготовленные в воде и в глицерине на основе DPPC фосфолипида, получились мультиламеллярными. Липосомы без добавки кальция, приготовленные основе DPPA фосфолипида в воде, получились униламеллярными, а с кальцием - мультиламеллярными. Липосомы, приготовленные на основе DPPA фосфолипида в глицерине, не зависимо от наличия в них кальция, получились мультиламеллярными. Кальцийсодержащие липосомы при успешном испытании на животных можно будет рекомендовать для людей, страдающих гиперкальциемией.
Калориметрия, сложные наночастицы, липосомы, кальций
Короткий адрес: https://sciup.org/146282972
IDR: 146282972 | УДК: 531/534: | DOI: 10.15593/RZhBiomeh/2024.2.12
Текст научной статьи Калориметрическое и спектрофотометрическое исследование комплексных липосом содержащих кальций
RUSSIAN JOURNAL OF BIOMECHANICS
На сегодняшний день болезни, связанные с костными тканями, представляют собой большую проблему как в социальном, так и в экономическом аспекте. Чаще всего эти проблемы коррелируют с возрастом человека. Известно, что пожилые люди страдают остеопорозом и остеопенией. Если учесть,
0000-0002-4311-779X
0000-0001-5691-1880
0000-0002-3985-1334
0000-0002-0689-2674
0000-0001-9156-6306


Эта статья доступна в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial 4.0 International
License (CC BY-NC 4.0)
This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License (CC BY-NC 4.0)
что за последние десятилетия наблюдается тенденция к увеличению продолжительности жизни населения, то, соответственно, количество таких заболеваний возрастает. Вдобавок лечение заболеваний костных тканей является продолжительным, что влияет как на качество жизни пациента, так и на затраты системы здравоохранения [1–5]. Поэтому актуальной задачей является создание таких препаратов, которые целенаправленно и максимально быстро смогут восполнить дефицит кальция в организме. С другой стороны, известно, что применение кальция в больших дозах не решает эту проблему. Причиной является увеличение концентрации кальция в крови, что вызывает ряд побочных эффектов, например панкреатит, высокое артериальное давление, возникновение камней в почках [6– 8 ]. Также гиперкальциемия препятствует нормальной деполяризации сердечной мышцы что является причиной аритмии и слабости в мышцах. Также повышение кальция в крови вызывает понижение объёма эритроцитов, что в свою очередь, влечет за собой развитие анемии. Гиперкальциемия может привести к увеличению количества красные кровяных клеток, которые способствуют коагуляции крови и возникновению тромбов [2, 9]. Инициатором этого является высокая концентрация кальция в крови [10, 11]. Из вышеперечисленного следует, что для лечения гиперкальциемии человека важно создание таких препаратов, которые, с одной стороны, восполнят дефицит кальция, а с другой стороны, не вызовут возникновения опасных для жизни человека побочных эффектов. Это возможно реализовать при использовании липосом, внутри которых инкорпорирован кальций в больших концентрациях.
Липосомы в основном состоят из двуслойных липидов, состав которых аналогичен составу клеточных мембран, вследствие чего у них хорошая биосовместимость. Благодаря использованию таких липосом возможна целенаправленная доставка ионов кальция в ткани без увеличения концентрации кальция в крови [12, 13]. Именно поэтому наши исследования сфокусированы на создании таких комплексных наночастиц, которые способны в нужных количествах доставить кальций непосредственно в поврежденную кость, избегая негативных эффектов [14–17].
Самые распространенные липосомы состоят из фосфолипидов, которые, в свою очередь, состоят из амфифильных молекул фосфатидилхолина. Для его структуры характерно наличие двух пар гидрофобных ацильных углеводородных цепей, которые с помощью глицерола связываются с полярными гидрофильными головками близлежащих липидов [18–22].
В наших экспериментах использовались дипальмитоилфосфатидилхолин (Dipalmitoyl-sn-glycero-3-phosphocholine DPPC) и 1-пальмитоил-2-линолеоил-фосфатид (Dipalmitoyl-sn-glycero-3- phosphatidic acid DPPA) фосфолипиды в качестве транспортных средств доставки препарата.
Структура и стабильность кальцийсодержащих комплексных липосом отслеживалась с использованием дифференциального сканирующего микрокалориметра ( DSC ) [26–28].
Методы приготовления DPPA и DPPC липосом
В экспериментах были использованы липосомы, приготовленные с использованием новой технологии [29]. Липосомы готовились из двух типов фосфолипидов . DPPA и DPPC фосфолипиды были поставлены компанией Lipoid ( Newark, NewJersey ) . Для их получения использовалась одна и та же технология [5]. Поскольку для целенаправленной доставки лекарственных средств эффективны наночастицы диаметром 200 нм, были приготовлены липосомы шириной 5 нм и диаметром 200 нм. Было установлено, что для приготовления одной липосомы шириной 5 нм и диаметром 200 нм необходимо 3,3x 104 штук липидов. В представленной работе использовался высокочувствительный дифференциальный сканирующий микрокалориметр DASM -4( DSC ) (Пущино, Россия).
Экспериментальная часть
Калориметрические эксперименты проводились на DPPA и DPPC -липосомах с использованием в качестве растворителя бидистиллированной воды и 20%-ного глицерина как в случае чистых липосом, так и в случае комплексных липосом с инкорпорированным карбонатом кальция. С целью установления термостабильности был выбран температурный интервал в пределах 0°C–100°C и скорость температурного сканирования – 2°C/мин. Калориметрические измерения, проведенные на DPPA- липосомах с использованием в качестве растворителя бидистиллированной воды, показаны на рис. 1, а. С использованием в качестве растворителя 20%-ного глицерина – на рис. 2.
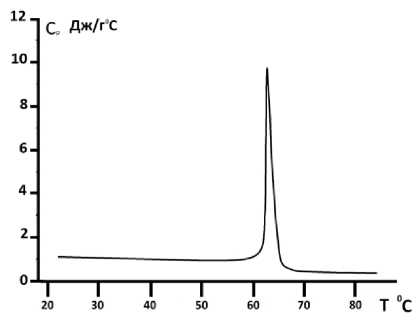
Рис. 1. Зависимость теплоемкости от температуры для DPPA- липосом с использованием в качестве растворителя бидистиллированной воды. Скорость температурного сканирования V =2°С/ min
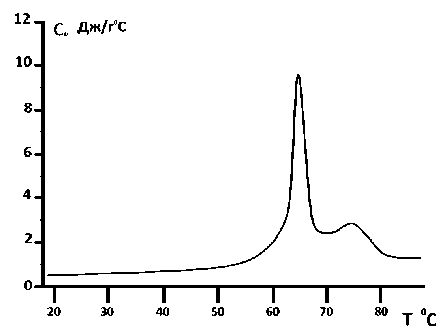
Рис. 2. Зависимость теплоемкости от температуры для DPPA- липосом с использованием в качестве растворителя 20%-ного глицерина. Скорость температурного сканирования V =2°С/ min
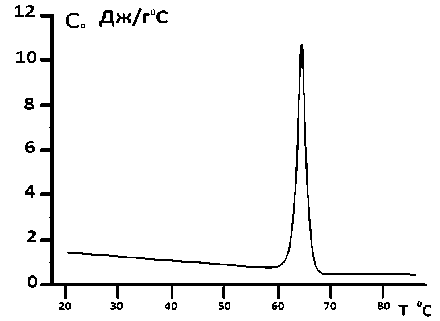
Рис. 3. Зависимость теплоемкости от температуры суспензии DPPA комплексных липосом с инкорпорированным карбонатом кальция с использованием в качестве растворителя бидистиллированной воды. Скорость температурного сканирования V =2°С/ min
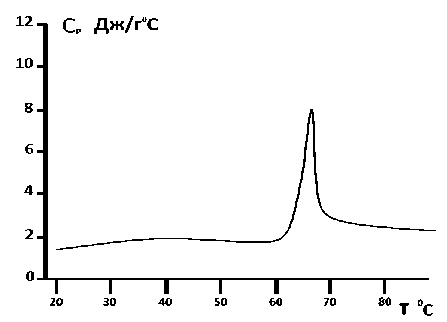
Рис. 4. Зависимость теплоемкости от температуры суспензии DPPA комплексных липосом с инкорпорированным карбонатом кальция с использованием в качестве растворителя 20%-ного глицерина. Скорость температурного сканирования V =2°С/ min
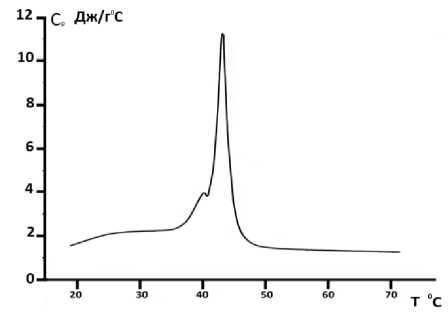
Рис. 5. Зависимость теплоемкости от температуры для DPPC- липосом с использованием в качестве растворителя бидистиллированной воды. Скорость температурного сканирования V =2°С/ min
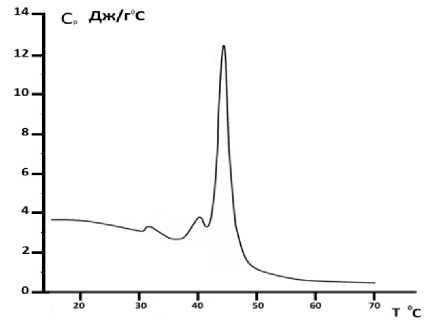
Рис. 6. Зависимость теплоемкости от температуры для DPPC- липосом с использованием в качестве растворителя 20%-ного глицерина.
Скорость температурного сканирования V =2°С/ min
Опираясь на калориметрические измерения, было вычислено количество тепла, выделяемое из DPPA- липосом в результате тепловой денатурации. Оказалось, что для DPPA -липосом, приготовленных с использованием в качестве растворителя бидистиллированной воды, теплота денатурации составляет 21,2 МДж. Что касается DPPA –липосом с использованием в качестве растворителя 20%-ного глицерина, то в этом случае в результате тепловой денатурации выделенное тепло составило 25,3 МДж .
Также эксперименты были проведены на DPPA комплексных липосомах с инкорпорированным карбонатом кальция с использованием в качестве растворителя бидистиллированной воды (рис. 3) и 20%-ного глицерина (рис. 4).
Изучение кривых зависимости теплоемкости от температуры при плавлении DPPA- липосом дает возможность определить структуру липосом. Особое внимание необходимо уделить калориметрическому исследованию DPPA -липосом с инкорпорированным кальцием в 20%-ного глицериновом растворителе. Как показывают калориметрические измерения, чистые DPPA- липосомы, растворенные в 20%-ного глицериновом растворителе, являются многослойными мультиламеллярными структурами, на что указывает существование двух пиков на калориметрических кривых (см. рис. 2). В отличие от чистых DPPA липосом, DPPA комплексные липосомы с инкорпорированным карбонатом кальция имеют только один главный пик плавления, а второй маленький пик исчезает, это указывает, что ионы кальция точно установили связь с DPPA липидами (см. рис. 4).
Основываясь на калориметрических измерениях, было определено количество теплоты, которое выделилось в результате плавления DPPA -липосом, содержащих кальций карбонат, растворенных как в воде, так и в 20%-ного глицерине. Выделенное тепло в обоих случаях оказалось отличным от такового DPPС комплексных липосом. Оказалось, что для DPPA комплексных липосом, содержащих кальция карбонат, приготовленных с использованием в качестве растворителя бидистиллированной воды, теплота денатурации составляет 18,6 МДж, в то время как для DPPA комплексных липосом, содержащих кальция карбонат, при использовании в качестве растворителя 20%-ного глицерина, выделенное тепло составило 13,5 МДж.
Также калориметрические измерения были проведены на DPPC -липосомах с использованием аналогичных растворителей (рис. 5, 6).
С помощью калориметрических измерений было определено то количество тепла, которое выделилось из DPPC-липосом в результате тепловой денатурации. Оказалось, что для DPPC-липосом, приготовленных с использованием в качестве растворителя бидистиллированной воды, теплота денатурации составляет 23,6 МДж. Для DPPC-липосом с использованием в качестве растворителя 20%-ного глицерина количество выделенного теплf составило 25,4 МДж.
Также калориметрические измерения были проведены на DPPC комплексных липосомах с инкорпорированным карбонатом кальция с использованием в качестве растворителя бидистиллированной воды (рис. 7) и 20%-ного глицерина (рис. 8).
Калориметрические эксперименты показали, что, в отличие от DPPA- липосом, DPPC- липосомы, приготовленные как в воде, так и в глицериновом растворителе как в чистом виде, так и при инкорпорировании карбоната кальция, сохраняют мультиламеллярную структуру (см. рис. 5–8).
Основываясь на калориметрических измерениях, было рассчитано количество теплоты, которое выделилось в результате плавления DPPC- липосом, содержащих кальция карбонат, приготовленных как в воде, так и в 20%-ного глицерине. Выделенное тепло в обоих случаях разное. Оказалось, что для DPPC- липосом комплексных, содержащих кальция карбонат, приготовленных с использованием в качестве растворителя бидистиллированной воды, теплота денатурации составляет 15,0 МДж, в то время как для DPPC комплексных липосом, содержащих кальция карбонат, при использовании в качестве растворителя 20%-ного глицерина в результате тепловой денатурации выделенное тепло составило 18,0 МДж.
Факт, что кальций карбонат в действительности образует связи с DPPA и DPPC- липосомами как в воде, так в глицериновом растворителе, кроме калориметрических экспериментов, был подтвержден и на проведенных спектрофотометрических экспериментах. На рис. 9 показаны кривые зависимости поглощения от длины волны для чистых DPPA -липосом и при инкорпорировании ионов кальция.
Спектрофотометрические измерения также проведены на DPPC -липосомах. На рис. 10 показаны кривые зависимости поглощения от длины волны для чистых DPPC -липосом, приготовленных в бидистиллированной воде, и комплексных DPPC -липосом, содержащих ионы кальция.
На спектрофотометрических кривых в случае чистых DPPA и DPPC при длине волны 235 нм наблюдается небольшой пик поглощения, который исчезает при создании кальций содержащих комплексных липосом. Это указывает, что кальция карбонат действительно создал комплексы с липосомами, приготовленными из DPPA и DPPC- липидов.
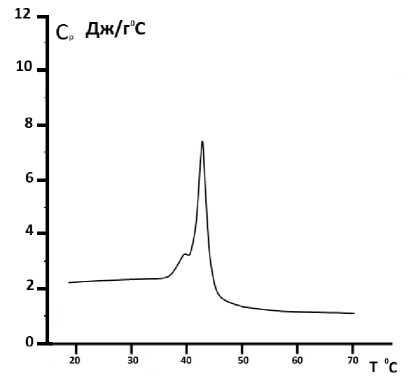
Рис. 7. Зависимость теплоемкости от температуры суспензии DPPC липосом комплексных с инкорпорированием карбоната кальция с использованием в качестве растворителя бидистиллированной воды. Скорость температурного сканирования V =2°С/ min
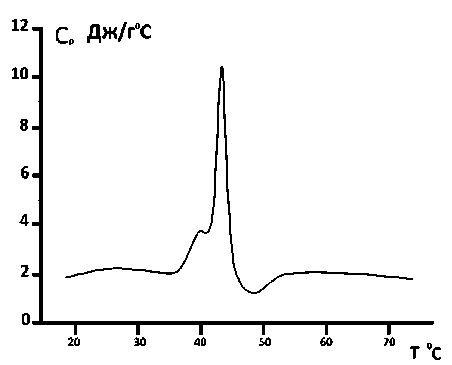
Рис. 8. Зависимость теплоемкости от температуры суспензии DPPC липосом комплексных с инкорпорированием карбоната кальция с использованием в качестве растворителя 20%-ного глицерина. Скорость температурного сканирования V =2°С/ min
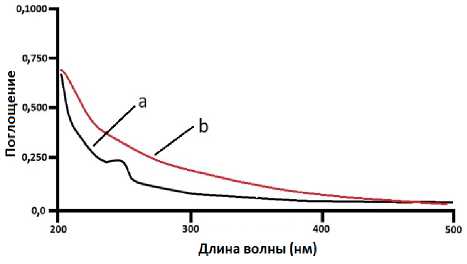
Рис. 9. Зависимость поглощения от длины волны для суспензии чистых DPPA- липосом и при инкорпорировании ионов кальция.
Растворитель –бидистиллированная вода, а – чистые DPPA- липосомы, б – комплексные DPPA- липосомы, содержащие ионы кальция
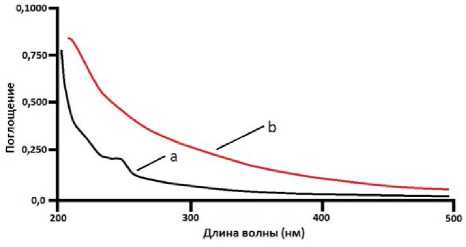
Рис. 10. Зависимость поглощения от длины волны для суспензии чистых DPPC- липосом и при инкорпорировании ионов кальция.
Растворитель – бидистиллированная вода:
а – чистые DPPC- липосомы, б – комплексные DPPC- липосомы, содержащие ионы кальция
Обсуждение
Необходимо отметить, что пики поглощения, наблюдаемые на калориметрических записях, являются результатом разрыва водородных связей, существующих между гидрофильными головками фосфолипидов, протекающем при нагреве калориметрической ячейки с образцом. В частности, разрыв связи происходит между группой О=Р–ОН одного фосфолипида и группой С=О другого фосфолипида. Из проведенных нами исследований видно, что в случае чистых липосом, приготовленных из DPPA-липидов плавление упорядоченной структуры происходит на 24°C выше, чем в случае чистых липосом, приготовленных из DPPC липидов (см. рис. 1, 2, 5, 6). Если учесть тот факт, что длина фосфолипидных цепей и состав у DPPC и DPPA одинаковый, ясно, что различие в температуре фазового перехода у этих липидов должно быть обусловлено различием сил взаимодействия, существующих между их головками. Энергия водородных связей между головками DPPA-липидов больше, чем энергия водородных связей между головками DPPC-липидов, так как головки DPPA-липидов меньше по размеру, чем головки DPPC-липидов [4], что дает возможность гидрофильным головкам DPPA-липидов сблизиться друг с другом. Это в свою очередь, обусловливает, что длина водородных связей, существующих между головками DPPA-липидов, меньше, чем длина водородных связей, существующих между головками DPPC-липидов. В то же время сильные водородные связи являются причиной того, что структура чистых DPPA-липосом будет однослойной, то есть униламеллярной, что подтверждается калориметрическими измерениями DPPA-липосом, приготовленных в бидистиллированной воде, в которых пик поглощения является узким (см. рис. 1). Что касается DPPC-липосом, их структура может быть многослойной, то есть мультиламеллярной, при которой возможно возникновение дополнительных новых водородных связей между существующими внутри липосом слоями. Это подтверждается формой калориметрических пиков теплопоглощения, которое в случае DPPC-липосом не является кооперативным, и их главный пик фазового перехода содержит так называемые препики, которые, по нашим соображениям, обусловленым ультиламеллярной структурой DPPC-липосом (см. рис. 5).
В случае DPPC и DPPA -липосом, приготовленных в 20%-ного растворе глицерина, энергия водородных связей сильнее, чем у DPPC и DPPA- липосом, приготовленных в дистиллированной воде, так как глицерин способствует возникновению дополнительных водородных связей между головками и хвостами DPPC и DPPA -липидов. Из-за этих связей они способны образовывать многослойные, мультиламеллярные структуры, и устанавливать связи между соседними слоями.
Калориметрические кривые DPPA- липосом, приготовленных в 20%-ного растворе глицерина, вместо кооперативных становятся некооперативными, и дополнительно возникает небольшой пик в интервале 75°С (см. рис. 2), причиной которого могут быть дополнительные водородные связи, которые глицерин устанавливает с DPPA- липидами. Эти водородные связи являются более сильными, чем водородные связи между самими липидами. Из литературных данных известно, что при добавлении глицерина к DPPC- липидам изменяется угол наклона липидных цепей так, что они располагаются параллельно друг относительно друга [30, 31], что им дает возможность сильнее сблизиться. Поэтому, в отличие от DPPC- липосом, приготовленных в воде, в этом случае возникают более сильные водородные связи, что, в свою очередь, определяет количество тепла, выделенного после термического плавления DPPA- липосом.
Из литературы также известно, что ионы кальция связываются с фосфатными группами во всех типах фосфолипидов [32-37]. Поэтому получается, что кальций конкурирует с фосфолипидами в образовании водородных связей [38, 39]. В присутствии кальция не все фосфолипиды способны образовывать водородные связи, в результате чего выделенное ими количество тепла меньше, чем в случае чистых липосом.
Структура комплексных липосом, содержащих карбонат кальция, приготовленных в глицериновом растворителе, иная, чем структура чистых липосом, приготовленных в глицериновом растворителе, так как кальций конкурирует с теми дополнительными водородными связями, которыми глицерин связывается с DPPC и DPPA-липидами. В результате в полученной структуре количество фосфолипидных слоев уменьшено, как в случае DPPA-липидов, так и в случае DPPC липидов. Это подтверждается калориметрическими экспериментами (см. рис. 4, 8), в соответствии с которыми у кальцийсодержащих комплексных DPPA-липосом, приготовленных в глицериновом растворителе, наблюдается один пик, в отличии от чистых DPPA-липосом, приготовленных в глицериновом растворителе (см. рис. 2). Из выше приведенного можно заключить, что, в отличие от чистых DPPA-липосом, приготовленных в глицериновом растворителе, CaCO 3 - содержащие комплексные DPPA-липосомы, приготовленных в глицериновом растворителе, образуют униламеллярную структуру (см. рис. 4). Что касается CaCO 3 - содержащих комплексных DPPC-липосом, приготовленных в глицериновом растворителе (рис. 8), в отличии от чистых DPPC-липосом, приготовленных в глицериновом растворителе (см. рис. 7), калориметрические эксперименты показывают наличие кроме главного пика только один дополнительный препик. В связи с этим можно предположить, что количество слоев, по сравнению с чистыми липосомами, в случае CaCO3-содержащих комплексных DPPC- липосом меньше.
Кроме калориметрических экспериментов, образование комплексов между липосомами и карбонатом кальция подтверждается спектрофотометрическими исследованиями. Такое заключение можно сделать, наблюдая на спектрофотометрических записях существующий на длине волне 235 нм пик поглощения в случае DPPA и DPPC , чистых липосом, который исчезает у кальцийсодержащих комплексных липосом обоих типов, это указывает, что карбонат кальция действительно установил связи с DPPA и DPPC -липосомами.
Заключение
По форме пика теплопоглощения при плавлении макромолекул возможно судить об упорядоченной структуре макромолекул. Основываясь на полученных экспериментальных результатах, можно определить структуру липосом. В частности, кооперативный и узкий пик фазового перехода плавления липосом указывает, что мы имеем дело с разрывами однотипных связей в структуре липосом под воздействием температуры. В то время как несколько пиков и/или увеличение ширины пика поглощения на полувысоте температурного перехода указывает, что имеем дело с некооперативным процессом. В проведенных экспериментах температурное плавление DPPA- липосом является кооперативным (ширина пика на полувысоте которого 1,8°С), в случае кальцийсодержащих комплексных DPPA-липосом имеется несколько пиков, то есть плавление является не кооперативным. Вышеприведенное дает возможность заключить, что DPPA-липосомы являются одной двуслойной униламеллярной наночастицей. Структура кальцийсодержащий комплексных DPPA-липосом является многослойной, на что указывает тот факт, что количество пиков
Список литературы теплопоглощения увеличевается до двух. Можно заключить, что структура кальцийсодержащих комплексных DPPA и DPPС-липосом является многослойной мультиламеллярной структурой. Мультиламеллярная структура, с другой стороны, дает возможность размещения внутри наночастицы большого количества кальций карбоната. Соответственно, использование таких наночастицах с лечебной точки зрения должно быть эффективным и не имеет побочных эффектов.
No. 3. – P. 39–59.
P. 399–420.
Финансирование Работа финансируется Грузинским научным фондом Шота Руставели в рамках фундаментального гранта FR-21-19898.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов .
Список литературы Калориметрическое и спектрофотометрическое исследование комплексных липосом содержащих кальций
- Calcium carbonate / M.M. Al Omari, I.S. Rashid, N.A. Qinna, A.M. Jaber, A.A. Badwan. // Profiles Drug Subst. Excip. Relat. Methodol. - 2016. - No. 41. - P. 13-31.
- Balmayor, E.R. Gene therapy for bone engineering / E.R. Balmayor, M. van Griensven // Front. Bioeng. Biotechnol. - 2015. DOI: 10.3389/fbioe.2015.00009
- Nordin, B.E. Calcium and osteoporosis / B.E. Nordin // Nutrition. - 1997. - no. 13. - P. 466-486.
- Nordin, B.E. The calcium deficiency model for osteoporosis / B.E. Nordin, H.A. Morris // Nutr. Rev. - 1989. - No. 47. -P. 65-72.
- Management of hypoparathyroidism: present and future / J.P. Bilezikian, M.L. Brandi, N.E. Cusano, M. Mannstadt, L. Rejnmark, R. Rizzoli, M.R. Rubin, K.K. Winer, U.A. Liberman, J.T. Potts // J. Clin. Endocrinol. Metab. - 2016. - No. 101. - P. 13-24.
- Atomic view of calcium-induced clustering of phosphatidylserine in mixed lipid bilayers. / J.M. Boettcher, R.L. Davis-Harrison, M.C. Clay, A.J. Nieuwkoop, Y.Z. Ohkubo, E. Tajkhorshid, J.H. Morrissey, C.M. Rienstra // Biochemistry. - 2011. - no. 29. -P. 2264-2273.
- Bose, S. Calcium phosphate ceramic systems in growth factor and drug delivery for bone tissue engineering / S. Bose, S. Tarafder // Acta Biomater. - 2012. - No. 8. - P. 1401-1421.
- Carrick, A.I. Rapid fire: hypercalcemia / A.I. Carrick, H.B. Costner // Emerg. Med. Clin. North. Am. - 2018. -No. 36. - P. 549-555.
- Osteotropic nanoscale drug delivery systems based on small molecule bone-targeting moieties / E.J. Carbone, K. Rajpura, B.N. Allen, E. Cheng, B.D. Ulery, K.W.H. Lo // Nanomedicine: Nanotechnology, Biology, And Medicine. - 2017. - No. 13. - P. 37-47.
- Development of nanomaterials for bone-targeted drug delivery / H. Cheng, A. Chawla, Y. Yang, Y. Li, J. Zhang, H.L. Jang, A. Khademhosseini // Drug Discovery Today. - 2017. -No. 22. - P. 1336-1350.
- Chiu, M.H. Differential scanning calorimetry: an invaluable tool for a detailed thermodynamic characterization of macromolecules and their interactions / M.H. Chiu, E.J. Prenner // Journal of Pharmacy and Bioallied Sciences. -2011. -No. 3. - P. 39-59.
- Cullis, Pt. Lipid polymorphism and the functional roles of lipids in biological membranes / Pt. Cullis, B. De. Kruijff // Biochim. Biophys. Acta. - 1979. - Vol. 559, no. 4. -P. 399-420.
- A model of hydrogen bond formation in phosphatidylethanolamine bilayers / A. David, A. Pink, McNeil A. Stew, A. Bonnie Quinn, J. Martin, B. Zuckermann // Biochimica et Biophysica Acta - Biomembranes. - 1998. -Vol. 1368, no. 2. - P. 289-305.
- Shekiladze, E. Calorimertic study the stability of DPPC liposomes and C and E vitamins complexes / T. Mdzinarashvili, M. Khvedelidze // Experimental and Clinical medicine. - 2017. - Vol. 2. -P. 71-73.
- Bone diseases: current approach and future perspectives in drug delivery systems for bone targeted therapeutics / G. Chindamo, S. Sapino, E. Peira, D. Chirio, M.C. Gonzalez, M. Gallarate // Nanomaterials. - 2020. - Vol. 10, no. 5. -P. 875-883.
- Grigore, M.E. Drug delivery systems in hard tissue engineering / M.E. Grigore // J. Biotechnol. Biomed. Eng. - 2018. - Vol. 1. - P. 1001-1006.
- Exhibit different biopharmaceutical profiles in vitro / M. Haghi, M. Bebawy, P. Colombo, B. Forbes, D.A. Lewis, R. Salama, D. Traini, P.M. Young // Eur. J. Pharm. Biopharm. - 2014. - Vol. 86. - P. 38-45.
- Liposomes: structure, composition, types, and clinical applications / H. Nsairat, D. Khater, U. Saye, F. Odeh // Heliyon. - 2022. - Vol. 8, no. 5. - P. 09394.
- Huster, D. Strength of Ca (2+) binding to retinal lipid membranes: consequences for lipid organization / D. Huster, K. Arnold, K. Gawrisch // J. Biophys - 2000. -Vol. 78. - P. 3011-3018.
- John, P. Bilezikian. Primary Hyperparathyroidism. // J. Clin. Endocrinol Metab. - 2018. - Vol. 103, no. 11. - P. 3993-4004.
- The effects of calcium supplementation to patients with primary hyperparathyroidism and a low calcium intake / R. Jorde, K. Szumlas, E. Haug, J. Sundsfjord // Eur. J. Nutr. -2002. - Vol. 41, no. 6. - P. 258-63.
- Ke Ren, A.D. Drug delivery strategies for treating osteoporosis / A.D. Ke Ren // Orthop. Muscular Syst. - 2014. - Vol. 2. -P. 8-11.
- Kuck, L. Calcium dynamically alters erythrocyte mechanical response to shear. / L. Kuck., J.N. Peart, M.J. Simmonds // Biochimica et Biophysica. -2020. - Vol. 1867. - P. 11-17.
- Liu, B. Highly purified scavenger receptor class b, type i reconstituted into phosphatidylcholine/cholesterol liposomes mediates high affinity high density lipoprotein binding and selective lipid uptake / B. Liu, M. Krieger // J. Biol. Chem. - 2002. - Vol. 277, no. 37. - P. 34125-34135.
- Recent advances of cell membrane-coated nanomaterials for biomedical applications / W.L. Liu, M.Z. Zou, S.Y. Qin, Y.J. Cheng, Y.H. Ma, Y.X. Sun // Adv. Funct. Mater. - 2020. - Vol. 30, no. 39. - P. 2003559.
- Mabrey, S. Investigation of phase transitions of lipids and lipid mixtures by sensitivity differential scanning calorimetry / S. Mabrey, J.M. Sturtevant // Proceedings of the National Academy of Sciences. - 1976 - Vol. 73. - P. 3862-3866.
- Martín-Molina, A. Effect of calcium and magnesium on phosphatidylserine membranes: experiments and all-atomic simulations / A. Martín-Molina, C. Rodríguez-Beas, J. Faraudo // Biophysical Journal. - 2012. - Vol. 102. - P. 2095-2103.
- Calcium-lipid interactions observed with isotope-edited infrared spectroscopy / L.V. Mason, E.C. Alfredo, E. Ron, R.B. Carlos // Biophys. J. - 2020. - Vol. 118, no. 11. -P. 2694-2702.
- Dendrimer, liposomes, carbon nanotubes and PLGA nanoparticles: one platform assessment of drug delivery potential / M. Nishi, K.T. Rakesh, K.M. Neelesh, C. Prashant, K.J. Narendra // American Association of Pharmaceutical Scientists. - 2014.
- Glycerol-induced membrane stiffening: the role of viscous fluid adlayers / L. Pocivavsek, K. Gavrilov, K.D. Cao, E.Y. Chi, D. Li, B. Lin, M. Meron, J. Majewski, K.Y.C. Lee // Biophys. J. - 2011. - Vol. 101. - no. 1. - P. 118-127.
- Liposomes: structure, biomedical applications, and stability parameters with emphasis on cholesterol / P. Nakhaei, R. Margiana, D.O. Bokov, W.K. Abdelbasset, M. Amin J. Kouhbanani., R.S. Varma, F. Marofi, M. Jarahian, N. Beheshtkhoo // Front. Bioeng. Biotechnol. - 2021. -Vol. 9. - P. 705886.
- Investigating the structure of multicomponent gel-phase lipid bilayers / R. Hartkamp, T.C. Moore, C.R. Iacovella, M.A. Thompson, P. Bulsara, D.J. Moore, C. Mccabe // Biophysical Journal. - 2016. - Vol. 111, no. 4. - P. 813-823.
- Salgado, A.J. Bone tissue engineering: state of the art and future trends / A.J. Salgado, O.P. Macromol Coutinho, R.L. Reis // Biosci. - 2004. - Vol. 4. -P. 743-765.
- Ul-Islam A: Liposome as a carrier for advanced drug delivery / S.M. Shaheen, A.R. Shakil, M.N. Hossen, M. Ahmed, M.S. Amran // Pak. J. BiolSci. - 2006. - Vol. 9, no. 6. - P. 1181-1191.
- Ca2+ channel nanodomains boost local Ca2+ amplitude / A.J. Salgado, R.W. Tsien, D.T Yue // Proceedings of the National Academy of Sciences. - 2013. -Vol. 110.- P. 15794-15799.
- Structural changes in dipalmitoylphosphatidylcholine bilayer promoted by Ca (2+) ions: a small-angle neutron scattering study / D. Uhrikova, N. Kucerka, J. Teixeira, V. Gordeliy, P. Balgavy // Chemistry and Physics of Lipids. -2008. - Vol. 155. - P. 80-89.
- Calcium and vitamin-D deficiency marginally impairs fracture healing but aggravates posttraumatic bone loss in osteoporotic mice / V. Fischer, M. Haffner-Luntzer, K. Prystaz, A. vom Scheidt, B. Busse, T. Schinke, M. Amling // Sci. Rep. - 2017. - Vol. 7. - P. 7223.
- Vo, T.T.N. Strategies for controlled delivery of growth factors and cells for bone regeneration / T.T.N. Vo, F.K. Kasper, A.G.A. Mikos // Adv. Drug Deliv. - 2012. - Vol. 64. -P. 1292-1309.
- Nanotechnology in bone tissue engineering. Nanomed. Nanotechnol / G.G. Walmsley, A. McArdle, R. Tevlin, A. Momeni, D. Atashroo, M.S. Hu, A.H. Feroze, V.W. Wong, P.H. Lorenz, M.T. Longaker // Biol. Med. - 2015. -Vol. 11. - P. 1253-1263.
- Xin L. Formation strategies, mechanism of intracellular delivery and potential clinical applications of pH-sensitive liposomes / L. Xin, H. Guihua // Asian. Journal of Pharmaceutical Sciences, - 2013. - Vol. 8. - P. 319-328.
- Role of phospholipids and copolymers in enhancing stability and controlling degradation of intravenous lipid emulsions / R. Yang, X. Zhang, F. Li, L. Ding // Colloid. Surf. A Physicochem. Eng. Asp. - 2013. - Vol. 436. - P. 434-442.


