Клеточная кардиомиопластика в хирургическом лечении больных ишемической болезнью сердца и постинфарктным кардиосклерозом: результаты 3-летнего наблюдения
Автор: Буховец И.Л., Ворожцова И.Н., Лавров А.Г., Гракова Е.В., Сазонова С.И., Ахмедов Ш.Д., Коркин Ю.Г., Макарова Е.В., Тепляков А.Т.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.26, 2011 года.
Бесплатный доступ
Цель исследования: оценить эффект коронарного шунтирования (КШ) с применением клеточной кардиомиопластики (ККМП) по результатам 3-летнего наблюдения. В исследование вошли 66 пациентов c ИБС и постинфарктным кардиосклерозом. I (основная) группа - 38 мужчин в возрасте от 46 до 64 лет с ИБС, которым выполнялись КШ в сочетании с клеточной кардиомиопластикой (аутоимплантация культур стволовых клеток костного мозга - СККМ). II (контрольная) группа - 28 мужчин в возрасте от 41 до 63 лет, которым выполнялось только КШ. В проспективное исследование вошло 40 пациентов после ККМП. Пациентам первой и второй групп до и после операции КШ (3, 6, 12 мес. и 3 года) проводилась эхокардиография сердца (покой, проба с таблетированным нитроглицерином), однофотонная эмиссионная компьютерная томография миокарда с 199Tl. Для оценки морфологических изменений в миокарде до и после имплантации СККМ выполняли гистологическое исследование биопсийного материала. Через 6 мес. после КШ отмечен наибольший клинический эффект. У большинства пациентов понизился функциональный класс стенокардии и недостаточности кровообращения по NYHA. В обеих группах установлено статистически значимое улучшение показателей глобальной систолической функции левого желудочка и увеличение ФВ, без значимых различий между группами. Отмечено достоверное уменьшение объема как стабильных, так и преходящих дефектов перфузии. Актуарная выживаемость к третьему году составила 80%.
Клеточная кардиомиопластика, стволовые клетки костного мозга, ишемическая болезнь сердца, хроническая сердечная недостаточность
Короткий адрес: https://sciup.org/14919607
IDR: 14919607 | УДК: 616-124.2
Текст научной статьи Клеточная кардиомиопластика в хирургическом лечении больных ишемической болезнью сердца и постинфарктным кардиосклерозом: результаты 3-летнего наблюдения
Одно из наиболее актуальных направлений клеточной трансплантологии – это пересадка собственных стволовых клеток костного мозга (СККМ). На сегодняшний день уже стала реальностью кардиомиопластика ИБС с использованием СККМ. В отличие от медикаментозного и хирургического методов лечения при трансплантации СККМ возможно создание новых устойчивых ростков кардиомиоцитов в сердечной мышце [6, 9, 11]. В настоящее время активно обсуждаются вопросы о том, могут ли циркулирующие в крови СККМ мигрировать в миокард и дифференцироваться в кардиомиоциты (КМЦ)? Уточняются механизмы регенеративного эффекта стволовых клеток: связан ли он с дифференцировкой клеток в КМЦ и сосуды или же подобное благотворное действие СККМ является результатом секреции ими ростовых факторов, стимулирующих пролиферацию собственных стволовых клеток (СК) миокарда, КМЦ и неоваскулогенез [20]?
В довольно обширном экспериментальном материале по трансплантации в миокард СККМ, накопленном к настоящему времени, освещаются ответы преимущественно на три основных вопроса:
-
1. Улучшается ли функция миокарда после трансплантации (эффект терапии).
-
2. Механизмы реализации эффекта СККМ, т.е., что происходит с клетками после их трансплантации в миокард и как они изменяют структуру сердечной мышцы.
-
3. Продолжительность эффекта. Тем не менее, результаты действия трансплантации СККМ в миокард и отдаленные клинические последствия клеточной терапии остаются до конца не изученными.
Цель исследования: оценить эффект коронарного шунтирования (КШ) с применением клеточной кардиомиопластики при проспективном 3-летнем наблюдении.
Материал и методы
Проведено открытое рандомизированное контролируемое исследование, в которое вошли 66 пациентов с ИБС и постинфарктным кардиосклерозом (табл. 1). Для распределения пациентов на группы использовали ме- тод случайной выборки.
I (основная) группа – 38 мужчин в возрасте от 46 до 64 лет (средний возраст 56,36±9,2 лет), которым выполнялись КШ в сочетании с клеточной кардиомиопластикой (имплантация культур аутологичных СККМ).
II (контрольная) группа – 28 мужчин в возрасте от 41 до 63 лет (средний возраст 56±7,37 лет), которым выполнялось только КШ.
В проспективное исследование вошло 40 пациентов через 3 года после проведения клеточной терапии.
На этапах наблюдения пациенты получали стандартную медикаментозную терапию, согласно Национальным рекомендациям ВНОК и ОССН по диагностике и лечению хронической сердечной недостаточности – ХСН (второго пересмотра) [8], включающую ингибиторы АПФ, диуретики, сердечные гликозиды, β -адреноблокаторы, антиагреганты, нитраты.
Для верификации диагноза и в процессе наблюдения – до и после операции КШ (3, 6, 12 мес. и 3 года) – пациентам I и II групп проводился комплекс исследований: ЭКГ, тест 6-минутной ходьбы, эхокардиография (ЭхоКГ) и тканевая допплерографическая визуализация, коронарная ангиография, динамическая томосцинтиграфия миокарда.
Внутрисердечная гемодинамика оценивалась методом эхокардиографии (ЭхоКГ) сердца в условиях покоя и пробы с таблетированным нитроглицерином (0,5–1 мг). Регистрацию показателей осуществляли с использованием ультразвукового сканера “Ge Vivid 7 Expert” (General Electric, Норвегия) в М-, В- и D-режимах, а также с использованием тканевого допплера. Расчеты показателей осуществляли по общепринятым методикам [17].
Для оценки коронарной перфузии выполнялась динамическая однофотонная эмиссионная компьютерная томография (ОЭКТ) миокарда с 199Tl на томографической гамма-камере Омега-500 (Technicare, США-ФРГ) по протоколу “нагрузка-перераспределение”. Запись нативного сцинтиграфического изображения производилась по стандартной методике через 15 мин после введения 185 МБк 199Тl на пике аденозиновой пробы. Регистрация изображений и обработка томограмм велась с помощью компьютерной системы “Сцинти” производства НПО “Гелмос” (Россия). Рассчитывали величины стабильных
Таблица 1
Характеристика больных по клинико-анамнестическим данным M±SD, абс. (%)
|
Показатели |
Основная группа |
Контрольная группа |
p |
|
Количество больных |
38 |
28 |
– |
|
Средний возраст, лет |
56,36±9,20 |
56,00±7,37 |
ns |
|
Мужчины |
38 (100) |
28 (100) |
ns |
|
Количество инфарктов миокарда в анамнезе |
1,37±0,54 |
1,49±0,62 |
ns |
|
Давность инфаркта миокарда |
|||
|
До 1 года |
13 (34,2) |
8 (44,5) |
ns |
|
От 1 до 5 лет |
17 (44,7) |
6 (33,3) |
ns |
|
Более 5 лет |
8 (21,1) |
4 (22,2) |
ns |
|
ФК стенокардии |
|||
|
III |
30 (78,9) |
22 (78,6) |
ns |
|
IV |
8 (21,1) |
6 (21,4) |
ns |
|
ФК НК по NYHA |
|||
|
II |
18 (47,4) |
13 (46,4) |
ns |
|
III |
20 (52,6) |
15 (53,6) |
ns |
|
Тест 6-минутной ходьбы, мин |
340,80±96,06 |
280,94±64,87 |
0,037 |
|
Качество жизни больных, балл |
54,20±21,55 |
53,94±12,34 |
ns |
|
Поражение коронарных артерий |
|||
|
<50% |
1,80±0,63 |
2,32±1,19 |
ns |
|
50–75% |
1,10±0,57 |
1,00±0,77 |
ns |
|
100% |
0,50±0,53 |
0,61±0,57 |
ns |
|
Распространенность правого типа кровоснабжения |
28 (73) |
19 (66,6) |
ns |
|
Распространенность левого типа кровоснабжения |
6 (15,0) |
2 (7,0) |
ns |
|
Смешанный тип кровоснабжения |
4 (12,0) |
7 (26,4) |
ns |
|
Количество шунтов |
2,60±0,97 |
2,61±0,96 |
ns |
|
Однососудистое шунтирование |
2 (3,3) |
2 (6,2) |
ns |
|
Двух и более сосудистое шунтирование |
36 (96,7) |
26 (93,8) |
ns |
|
Венозное шунтирование |
33 (86,7) |
22 (81,1) |
ns |
|
Тотальное артериальное шунтирование |
5 (13,2) |
6 (21,4) |
ns |
|
Шунтирование внутренней грудной артерией |
38 (100) |
28 (100) |
ns |
|
Шунтирование лучевой артерией |
13 (34,9) |
10 (35,8) |
ns |
|
Артериальная гипертензия |
33 (86,8) |
24 (85,7) |
ns |
|
Курение |
24 (63,2) |
19 (67,9) |
ns |
|
Отягощенная наследственность |
13 (34,2) |
10 (35,7) |
ns |
|
Ожирение |
9 (23,7) |
7 (25,0) |
ns |
|
Сахарный диабет |
12 (31,6) |
8 (28,6) |
ns |
и преходящих дефектов перфузии [10].
Критерии включения в группы: один и более инфарктов миокарда в анамнезе и ХНК II–III функциональный класс (ФК) по NYHA, фракция выброса левого желудочка (ФВЛЖ)<59%, конечно-диастолический объем (КДОЛЖ)>140 мл, акинез/дискинез/гипокинез миокарда ЛЖ по ЭхоКГ. Критерии исключения: постоянная форма фибрилляции предсердий; клапанные пороки сердца; отказ пациента (рис. 1).
Имплантация культуры аутологичных стволовых клеток костного мозга одновременно с КШ выполнена у 21 пациента I группы. СККМ выделялись за 3–4 ч до введения в миокард из аспирата костного мозга путем пункции крыла подвздошной кости в верхнепередней области [14]. При этом у 3 из оперированных больных операция реваскуляризации миокарда проведена в сочетании с аневризмэктомией и эндовентрикулопластикой. Операции выполняли в условиях искусственного кровообращения и фармакохолодовой кровяной кардиоплегии. Индекс реваскуляризации составил 2,6. Через 2 нед. после КШ в условиях ангиоблока 17 пациентам этой группы внутрикоронарно введены СККМ [15]. У больных II группы (n=28) операция АКШ не сопровождалась введением аутологичных СККМ.
Для оценки морфологических изменений в миокарде до и после имплантации СККМ выполняли гистологическое исследование биопсийного материала. Биопсия миокарда ЛЖ проводилась во время операции КШ и через 6 и 12 мес. при проведении коронароангиографичес-кого исследования. Все пациенты подписывали информированное согласие. Исследование проводилось на люминесцентном микроскопе Micros MI 300 FX при увеличении х200, х400, х1000.
Данное исследование одобрено этическим комитетом НИИ кардиологии СО РАМН (протокол № 2 от 26.03.2004 г.).
Статистическая обработка материала проводилась с использованием пакетов программ SPSS 17.0, SAS 8, STATISTICA 6.0. Характер распределения полученных данных оценивали с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса, критерия Шапиро–Вилка, а также визуально – методом построения гистограмм. Статистическую значимость различий между группами оценивали критерием Манна–Уитни, достоверность различий парных сравнений определяли критерием Вилкок-сона. Зависимости между переменными вычисляли с помощью коэффициента корреляции Спирмена (r). Данные представляли в виде “M±SD” (М – среднее арифметичес-
Таблица 2
Динамика основных гемодинамических показателей левого желудочка в I и II группах (M±SD)
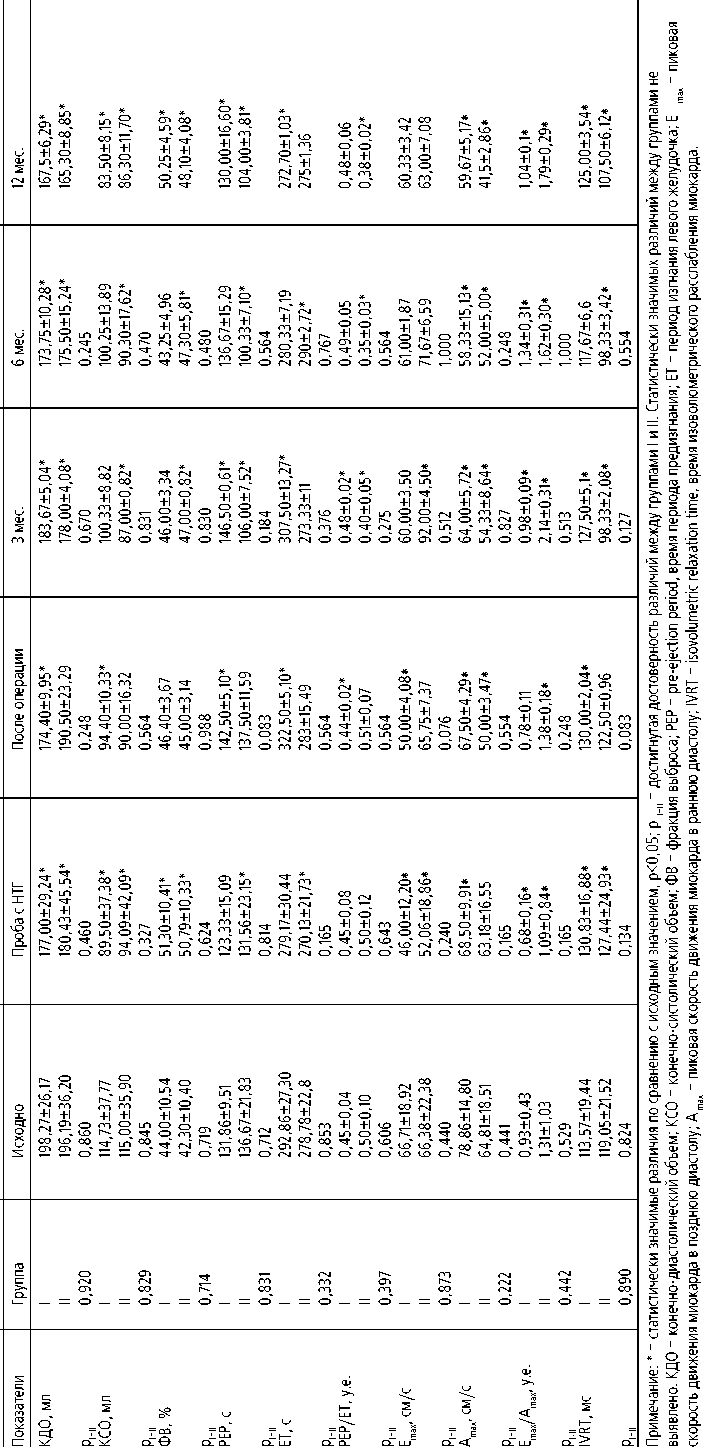
кое, SD – среднеквадратическое отклонение) или Me (Q25–Q75): Me – медиана, Q25–Q75 – квартильный размах. Статистически значимым считали уровень p<0,05 [5].
Результаты
Послеоперационный период у всех больных после клеточной кардиомиопластики и хирургической реваскуляризации протекал без осложнений. Повторных инфарктов миокарда (ИМ) непосредственно после введения СККМ и в последующие 3, 6 и 12 мес. наблюдения не зафиксировано. При контрольном обследовании в указанные сроки ультразвуковыми и рентгенологическими исследованиями не выявлено интрамиокардиальных опухолей и/или неопластических процессов другой локализации. Летальных исходов в течении 12 мес. наблюдения не было ни в одной из групп.
Наибольший клинический эффект хирургической коррекции отмечен через 6 мес. после вмешательства [4, 15]. Установлено, что у большинства пациентов улучшился ФК стенокардии и снизилась тяжесть ХСН по NYHA. В обеих группах отмечалось статистически значимое улучшение показателей глобальной систолической функции левого желудочка, а именно: уменьшение конечно-диастолического объема (КДО), конечно-систолического объема (КСО), конечно-диастолического индекса (КДИ), конечно-систолического индекса (КСИ) и увеличение фракции выброса (ФВ), без значимых различий между группами (табл. 2).
Установлено также, что к 6 мес. наблюдения в I и II группах нормализовались показатели диастолической функции: соотношение пиков Е и А и периода изоволюмической релаксации (IVRT). Однако к 12 мес. эти показатели у пациентов с проведенной трансплантацией СККМ не только вернулись к исходным цифрам, но и ухудшились. Сравнивая показатели насосной функции ЛЖ, мы не выявили достоверных различий между группами.
Перед операцией проводилась проба с таблетированным нитроглицерином (ПНГ) с целью оценки резерва сократимости ЛЖ. По данным ПНГ, у пациентов как I, так и II группы на высоте действия препарата по сравнению с исходным состоянием количество сегментов с нарушенной контрактильностью статистически значимо уменьшалось. В то же время после операции АКШ кинез жизнеспособных сегментов по данным эхокардиографии улучшался [15].
Необходимо отметить, что у пациентов основной и контрольной групп по результатам ОЭКТ с 199Tl через 3 и 6 мес. после операции КШ и имплантации аутологичных
Таблица 3
Дельта преходящих и стабильных дефектов перфузии миокарда по данным сцинтиграфии с 199Tl у больных с клеточной терапией (n1=17) и без (n2=25), Me (Q25–Q75)
|
Показатели |
Группа 1 |
Группа 2 |
p 1–2 |
|
Pr 0–6, % |
8,70 (6,50–10,50) |
3,56 (3,00–7,00) |
0,0018 |
|
St 0–6, % |
2,50 (2,00–3,50) |
3,94 (2,00–3,94) |
0,1796 |
|
Pr 0–12, % |
6,50 (5,00–7,50) |
1,81 (1,81–4,00) |
0,0011 |
|
St 0–12, % |
0,60 (–1,00–2,00) |
2,56 (2,56–3,00) |
0,0036 |
Примечание: Pr – преходящий дефект перфузии миокарда; St – стабильный дефект перфузии миокарда; 0–6, 0–12 – дельта значений преходящего и стабильного дефектов перфузии миокарда между исходом и 6, 12 мес. после лечения соответственно.
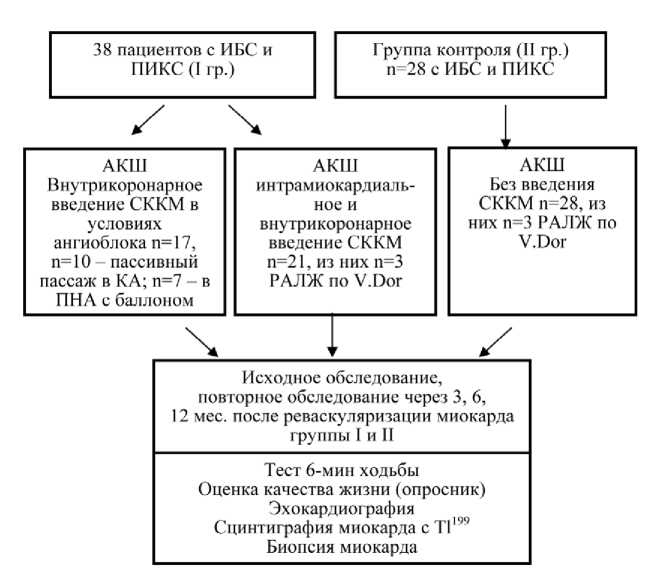
Рис. 1. Дизайн исседования. ПИКС – постинфарктный кардиосклероз, КА – коронарная артерия, ПНА – передняя нисходящая артерия, РАЛЖ – резекция аневризмы левого желудочка
СККМ отмечено достоверное уменьшение объема как стабильных, так и преходящих дефектов перфузии без статистически достоверной разницы между группами [15]. Однако подсчет показателя дельты изменения дефектов перфузии ( ∆ %) выявил статистически значимую разницу между группами. В срок наблюдения 6 мес. размер преходящих дефектов уменьшился в обеих группах. При этом ∆ % оказалась выше в группе с проведенной клеточной терапией (табл. 3).
Через 6 мес. после оперативного вмешательства, по данным гистологического исследования биопсийного материала [15], в I группе количество открытых капилляров в сравнении с исходным значением увеличилось. Однако через 12 мес. после трансплантации стволовых клеток появилась тенденция к сокращению их числа, а в сравнении с группой контроля установлено статистичес-
Таблица 4
Изменения количества капилляров в группах I (CККМ) и II (группа контроля) в течение 12 мес. наблюдения (M±SD)
|
Показатели |
Группа |
Исходно |
6 мес. |
12 мес. |
|
Общее количество капилляров |
I |
26,60±1,84 |
31,50±6,55 * |
25,90±2,23 |
|
II |
26,54±1,77 |
25,29±3,90 |
24,96±3,36 |
|
|
p I–II |
0,947 |
0,012 |
0,426 |
|
|
Количество открытых капилляров |
I |
16,30±6,68 |
20,30±2,83* |
11,80±3,99* |
|
II |
24,61±3,90 |
18,60±13,02* |
18,82±4,64* |
|
|
p I–II |
0,001 |
0,040 |
0,004 |
|
|
Количество закрытых капилляров |
I |
15,22±4,12 |
9,00±1,94* |
17,11±4,70* |
|
II |
17,11±5,48 |
16,75±6,10 |
9,71±2,14* |
|
|
p I–II |
0,305 |
0,001 |
0,001 |
Примечание: * – статистически значимые различия по сравнению с исходным значением, р<0,05; pI–II – достигнутая достоверность различий между группами I и II.
Таблица 5
Динамика показателей на фоне пробы с нитроглицерином в группах А и Б
|
Показатели |
Группа А |
Группа Б |
Межгрупповые различия, pА–Б |
|||
|
Исход |
НТГ |
Исход |
НТГ |
Исход |
НТГ |
|
|
КДО |
205,08±53,01 |
186,67±58,79* |
228,20±54,14 |
196,20±43,84* |
0,298 |
0,602 |
|
КСО |
124,38±52,21 |
99,86±51,36* |
133,40±52,32 |
103,60±41,10* |
0,707 |
0,558 |
|
ФВ |
41,58±11,31 |
49,24±11,62* |
43,00±10,42 |
48,80±10,03* |
0,686 |
0,871 |
|
ЧСС |
64,38±9,23 |
67,32±8,66 |
66,80±9,42 |
77,20±9,01* |
0,431 |
0,039 |
Примечание: * – статистически значимые различия по сравнению с исходным состоянием, р<0,05.
ки значимое уменьшение (табл. 4). Напротив, количество закрытых капилляров в те же сроки у пациентов после клеточной кардиомиопластики уменьшалось, а к 12 мес. наблюдения, соответственно, увеличивалось в сравнении с пациентами, которым не вводились СККМ.
При ретроспективном анализе гемодинамических показателей выделены подгруппы пациентов с улучшением показателей гемодинамики – группа А (“responders”) и с ухудшением – группа Б (“nonresponders”). При этом обращала на себя внимание различная реакция частоты сердечных сокращений (ЧСС) в условиях пробы с таблетированным нитроглицерином до оперативного вмешательства. У пациентов группы А в условиях пробы ЧСС практически не изменилась (64,38±9,23 и 67,32±8,66 уд/мин) в отличие от пациентов группы Б, в которой отмечался значительный прирост этого показателя – с 66,8±9,42 до 77,2±9,01 уд/мин (р<0,03). На этапах обследования 6 и 12 мес. наблюдалась статистически достоверная разница основных показателей, характеризующих систолическую функцию ЛЖ – КСО, КДО и ФВ (табл. 5, 6). За 12-месячный период наблюдения летальных исходов не было ни в одной из анализируемых групп.
В процессе динамического наблюдения в сроки от 12 до 36 мес. с пациентами поддерживалась постоянная связь посредством переписки, телефонных переговоров, а также приглашения в НИИ кардиологии СО
РАМН для обследования и коррекции проводимой терапии. Спустя три года после выполнения клеточной кардиомиопластики умерло 4 (10,5%) пациента из I группы и 2 (7,1%) – из II группы. В подавляющем большинстве случаев (83,3%) имела место внезапная смерть и один пациент умер от прогрессирования хронической сердеч-
Таблица 6
Динамика показателей систолической функции левого желудочка в группах А и Б
|
Группы |
КДО |
КСО |
ФВ |
|
|
А |
Исходно |
205,08±53,01 |
124,38±52,21 |
41,58±11,31 |
|
1 год |
170,93±47,16* |
88,40±36,57* |
50,00±8,39* |
|
|
2 года |
187,20±69,75 |
115,07±62,86 |
44,07±11,98 |
|
|
Б |
Исходно |
228,20±54,14 |
133,40±52,32 |
43,00±10,42 |
|
1 год |
210,00±31,61 |
130,80±33,19 |
38,80±7,19 |
|
|
2 года |
206,20±26,30 |
129,60±31,25 |
39,00±8,80 |
Примечание: * – статистически значимые различия по сравнению с исходным состоянием, р<0,05.
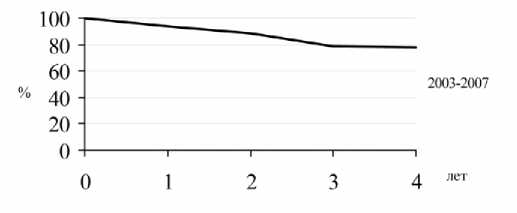
Рис. 2. Выживаемость больных ИБС, корригированных АКШ в сочетании с клеточной терапией (2003–2007 гг.)
ной недостаточности. В соответствии с актуарным методом оценки к третьему году наблюдения отдаленная выживаемость оперированных больных составила 80% (рис. 2).
Обсуждение
Лечение ИБС, инфаркта миокарда, сердечной недостаточности на настоящий момент прошло большой путь – от медикаментозной коррекции и хирургического вмешательства до регенерационной терапии стволовыми клетками (клеточной миокардиопластики). Новый метод – трансплантация стволовых клеток – привлекает все больше внимания. Ряд проведенных исследований показал возможность улучшения сократительной функции миокарда при интрамиокардиальном введении костномозговых стволовых клеток [21, 23]. В связи с этим рассматривается перспектива активного клинического использования данного метода как части комплексного лечения ХСН [18, 24].
Обкалывание перирубцовых зон миокарда ЛЖ во время операции на открытом сердце позволяет достигнуть лучшей визуализации потенциальных зон для имплантации культуры аутологичных СККМ и доставлять клеточный материал непосредственно в зону повреждения миокарда. Такой метод требует меньшего количества клеток, чем при интракоронарном и внутривенном методах введения. Часто отдифференцировать результат КШ и клеточной терапии сложно, так как введение стволовых клеток производится единовременно в сочетании с реваскуляризацией миокарда [3, 7].
В нашем исследовании не получено статистически значимых различий в отношении влияния терапии СККМ на сократительную функцию ЛЖ, но она оказывала положительное влияние на морфологическую картину миокарда. При этом максимальный эффект наблюдался через 6 мес. после их имплантации, что близко к данным других исследователей [21]. Нами также было установлено, что в срок наблюдения 6 мес. размер преходящих дефектов перфузии миокарда уменьшился в обеих группах [15]. При этом дельта дефектов перфузии ( ∆ %) оказалась больше в группе с клеточной терапией. Подобные результаты получены в исследовании, выполненном группой авторов из Медицинского центра Лейденского университета, которые показали, что интракардиальное введение СККМ улучшает перфузию сегментов миокарда как в месте введения, так и прилегающих сегментах [22].
Обращало внимание, что в течение первого года после операций реваскуляризации и реваскуляризации с клеточной кардиомиопластикой у подавляющего большинства пациентов существенно увеличивалась глобальная сократимость миокарда, уменьшалось количество диссенергичных сегментов и, соответственно, увеличивалось количество сегментов с нормальной контрактильностью. Это согласуется с концепциями функционально адекватной реваскуляризации миокарда и восстановлением функционально компетентного миокарда [2]. Практически в равной степени увеличилось количество нор-мокинетичных сегментов только у пациентов с КШ и с КШ в комплексе с клеточной кардиомиопластикой СККМ. В нашей работе 40 пациентов с проведенной клеточной терапией наблюдались в течение 3 лет. Актуарная выживаемость составила 80%. За этот период в целом по группе отмечено увеличение объемов ЛЖ и снижение его ФВ. В литературе также приводятся данные, что трансплан- тация СККМ приводит к незначительным улучшениям анатомических и физиологических параметров сердца у пациентов с острым инфарктом миокарда и хронической ИБС [17]. Так, для оценки роли клеточной терапии на лечение хронической сердечной недостаточности Национальным институтом сердца (США) проведено рандомизированное, плацебоконтролируемое многоцентровое исследование FOCUS (First Mononuclear Cells injected in the US) [24]. В исследование вошло 87 пациентов с проведенной клеточной терапией, которых наблюдали на протяжении 5 лет. К концу 5-го года наблюдения актуарная выживаемость составила 50%, что в какой-то степени согласуется и с нашими данными. Основной причиной смерти назывался острый инфаркт миокарда и сердечная недостаточность, не поддающаяся лечению. Таким образом, можно сделать вывод о том, что терапия СККМ безопасна, но желательно проведение крупного рандомизированного исследования, которое позволит определить эффективность клеточной терапии в сравнении со стандартными методами лечения.
Выводы
-
1. Однократная имплантация культуры аутологичных стволовых клеток костного мозга не оказывает отрицательного влияния на процесс положительной послеоперационной динамики показателей насосной функции и кинетики левого желудочка у больных с ИБС и постинфарктным кардиосклерозом.
-
2. По данным морфологического исследования биопсийного материала, к 6 мес. после клеточной кардиомиопластики отмечается увеличение количества открытых капилляров и уменьшение стабильных дефектов перфузии.
-
3. Клеточная трансплантация аутологичными стволовыми клетками костного мозга является безопасной процедурой: взятие костного аспирата переносится хорошо, постпункционных кровотечений, гематом мы не выявили, не зафиксировано кровоточения в местах инъекций после интрамиокардиального их введения, СККМ не оказывают аритмогенного действия, не вызывают повторных инфарктов.
Список литературы Клеточная кардиомиопластика в хирургическом лечении больных ишемической болезнью сердца и постинфарктным кардиосклерозом: результаты 3-летнего наблюдения
- Акчурин Р.С., Белявская Т.М., Скридлевская Е.А. и др. Трансплантация аутологичных стволовых клеток во время операции коронарного шунтирования у больных ишемической болезнью сердца с постинфарктным кардиосклерозом и хронической сердечной недостаточностью//Грудная и сердечно-сосудистая хирургия. -2009. -№ 4. -С. 23-28.
- Белов Ю.В., Россейкин Е.В. Концепция "адекватной" реваскуляризации миокарда -новое направление в хирургическом лечении ишемической болезни сердца//Грудная и сердечно-сосудистая хирургия. -2001. -№ 2. -С. 50-54.
- Бокерия Л.А., Голухова Е.З., Еремеева М.В. и др. Новые подходы к лечению ишемической болезни сердца: терапевтический ангиогенез в сочетании с хирургической реваскуляризацией миокарда//Тер. архив. -2004. -№ 6. -С. 25-30.
- Ворожцова И.Н., Буховец И.Л., Лавров А.Г. и др. Динамика показателей доплер-, стрессэхокардиографии и геометрии левого желудочка при лечении аутологичными мононуклеарными клетками костного мозга//Сибирский медицинский журнал (Томск). -2006. -№ 2. -С. 35-39.
- Гланц С. Медико-биологическая статистика/пер. с англ. -М.: Практика, 1998. -459 с.
- Казаков А.В., Мюллер П., Бельтрами А.П. и др. Стволовые клетки и регенерация миокарда человека//Кардиология. -2005. -№ 11. -С. 65-75.
- Караськов А.М., Ларионов П.М., Чернявский А.М. и др. Морфофункциональная и молекулярно#генетическая оценка экспериментальных результатов вариантов непрямой реваскуляризации с использованием различных клеток костномозгового происхождения//Патология кровообращения и кардиохирургия. -2007. -№ 4. -С. 75-1.
- Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные Рекомендации ВНОК и ОССН по диагностике и лечению ХСН (второй пересмотр)//Сердечная недостаточность. -2007. -№ 1. -С. 1-6.
- Марков В.А., Рябов В.В., Суслова Т.Е. и др. Клеточная кардиомиопластика: состояние вопроса и результаты собственного исследования//Бюллетень сибирской медицины. -2009. -№ 4 (2). -С. 174-82.
- Национальное руководство по радионуклидной диагностике/под ред. Ю.Б. Лишманова, В.И. Чернова. -Томск: STT, 2010. -686 с.
- Потапов И.В., Крашенинников М.Е., Онищенко Н.А. Клеточная кардиомиопластика//Вестн. трансплантологии и искусственных органов. -2001. -№ 2. -С. 53-2.
- Рахмат-Заде Т.М., Скридлевская Е.А., Акчурин Р.С. Костномозговые стволовые клетки в лечении ишемической болезни сердца//Кардиология. -2007. -№ 1. -С. 47-1.
- Сергиенко И.В., Масенко В.П., Семенова А.Е. и др. Влияние реваскуляризации миокарда на динамику факторов ангиогенеза у больных ишемической болезнью сердца//Кардиология. -2009. -№ 12. -С. 4-0.
- Суслова Т.Е., Рябов В.В., Ахмедов Ш.Д. и др. Способ выделения мононуклеарных клеток костного мозга человека: пат. 2292895 Рос. Федерация. -2007.
- Ахмедов Ш.Д., Бабокин В.Е., Буховец И.Л. и др. Клеточная терапия в лечении больных ИБС//Фундаментальные аспекты лечения сердечной недостаточности в кардиохирургии = Fundamental aspects of treatment of cardiac insufficiency in cadio#surgery: коллективная монография/под ред. В.М. Шипулина, Р.С. Карпова. -Томск: STT, 2009. -С. 116-29.
- Центр клеточных технологий [Электронный ресурс]. -URL: www.uvenal.ru.
- Шиллер Н.Б., Осипов М.А. Клиническая эхокардиография: руководство. -2-е изд. -М.: Практика, 2005. -663 с.
- Штатолкина М.А., Рябов В.В., Суслова Т.Е. и др. Циркулирующие в крови стволовые клетки: динамика и значение при остром инфаркте миокарда//Сибирский медицинский журнал (Томск). -2010. -Т. 25, № 4, вып. 1. -С. 58-2.
- Cleland J.G., Freemantle N., Coletta A.P. et al. Clinical trials update from the American Heart Association: REPAIR-AMI, ASTAMI, JELIS, MEGA, REVIVE-II, SURVIVE, and PROACTIVE//Eur. J. Heart Fail. -2006. -No. 1. -P. 105-10.
- Orlic D., Hill J.M., Arai A.E. Stem cells for myocardial regeneration//Circ. Res. -2002. -Vol. 91. -No. 12. -P. 1092-102.
- Perin E.C., Dohmann H.F., Borojevic R. et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure//Circulation. -2003. -Vol. 107. -P. 2294-302.
- Saskia L.M.A. Beeres, Jeroen J. Bax, Dibbets P. et al. Atsma Effect of intramyocardial injection of autologous bone marrow-derived mononuclear cells on perfusion, function, and viability in patients with drug#refractory chronic ischemia//J. Nucl. Med. -2006. -Vol. 47, No. 4. -P. 574-80.
- Tse H.F., Kwong Y.L., Chan J.K. et al. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation//Lancet. -2003. -Vol. 361. -P. 47-9.
- Willerson J.T., Perin E.C., Ellis S.G. et al. Intramyocardial injection of autologous bone marrow mononuclear cells for patients with chronic ischemic heart disease and left ventricular dysfunction (First Mononuclear Cells injected in the US [FOCUS]): Rationale and design//Am. Heart. J. -2010. -Vol. 160. -No. 2. -P. 215-223.


