Клиническая оценка эффективности радиочастотной аблации ганглионарных сплетений левого предсердия у пациентов с фибрилляцией предсердий
Автор: Покушалов Евгений Анатольевич, Широкова Наталья Васильевна, Романов Александр Борисович, Туров Алексей Николаевич, Селина Вера Владимировна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Электрофизиология
Статья в выпуске: 4 т.13, 2009 года.
Бесплатный доступ
В настоящей статье представлен анализ клинической эффективности радиочастотной аблации ганглиозных сплетений у пациентов с мерцательной аритмией (ФП). В наше исследование включено 415 пациентов с пароксизмальной фибрилляцией предсердий (ФП), которым была выполнена анатомическая абляция ганглиозных сплетений. Выявлено, что свобода от фибрилляции предсердий в отдаленном периоде наблюдения составила 81,9%, 80% и 61,9% у больных с пароксизмальной, персистирующей и постоянной формами соответственно. Показатель КЖ у пациентов с ФП значительно увеличился после аблации ганглиозных сплетений по данным SF-36. Многопараметрический анализ выявил следующие предикторы позднего рецидива ФП: предсердная гипертензия и гиперлипидемия, объем левого предсердия более 62 мм, ИМТ > 40 кг/м2, наличие ФП более 10 лет и постоянная ФП более 3 лет. Таким образом, радиочастотная абляция ФП является высокоэффективным методом у отдельных пациентов без экстракардиальных и структурных заболеваний сердца и стойкой длительной ФП. Ранний рецидив ФП в течение 3 мес после аблации не может быть критерием неэффективности.
Фибрилляция предсердий, катетерная аблация
Короткий адрес: https://sciup.org/142233464
IDR: 142233464 | УДК: 616.124-089
Текст краткого сообщения Клиническая оценка эффективности радиочастотной аблации ганглионарных сплетений левого предсердия у пациентов с фибрилляцией предсердий
Фибрилляция предсердий (ФП) является наиболее распространённой аритмией, создающей риск инсультов, тромбоэмболий и сердечной недостаточности [2]. Всё большие надежды на устранение этой аритмии связываются с интервенционными катетерными технологиями [3]. В 2005 году коллектив центра хирургической аритмологии ФГУ «ННИИПК Росмедтехнологий» предложил новый метод инвазивного лечения ФП – анатомическую аблацию ганглионарных сплетений левого предсердия (anatomical GPA, AGPA) [1], которая направлена на принципиально новую анатомическую мишень – периферический отдел автономной нервной системы. Получен хороший антиаритмический эффект процедуры в течение первого года после операции [7, 8]. Однако отсутствуют ещё сведения, связанные с оценкой качества жизни пациентов в послеоперационном периоде, необход им анализ, позволяющий выявить возможные предикторы неэффективности выполняемой процедуры. Цель исследования – оценить качество жизни пациентов с ФП, перенесших анатомическую аблацию ганглионарных сплетений левого предсердия (ЛП), выявить возможные предикторы неэффективности выполняемой процедуры.
МАТЕРИАЛ И МЕТОДЫ
Исследование включает анализ 415 пациентов, оперированных в ФГУ «ННИИПК Росмедтехноло-гий» по поводу ФП за период с 2006 по 2008 год.
Критериями включения были: наличие ФП; дли-тел ьность аритмического анамнеза более 6 мес.; рефрактерность к антиаритмической терапии (как минимум к двум препаратам I C или III класса).
В обследуемой группе пациентов ФП наблюдалась: 1. На фоне кардиальной патологии – ИБС без хирургически значимых стенозов коронарных артерий либо не менее 6 мес. после выполненной ЧТКА со стентированием коронарных артерий у 49 пациентов (11,8%); АГ I и II стадии у 265 (63,8%) бол ьных; сочетание ИБС (без хирургически значимого стеноза коронарных артерий) + АГ I и II стадии у 27 пациентов (6,5%). 2. Без кардиальной патологии (идиопатическая форма) – у 68 (16,4%).
До операции всем пациентам выполнены антропометрические исследования (индекс массы тела – ИМТ), электрокардиография (ЭКГ), трансторакальная эхокардиография (ЭхоКГ), суточное мониторирование ЭКГ. Чреспищеводная ЭхоКГ проводилась для точной оценки размера предсердных камер, а также для исключения тромбоза левого предсердия. Анкетирование пациентов с использованием неспецифического опросника для оценки качества жизни (КЖ) SF-36 проведено у 172 пациентов до операции, через 3, 6 и 12 мес. после РЧА ганглионарных сплетений. Тридцать шесть пунктов опросника сгруппированы в восемь шкал: физическое функционирование, ролевая деятел ьность, телесная боль, общее здоровье, жизнеспособность, социал ьное функционирование, эмоциональное состояние и психическое здоровье. Показатели каждой шкалы варьируют между 0 и 100, где 100 представляет полное здоровье, все шкалы формируют два показателя: душевное и физическое благополучие.
В процессе работы использовали следующие классификации ФП.
Классификация АСС/АНА/ESC [4]:
-
1) Пароксизмальная – длительность менее 7 дней, спонтанное купирование.
-
2) Персистирующая – дл ител ьность более 7 дней, эффективная медикаментозная или электрическая кардиоверсия.
-
3) Хроническая (постоянная) – неэффективность любой кардиоверсии или она не проводилась. Для удобства изложения в некоторых случаях первая
и вторая формы объединены под названием «пароксизмальная ФП».
Клиническая характеристика и результаты ЭхоКГ пациентов, включенных в исследование, приведены ниже.
Клини ческая ха рак тер ис тика па цие нтов
|
К ол-во пац иен тов |
415 |
|
Сре дн ий возра ст, лет |
53,5±8,7 |
|
Возраст <30 лет, n (%) |
98 (23,6%) |
|
Возраст >50 лет, n (%) |
178 (42,9%) |
|
Мужчи ны, n (%) |
242 (58,3%) |
|
Экстракардиальная пато ло гия, n (%) |
80 (19,3%) |
|
пато ло гия п озво ночни ка, n (%) |
56 (13,5%) |
|
саха рный диабет, n (%) |
14 (3,4%) |
|
пато ло гия щитовидной же лезы, n (%) |
32 (7,7%) |
|
пато ло гия желудочно-кишечн ого тракта, n (%) |
45 (10,8%) |
|
Артериальная гипе рте нзия, n (%) |
279 (67,2%) |
|
ИБС, n (%) |
84 (20,2%) |
Результаты ЭхоКГ
КДР ЛЖ, мм 48,1±0,6
ФВ ЛЖ, % 65±1,2
ПЖ, мм 21,3±1,3
ЛП, мм 49,3±0,9
ПП, мм 46,1±0,9
Пароксизмальная форма ФП наблюдалась у 177 пациентов (42,6%), персистирующая у 170 пациентов (41,0%), хроническая у 68 пациентов (16,4%). Полный аритмологический анамнез составил 6,9±0,7 года (от 1 до 17 лет).
Средний функциональный класс (ФК) сердечной недостаточности по NYHA в группах составил 1,81±0,15 (р>0,05). По данным трансторакальной ЭхоКГ, конечный диастолический размер левого желудочка (КДР ЛЖ) превышал верхнюю границу возрастной нормы у 7 пациентов (3,6%). У 135 (70,3%) пациентов констатировано увеличение ЛП и у 52 (27%) пациентов правого предсердия.
Технология анатом ической радиочастотной аблации ганглионарных сплетений левого предсердия
Операция проводилась на электрофизиологическом комплексе CardioLab Version 6.0 (Pruka Engeneering, Inc). Для диагностической стимуляции использовали электростимулятор Bloom Electrophysiology (США). Электроанатомическое картирование осуществляли в условиях навигационной системы CARTO XP (Biosense Webster, США).
Под местной анестезией раствором новокаина (0,5%) или лидокаина (1%) пунктировали левую подключичную вену (для проведения диагности- ческого/референтного электрода) и правую бедренную вену (для проведения картирующего/абла-ционного электрода). В качестве последнего использовали 10-полюсный электрод Webster (6F), который проводился во всех случаях в коронарный синус и служил для регистрации левопредсердной электрограммы, диагностической стимуляции и в качестве анатомического ориентира (фиброзное кольцо митрального клапана). Для манипуляций в полости ЛП провод илась пункция межпредсердной перегородки (транссептальная пункция, ТСП) при помощи транссептальной иглы BRK-1 под контролем чреспищеводной ЭхоКГ.
Анатомическое построение 3D изображения ЛП выполняли в условиях системы СARTO. В качестве референтного отведения во всех случаях использовали биполярную электрограмму из коронарного синуса, имеющую наиболее высокоамплитудный левопредсердный потенциал (Acs). Для аблации накожный электрод RefStar фиксировали в проекции предсердных камер (паравертебральная область, уровень Th4-Th9). Картирующий электрод продвигали, описывая эллиптоидную траекторию, по эндокардиальной поверхности камеры, регистрируя биполярные эл ектрограммы и фиксируя их в качестве анатомических точек карты. Для исключения низкоамплитудного сигнала как следствие плохого контакта кончика катетера с эндокардом полученную точку принимали для построения карты, если вариабильность в длине цикла (CL), времени локальной активации и движении сердечной стенки не превышали 2%, 3 мс и 4 мм, соответственно. При этом в качестве анатомических ориентиров обозначали устья лёгочных вен и фиброзное кольцо митрального клапана.
После транссептальной пункции и построения анатомического 3D-изображения ЛП проводилось воздействие в пределах скопления вегетативных ганглиев – четырёх зон округлой или овальной формы, размером 1,5–2,5 см, каждая из которых соприкасается с устьем лёгочной вены, а именно: зона 1 (left superior, рис.1; 1) примыкает к устью левой верхней лёгочной вены на 8 ч – 1 ч по окружности устья вены в проекции изнутри ЛП, зона 2 (left inferior, рис. 1; 2) примыкает к устью левой нижней лёгочной вены на 5 ч – 10 ч по окружности устья вены в проекции изнутри ЛП, зона 3 (right superior, рис. 1; 3) примыкает к устью правой верхней лёгочной вены на 7 ч – 1 ч по окружности устья вены в проекции изнутри ЛП, зона 4 (right inferior, рис. 1; 4) примыкает к устью правой нижней лёгочной вены на 2 ч – 8 ч по окружности устья вены в проекции изнутри ЛП.
Последовател ьность воздействия определялась произвольно. В большинстве случаев (n=48; 82,8%) указанные области обрабатывались в очередности «1–2–3–4». Последовательность «2–1– 3–4» использована у троих пациентов (5,2%), «2–
1–4–3» у двоих пациентов (3,4%), «3–4–1–2» у четырех пациентов (6,9%), «4–3–1–2» у одного пациента (1,7%). Конечной точкой процедуры считали исчезновение предсердного потенциала в указанных областях с регистрацией изоэлектрической линии, а также отсутствие вагусных рефлексов при последних аппликациях. Электрическая активность в устьях лёгочных вен не изучалась, и её исчезновение не было целью вмешательства.
Локализация воздействия объясняется постоянством расположения GP у homo sapiens, т. е. процедура носила исключительно анатомический характер, не сопровождалась активационным картированием и не приводила к изоляции лёгочных вен или изменению их электрической активности.
Для профилактики тромбоэмболических осложнений все пациенты получали до операции варфа-рин с целевым значением МНО от 2 до 3 и продолжали принимать его на протяжении 3 мес. после процедуры. Профилактическая антиаритмическая терапия проводилась на протяжении от 8 до 136 мес. (в среднем 3,2±0,6 года) у 398 (95,9%) пациентов. За весь период лечения до операции обследованные пациенты принимали 2,9±0,3 анти-аритмических препарата в течение 3 мес. после процедуры с целью профилактики ятрогенных аритмий и обеспечения наилучших условий для обратного электрического ремоделирования. Схема последующего наблюдения включала осмотр через 1, 3, 6 мес. после процедуры с проведением суточного мониторирования ЭКГ и ЭхоКГ. В случае по-ложител ьной динамики через 3 мес. после аблации производилась отмена антикоагулянтов и антиаритмических препаратов.
Все результаты выражены как арифметическое среднее±стандартное отклонение. Для оценки достоверности различий между средними и долями при соответствии распределения вариант закону нормального распределения использовали t-критерий Стьюдента при значении p=0,05 (уровень достоверности для медиан 95%) и χ 2 -критерий для дискретных переменных. Для оценки статистичес-
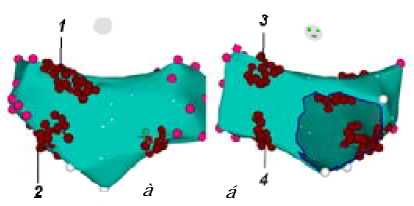
Рис. 1. 3D-анатомическое изображение ЛП при выполнении анатомической аблации ганглионарных сплетений: а – задняя проекция (РА); б – передняя проекция (АР). Розов ые маркёры обозначают устья лёгочных вен, белые – проекцию митрального клапана, бордовые – место аблации. 1 – левое верхнее сплетение, 2 – левое нижнее сплетение, 3 – правое верхнее сплетение, 4 – правое нижнее сплетение.
ких различий внутри групп и между группами использовали непараметрический Wilcoxon-Mann-Whitney U-тест.
РЕЗУЛЬТАТЫ
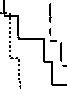
Срок послеоперационного наблюдения пациентов составил 24,7±12,2 мес. (от 6 до 34 мес.). Синусовый ритм сохранялся без приступов аритмии у 81,9% пациентов с пароксизмальной, у 80,0% с персистирующей и у 69,1% пациентов при хронической форме ФП. Таким образом, отсутствие ФП отмечалось в общей сложности у 76,9% пациентов. Свобода от ФП в зависимости от формы аритмии представлена на рис. 2.
У пациентов с исходной симптоматикой сердечной недостаточности (ФК 1,43±0,2 по NYHA) наблюдалось ее исчезновение и значимый регресс до ФК 1,13±0,2 по NYHA. Отмечено уменьшение эхографического размера ЛП у пациентов с его исходной дилатацией с 56,9±3,9 до 43,6±4,2 мм (p<0,01). Использование многофакторного регрессионного анализа позволило дополнительно выделить следующие факторы неэффективности операции: наличие у пациента АГ и гиперлипидемии (p=0,02); гиперстеническая конституция – ИМТ более 37 кг/м2 (p=0,0011); объём ЛП более 120 мл (r=0,69; p=0,012); размер ЛП более 55 мм у больных моложе 45 лет (p=0,02); аритмический анамнез более 10 лет (p=0,007); длительность постоянной ФП более 3 лет (p=0,002).
Следует отметить отсутствие корреляционной зависимости между развитием «ранних» (до 3 мес. после операции) рецидивов ФП и равитием рецидивов ФП в позднем (более 6 мес.) послеоперационном периодах. Полученные результаты оценки качества жизни представлены на рис. 3.
Проводя анализ полученных результатов, следует отметить, что после процедуры РЧ аблации ганглионарных сплетений показатели качества жизни пациентов улучшились по всем шкалам опросника SF-36.
ОБСУЖДЕНИЕ
Осенью 2005 г. коллектив центра хирургической аритмологии ННИИПК предложил новую методику лечения ФП – анатомическую катетерную аблацию ганглионарных сплетений левого предсердия (anatomical GP ablation) [1]. Полученные результаты показали, что данная процедура позволяет сохранить синусовый ритм в отдаленном послеоперационном периоде у 76,9% пациентов, в том числе полностью отказаться от антиаритмической терапии у 27,9% пациентов.
Если оценивать не только антиаритмическую эффективность проводимого вмешательства, а конечную цель л юбого вида лечения – улучшение
Kaplan-Meier plot
0,8
Пароксизмальная форма
L П е р с и ст и р ующ а я форм а
Хроническая форма
0,6
3 6 9 12 15 1821 24 2730 33 36
Месяцы после операции
Рис. 2. Свобода от аритмии у пациентов, имеющих пароксизмальную, персистирующую и хроническую форму ФП после выполнения РЧА ганглионарных сплте-ний ЛП.
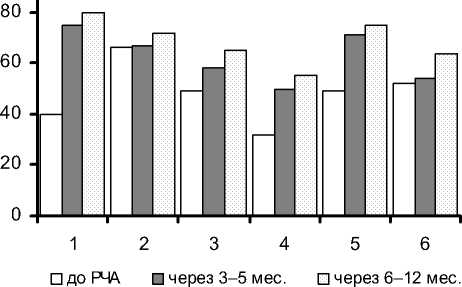
Рис. 3. Основные показатели качества жизни по результатам опросника SF-36 у пациентов с ФП:
-
1. Физическое функционирование, отражающее степень, в которой физическое состояние ограничивает выполнение физических нагрузок.
-
3. Показатель общего состояния здоровья – оценка больным своего состояния здоровья в настоящий момент и перспектив лечения.
-
4. Показатель жизненной акти вности подразумевает ощущение себя полным сил и энергии или, напротив, обессиленным.
-
5. Показатель социального функционирования определяется степенью, в которой физическое или эмоциональное состояние ограничивает социальную активность.
-
6. Показатель психического здоровья характеризует настроение, наличие депрессии, трево ги, общий показатель положител ьных эмоций.
. оказатель интенсивности оли и ее влияние на способность заниматься повседневной деятельностью, включая работу по дому и вне дома.
качества жизни, то полученные нами резул ьтаты свидетельствуют о значительном улучшении всех исследуемых показателей и позволяют говорить о применяемой нами методике как о высокоэффективной процедуре.
Обсуждая эффективность выполняемой нами анатомической аблации ганглионарных сплетений, следует остановиться на возможных причинах, способствующих снижению эффекта этой процедуры. Проведенный нами анализ предикторов не- эффективности выполняемого вмешательства выявил достоверные факторы, способствующие неэффективности проводимого вмешательства у пациентов с: АГ 70,5% по сравнению с 23,6% у пациентов, не имеющих рецидива (р<0,05); гиперлипидемией (62,1% у пациентов с редицивами ФП по сравнению с 28,7%, не имеющих рецидива). Тенденция к снижению эффективности наблюдается у пациентов с имеющейся коронарной патологией сердца, однако при исследовании в эту группу включены только пациенты с хирургически не значимым атеросклеротическим поражением коронарных артерий либо перенесшие реваскуля-тентирова-оэтому в оценивать даже при на тенден-ивов ФП с кторов рис-вления ре-87,4%. Пос данными в своем ис-икторы нех операцию циркулярной изоляции легочных вен.
ия показа-ЛП мы ру-казаниями, ртов HRS/ ческой аб-дставляло ции гангли-телей [5, 9] подтверждает, что у пациентов с , имеющих структурные сердечные изменения, отсутствует какое-либо изменение вагусной активности перед началом ФП, что может ограничивать у них использование данного подхода. Необходимо помнить, что исходный автономный дисбаланс имеет индивидуал ьную окраску c различной спектральной выраженностью, поэтому не все пациенты с ФП могут получить выгоду от воздействия на периферическое звено парасимпатической нервной системы. Идеальным кандидатом для аблации ганглионарных сплетений, по нашему мнению, должен быть пациент моложе 45 лет, с пароксизмальной формой ФП; имеющий признаки ваготонической формы ФП, не имеющий структурной патологии сердца, АГ и гиперхолестериемии; имеющий ИМТ менее 20–25 кг/м2; размер ЛП менее 55 мм; аритмический анамнез менее 10 лет.
Наше исследование было также направлено на выяснение роли ранних рецидивов ФП в оценке прогноза общей эффективности проводимого лечения. Полученные результаты позволили выделить три основные периода в эволюции клинической картины послеоперационного периода, от острого, имеющего наибольшее количество рецидивов ФП до завершающего (после 6 мес.), когда происходило окончание процессов ремоделирования, стабилизировался антиаритмический эффект операции. Наши результаты согласуются с данными зарубежных авторов [6], демонстрирующих аналогичные результаты у пациентов после выполнения различных модификаций циркулярной аблации ФП. Таким образом, развитие ранних рецидивов ФП в ближайшем послеоперационном периоде не может служить индикатором неэффективности выполненной аблации при ФП.
Исследование открывает новые возможности в лечении ФП и в то же время создаёт ряд новых вопросов. В частности, антиаритмический эффект операции оценивался, главным образом, по субъктивным критериям – жалобам пациента, поскольку объективный критерий (регистрация ЭКГ во время аритмии, запись суточного мониторирования) не может использоваться постоянно. Однако появление в недавнем прошлом аппаратов для длительного мониторирования ЭКГ (в частности, Reveal Plus) предоставляет заманчивые перспективы для объективного контроля в будущем за оперированными пациентами. Также безусловно необходимо проведение многоцентровых исследований для подтверждения результатов данной работы.
ВЫВОДЫ
-
1. Радиочастотная анатомическая катетерная аблация ганглионарных сплетений ЛП – высокоэффективная процедура у пациентов с различными формами ФП, которая позволяет сохранить синусовый ритм в отдаленном послеоперационном периоде у 76,9% пациентов, в том числе полностью отказаться от антиаритмической терапии у 27,9% пациентов.
-
2. Использование метода анатомической радиочастотной аблации ганглионарных сплетений ЛП значимо улучшает качество жизни пациентов с ФП по всем шкалам опросника SF-36.
-
3. Факторами, снижающими эффективность радиочастотной аблации при ФП, являются: наличие у пациента АГ и гиперлипидемии, гиперстеническая конституция, размер ЛП более 62 мм, аритмоло-гический анамнез более 10 лет, длительность постоянной ФП более 3 лет, особенности анатомии лёгочн ых вен. Повышают вероятность успеха РЧА пароксизмальная форма ФП и вагусная денервация.
-
4. Максимальная эффективность аблации ганглионарных сплетений наблюдается у пациентов: моложе 50 лет; с пароксизмальной формой ФП; имеющих признаки ваготонической формы ФП, не имеющих структурной патологии сердца, АГ и ги-перхолестериемии; с ИМТ менее 25 кг/м2; с раз-
- мером ЛП менее 55 мм; аритмический анамнез менее 10 лет, при отсутствии противопоказаний к интервенционному лечению ФП, что необходимо учитывать при отборе пациентов для хирургического лечения.
-
5. Развитие рецидивов ФП в ближайшем (до 3 мес.) послеоперационном периоде не может служить индикатором неэффективности выполненной аблации при ФП и не может служить показанием к выполнению повторной процедуры в раннем послеоперационном периоде.
Список литературы Клиническая оценка эффективности радиочастотной аблации ганглионарных сплетений левого предсердия у пациентов с фибрилляцией предсердий
- Покушалов Е.А., Туров А.Н., Шугаев П.Л. и др. // Вестн. аритмологии. 2006. № 45. С. 17-27.
- EDN: HSSIMB
- Benjamin E.J., Levy D., Vaziri S.M. et al. // JAMA. 1994. V. 271. P. 840-844.
- Chen S.A., Hsieh M.H., Tai C.T. et al. // Circulation. 1999. V. 100. P. 1879-1886.
- Fuster V., Ryden L.E., Asinger R.W. et al. // Circulation. 2001. V. 104. P. 2118-2150.
- EDN: LUCJED
- Klingenheben T., Gronefeld G., Li Y.G. et al. // Ann. Noninvas. Electrocardiol. 1999. V. 4. P. 19-26.
- Moreira W., Timmermans C., Wellens H. et al. // Circulation. 2007. V. 116. P. 2786-2792.
- Pokushalov E., Turov A., Artemenko S. et al. // Asian Cardiovasc. Thorac. Ann. 2008. V. 16 (3). P. 194-201.
- EDN: LLLWZT
- Pokushalov E., Shugaev P., Artemenko S. et al. // Eur. Heart J. 2008. V. 29. Suppl. 1. P. 902.
- Stollberger C., Finsterer J., Schneider B. // Stroke. 2006. V. 37. № 8. P. 1960-1961.
- Shan A.N. et al. // J. Cardiovasc. Electrophysiol. 2008. V. 19. P. 661-667.


