Клинические, эпидемиологические и биологические предпосылки адаптации больных шизофренией как основа персонифицированного подхода к антипсихотической терапии
Автор: Семке Аркадий Валентинович, Федоренко О.Ю., Лобачева О.А., Рахмазова Л.Д., Корнетова Е.Г., Смирнова Л.П., Микилев Ф.Ф., Щигорева Ю.Г.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Клиническая психиатрия
Статья в выпуске: 3 (88), 2015 года.
Бесплатный доступ
Показана большая распространенность больных шизофренией, нуждающихся в стационарном лечении, в том числе повторно, что является свидетельством тяжести данного заболевания. Выявлены эпидемиологические, клиникоантропометрические, клинико-иммунологические и биохимические предпосылки адаптации больных шизофренией для разработки критериев персонифицированного подхода к назначению антипсихотиков и их вклада в формирование неблагоприятных типов адаптации у пациентов с шизофренией.
Шизофрения, эпидемиология, соматотип, психонейроиммунология, антиоксидантная система
Короткий адрес: https://sciup.org/14295832
IDR: 14295832 | УДК: 616.895.8:616-036.2
Текст научной статьи Клинические, эпидемиологические и биологические предпосылки адаптации больных шизофренией как основа персонифицированного подхода к антипсихотической терапии
Шизофрения занимает первое место среди психозов по распространенности, прогредиентности и тяжести социальных последствий. По данным эпидемиологических исследований, распространенность шизофрении в мире оценивается в пределах 0,8—1,0 % [Шмуклер А. Б., 2011; Chen Y. H., 2009]. Этим тяжелым недугом страдает 45 млн человек в мире, число новых случаев в год составило 4,5 миллиона человек [Дмитриева Т. Б., 2009].
В России ежегодно госпитализируется
50,6 % от числа всех больных шизофренией [Гурович И. Я., 2000; Lin, 2011]. В данном контексте изучение распространенности шизофрении в региональном аспекте представляется актуальным для решения задач целевого планирования психиатрического сервиса, оценки эффективности специализированной помощи.
Изучение распространенности шизофрении по данным статистической отчетности Томской области показало неравномерность темпов роста как по области в целом, так и по отдельным территориальным единицам. В общей структуре заболеваемости психическими расстройствами на долю шизофрении приходится 54,3 %. Изучение госпитальной структуры психических расстройств показало, что удельный вес больных шизофренией колеблется в течение последнего десятилетия от 17 до 20 % от всех поступивших в течение года, 9,5 % составляют случаи первичной госпитализации. Широкий диапазон основных показателей по госпитализированным больным определил необходимость расчета медианы для 10-летнего ряда. Показаны высокие уровни распространенности поступающих в стационар больных шизофренией – 150,2 на 100 тысяч населения, в том числе впервые в жизни ежегодно стациониру-ются 9,1 на 100 тысяч населения. О необходимости повышения эффективности терапевтического и социально-реабилитационного воздействий свидетельствуют высокие уровни распространенности: случаев повторных госпитализаций (медиана 10-летнего периода равна 37,5 на 100 тысяч населения) и инвалидизации в связи с шизофренией – 65,95 на 100 диспансерных больных.
Важными составляющими качества оказания медицинской помощи больным психическими расстройствами являются точность диагностики и прогноза течения заболевания, прогноз и оценка эффективности терапии с целью оптимизации схем лечения и выбора дифференцированной терапевтической тактики, в том числе при коморбидных расстройствах [Семке А. В. и др., 2011; Красильников Г. Т. и др., 2002].
Нервная и различные гомеостатические системы организма являются составными частями общей системы адаптации, а особенности ней-роиммунных взаимодействий в значительной мере определяют тип индивидуальной стратегии адаптации организма. Результаты проведенных в последние десятилетия исследований показали, что выявленные изменения в субпопуляционной структуре, функциональных свойствах иммунокомпетентных клеток и уровне цитокинов больных шизофренией лежат в основе патогенеза заболевания и свидетельствуют о глубоких изменениях в иммунной системе, дисбалансе Th1/Th2 иммунного ответа, а также о нарушении интеграции между нервной и им- мунной системами [Na K. S., 2007; Watanabe Y. et al., 2010; Drexhage R. C., 2011; Műller N. et al., 2012]. Значимым звеном нарушения молекулярных процессов при шизофрении являются изменения, связанные с дисрегуляцией нейрональной киназной активности, активацией деструктивных процессов и окислительного стресса, структурно-функциональными перестройками биологических мембран [Рязанцева Н. В. и др., 2001; Узбеков М. Г. и др., 2009; Иванова С. А. и др., 2013; Fedorenko O., 2009, 2014; Al Hadithy A. F., 2010; Gu F., Chauhan V., Chauhan A., 2015].
Антипсихотики в настоящее время являются основным методом фармакотерапии шизофрении. Длительное их применение оказывает дезадаптирующее влияние на организм, которое сопровождается различными побочными эффектами и явлениями, снижающими эффективность терапии [Цыганков Б. Д. и др., 2010; Кор-нетова Е. Г. и др., 2014]. Препараты различного механизма действия оказывают неоднозначное влияние на метаболизм, иммунитет и на состояние про- и антиоксидантных систем пациентов [Смирнова Л. П. и др., 2008; Бойко А. С. и др., 2013; Иванова С. А. и др., 2014; Tsai M. C. et al., 2013]. Как показали исследования, проведенные нами ранее [Лобачева О. А., 2006; Ветлугина Т. П., 2006, 2010], побочные эффекты и резистентность к психофармакотерапии формируются на фоне дефицита и функциональных нарушений основных популяций иммунокомпетентных клеток, активации гуморальных факторов иммунитета, дисбаланса продукции цитокинов (IL1, IL2, IL4, TNFα, INFα, INFγ) мо-нонуклеарными клетками больных. Однако до настоящего времени практически отсутствуют биологические критерии персонифицированного подхода к назначению антипсихотиков.
Нами проведены исследования клинических, биохимических и иммунологических критериев для разработки персонифицированных подходов к назначению антипсихотической терапии при шизофрении.
С целью разработки модели прогноза неблагоприятного варианта течения шизофрении, адаптации и неполного ответа на психофармакотерапию проведено клинико-динамическое, клинико-антропометрическое, антропоморфо-скопическое, и клинико-терапевтическое исследование 330 больных шизофренией с преобладанием негативных нарушений в клинической картине заболевания (214 мужчин; 35,2 % и 116 женщин; 64,8 %). Для сравнительной оценки разрабатываемой прогностической модели в отношении неблагоприятного течения шизофрении сформировано две группы сравнения, включающих практически здоровых лиц (n=320) и больных шизофренией с преобладающей позитивной симптоматикой (n=290), 20
соответствующих основной выборке по полу, возрасту и количественным показателям. Такой подход на основании методологии исследований, проведенных ранее в НИИПЗ [Бохан Н. А., Семке В. Я., 1998], продиктован необходимостью выбора противоположных точек отсчета в клинико-динамических особенностях шизофрении, в рамках негативной и позитивной дихотомии шизофренических расстройств, где негативный полюс является неблагоприятным, а позитивный – относительно благоприятным вариантом течения заболевания.
Клинико-антропометрическое исследование пациентов показало возможность прогнозирования неблагоприятного течения шизофрении с помощью оценки конституционально-морфологического статуса пациентов. Астенический тип телосложения статистически значимо преобладал у больных (p<0,001), гиперстенический конституционально-морфологический тип чаще наблюдался в группе здоровых лиц (p<0,001). Мезостенический тип встречался с равной вероятностью (p>0,1). Сопоставление распределения типов телосложения среди пациентов с позитивной и негативной симптоматикой показало, что астенический конституциональноморфологический тип наблюдался у 59,1 % пациентов, страдающих шизофренией с преобладанием негативных нарушений. При позитивной шизофрении астенический соматотип отмечен у 1 % больных. Мезостенический тип телосложения достоверно чаще (p<0,001) выявлен при негативных нарушениях, гиперстенический – статистически значимо (p<0,001) преобладал при позитивных. В клинической картине отмечалось варьирование симптоматики – от гиперстенического к астеническому конституциональному полюсу наблюдалось снижение степени выраженности рудиментарных позитивных симптомов, усиление апатико-абулических нарушений. Кроме того, в выборке больных с ведущей негативной симптоматикой доминировали лица с присутствием множественных регионарных морфологических дисплазий – 91,8 % против 31,6 % группы здоровых лиц (p<0,001). То есть сочетание астенического телосложения и множественных регионарных морфодиспла-зий явилось соматотипологической основой негативных нарушений при шизофрении.
Изучен ответ на психофармакотерапию антипсихотиками в зависимости от конституциональной принадлежности больных. Выявлено, что лица с астеническим телосложением достоверно чаще (p<0,001) демонстрируют неполный ответ на терапию. Противоположная тенденция выявлена у пациентов с гиперстеническим телосложением. В целом в основной группе число респондеров оказалось ниже, чем в контрольной группе больных шизофренией с доминированием позитивных нарушений.
Таким образом, конституциональноморфологический тип являлся важным фактором клинического полиморфизма и динамики шизофрении. Клинико-антропометрическое исследование больных может стать основой для прогноза течения шизофрении, правильного выбора базового препарата для лечения с подбором индивидуально приемлемых дозировок. В конечном счете это позволит повысить эффективность реабилитационных мероприятий, оптимизировать затраты системы здравоохранения на помощь этой тяжелой группе больных.
Наиболее частой причиной обращения больных шизофренией за медицинской помощью является наличие стойкой ипохондрической симптоматики, ассоциированной с негативными нарушениями [Kobayashi T., Kato S., 2004], что приводит к хроническим изменениям психического состояния и инвалидизации больных на отдаленных этапах болезни [Kornetov A. N., 2002].
С целью изучения клинико-динамических особенностей течения заболевания и клиникоконституциональных взаимосвязей проведено клинико-психопатологическое, клинико-динамическое, клинико-катамнестическое, клиникотерапевтическое, клинико-антропометрическое исследование больных шизофренией и шизотипическим расстройством с ипохондрической симптоматикой (70 мужчин – 58,3 % и 50 женщин – 41,7 %). В основную группу вошли 120 пациентов, в структуре расстройств которых, наряду с типично шизофреническими нарушениями, присутствовала ипохондрическая симптоматика. Группу сравнения составили 50 аналогичных по возрастно-половым характеристикам пациентов, не имеющих ипохондрической симптоматики в структуре заболевания.
Среди больных шизофренией в основной группе преобладали лица с нормостеническим соматотипом (32 – 45,7 %), в группе контроля наибольшее количество лиц имели астенический соматотип (19 – 55,9 %), что являлось статистически значимым (p=0,03704) отличием между исследуемыми группами. В основной группе выявлены статистически значимые различия в возникновении ипохондрической симптоматики в зависимости от их соматотипа (p<0,05). Среди больных шизофренией с астеническим соматотипом у большинства (11 – 52,4 %) ипохондрическая симптоматика присутствовала как в инициальный, так и в манифестный период заболевания, а у нормостеников и гиперстеников ипохондрическая симптоматика, как правило, имелась только в манифестный период заболевания (24 – 62,5 %; 12 – 47,1 %), при этом различия между подгруппами были статистически значимыми (p<0,05).
Следовательно, соматотип как один из важнейших конституциональных факторов способен оказывать влияние на проявления ипохон- дрической симптоматики в клинической картине шизофрении.
У пациентов основной группы с выраженной негативной и паранегативной симптоматикой в сравнении с больными без выраженных дефи-цитарных расстройств на момент осмотра отмечались нарушения приспособительного поведения в виде преобладания условно-декомпенсированного и парциально-декомпенсированного (p<0,01) уровней клинической адаптации, а также парциально-декомпенсированного уровня социальной адаптации. Их внутренние адаптационные реакции носили гиперболизированный характер (p<0,05), что способствовало формированию индивидуальной компенсаторноприспособительной защиты по типу «укрытия под опекой» (p<0,05). Социальная адаптация пациентов с выраженной негативной и паранега-тивной симптоматикой характеризовалась формированием неблагоприятного деструктивного типа адаптации в 54,5 % случаев и выраженным снижением социального статуса в первые 5 лет после начала заболевания (p<0,05). Таким образом, негативная симптоматика вносит весомый вклад в формирование неблагоприятных типов адаптации у пациентов с шизофренией.
С целью оценки влияния терапии традиционными антипсихотиками на активность каталазы и глюкозо-6-фосфатдегидрогеназы в эритроцитах крови, а также на содержание окисленного и восстановленного глутатиона в сыворотке крови проведено комплексное клиникобиохимическое обследование 32 больных шизофренией (параноидная шизофрения – F20.0, резидуальная шизофрения – F20.5, простая шизофрения – F20.6). Средний возраст пациентов 31±10 лет; средняя продолжительность заболевания 8±7 лет. Все пациенты получали терапию традиционными антипсихотиками в виде монотерапии или их комбинаций: галоперидол, хлор-протиксен, хлорпромазин, трифлуоперазин. Каждый пациент в динамике фармакотерапии обследовался по психометрическим шкалам PANSS и CGI. Контрольную группу составили 54 здоровых лица, сопоставимые по полу и возрасту (средний возраст 32,6±2,16 года).
Лабораторное обследование проводилось в двух точках: при поступлении в клинику до начала ПФТ и через 5—6 недель антипсихотической терапии. Активность глюкозо-6-фосфат-дегидрогеназы (Г6ФД) и каталазы в эритроцитах определяли спектрофотометрически. Содержание белка в исследуемом образце определяли по методу Лоури. Концентрацию восстановленного (GSH) и окисленного (GSSG) глутатиона в сыворотке крови определяли на спектрофлуо-риметре Varion (США) при Еm (длина волны испускания) 420 нм и Еx (длина волны возбуждения) 350 нм. Результаты выражали в мкг глутатиона на 1 мл сыворотки.
У больных шизофренией при поступлении в клинику на фоне выраженной симптоматики была отмечена достоверно сниженная активность Г6ФД (2,06±0,2 U/мг белка) по сравнению со здоровыми лицами (4,08±0,5 U/мг белка, р<0,05). После 6-недельной терапии у пациентов наблюдалось дальнейшее снижение активности фермента. Активность каталазы в эритроцитах пациентов (90,16±2,3 U/мг белка) была достоверно выше по сравнению с контрольной группой (58,65±2 U/мг белка, р<0,05). Терапия типичными нейролептиками приводила к нормализации этого показателя.
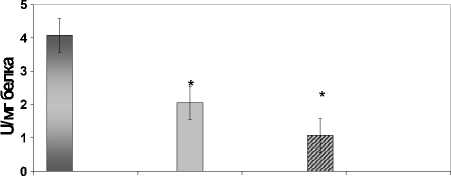
[□ Контроль □ пациенты до терапии a пациенты после терапии
Рис. 1 . Активность глюкозо-6-фосфатдегидрогеназы в эритроцитах больных шизофренией в динамике фармакотерапии и в эритроцитах здоровых лиц.
Примечание . U=мкмоль НАДФ /мин; * – уровень значимости достоверных различий по сравнению с контрольной группой (p<0,05)
В группе пациентов до терапии типичными антипсихотиками содержание восстановленного глутатиона снижено по сравнению с контрольной группой (298,54±41,02 мкг/мл, 394,23±80,2 мкг/мл; p<0,05). На фоне лечения типичными препаратами наблюдается дальнейшее снижение содержания GSH. Содержание окисленного глутатиона не отличается от значений в контрольной группе и не изменяется достоверно в динамике терапии.
Проведенное исследование показало, что терапия типичными антипсихотиками оказывает выраженное, но неоднозначное влияние на активность ферментов, в том числе и на антиоксидантную систему эритроцитов больных шизофренией. В динамике терапии на фоне нормализации активности каталазы продолжает снижаться активность глюкозо-6-фосфат-дегидрогеназы в сравнении с контролем и значениями пациентов до терапии, усугубляя тем самым существующий при шизофрении дисбаланс метаболических процессов. Так же показано, что у больных шизофренией достоверно снижен уровень восстановленого глутатиона – значимого компонента неферментативной антиоксидантной защиты.
Терапия типичными антипсихотиками приводит к его дальнейшему снижению, усугубляя тем самым существующий при шизофрении дисбаланс свободнорадикальных процессов.
Снижение концентрации восстановленного глутатиона у больных шизофренией, вероятно, патогенетически обусловлено и зависит от уменьшения способности организма больных к синтезу восстановленной формы глутатиона.
С целью разработки модели прогноза неблагоприятного варианта адаптации, обусловленного резистентностью к психофармакотерапии, с использованием клинических и иммунобиологических критериев проведен дискриминантный анализ межгрупповых различий клинических и иммунобиологических показателей в группах резистентных (1-я группа – 167 пациентов) и чувствительных к ПФТ больных (2-я группа – 129 человек). Всего проанализировано 18 клинических и 41 иммунобиологических показателей. Отобраны показатели, подчиняющиеся нормальному закону распределения либо близкие к нормальному распределению. Для каждой группы выделены дискриминантные функции, стандартизованные коэффициенты дискриминантной функции, отражающие вклад клинических и иммунобиологических параметров в разделение групп.
В модель вошли следующие клинические переменные: давность заболевания (в 1-й группе 1–5 лет, в 2-й группе 6–10 лет; F=2,32297, p=0,013); частота поступлений в стационар (в 1-й группе чаще 1 раза в год, в 2-й группе реже 1 раза в год; F=15,35096, p=0,0001); преобладание позитивной симптоматики в 1-й группе пациентов (F=17,48628, p=0,00004); преобладание эпизодического течения с нарастающим дефектом в 1-й группе и эпизодического течения со стабильным дефектом во 2-й группе (F=11,41237, p=0,0008); вид базовой терапии и её интенсивность – преимущественное лечение пациентов с терапевтической резистентностью высокими дозами типичных нейролептиков (F=8,76187, p=0,0033); сопутствующая соматическая патология в анамнезе у пациентов 1-й группы (F=7,00035, p=0,0086).
Иммунобиологические переменные составили: достоверное снижение в 1-й группе больных по сравнению со 2-й группой общего количества лимфоцитов (F=2,40819, p=0,0122); CD8+-лимфоцитов (F=26,23185, p=0,0001); HLADR+-лимфоцитов (F=9,13194, p=0,0027); повышение ИРИ CD4/CD8 (F=2,72254, p=0,0999); CD16+-лимфоцитов (F=3,90225, p=0,0491); фагоцитарной (F=51,13075, p=0,00001) и кислородзависи-мой бактерицидной активности нейтрофилов (НСТ стимулированный, F=13,11076, p=0,0003); концентрации IgM (F=2,34323, p=0,0127); стимулированного варианта НСТ (F=13,11076, p=0,0003); митогениндуцированной продукции IL-4 (F=52,79366, p=0,00001) и TNFα (F=28,76253, p=0,00001); повышение уровней трансаминаз АСТ и АЛТ в сыворотке крови (F=3,47208, p=0,0633 и F=4,28325, p=0,0393).
Процедура переклассификации (оценка «качества работы» дискриминантных функций) выявила высокую точность классификации в группах резистентных и чувствительных к ПФТ больных шизофренией – 87,16 % (p<0,001). При этом терапевтическая резистентность правильно классифицируется в 92,72 % случаев, отсутствие резистентности – в 81,38 %. Случаи несовпадения при отнесении пациента к группе резистентных или чувствительных больных, разделенных на основе клинических и биологических критериев (11 лиц из группы терапевтически резистентных больных отнесены в группу чувствительных, а 27 пациентов из группы чувствительных больных – в группу резистентных) могут быть связаны со сложностями распознавания клинических синдромов и симптомов шизофрении в связи с их нивелированием под влиянием применяемой ПФТ.
Выявленный нами в результате дискриминантного анализа комплекс биологических параметров в совокупности с клиническими характеристиками позволяет с высокой точностью дифференцировать характер ответа пациента (уровень, степень чувствительности) на терапию и прогнозировать формирование резистентности к психофармакологическим препаратам. При выборе оптимального способа лечения больных эндогенными расстройствами необходимо принимать во внимание выявленные устойчивые типологические характеристики пациентов (давность и тип течения заболевания, частоту поступлений, преобладание продуктивной или негативной симптоматики, наличие сопутствующей соматической патологии), а также вариабельные факторы (вид и интенсивность используемой базисной терапии, индивидуальные характеристики состояния иммунной системы), вносящие существенный вклад в формирование терапевтической резистентности.
В целом на основе анализа особенностей пси-хонейроиммуномодуляции в группах резистентных и чувствительных к ПФТ пациентов разработан комплекс клинических и иммунобиологических критериев, позволяющий с высокой точностью (87,16 %) и с высокой степенью достоверности (p<0,001) прогнозировать вероятность формирования у пациента неблагоприятного варианта адаптации, обусловленного резистентностью к ПФТ. Предложенный комплекс позволяет своевременно вносить коррективы в терапевтическую тактику, назначать дифференцированную терапию с возможным включением иммуноактивных препаратов, оптимизирующих нейроиммунное взаимодействие и повышающих адаптационные возможности больных.
Выводы. Таким образом, на основе клиникоэпидемиологического анализа структуры стационарной когорты психически больных показана большая распространенность больных ши- зофренией, нуждающихся в стационарном лечении, в том числе повторно, что является свидетельством тяжести данного заболевания. Многолетние показатели высокого уровня инвалидизации данной когорты больных указывают на необходимость определения вклада внешних и внутренних факторов в клиникодинамические показатели заболевания и прогностические критерии эффективности лечебно-реабилитационных мероприятий. Выявлены критерии (клинико-антропометрические, клинико-иммунологические и биохимические) персонифицированного подхода к назначению антипсихотиков и их вклада в формирование неблагоприятных типов адаптации у пациентов с шизофренией. Полученные результаты вносят вклад в выявление факторов прогноза течения шизофрении и позволяют повысить эффективность реабилитационных мероприятий этой тяжелой группе больных.
Список литературы Клинические, эпидемиологические и биологические предпосылки адаптации больных шизофренией как основа персонифицированного подхода к антипсихотической терапии
- Шмуклер А. Б. Проблема шизофрении в современных исследованиях: достижения и дискуссионные вопросы. -М., 2011. -84 с.
- Chen Y. H., Lee H. C., Lin H. C. Prevalence and risk of atopic disorders among schizophrenia patients: a nationwide population based study//Schizophr. Res. -2009. -V. 108. -P. 191-196.
- Психиатрия: национальное руководство/под ред. Т. Б. Дмитриевой и др. -М., 2009. -1000 с.
- Гурович И. Я., Голланд В. Б., Зайченко Н. М. Динамика показателей деятельности психиатрической службы России (1994-1999 гг.). -М.: Медпрактика, 2000. -506 с.
- Lin H. C., Huang C. C., Chen S. F. et al. Increased Risk of Avoidable Hospitalization Among Patients With Schizophrenia//Can. J. Psychiatry. -2011. -V. 56, № 3. -P. 171-178.
- Бохан Н. А., Семке В. Я. Психиатрическая наука в Сибири: итоги и перспективы//Сибирский вестник психиатрии и наркологии. -1998. -№ 4. -С. 48.
- Kobayashi T., Kato S. Psychopathology and outcome of first-admission schizophrenic patients: hypochondriac-cenestopathic symptoms as predictors of an unfavorable outcome//Psychiat. Clin. Neurosci. -2004. -V. 58, № 5. -P. 567-572.
- Kornetov A. Old age psychiatry: training in Siberia//Mental Health Reforms. -2002. -V. 7, № 2. -P. 7-8.
- Красильников Г. Т., Дресвянников В. Л., Бохан Н. А. Коморбидные аддиктивные расстройства у больных шизофренией//Наркология. -2002. -№ 6.-С. 24-31.
- Семке А. В., Ветлугина Т. П., Иванова С. А., Рахмазова Л. Д., Корнетова Е. Г., Федоренко О. Ю., Лобачева О. А. Биологические и клинико-социальные механизмы развития эндогенных психических заболеваний//Сибирский вестник психиатрии и наркологии. -2011. -№ 4. -С. 19-23.
- Бойко А. С., Федоренко О. Ю., Серебров В. Ю., Семке А. В., Иванова С. А. Кортизол и антитела к ДНК у больных шизофренией на фоне антипсихотической терапии//Успехи современного естествознания. -2013. -№ 9. -С. 22-24.
- Смирнова Л. П., Кротенко Н. В., Кротенко Н. М., Логинов В. Н., Духан М. В., Иванова С. А., Мальцева Ю. Л. Активность антиоксидантных ферментов в эритроцитах больных психическими и неврологическими расстройствами//Сибирский вестник психиатрии и наркологии. -2008. -№ 1. -С. 133-135.
- Иванова С. А., Федоренко О. Ю., Смирнова Л. П., Семке А. В. Поиск биомаркеров и разработка фармакогенетических подходов к персонализированной терапии больных шизофренией//Сибирский вестник психиатрии и наркологии. -2013. -№ 1. -С. 12-17.
- Рязанцева Н. В., Новицкий В. В., Прокопьева В. Д., Степовая Е. А., Баскаков М. Б. Структурные особенности мембран эритроцитов у больных шизофренией//Бюллетень экспериментальной биологии и медицины. -2001. -№ S1. -С. 81-84.
- Иванова С. А., Смирнова Л. П., Щигорева Ю. Г., Бойко A. С., Семке А. В., Узбеков М. Г., Бохан Н. А. Активность глюкозо-6-фосфатдегидрогеназы и каталазы в эритроцитах больных шизофренией в динамике фармакотерапии традиционными антипсихотиками//Нейрохимия. -2014. -Т. 31, № 1. -С. 79-83.
- Узбеков М. Г., Мисионжник Э. Ю., Шмуклер А. Б., Гурович И. Я., Гоызунов Ю. А., Смолина Н. В., Калинина B. В., Соколова Т. Н., Москвитина Т. А., Шевченко В. А. Активность моноаминоксидазы и показателей эндогенной интоксикации у больных с первым эпизодом шизофрении//Журнал неврологии и психиатрии. -2009. -Т. 109, вып. 5. -С. 48-52.
- Al Hadithy A. F., Ivanova S., Pechlivanoglou P., Wilffert B., Semke A., Fedorenko O., Kornetova E., Ryadovaya L., Brouwers J. R., Loonen A. J. Missense polymorphisms in three oxidative-stress enzymes (GSTP1, SOD2 and GPX1) and dyskinesias in Russian psychiatric inpatients from Siberia//Hum. Psychopharmacol. -2010. -V. 25, № 1. -P. 84-91.
- Gu F., Chauhan V., Chauhan A. Glutathione redox imbalance in brain disorders//Curr. Opin. Clin. Nutr. Metab. Care. -2015. -V. 18, № 1. -P. 89-95.
- Ivanova S. A., Loonen A. J., Pechlivanoglou P., Freidin M. B., Al Hadithy A. F., Rudikov E. V., Zhukova I. A., Govorin N. V., Sorokina V. A., Fedorenko O. Y., Alifirova V. M., Semke A. V., Brouwers J. R., Wilffert B. NMDA receptor genotypes associated with the vulnerability to develop dyskinesia//Transl. Psychiatry. -2012. -Vol. 2. -P. e67.
- Tsai M. C., Liou C. W., Lin T. K., Lin I. M., Huang T. L. Changes in oxidative stress markers in patients with schizophrenia: the effect of antipsychotic drugs//Psychiatry Res. -2013. -V. 209, № 3. -P. 284-290.
- Fedorenko O., Tang C., Sopjani M., Föller M., Gehring E.-M., Strutz-Seebohm N., Ureche O. N., Lang F., Seebohm G., Ivanova S., Semke A., Lang U. E. PIP5K2A-dependent regulation of excitatory amino acid transporter EAAT3//Psychopharmacology. -2009. -V. 206. -P. 429-435.
- Fedorenko O. Y., Loonen A. J., Lang F., Toshchakova V. A., Boyarko E. G., Semke A. V., Bokhan N. A., Govorin N. V., Aftanas L. I., Ivanova S. A. Association study indicates a protective role of phosphatidylinositol-4-phosphate-5-kinase against tardive dyskinesia//Int. J. Neuropsychopharmacol. -2014. -Dec. -V. 18 (6).
- Na K. S., Kim Y. K. Monocytic, Th1 and Th2 cytokine alterations in the pathophysiology of schizophrenia//Neuropsychobiology. -2007. -V. 56, № 2-3. -P. 55-63.
- Watanabe Y., Someya T., Nawa H. Cytokine hypothesis of schizophreniapathogenesis: evidence from human studies and animal models//Psychiatry Clin. Neurosci. -2010. -V. 64, № 3. -P. 217-230.
- Drexhage R. C., Weigelt K., van Beveren N. et al. Immune and neuroimmune alterations in mood disorders and schizophrenia//Int. Rev. Neurobiol. -2011. -V. 101. -P. 169-201.
- Müller N., Wagner J. K., Krause D., Weidinger E., Wildenauer A., Obermeier M., Dehning S., Gruber R., Schwarz M. J. Impaired monocyte activation in schizophrenia//Psychiatry Res. -2012. -V. 198, № 3. -P. 341 -346.
- Цыганков Б. Д., Агасарян Э. Г. Анализ эффективности и безопасности современных и классических антипсихотических препаратов//Журн. неврологии и психиатрии. -2010. -Вып. 9. -С. 64-70.
- Корнетова Е. Г., Бойко А. С., Бородюк Ю. Н., Семке А. В. Тардивная дискинезия у больных шизофренией: клиника и факторы риска. -Томск: Изд-во ООО «Интегральный переплет», 2014. -106 с.
- Ветлугина Т. П., Лобачева О. А., Найденова Н. Н., Семке А. В. Клинико-динамические аспекты психонейроиммунологии (на модели шизофрении)//Патофизиология психических расстройств. -Томск: Изд-во ГУ НИИ ПЗ ТНЦ СО РАМН, 2006. -С. 143-154.
- Ветлугина Т. П., Невидимова Т. И., Лобачева О. А., Никитина В. Б. Технология иммунокоррекции при психических расстройствах. -Томск: Изд-во Том. ун-та, 2010. -172 с.
- Лобачева О. А., Найденова Н. Н., Ветлугина Т. П. Цитокины при шизофрении//Патогенез. -2006. -Т. 4, № 1. -С. 59-60.


