Клинический случай лечения пациента с локальным поздним рецидивом фолликулярной лимфомы – узловым поражением мягких тканей левой щеки
Автор: Петровский В.Ю., Ивашин А.В., Дыкина А.В., Соловьева С.В., Гурбатова М.Д., Измайлов Т.Р.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клинические наблюдения
Статья в выпуске: 1 т.21, 2021 года.
Бесплатный доступ
Приведен клинический случай пациента с локальным поздним рецидивом фолликулярной лимфомы IV стадии с поражением мягких тканей левой щеки. Рецидив зарегистрирован после радиологического лечения по радикальной программе с хорошими непосредственными результатами. Вопрос лечения пациентов с данной патологией имеет большое значение, так как на сегодняшний день не существует единых стандартов лечения при рецидивах заболевания.
Фолликулярная лимфома, рецидив, конформная лучевая терапия
Короткий адрес: https://sciup.org/149132164
IDR: 149132164
Текст научной статьи Клинический случай лечения пациента с локальным поздним рецидивом фолликулярной лимфомы – узловым поражением мягких тканей левой щеки
Наиболее распространенным вариантом индолентных лимфом является фолликулярная лимфома (ФЛ), которая занимает второе место в мире по частоте встречаемости после диффузной В-клеточной крупноклеточной лимфомы (ДВККЛ) и составляет в среднем 20–30% всех лимфопролиферативных заболеваний. Этот показатель значительно варьирует в различных географических регионах, а также зависит от этнической и расовой принадлежности пациентов, например, в азиатских странах доля ФЛ в структуре лимфопролиферативных заболеваний существенно ниже, чем в Европе и составляет 9–10%. По данным литературы в западных странах заболеваемость ФЛ равна 5–7 случаев на 100 тыс.
населения. В США ежегодно этот диагноз устанавливается у 14 тыс. человек. Заболеваемость ФЛ увеличивается с возрастом. Средний возраст заболевших составляет 60 лет, при этом заболеваемость среди лиц моложе 30 лет низкая, а возникновение ФЛ у детей является редкостью. Женщины заболевают несколько чаще и соотношение заболеваемости ФЛ мужчины/женщины равно 1:1,7 [1–3]. Морфологически выделяют три типа фолликулярной НХЛ: I тип – опухоль состоит преимущественно из мелких клеток (количество центробластов менее 5 в поле зрения); II тип – смешанное представительство мелких и крупных клеток (6–15 центробластов в поле зрения), III тип – преобладание в опухолевой ткани крупных клеток (>15 центробластов в поле зрения). В настоящее время ВОЗ не рекомендует различать тип I и II (наиболее часто встречаемые типы, содержащие до 15 центробластов на поле). Кроме того, ФЛ III типа с диффузным ростом, содержащим > 15 центробластов на поле с большим увеличением, следует классифицировать как ДВККЛ в соответствии с системой ВОЗ [1]. При установлении диагноза следует учитывать наличие четырех вариантов ФЛ (ВОЗ 2016):
-
1. Фолликулярная неоплазия in situ
-
2. Дуоденальный тип ФЛ
-
3. ФЛ яичек
-
4. Диффузный вариант ФЛ
Стадирование ФЛ проводится в соответствии с критериями классификации Аnn Arbor, модификация Лугано от 2014 г. (Таблица 1).
Таблица 1. Стадирование лимфом по Ann Arbor, модификация Лугано (2014 год)
|
Стадии |
Поражения лимфатических узлов |
Экстранодальное поражение |
|
I |
вовлечение одного или одной группы лимфатических узлов |
локализованное поражение одного экстралимфатического органа или ткани без поражения лимфатических узлов |
|
II |
вовлечение двух и более лимфатических узлов по одну сторону диафрагмы. Стадия II bulky-стадия II с массивным поражением лимфатических узлов |
локализованное поражеиие экстралимфатического органа или ткани + поражение регионарных лимфатических узлов по одну сторону диафрагмы |
|
III |
вовлечение лимфатических узлов по обе стороны диафрагмы или вовлечение лимфатических узлов выше диафрагмы с поражением селезенки |
|
|
IV |
диффузное или диссеминированное поражение экстралимфатического органа или ткани с/без вовлеченных лимфатических узлов либо поражение экстранодального органа или ткани + поражение не регионарных лимфатических узлов |
|
Примечание: миндалины, кольцо Вальдейера, селезенка относятся к нодальным образованиям.
Правильному стадированию в последние годы помогает позитронно-эмиссионная томография/компьютерная томография (ПЭТ/КТ). Использованию ПЭТ/КТ при первоначальном диагнозе и рецидиве ФЛ посвящено много литературы. Несмотря на погрешности, применение ПЭТ/КТ в клинической практике сохраняет высокую прогностическую ценность при ФЛ [5, 6]. Ведущим методом лечения ФЛ является химиотерапия. Новая эра лечения ФЛ наступила с введением ритуксимаба вхимиотерапевтический протокол, 5-летняя выживаемость пациентов увеличилась с 70% до 88,4%. Пациенты с рецидивом ФЛ имеют широкий спектр вариантов лечения, включая несколько режимов химиоиммунотерапии с использованием ингибиторов фосфоинозитид-3-киназы и леналидомида в сочетании с ритуксимабом. Несмотря на терапевтические достижения, все чаще признается неоднородность клинического течения ФЛ. Для анализа индивидуального риска раннего прогрессирования используются два варианта
Международного прогностического индекса ФЛ FLIPI и FLIPI-2 (Follicular Lymphoma International Prognostic Index) (Таблица 2). К группе низкого риска относятся пациенты с 0 – 1 фактором, промежуточного риска – с двумя факторами, высокого риска – 3 – 5 факторами риска [1, 4].
Таблица 2. Прогностические индексы FLIPI и FLIPI-2
|
Параметры |
Факторы риска FLIPI |
Факторы риска FLIPI-2 |
|
зона поражения |
более 4 зон |
максимальный размер более 6 см |
|
возраст |
старше 60 лет |
старше 60 лет |
|
биохимические маркеры |
повышение ЛДГ |
повышение B 2 - микроглобулина |
|
стадия |
III–IV |
поражение костного мозга |
|
уровень гемоглобина |
ниже 12 г/дл |
ниже 12 г/дл |
Рецидивы при ФЛ неизбежны, причем каждая последующая ремиссия бывает короче предыдущей. При рецидиве желательно выполнение повторной биопсии, поскольку известно, чем длительнее наблюдение за больным, тем выше риск трансформации ФЛ в диффузную В-крупноклеточную лимфому: 15% при 10-летнем и 26% при 14-летнем наблюдении. Как при первичном обращении, так и при рецидиве больной может не нуждаться в немедленном лечении, если на это нет оснований [4]. Выбор тактики лечения рецидива зависит от множества факторов, однако решающими все же являются длительность предшествующей ремиссии и метод ее достижения. Прогноз на длительную выживаемость больных, у которых было прогрессирование или рецидив ФЛ в течение 24 месяцев от начала лечения крайне неблагоприятный – пятилетняя общая выживаемость (OS) в этой подгруппе не превышает 50%. Одним из ведущих методов лечения ФС при рецидиве является лучевая терапия. Лучевая терапия – высокоэффективный метод лечения больных с небольшой опухолевой нагрузкой и при локальных стадиях ФЛ. Для определения объема опухоли (опухолевой нагрузки) и показаний к началу лечения наиболее полезными представляются критерии французской группы по изучению ФЛ (Groupe d’Etudedes Lymphomes Folliculaire – GELF) и Британской национальной группы по исследованию лимфом (British National Lymphoma Investigators – BNLI). Опухолевая нагрузка считается низкой при отсутствии следующих 4 групп признаков: 1) признаки, связанные с опухолью – лимфатические узлы или узлы опухолевой массы > 3 см в 3 различных зонах, симптомы сдавления органов, плеврит, асцит, спленомегалия, поражение печени, почек, костей; 2) признаки биологические – повышение уровня сывороточного ЛДГ и/или 2-микроглобулина, цитопении, связанные с выраженной инфильтрацией костного мозга (лейкоциты < 100 х 109 /л и/или тромбоциты < 100 х 109 /л); 3) признаки, характеризующие состояние больного - симптомы интоксикации (лихорадка, потливость, потеря веса), соматический статус по ECOG > 2; 4) признаки, отражающие течение болезни – генерализованное прогрессирование заболевания за последние 3 месяца [1, 3, 7]. Выбор оптимальной лечебной тактики у пациентов с рецидивом/прогрессированием ФЛ зависит от сроков развития рецидива/прогрессирования по отношению к ранее проведенному лечению, варианта ранее проведенного лечения, клинической манифестации рецидива/прогрессирования, возраста и соматического состояния пациента, наличия или отсутствия признаков рефрактерности к ритуксимабу [8]. Пациентам с химиорезистентным локальным рецидивом ФЛ рекомендовано применение лучевой терапии в низких суммарных дозах с использованием крупных фракций – РОД 4 Гр однократно или РОД 2 Гр х 2 фракции с паллиативной целью [9, 10]. Как и при первичном обращении, в период рецидива пациенту может быть предложена выжидательная тактика, и начало лечения может быть отложено c учетом прогностических факторов, которые были перечислены выше. Тактика лечения рецидивов зависит от многих факторов, однако решающими все же являются: длительность предшествующей ремиссии и метод ее достижения. Например, прогноз на повторную длительную выживаемость пациентов с прогрессированием ФЛ на фоне наблюдения без противоопухолевой терапии или пациентов с рецидивами менее чем 6 месяцев после завершения иммунохимиотерапии принципиально различаются. OS напрямую зависит от периода наступления прогрессирования заболевания. Планирование дистанционной лучевой терапии осуществляется с помощью методов визуализации, позволяющих получать трехмерные изображения. Лечение целесообразно осуществлять на линейном ускорителе электронов с использованием стандартного фракционирования дозы (одна фракция в день, 5 раз в неделю), разовая очаговая доза (РОД) 1,8–2,0 Гр, суммарная очаговая доза (СОД) составляет 24–30 Гр на зоны поражения. При отсутствии полной регрессии опухоли может быть использовано дополнительно локальное облучение (“буст”) в СОД 6–10 Гр [1]. Локализованная ФЛ традиционно считалась «излечимой» с применением локальной лучевой терапии. Одним из первых исследований, в которых упоминается "излечимость", стала серия работ Mac Manus M.P. и Hoppe R.T. из Стэнфорда, опубликованная еще в 1996 году [11]. Seymour J. с соавторами обобщили результаты эффективности лучевой терапии 6568 больных с I–II стадией ФЛ. Целью исследования была оценка эффективности лучевой терапии в первой линии. Оказалось, что 10- и 20-летняя ОS при I и II стадиях составила 62% и 35%, соответственно, для получавших лучевую терапию, против 48% и 23% в группе без облучения (p < 0,0001). Однако, если обобщить мировой опыт, только 20–30 % больных с локальными стадиями получают лучевую терапию. Было предпринято несколько попыток комбинировать лучевую терапию с другими методами. Оказалось, что добавление химиотерапии к облучению не улучшает показателей выживаемости больных за счет высокой частоты поздних осложнений [12]. Более того, согласно материалам Стэнфордского университета [13], отдаленные результаты комбинированного лечения вполне сопоставимы не только с данными больных, получавших лучевую терапию, но и с группой пациентов, которые только наблюдались.
Oliver J. Ott с соавторами провели ретроспективный анализ пролеченных 58 пациентов (средний период наблюдения 8,75 г.), из них 48 пациентов (83%) с ФЛ (I стадия – 23 пациента, II стадия– 15 пациентов и III стадия – 10 пациентов). Средний возраст составил 51 год. Облучение было применено со средней общей дозой 40 Гр, 13 пациентов (22%) дополнительно получили химиотерапию. Через 6 недель после лечения у 91% пациентов имелся полный ответ, у 7% – частичный ответ. Прогрессирование заболевания отмечено у одного пациента. Пяти- и 10-летняя OS составили 86% и 69%, соответственно. Что касается OS, то многовариантный анализ определил возраст (р=0,001) как независимый прогностический фактор. В подгруппе пациентов с ФЛ у 92% была зарегистрирована полная ремиссия, у 6% – частичная ремиссия, и у одного пациента (2%) наблюдалось прогрессирование заболевания. 5- и 10-летняя OS составили 87% и 70%, соответственно. Частота рецидивов вне поля облучения для всех 58 пациентов составила 34%. Представленные результаты, по мнению авторов, свидетельствуют в пользу лучевой терапии при лечении ФЛ ранних стадий, особенно у молодых пациентов [14].
-
K. Fakhrian с соавторами сообщили о лечении лучевой терапией 50 пациентов I–III стадиями ФЛ. Общая доза лучевой терапии колебалась от 26 до 56 Гр (медиана 40 Гр) с ежедневными фракциями 1,2–2,5 Гр, полная и частичная регрессия наблюдалась у 76% и 20% пациентов, соответственно, медиана ОS и бессобытийная выживаемость (EFS) составили 18 лет (95% доверительный интервал (ДИ) 10–26 лет) и 7 лет (6–8 лет), соответственно. Двух-, 5- и 10-летняя ОS были 96 ± 3%, 90 ± 5% и 70 ± 9%, соответственно; 2-, 5-, и 10-летняя EFS – 90 ± 5%, 70 ± 7%, и 38 ± 9%, соответственно. Лечение с размером очага ФЛ < 5 см (р = 0,039) и полная ремиссия после лучевой терапии (р = 0,021) были статистически достоверно связаны с лучшей OS [15].
Laila König с соавторами провели анализ лечения 47 пациентов (средний возраст 64 г.) с 50 поражениями, которым проводилась лучевая терапия и при рецидивирующем заболевании, в т.ч. включались ФЛ (57%). Средний срок наблюдения составил 21 месяц. 84% поражений были экстранодальными (32% орбиты, 14% слюнных желез, 30% кожи и 8%
– другие локализации). Большинство поражений были ≤ 5 см (90%). 26% пациентов получали одновременно ритуксимаб с лучевой терапией. Общие ответы (ORR) составили 90% (все поражения), 93,3% (первичное лечение) и 85% (лечение рецидивов) при р=0,341. Двухлетняя OS составила 91,1% при р=0,522. Прогностическим фактором для выживаемости отмечен размер опухоли ≤ 5 см (р=0,003) [16].
В исследовании J.L. Brady проанализировано лечение 512 пациентов, средний возраст составил 58 лет (диапазон, 20 – 90 лет), у 410 пациентов (80,1%) была болезнь I стадии, средняя доза лучевой терапии составила 30 Гр (24 – 52Гр), медиана наблюдения – 52 месяца (3,2–174,6), 5-летняя OS – 95,7% [17].
Michael Oertel с соавторами ретроспективно проанализировали лечение 26 пациентов с 44 очагами, из них семь пациентов (16%) лечились низкими дозами (LDRT) (4Гр) и 37 (84%) с обычной дозой лучевой терапии ≥24 Гр, средняя доза составила 40 Гр. Средняя продолжительность наблюдений была 76 месяцев. Были получены следующие показатели лечения: ORR – 91% , полная ремиссия (CRR) – 75%, 5-летний локальный контроль (LCR) – 88%, 10-летний LCR – 84%. Показатели ответов были значительно выше после обычной лучевой терапии (ORR: 92% против 86%; CRR: 84% против 29%; р= 0,007). С точки зрения дозы облучения, частота рецидивов в области полей облучения (14% против 11%, P= 0,4) и 5 лет LCR (86% против 90%, P=0,4) были сопоставимы в группах при LDRT и обычной лучевой терапии. Во время проведения лучевой терапии около двух третей пациентов испытывали легкую токсичность, с I и II степенями острой токсичности были 61% и 9% пациентов, соответственно. После LDRT показатели токсичности I и II степени были ниже (р=0,004). Таким образом, долгосрочный анализ подтверждает высокую эффективность лучевой терапии при лимфомах. Концепция LDRT с 4 Гр была связана с сопоставимым LCR и снижением выраженности острой токсичности. Тем не менее, показатели ответов на лечение были значительно ниже для этой группы, и поэтому LDRT не может быть рекомендована в качестве стандартного лечения [18].
В одном из последних исследований G. Pedro Mauro c соавторми (2021 г.) были проанализированы результаты лечения 34 больных с ФЛ, получавших лучевую терапию (у более 2/3 пациентов СОД составила 30–36 Гр). Острые реакции 0 – 1 степени отмечались у 76,4%, OS и выживаемость без прогрессии были 48,7 и 33,6 месяца, соответственно, 2- и 3-летная OS составили 94,1% и 91,2% соответственно. Авторы отмечают, что ФЛ является индолентным заболеванием, при этом наблюдаются хорошие результаты для пациентов, пролеченных лучевой терапией с низким уровнем трансформации и низкой частотой рецидивов, и делается заключение, что лучевая терапия является важной частью лечения этих пациентов [19].
Таким образом можно отметить, что на текущий момент по данным отечественной и мировой литературы при рецидиве ФЛ возможно применение химиотерапии и (или) лучевой терапии, но нет единых критериев использования данных методов лечения. По нашему мнению, использование лучевой терапии в качестве самостоятельного радикального курса лечения у данной группы больных с низкой опухолевой нагрузкой возможно с учетом низкой токсичности данного метода и высокой эффективности по данным литературы. Клиническое наблюдение
Пациент А., 1961 г. р. У пациента установлена в 2011 году фолликулярная лимфома IV стадии с множественным поражением легких, периферической и висцеральной лимфаденопатией в средостении и брюшной полости, поражением костного мозга. Проведено 6 курсов химиотерапии по схеме R-CHOP, далее 3 курса монотерапии ритуксимабом. Достигнута полная ремиссия. При дальнейших контрольных обследованиях данных за прогрессирования заболевания не было. По данным контрольной ПЭТ-КТ от 12.04.2020 г. – данных о наличии активной специфической ткани получено не было. По поводу появившегося образования в области левой щеки в начале августа 2020 г. пациент был направлен к челюстно-лицевому хирургу. Выполнена биопсия данного образования.
При гистологическом исследовании и ИГХ – фолликулярная лимфома, G I–II. По данным
ПЭТ-КТ от 08.09.2020 г. – узловое образование мягких тканей щеки слева 25 × 20 × 22 мм
(SUVmax-8.34) (Рис. 1–3).
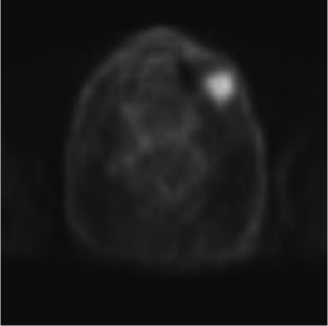
Рис 1. Накопление РФП при ПЭТ-КТ
На рисунках 2 и 3 показаны объемы поражения на сканах компьютерной томографии больного А. в двух плоскостях.
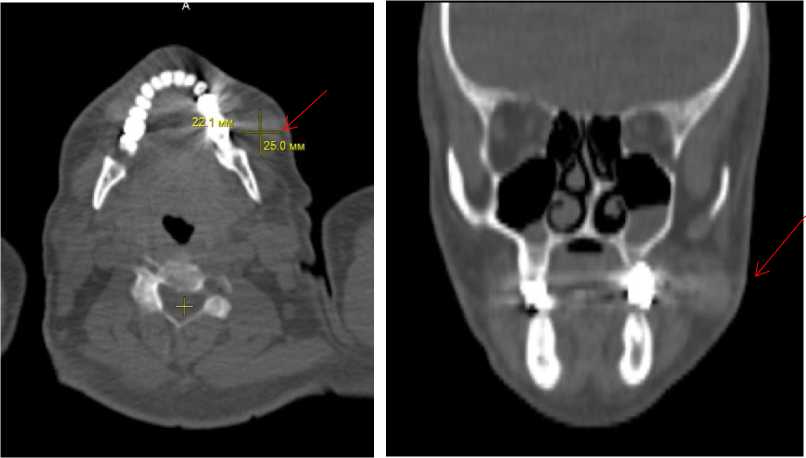
Рис 2. Компьютерная томография
Рис 3. Компьютерная томография
(сагиттальная плоскость)
(фронтальная плоскость)
По данным УЗИ-исследования – в мягких тканях левой щеки на глубине примерно 5,5 мм определяется гипоэхогенное образование с умеренно неровными, несколько нечеткими контурами, размерами 26×14 мм, однородной структуры (Рис. 4). Других очагов поражения не выявлено.
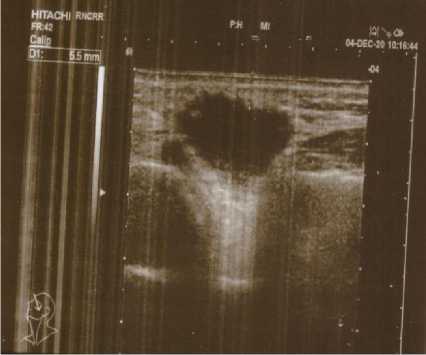
Рис 4. УЗИ мягких тканей левой щеки (до лечения)
Пациент проконсультирован гематологом – с учетом локального рецидива лимфомы проведение химиотерапии не целесообразно. Больной также проконсультирован врачом-радиотерапевтом. Рекомендовано провести курс конформной дистанционной лучевой терапии в режиме классического фракционирования с РОД 2 Гр 5 раз в неделю на аппарате ЛУЭ на зону локального рецидива – мягкие ткани щеки слева до СОД 36–40 Гр с учетом рецидивного характера болезни. С 23.11.2020 г. после предлучевой подготовки (МСКТ-топометрии в положении лечения, в фиксирующем устройстве, оконтуривания клинического объема облучения/органов риска, 3D-дозиметрического планирования, верификации дозиметрического плана с портальной визуализацией) начат курс в рамках 3D адаптивной конформной дистанционной лучевой терапии на аппарате ЛУЭ в режиме классического фракционирования в термофиксирующей маске на зону рецидива (щечная область слева) с РОД 2 Гр, с учетом методики, принятой в РНЦРР [20, 21]. Позиционирование пациента проводилась в соответствии с методикой, описанной Смысловым А.Ю. с соавторами [22]. По данным контрольного УЗИ-исследования (Рис. 5) после подведения СОД 20 Гр в мягких тканях левой щеки определялось гипоэхогенное образование с несколько неровными, нечеткими контурами, размерами 19 × 10 мм, однородной структуры. По сравнению с предыдущими данными отмечается уменьшение объема образования на 52% (с 19.05 см3 до 9.9 см3).
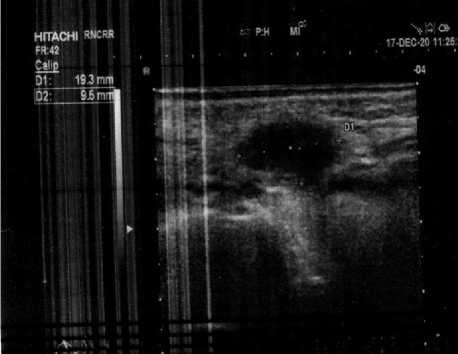
Рис 5. УЗИ мягких тканей левой щеки ( после СОД 20 Гр)
После контрольного УЗИ исследования мягких тканей щеки слева проведена ре- топометрия с ремоделированием фиксирующей термомаски с новым объемом и продолжена лучевая терапия в режиме классического фракционирования 5 раз в неделю на линейном ускорителе электронов (ЛУЭ) на зону рецидива с РОД 2 Гр до СОД 40 Гр. На Рис. 6 и 7
представлены изодозные кривые при планирования лучевой терапии с изначальным PTV1 и
PTV2 (рассчитанный после подведенной дозы 20 Гр и контрольного УЗИ с ре- планированием лучевой терапии) и гистограмма доза-объем (обобщенной для PTV1/PTV2).
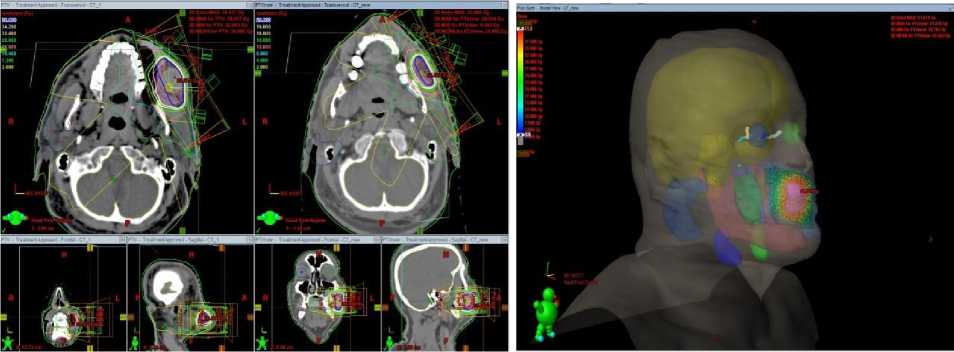
Рис.6. Дозиметрический план лучевого лечения
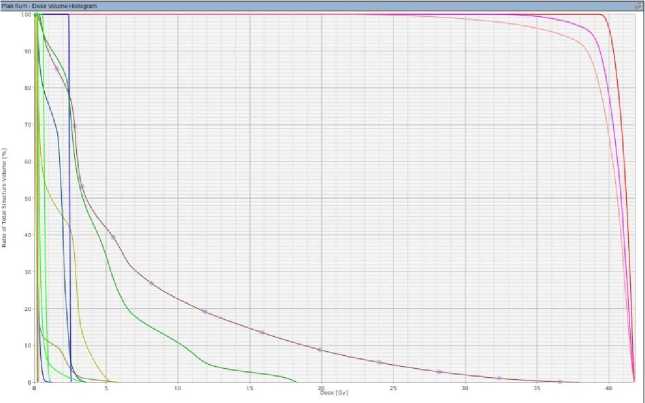
Рис.7. Гистограмма доза-объем для суммированного PTV
К концу лучевой терапии у пациента развились ранние лучевые реакции в виде лучевого мукозита в зоне облучения минимальной выраженности 1 степени по классификации RTOG. Лечение перенес относительно удовлетворительно, при выписке минимальные явления мукозита без отрицательной динамики, общий статус пациента 1 ст. по ECOG. По данным контрольного УЗИ щеки через 8 недель (Рис. 8) после завершения лучевой терапии – в мягких тканях левой щеки дополнительных образований не выявлено.
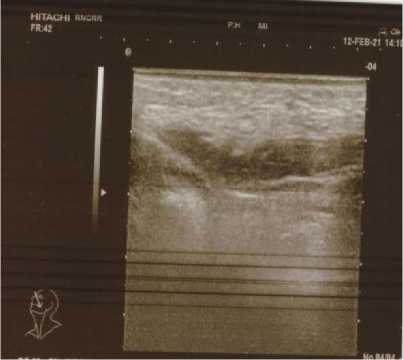
Рис. 8. Контрольное УЗИ мягких тканей щеки слева
Заключение
Рассмотренный клинический случай показывает, что возможно проведение лучевого лечения по радикальной программе у больных с локальным поздним рецидивом фолликулярной лимфомы G I–II после ранее проведенной полихимиотерапии по поводу первичного заболевания. Выбранный алгоритм лечения с применением современного радиологического режима облучения позволил получить хорошие непосредственные результаты лечения при минимальной лучевой токсичности и без ухудшения качества жизни пациента.
Список литературы Клинический случай лечения пациента с локальным поздним рецидивом фолликулярной лимфомы – узловым поражением мягких тканей левой щеки
- Бабичева Л.Г., Тумян Г.С., Кравченко С.К. и др. Фолликулярная лимфома. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Под ред. И.В. Поддубной, В.Г. Савченко. 2018. С.43-52.
- Демина Е.А. Тумян Г.С., Моисеева Т.Н. и др. Общие принципы диагностики лимфом. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Под редакцией Поддубной И.В., Савченко В.Г. 2018. С. 9-27.
- Armitage J.O. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma. Blood. 1997. V. 89. No. 11. P. 3909- 3918.
- Matasar M.J., Luminari S., Barr P.M. et al. Follicular Lymphoma: Recent and Emerging Therapies, Treatment Strategies, and Remaining Unmet Needs. Oncologist. 2019. V. 24. No. 11. P. e1236-e1250. doi: 10.1634/theoncologist.2019-0138.
- Бабичева Л. Г., Поддубная И. В. Роль ПЭТ в лечении В-клеточных лимфопролиферативных заболеваний в рутинной клинической практике в России. Злокачественные опухоли. 2020. Т. 10. № 2. С.53-58. doi: 10.18027 / 2224-5057-2020-10-2-5.
- Barrington S. F., Trotman J. The role of PET in the first-line treatment of the most common subtypes of non-Hodgkin lymphoma. Lancet Haematology. 2021. V. 8. No 1. P.80-93. doi.org/10.1016/S2352-3026(20)30365-3.
- Ghielmini M., Rule S., Salles G., et al. Newly diagnosed and relapsed follicular lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016. V. 27 (Suppl 5). P. v83-v90.
- Поддубная И.В. Рецидивы фолликулярной лимфомы: проблемы и пути решения. Современная онкология. 2011. Т. 1. С. 10-15.
- Zelenetz A.D., Gordon L.I., Abramson J.S., et al. NCCN Guidelines Insights: B-Cell Lymphomas, Version 3.2019. J Natl Compr Canc Netw. 2019. V. 17. No. 6. P. 650-661. doi: 10.6004/jnccn.2019.0029.
- GrignanoE., Deau-Fischer B., Loganadane G., et al. Radiotherapy of relapse-refractory follicular lymphoma. Сancer Radiother. 2018. V. 22. No. 2. P.126-130.
- Mac Manus M.P., Hoppe R.T. Is radiotherapy curative for stage I and II low-grade follicular lymphoma? Results of a long-term follow-up study of patients treated at Stanford University. J Clin Oncol. 1996. V. 14. No. 4. P.1282-1290.
- Seymour J.F., Pro B., Fuller L.M., et al. Long-Term Follow-Up of a Prospective Study of Combined Modality Therapy for Stage I-II Indolent Non-Hodgkin’s Lymphoma. J. Clin. Oncol. 2003. V. 21. No. 11. P. 2115-2122.
- Petersen P.M., Gospodarowicz M., Tsang R., et al. Long-term outcome in stage I and II follicular lymphoma following treatment with involved field radiation therapy alone. J Clin Oncol. 2004. V. 22. Suppl. 14. Poster 6521.
- Ott O.J., Rödel C., Gramatzki M., et al. Radiotherapy for stage I-III nodal low-grade non-Hodgkin's lymphoma. Strahlenther Onkol. 2003. V. 179. No. 10. P. 694-701. doi: 10.1007/s00066-003-1062-8.
- Fakhrian K., Klemm S., Keller U., et al. Radiotherapy in stage I-III follicular non-Hodgkin lymphoma. Retrospective analysis of a series of 50 patients. Strahlenther Onkol. 2012. V. 188. No. 6. P. 464-470. doi: 10.1007/s00066-011-0057-0.
- König L., Hörner-Rieber J., Bernhardt D.et al. Response rates and recurrence patterns after low-dose radiotherapy with 4 Gy in patients with low-grade lymphomas. Strahlenther Onkol. 2018. V. 194. No. 5. P. 454-461. doi: 10.1007/s00066-018-1277-3.
- Brady J.L., Binkley M.S., Hajj C., et al. Definitive radiotherapy for localized follicular lymphoma staged by 18 F-FDG PET-CT: a collaborative study by ILROG. Blood. 2019. V. 133. No. 3. P. 237-245. doi: 10.1182/blood-2018-04-843540.
- Oertel M., Elsayad K., Weishaupt C. et al. De-escalated radiotherapy for indolent primary cutaneous B-cell lymphoma. Strahlenther Onkol. 2020. V. 196. No. 2. P. 126-131.doi: 10.1007/s00066-019-01541-7.
- Mauro G.P., Medici C.T.M., Casimiro L.C., Weltman E. Radiotherapy for early and advanced stages Follicular Lymphoma. Clinics (Sao Paulo). 2021. V.76. P. e2059. doi: 10.6061/clinics/2021/e2059.
- Измайлов Т.Р., Смыслов А.Ю., Амелина Н.С. Подготовка и реализация планов облучения пациента, проходившего лечение в ФГБУ «РНЦРР» с использованием метода стереотаксиса. Вестник "Российского научного центра рентгенорадиологии". 2017. № 3. http://vestnik.rncrr.ru/vestnik/v17/docs/izmailov.pdf.
- Петровский В.Ю., Цаллагова З.С., Амелина Н.С. и др. Клинический случай лечения пациента с местно-распространенным раком ротоглотки с регионарными метастазами и тяжелой сопутствующей соматической патологией. Вестник РНЦРР. 2018. T.18. № 3.
- Смыслов А.Ю., Васильев В.Н., Дыкина А.В., Коконцев А.А. Оценка точности позиционирования мишени при лучевой терапии с использованием термопластиковых масок Q-Fix. Медицинская физика. 2018. Т. 2. № 78. С. 53-61.


