Клинический случай повторной коррекции аномалии Эбштейна методом конусной реконструкции
Автор: Трошкинев Никита Михайлович, Связов Е.А., Мочула О.В., Шмакова Н.А., Иванова И.В., Егунов О.А., Кривощеков Е.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 2 т.24, 2020 года.
Бесплатный доступ
Томск, Российская Федерация Представлен случай успешной повторной коррекции методом конусной реконструкции у ребенка в возрасте 16 лет с использованием опорного кольца трикуспидального клапана. Из-за атриовентрикулярной блокады высоких градаций у пациента имплантирован электрокардиостимулятор. Для определения анатомии и гемоди-намических показателей правого желудочка проведены ультразвуковое исследование и магнитно-резонансная томография. По данным эхокардиографии при выписке отмечается хороший гемодинамический эффект коррекции: регургитация на трикуспидальном клапане до I ст., градиент давления - 10/5 мм рт. ст.
Аномалия эбштейна, врожденный порок сердца, клинический случай, конусная реконструкция, повторная операция
Короткий адрес: https://sciup.org/142230612
IDR: 142230612 | DOI: 10.21688/1681-3472-2020-2-102-108
Текст научной статьи Клинический случай повторной коррекции аномалии Эбштейна методом конусной реконструкции
Трошкинев Н.М., Связов Е.А., Мочула О.В., Шмакова Н.А., Иванова И.В., Егунов О.А., Кривощеков Е.В. Клинический случай повторной коррекции аномалии Эбштейна методом конусной реконструкции. Патология кровообращения и кардиохирургия. 2020;24(2):102-108.
Среди врожденных пороков сердечно-сосудистой системы наиболее редким является аномалия Эбштейна, частота встречаемости которой около 1 %. Впервые патология описана в 1866 г. при патологоанатомическом исследовании па- циента, умершего в возрасте 19 лет от правожелудочковой сердечной недостаточности [1]. Название в честь знаменитого патолога аномалия приобрела благодаря W.M. Yater и M.J. Shapiro в 1937 г., выполнивших обзор 16 летальных случаев аномалии [2].
Наиболее принятой в клинической практике признана классификация, которую предложил французский кардиохирург A. Carpentier и соавт. в 1988 г., — 4 типа аномалии Эбштейна: A, B, C, D [3].
Существуют различные подходы к хирургическому лечению порока: пластика или протезирование трикуспидального клапана (ТК) с пликацией атриа-лизованной части правого желудочка (ПЖ) [4].
В конце прошлого века появился новый способ пластики ТК при аномалии Эбштейна, который назван конусной реконструкцией, его основателем является бразильский кардиохирург J.P. da Silva. Основная задача пластики — с помощью собственных тканей ТК создать компетентный клапан с минимальной недостаточностью и регургитацией. За последние 20 лет эта техника стала использоваться в крупнейших клиниках мира, идет накопление опыта и обобщение ранних и отдаленных результатов этого метода пластики.
В статье представлен успешный случай повторной коррекции аномалии Эбштейна методом конусной реконструкции с имплантацией опорного кольца и двухкамерного электрокардиостумулятора.
Клинический случай
Пациент М., 16 лет, поступил в кардиохирургическое отделение № 2 НИИ кардиологии Томского НИМЦ в марте 2019 г. На момент поступления рост пациента 186 см, вес 71 кг. Пациент предъявлял жалобы на одышку при подъеме на 1-й этаж, слабость, эпизоды учащенного сердцебиения.
Из анамнеза известно, что аномалия Эбштейна диагностирована сразу после рождения. Мальчик наблюдался кардиологом по месту жительства, с осени 2013 г. отмечалась отрицательная динамика в самочувствии ребенка: появились быстрая утомляемость, одышка при небольшой физической нагрузке, цианоз. Из выписки предыдущей госпитализации известно, что состояние при поступлении расценено как средней степени тяжести, сатурация 92 %, тоны сердца ясные, ритмичные, I тон расщеплен, короткий систолический шум выслушивался вдоль левого края грудины. Выраженной патологии других органов и систем нет. По данным ультразвукового исследования сердца, дилатация правых камер сердца выраженная, межжелудочковая перегородка смещена в полость левого желудочка, при этом сократительная способность обоих же- лудочков в норме. Трехстворчатый клапан типичен для аномалии Эбштейна: сращение створок ТК к стенкам ПЖ с тотальной недостаточностью на клапане. Передняя створка удлинена, фиксирована к прилежащему миокарду фиброзными сращениями, за счет чего точка смыкания створок смещена на 26 мм к верхушке сердца, что характерно для типа В аномалии Эбштейна. Также обнаружен дефект межпредсердной перегородки 5 мм.
В феврале 2014 г. ребенку выполнена хирургическая коррекция — пластика трикуспидального клапана с двунаправленным кавапульмональным анастомозом, ушивание дефекта межпредсердной перегородки. В раннем послеоперационном периоде отмечалась полная АВ-блокада, потребовавшая временной электрокардиостимуляции продолжительностью 11 сут. После оперативного лечения недостаточность на ТК сохранялась до II ст. После выписки ребенок находился под наблюдением кардиолога амбулаторно. Из медикаментозной терапии принимал энап 10 мг 1 раз в сут., гипо-тиазид 25 мг 1 раз в сут., верошпирон 25 мг 2 раза в сут. Сохранялся синусовый ритм 40–163 уд./мин с эпизодами желудочкового ритма, полная блокада правой ножки пучка Гиса, в течение суток эпизоды полной АВ-блокады с паузами ритма 1 689–1 926 мс.
В 2017 г., по данным холтеровского мониторирования, выявлен транзиторный феномен Вольфа – Паркинсона – Уайта. С учетом ухудшения состояния и сохраняющейся недостаточности на ТК до III ст. пациент направлен в НИИ кардиологии Томского НИМЦ для обследования и решения вопроса о повторном оперативном вмешательстве.
При поступлении в кардиохирургическое отделение № 2 НИИ кардиологии Томского НИМЦ состояние расценено как удовлетворительное. Пациент жаловался на одышку при физической нагрузке, эпизоды учащенного сердцебиения. Объективно: тоны сердца ясные, ритмичные. Выслушивался систолический шум по левому краю грудины, максимально в III–IV межреберье, усиливался в горизонтальном положении. Сатурация в покое 99 %. По данным лабораторных методов исследования, общий анализ крови, биохимические показатели крови без патологических отклонений. Ультразвуковое исследование сердца (рис. 1): правое предсердие (ПП) — 59 × 51 мм, объем ПП — 107,42
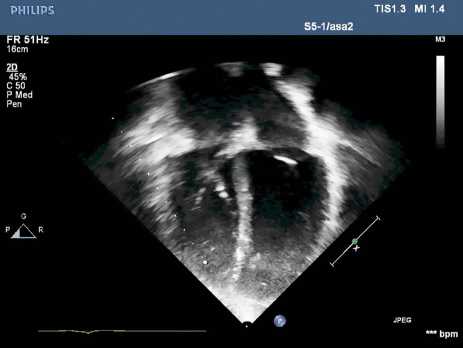
Рис. 1. Эхокардиография до операции мл (245 % нормы), конечный диастолический размер левого желудочка (КДР ЛЖ) — 49 мм, конечный систолический размер (КСР) ЛЖ — 31 мм, конечный диастолический объем (КДО) ЛЖ — 115 см3 (114 % нормы), конечный систолический объем (КСО) ЛЖ — 46 см3, фракция выброса (ФВ, m) — 66%, ФВ (b) — 64 %, ударный объем (УО) — 69 мл, ударный индекс (УИ) — 35,5 мл/м2, систолический индекс (СИ) — 1,4557 л/мин/м2, конечный диастолический индекс (КДИ) — 59,18 мл/м2, конечный систолический индекс (КСИ) — 23,7 мл/м2, ПЖ (m) — 28 мм, ПЖ (b) — 31 мм. Трикуспидальный клапан: фиброзное кольцо (ФК) — 20 мм, градиент на клапане — 6/3 мм рт. ст., регургитация III ст. Систолическое давление в ПЖ — 27 мм рт. ст.; скоростные показатели кровотока в кавапульмональ-ном анастомозе в пределах нормы (скорость на вдохе 54 см/с, скорость на выдохе 30 см/с). Кардиоторакаль-ный индекс — 64 %.
Выполнена магнитно-резонансная томография сердца (рис. 2) на аппарате Toshiba Vantage Titan (Япония) с индукцией магнитного поля 1,5 Тл. Для визуализации ТК использованы динамические изображения в 2- и 4-камерной проекции по длинной оси левого желудочка в импульсной последовательности GRE-SSFP (устойчивое состояние свободной прецессии). Передняя створка клапана ограничена в движении в нижней трети, за счет чего не было достаточной коаптации тканей ТК в систолическую фазу, что приводило к значительной регургитации; показатели КСО ПЖ — 165 мл, КДО ПЖ — 203 мл, КДР ПЖ — 52 мм, КСР ПЖ — 47 мм, фракция выброса ПЖ — 18 %, левые камеры сердца не увеличены.
С целью диагностики нарушения ритма сердца проведено суточное мониторирование электрокардиографии: частота сердечных сокращений (ЧСС) ср. — 69 в мин, ЧСС max — 141 в мин, ЧСС min — 30 в мин, максимальная пауза ритма — 2 632 мс. Количество пауз ритма более 1,5 с — 7 389 за сут. Желудочковая экстрасистолия — 2 988 за сут. Заключение: в течение суток АВ-блокада 1 ст. (PQ до 500 мс), 2 ст. Мобиц 1,2 и 2:1. Среднесуточная ЧСС ближе к минимальной норме. Паузы ритма до 2 632 мс. Желудочковая экстрасистолия — эктопическая активность 3 %, групповых желудочковых экстрасистолий нет. Проведено чреспищеводное электрофизиологическое исследование, пароксизмы тахикардии не индуцировались.
После обследования пациенту требовались повторная хирургическая коррекция и с учетом преходящей полной АВ-блокады имплантация двухкамерного электрокардиостимулятора (класс показаний I, уровень доказательности B).
Рис. 2.
Магнитно-резонансная томография сердца, 4-камерная проекция по длинной оси левого желудочка в импульсной последовательности GRE-SSFP: диастола (A); систола (B)
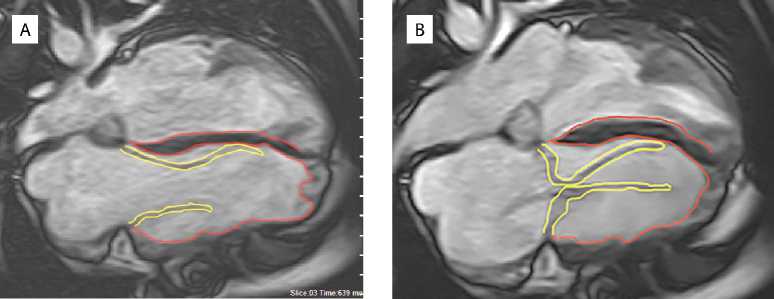
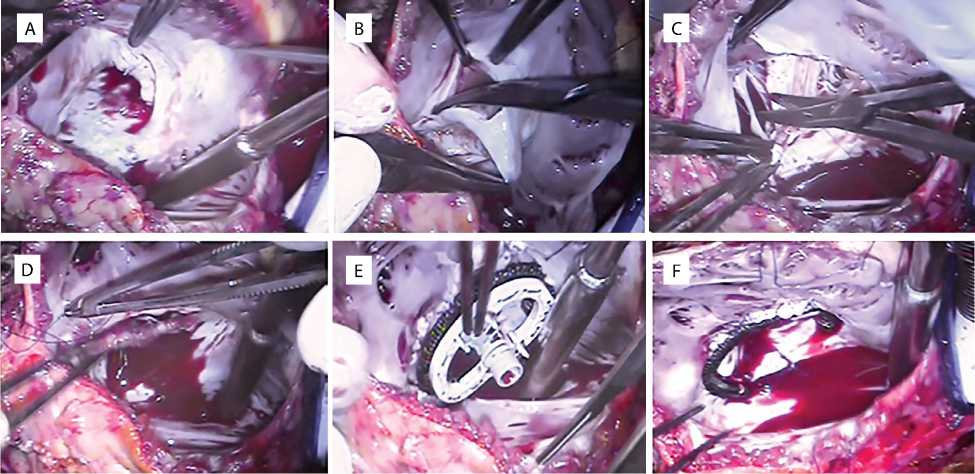
Рис. 3. Этапы операции: клапан до реконструкции (А); рассечение передней створки ниже фиброзного кольца (B); тотальная деламинация передней створки (C); подшивание ткани створки к истинному фиброзному кольцу (D); имплантация опорного кольца (E); клапан после реконструкции (F)
Техника операции
Оперативный доступ — срединная продольная рестернотомия. Кардиолиз. Подключение аппарата искусственного кровообращения по схеме: восходящая аорта — верхняя полая вена, нижняя полая вена. Кровяная холодовая кардиоплегия подавалась в корень аорты. Правая атриотомия. Гидродинамическая проба — недостаточность ТК III ст. При ревизии ТК: передняя створка деламинирована частично от передней стенки ПЖ, что явилялось причиной недостаточной коаптации створок и регургитации. Передняя створка клапана рассечена на 0,5 см ниже фиброзного кольца; область рассечения — с переднесептальной до переднезадней комиссуры (рис. 3). Выполнена тотальная деламинация передней створки ТК путем рассечения фиброзно-мышечных сращений. Хорды, крепящиеся к па-пиллярой мышце, не рассекались, поскольку служат местом фиксации конусной реконструкции. Край створки фиксирован к истинному фиброзному кольцу нитью Premilene 6/0. С учетом возраста пациента для предотвращения последующей дилатации фиброзного кольца ТК имплантировано опорное кольцо Sorin Sovering Band Tricuspid 28 мм. Гидродинамическая проба ТК — регургитация 0–I ст. Снят зажим с аорты, правое предсердие ушито нитью Premilene 5/0. К правому предсердию и правому желудочку подшиты эпикардиальные электроды Medtronic Capsure Epi — 35 см. Электроды подключены к двухкамерному электрокардиостимулятору Medtronic Ensure DR MRI Sure Scan, который помещен под апоневроз прямых мышц живота.
Время искусственного кровообращения — 121 мин, время пережатия аорты — 89 мин. Пациент экстубирован через 3 ч после операции, на 3-е сут. переведен из отделения анестезиологии – реанимации в общую палату. Осуществлена терапия: фуросемид по ¼ таблетки 2 раза в сут., аспаркам по 1 таблетке 3 раза в сут. На 4-е послеоперационные сут., в связи с двусторонним гидротораксом, выполнена плевральная пункция. Получена серозная экссудативная жидкость (слева 320 мл, справа 400 мл). Ритм от электрокардиостимулятора устойчивый (режим стимуляции AAI-DDD; базовая ЧСС 50 в мин; максимальная ЧСС 170 в мин; чувствительность правого предсердия 4,0 мВ, правого желудочка 18,5 мВ; порог стимуляции правого предсердия 1,125 В, правого желудочка 0,375 В; АV-задержка auto).
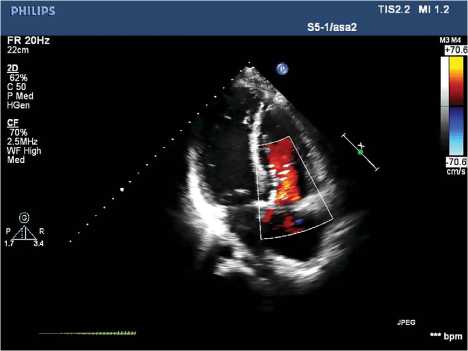
Рис. 4. Эхокардиография после операции
По данным послеоперационной эхокардиографии (рис. 4), ПП — 55 × 45 мм, объем ПП — 77,96 мл (188 % нормы), КДР — 50 мм, КСР — 29 мм, КДО — 106 см3 (105 % нормы), КСО — 35 см3, ФВ (m) — 72 %, ФВ (b) — 67 %, УО (b) — 71 мл, УИ — 36,5 мл/м2, КДИ — 54,55 мл/м2, КСИ — 18 мл/м2, ПЖ (m) — 29 мм, ПЖ (b) — 26 мм, систолическое давление в ПЖ 26 мм рт. ст., трикуспидальный клапан: ФК — 23 мм, градиент — 10/5 мм ст. рт.; регургитация до I ст. Пациент выписан на 13-е сут. после операции под наблюдение кардиолога амбулаторно-поликлинического звена.
Через 6 мес. пациент прошел контрольное обследование по месту жительства. За указанный период наблюдения пациент не предъявлял жалоб. По результатам ультразвукового обследования, ПП — 51 × 40 мм, объем ПП — 57 мл, КДР — 47 мм, КСР — 30 мм, КДО — 103 мл, КСО — 34 мл, ФВ (b) — 67 %, УО — 69 мл, УИ — 34,3 мл/м2, КДИ — 51,24 мл/м2, КСИ — 16,91 мл/м2, ПЖ — 28 мм, трикуспидальный клапан: ФК — 23 мм, градиент — 2,8/1,4 мм ст. рт.; регургитация до I ст. Контроль системы электрокардиостимулятора: режим стимуляции AAI-DDD; базовая ЧСС 50 в мин; максимальная ЧСС 130 в мин; чувствительность правого предсердия 4,9 мВ, правого желудочка 20 мВ; порог стимуляции правого предсердия 0,5 В, правого желудочка 0,5 В.
Обсуждение
В мировой литературе обсуждается вопрос о возможности выполнения конусной реконструкции. Конусная реконструкция разработана на ос- нове метода пластики A. Carpentier, ключевым моментом в котором была тотальная хирургическая деламинация тканей створок ТК от прилежащего миокарда. J.P. da Silva предложил ротировать полученную ткань створок по часовой стрелке и подшивать к истинному фиброзному кольцу [5]. Эта операция активно применяется хирургами в Азии, Европе и Америке.
По мнению кардиохирурга Клиники Майо (США) J.A. Dearani, этот метод наиболее приближен к анатомической коррекции. В статье в 2013 г. J.A. Dearani и соавт. описывают 20 случаев повторных вмешательств [6]. Средний возраст пациентов составил 15 лет. Среди причин увеличения степени недостаточности на ТК были расширение фиброзного кольца и недостаточная деламинация створок. У половины пациентов не было ткани септальной створки. При недостатке ткани створки хирург выполнял вставку из аутоперикарда или мембраны Cor-Matrix. Летальности и перехода к протезированию клапана в данной когорте пациентов не было. Как отмечают авторы, повторная пластика после конусной реконструкции возможна в большинстве случаев, поскольку имелся определенный объем ткани створок для пластики клапана, но он должен быть дополнен собственными или искусственными тканями. В исследовании Клиники Майо в 2018 г. количество повторных конусных реконструкций составило 17 % (41 пациент). Средний срок наблюдения — 3,5 ± 2,5 года. Выживаемость пациентов в педиатрической группе — 98,5 % [7].
D.J. Kim и соавт. представили два случая применения конусной реконструкции у пациентов 33 лет и 51 года, которым ранее выполнена коррекция по A. Carpentier. Авторы дополнительно выполнили деламинацию створок, рассекая фиброзо-мышечные сращения от миокарда ПЖ и пришили створки к истинному фиброзному кольцу. Во втором случае, помимо пластики ТК, проводилась криоаблация дополнительного предсердно-желудочкового пути [8].
Наиболее значимые методы оценки и визуализации ПЖ при аномалии Эбштейна — эхокардиография и магнитно-резонансная томография. Эхокардиографическое исследование позволяет оценить анатомию ТК и степень регургитации и стеноза, но из-за сложной формы желудочка рассчитать фракцию выброса часто не представляется возможным. Магнитно-резонансная томография дает возможность более подробно рассмотреть анатомию атриализованной и истинной частей ПЖ и достоверно определить фракцию выброса [9]. При помощи динамического изображения в режиме SSFP можно визуально определить степень приращения створок к миокарду ПЖ, что очень важно для хирурга.
В НИИ кардиологии Томского НИМЦ метод конусной реконструкции применяется с 2011 г. и насчитывает более 40 операций [10]. Представленный случай повторной хирургической коррекции первый в нашей практике.
Заключение
Аномалия Эбштейна — один из наиболее редких врожденных пороков сердечно-сосудистой системы. При бессимптомном течении диагностика патологии возможна только благодаря эхокардиографическому скринингу детей. Как правило, поступают на оперативное лечение в школьном возрасте, с проявлениями сердечной недостаточности обнаруживается одышка, ребенок устает при минимальной физической нагрузке. Усугубляют ситуацию сопутствующие нарушения ритма, из которых наиболее характерный для аномалии Эбштейна, синдром Вольфа – Паркинсона – Уайта.
В отечественной литературе нет статей, в которых был бы представлен опыт повторного вмешательства с применением конусной реконструкции. В данной статье продемонстрирована повторная коррекция с восстановлением функции ТК. Ключевой момент этой методики — полная деламинация тканей приращенных створок ТК с сохранением хорды крепления передней створки ТК к папиллярной мышце. Основной причиной увеличения недостаточности на ТК в отдаленном послеоперационном периоде после конусной реконструкции является дилатация фиброзного кольца. Для предотвращения дилатации при повторной пластике клапана следует использовать опорные кольца. «Золотым стандартом» для исследования анатомии и функции ПЖ при аномалии Эбштейна признана магнитно-резонансная томография. Необходимы накопление клинического опыта и наблюдение в отдаленном послеоперационном периоде пациентов с этим вариантом коррекции.
Список литературы Клинический случай повторной коррекции аномалии Эбштейна методом конусной реконструкции
- Robicsek F. Wilhelm Ebstein and the history of surgery for Ebstein's disease. Thorac Cardiovasc Surg. 2013;61(4):286-292. DOI: 10.1055/s-0032-1304540
- Yater W.M., Shapiro M.J. Congenital displacement of the tricuspid valve (Ebstein's disease): Review and report of a case with electrocardiographic abnormalities and detailed histologic study of the conduction system. Ann Intern Med. 1937;11(6):1043-1062. DOI: 10.7326/0003-4819-11-6-1043
- Carpentier A., Chauvaud S., Macé L., Relland J., Mihaileanu S., Marino J.P., Abry B., Guibourt P. A new reconstructive operation for Ebstein's anomaly of the tricuspid valve. J Thorac Cardiovasc Surg. 1988;96(1):92-101. DOI: 10.1016/S0022-5223(19)35302-4 PMID: 3386297
- Burri M., Lange R. Surgical treatment of Ebstein's anomaly. Thorac Cardiovasc Surg. 2017;65(08):639-648. DOI: 10.1055/s-0037-1604469 PMID: 28806824
- da Silva J.P., Baumgratz J.F., da Fonseca L., Franchi S.M., Lopes L.M., Tavares G.M., Soaresa A.M., Moreira L.F., Barbero-Marcial M. The cone reconstruction of the tricuspid valve in Ebstein's anomaly. The operation: early and midterm results. J Thorac Cardiovasc Surg. 2007;133(1 ):215-223. https://doi. org/ DOI: 10.1016/j.jtcvs.2006.09.018
- Dearani J.A., Said S.M., Burkhart H.M, Pike R.B., O'Leary P.W., Cetta F. Strategies for tricuspid re-repair in Ebstein malformation using the cone technique. Ann Thorac Surg. 2013;96(1):202-208. https:// DOI: 10.1016/j.athoracsur.2013.02.067 PMID: 23743062
- Holst K.A., Dearani J.A., Said S., Pike R.B., Connolly H.M., Cannon B.C. Sessions K.L., O'Byrne M.M., O'Leary P.W. Improving results of surgery for Ebstein anomaly: Where are we after 235 cone repairs? Ann Thorac Surg. 2018;105 ( 1 ): 160-169. https://doi. org/ DOI: 10.1016/j.athoracsur.2017.09.058 PMID: 29174783
- Kim D.J., Suh J.W., Shin Y.R., Shin H.J., Park H.K. Tricuspid valve re-repair in Ebstein anomaly using the cone technique. Korean J Thorac Cardiovasc Surg. 2016;49(1):35-38. https:// DOI: 10.5090/kjtcs.2016.49.1.35
- Davlouros P.A., Niwa K., Webb G., Gatzoulis M.A. The right ventricle in congenital heart disease. heart. 2006;92(Suppl 1):i27-38. , PMCID: PMC1860730. https:// DOI: 10.1136/hrt.2005.077438 PMID: 16543599
- Krivoshchekov E.V., Ackerman J.P.,Yanulevich O.S., Sokolov A.A., Ershova N.V., Dearani J.A., Cetta F. Modified cone reconstruction of the tricuspid valve for ebstein anomaly as performed in Siberia. Tex Heart Inst J. 2017;44(1):39-42. , PMCID: PMC5317358. DOI: 10.14503/THIJ-16-5832 PMID: 28265211


