Клинический случай стереотаксической лучевой терапии рецидива рака головки поджелудочной железы PT3N1M0
Автор: Паньшин Г.А., Кандакова Е.Ю., Ильин М.А., Коняхина А.В., Дыкина А.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клинические наблюдения
Статья в выпуске: 4 т.19, 2019 года.
Бесплатный доступ
На сегодняшний день лечение рака поджелудочной железы является одной из наиболее актуальных проблем в современной онкологии. Общая выживаемость пациентов с установленным диагнозом рака поджелудочной железы составляет не более 10%. Хотя хирургический метод является ведущим в лечении этого заболевания, резектабельность для впервые выявленных случаев остается низкой. Приблизительно у трети пациентов после проведенного хирургического лечения возникает локальный рецидив заболевания. Поскольку повторные операции обычно затруднительны, в подобных ситуациях необходимо рассмотреть возможность проведения альтернативных локальных методов лечения, в том числе стереотаксической лучевой терапии, как «спасительного» метода лечения.
Рак поджелудочной железы, стереотаксическая лучевая терапия, рецидив
Короткий адрес: https://sciup.org/149132120
IDR: 149132120
Текст научной статьи Клинический случай стереотаксической лучевой терапии рецидива рака головки поджелудочной железы PT3N1M0
Поджелудочная железа в общей структуре онкологической заболеваемости России является одной из ведущих локализаций – 3,1%, а в структуре смертности от злокачественных новообразований удельный вес опухолей поджелудочной железы (ПЖ) составляет 6,3% [2]. Общая выживаемость пациентов с диагнозом рак ПЖ остается наиболее низкой – 9%. Частично это связано с тем, что более половины случаев выявляется в IV стадии заболевания [8]. По данным одного из аутопсических исследований, около 30% пациентов погибают в результате местнораспространенного инфильтративного роста опухоли ПЖ [7].
Без сомнения, хирургическое лечение было и остается ведущим методом в лечении рака ПЖ. Однако только 10–25% случаев расцениваются как резектабельные на момент установления диагноза рака ПЖ [5]. При этом приблизительно 30% всех пациентов с впервые установленным диагнозом рака ПЖ уже имеют нерезектабельный местнораспространенный процесс. В то же время, у 30% пациентов после проведенного лечения по поводу рака ПЖ отмечается прогрессирование заболевания в виде локального продолженного роста опухоли [6].
Основным методом лечения рецидивов рака поджелудочной железы после хирургического лечения является химиотерапия [3]. Однако, по данным Zhou Y. с соавторами, после повторной операции у 55 пациентов при локальном рецидиве протокового рака ПЖ, 1-, 3- и 5-летняя общая выживаемость составили 82,2%, 49,2% и 40,6% соответственно [10].
Следует подчеркнуть, что в настоящее время применение стереотаксической лучевой терапии на различных этапах лечения рака ПЖ активно изучается, в том числе для лечения локальных рецидивов. Локальный контроль при проведении стереотаксической лучевой терапии достигает, по данным разных авторов, 60–83%. При этом необходимо отметить, что суммарные очаговые дозы и различные режимы фракционирования при проведении радиотерапевтического лечения при раке ПЖ ограничены толерантностью окружающих железу здоровых органов и тканей. В то же время, мета-анализ 15-ти исследований с включением 508 пациентов показал, что повышение BED10 более 70 Гр, то есть дальнейшая эскалация дозы, не привело к статистически значимому улучшению результатов лечения [9].
Клиническое наблюдение
Пациент Ш., мужчина 67 лет, обратился в Российский научный центр рентгенорадиологии в октябре 2019 г.
Анамнез заболевания: в сентябре 2018 г. пациент отметил появление желтухи.
10.09.19 выполнена чрескожная чреспеченочная холангиостомия. Желтуха разрешилась. По данным КТ органов брюшной полости: в головке поджелудочной железы визуализируется образование неправильной формы с нечеткими неровными контурами размерами 3,0 х 1,3 см с наличием умеренной билиарной гипертензии. 28.09.2018 г. пациенту выполнена гастропанкреатодуоденальная резекция с резекцией тела поджелудочной железы с диагональной резекцией конфлюэнса воротной вены. Холецистэктомия. Патогистологическое исследование № 63062-142:
низкодифференцированная протоковая аденокарцинома G3. В послеоперационном периоде с 11.2018 г. по 03.2019 г. пациенту проведено 6 курсов ХТ по схеме FOLFIRINOX. В марте 2019 г. отмечено прогрессирование заболевания в виде единичного метастаза в печени (по данным МРТ органов брюшной полости). С апреля по июнь 2019 г. проведены 7-й – 10-й курсы ХТ по схеме FOLFRINOX. При контрольном обследовании в июне 2019 г. по данным МРТ органов брюшной полости выявлен еще один метастаз печени, а также продолженный рост опухоли в ложе поджелудочной железы. Далее пациенту проведено 2 курса ХТ 2-й линии по схеме Абраксан+Гемцитабин. По данным ПЭТ - КТ (Рис. 1) всего тела с ФДГ от 04.10.2019 г. визуализируется образование с повышенной фиксацией ФДГ и неравномерно утолщенными стенками в области удаленной головки поджелудочной железы, а также 2 метастаза в правой доле печени. Рецидивная опухоль в проекции ложа головки поджелудочной железы признана нерезектабельной в связи с вовлечением верхней брыжеечнной артерии > 1800.
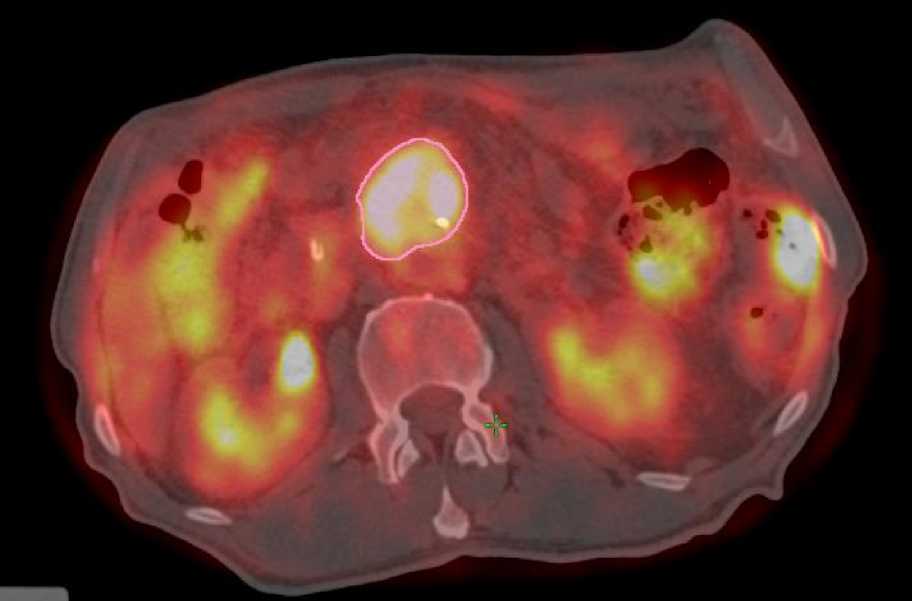
Рисунок 1. ПЭТ-КТ. Продолженный рост опухоли
Учитывая продолженный рост опухоли поджелудочной железы по данным ПЭТ КТ, высокий риск последующего местно-инфильтративного роста опухоли, а также проведенное ранее лечение, с целью достижения локального контроля опухолевого процесса в проекции ложа головки поджелудочной железы перед началом третьей линии химиотерапии, решено провести курс паллиативной («спасительной»)
стереотаксической лучевой терапии локально на область рецидивной опухоли поджелудочной железы с РОД 8,0 Гр до СОД 24,0 Гр за 3 ежедневных сеанса.
В рамках предлучевой подготовки пациенту проведена компьютернотомографическая топометрия с интервалом реконструкции 1 мм, толщина среза 1 мм в условиях индивидуальной фиксации (вакуумный матрас) и в условиях контроля дыхания (Varian Real-time Position ManagementTM) в положении пациента лежа на спине.
При планировании курса стереотаксической лучевой терапии были использованы ограничения доз на критические органы, предложенные в отчете Task Group 101 [4], а также принятая в РНЦРР методика проведения и контроля гарантии качества [1]. Был разработан план облучения с использованием технологии RapidArc (VMAT) на медицинском линейном ускорителе Varian True Beam с помощью планирующей системы «Varian Eclipse» External Beam Planning 10.0.42.
Распределение дозы при локальном стереотаксическом облучении рецидива рака поджелудочной железы представлено на рисунке 2.
При анализе плана лучевой терапии превышения толерантных доз на критические структуры не было, что явилось основным критерием безопасности проведенного лечения (таблица 1, рисунок 3). Важным моментом является отсутствие превышения максимальных доз в критических органах, в особенности кишечнике, поскольку данный полый орган обладает собственной подвижностью. Поэтому, несмотря на то, что в расчетном плане имеется достаточный запас по максимальной дозе на кишечник, увеличение числа фракций может привести к тяжелому энтериту, перфорации кишечника.
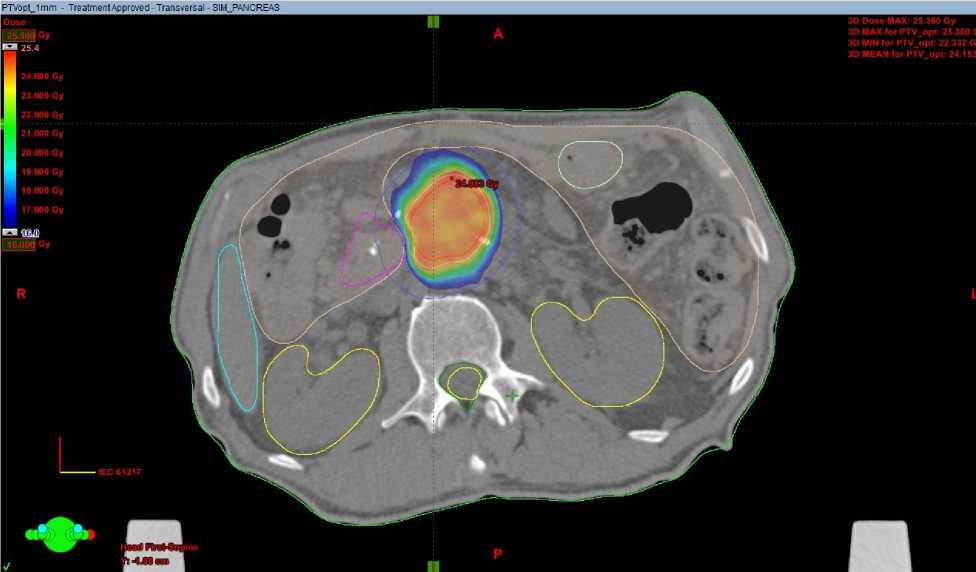
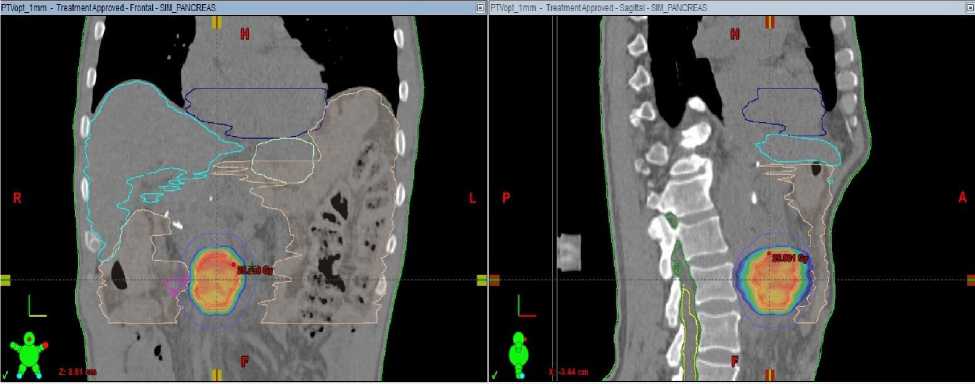
Рисунок 2. Распределение дозы при облучении локального рецидива опухоли рака поджелудочной железы
Таблица 1. Сравнение расчетной дозы с толерантными дозами при облучении локального рецидива опухоли рака поджелудочной железы
|
Орган/ткань |
Task group 101 |
Расчетный план |
||
|
Три фракции |
Три фракции |
|||
|
Доза, |
Максимальная доза, |
Доза, |
Максимальная доза, |
|
|
Гр |
Гр |
Гр |
Гр |
|
|
Конский хвост |
21,9 |
24,0 |
2,13 |
8,48 |
|
Сердце/перикард |
24,0 |
30,0 |
0,03 |
0,07 |
|
Желудок |
16,5 |
22,2 |
0,4 |
4,44 |
|
Печень |
19,2 |
0,14 |
5,42 |
|
|
Кишечник |
17,7 |
25,2 |
1,28 |
18 |
|
Почки |
16,0 |
- |
1,98 |
8,2 |
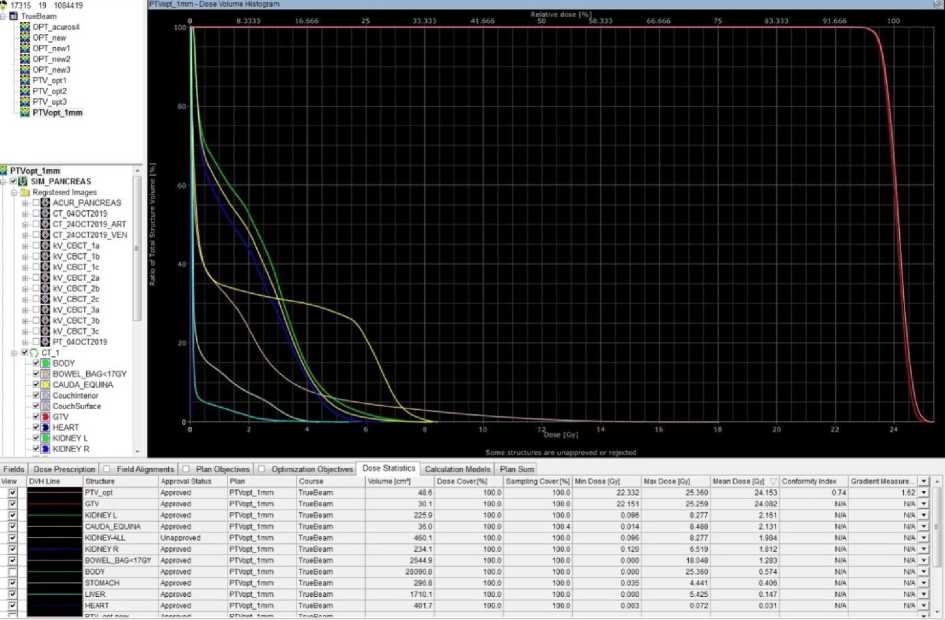
Рисунок 3. Гистограмма доза–объем при облучении локального рецидива опухоли рака поджелудочной железы и критических органов
Перед реализацией плана лучевой терапии на медицинском линейном ускорителе Varian True Beam были проведены контроль качества пучка и верификация плана облучения.
С 29.10.2019 г. по 01.11.2019 г. проведено лучевое лечение в заданных параметрах лечения. Перед каждым сеансом лучевой терапии проводилась визуализация в коническом пучке КТ на медицинском линейном ускорителе Varian True Beam с целью верификации объема облучения. Сразу после сеанса выполнялась контрольная визуализация для оценки интрафракционного смещения мишени. Пациент удовлетворительно перенес лечение. Лучевых реакций отмечено не было. В последующем планируется проведение химиотерапии 3-й линии и стереотаксическая лучевая терапия на два метастатических очага в печени.
Обсуждение
В настоящее время лечение рецидивов рака ПЖ остается актульной проблемой с учетом того, что местно-инфильтративный рост опухоли является причиной гибели 1/3 пациентов [7]. Принимая во внимание прогрессирование опухолевого процесса на фоне проведенных ранее 2 линий химиотерапии и невозможность выполнения хирургического лечения, была предпринята попытка локального контроля опухоли, Важным моментом является соблюдение технологии проведения стереотаксической лучевой терапии с ограничением доз на критические структуры, которые не должны превышать толерантные дозы здоровых тканей.
Заключение
Проведение стереотаксической лучевой терапии в комбинации с химиотерапевтическим лечением у нерезектабельных пациентов с локальным рецидивом рака ПЖ является приемлемой альтернативной методикой в группе пациентов без прорастания опухолью прилегающих полых органов.
Список литературы Клинический случай стереотаксической лучевой терапии рецидива рака головки поджелудочной железы PT3N1M0
- Измайлов Т.Р., Смыслов А.Ю., Амелина Н.С. Подготовка и реализация планов облучения пациента, проходившего лечение в ФГБУ "РНЦРР" с использованием метода стереотаксиса. Вестник РНЦРР. Т. 17. № 3. Клинические наблюдения. URL: http://vestnik.rncrr.ru/vestnik/v17/docs/izmailov.pdf
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018г (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена - филиал "НМИЦ Радиологии" Минздрава России. 2019. 250 с.
- Покатаев И.А., Алиева С.Б., Гладков О.А. и др. Злокачественные опухоли: практические рекомендации RUSSCO. 2019. Т.9. № 3s2. C. 456-468. 10.18027 / 2224-5057-2019-9-3s2-456-468 DOI: 10.18027/2224-5057-2019-9-3s2-456-468
- Benedict S.H., Yenice K.M., Followill D., et al. Stereotactic body radiation therapy: The report of AAPM Task Group 101. Med Phys. 2010. V. 37. No. 8. P. 4078-4101. DOI: 10.1118/1.3438081
- Bruynzeel A., Lagerwaard F. The role biological dose-escalation for pancreatic cancer. Clin Transl Radiat Oncol. 2019. V. 18. P. 128-130. DOI: 10.1016/j.ctro.2019.04.020
- Hidalgo M. Pancreatic cancer. N Eng J Med. 2010. V. 362. No. 17. P. 1605-1617. DOI: 10.1056/NEJMra0901557
- Iacobuzio-Donahue C., Fu B., Yachida S., et al. DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer. J Clin Oncol. 2009. V. 27. No. 11. P. 1806-1813. DOI: 10.1200/JCO.2008.17.7188
- Siegel R., Miller K., Jernal A. Cancer Staistics, 2019. CA Cancer J Clin. 2019. V. 69. No. 1. P. 7-34. DOI: 10.3322/caac.21551
- Zaorsky N., Lehrer E., Handorf E., Meyer J. Dose escalation in stereotactic body radiation therapy for pancreatic cancer: A meta-analysis. American Journal of Clinical Oncology. 2019. V. 42. No. 1. P. 46-55. DOI: 10.1097/COC.0000000000000472
- Zhou Y., Song A., Wu L., et al. Second pancreatectomy for recurrent pancreatic adenocarcinoma in the remnant pancreas: A pooled analysis. Pancreatology. 2016. V. 16. No.6. P. 1124-1128. DOI: 10.1016/j.pan.2016.09.015


