Клинический случай успешного лечения подростка с саркомой Юинга IV стадии
Автор: Кит Олег Иванович, Юрченко Дарья Юрьевна, Бурцев Дмитрий Владимирович, Кузнецов Сергей Алексеевич, Поповян Ольга Петровна, Барашев Артем Андреевич, Черногоров Павел Витальевич, Франциянц Елена Михайловна, Сагакянц Александр Борисович, Куштова Луиза Беслановна, Мкртчян Гюльнара Агабалаевна, Беспалова Александра Ивановна, Старжецкая Мария Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.19, 2020 года.
Бесплатный доступ
Актуальность. Саркома Юинга занимает одно из лидирующих мест в онкологической патологии опорно-двигательной системы у детей и подростков. Успешное лечение затрудняет крайне агрессивное течение опухолевого процесса. Несмотря на мультидисциплинарный подход в лечении, включающий наряду с химиотерапевтическим и хирургическим методами лечения лучевую терапию, быстрая генерализация опухолевого процесса, рецидивы и резистентные к химиотерапии формы опухоли по-прежнему часты. Целью работы явилось представление результатов персонифицированного подхода в комплексном мультидисциплинарном лечении злокачественной патологии опорно-двигательной системы с использованием многокомпонентной полихимиотерапии, 30-конформной лучевой терапии и высоких хирургических технологий. Описание клинического случая. Больная обратилась в ФГБУ «РНИОИ» МЗ РФ в апреле 2016 г. с жалобами на наличие опухолевого образования и умеренных болей в мягких тканях левой подвздошной области, левой нижней конечности, хромоту при ходьбе. По данным обследования установлен диагноз: саркома Юинга левой подвздошной кости с метастазами в легкие, IV стадия (T3N0M1). После 6 курсов неоадъювантной полихимиотерапии, согласно протоколу EWING 2008, отмечено прогрессирование опухоли с метастазами в легкие. Проведено 2 противо-рецидивных курса полихимиотерапии второй линии, решением консилиума врачей проведен первый этап хирургического лечения: резекция левой подвздошной кости с замещением дефекта временным цементным спейсером. В послеоперационном периоде больной проведено 8 курсов адъювантной полихимиотерапии, ДГТ на область обоих легких (СОД 12 Гр) и зону первичного очага (СОД 46 изоГР), 12 курсов поддерживающей терапии. Выполнен отсроченный реконструктивно-пластический этап хирургического лечения - удаление временного цементного спейсера с установкой индивидуальной тазовой стабилизирующей системы. Больная находится под наблюдением 25 мес после комплексного лечения, жалоб не предъявляет, передвигается самостоятельно, двигательная функция левого тазобедренного сустава сохранена в полном объеме. Заключение. Использование нестандартных высокотехнологичных подходов в хирургическом лечении саркомы Юинга неблагоприятных локализаций в сочетании с химиолучевой терапией позволяет достичь удовлетворительных результатов при лечении больных с распространенным опухолевым процессом и сохранения высокого уровня качества жизни.
Саркома юинга, комбинированное лечение, реконструктивно-пластическая хирургия
Короткий адрес: https://sciup.org/140254060
IDR: 140254060 | УДК: 616.7-006.83-089.053.2:615.28:615.849.1 | DOI: 10.21294/1814-4861-2020-19-3-172-179
Текст научной статьи Клинический случай успешного лечения подростка с саркомой Юинга IV стадии
В детской онкологии среди новообразований опорно-двигательной (костной) системы в последнее время лидируют опухоли семейства саркомы Юинга [1], характеризующиеся высокоагрессивным течением с ранним, преимущественно гематогенным, метастазированием и частыми рецидивами, большой вариабельностью как молекулярно-генетической структуры, так и клинико-морфологических проявлений [2], требующие высокоточного подхода в дифференциальной диагностике [3, 4].
Данные опухоли чаще всего поражают плоские и длинные трубчатые кости различных отделов скелета, а также мягкие ткани различных локализаций. При костной форме саркомы Юинга (СЮ) наиболее часто поражаются длинные кости верхней и нижней конечности, плоские кости грудной клетки, однако встречаются и более редкие, неблагоприятные локализации опухоли, к ним относят: кости таза, позвоночник, кости черепа. Лечение опухолей неблагоприятных локализаций осложняется, прежде всего, анатомическим расположением новообразования, вовлечением в процесс осевых структур скелета [5], а в некоторых случаях и жизненно важных структур. В настоящее время отмечается тенденция к органосохраняющим операциям с соблюдением принципов радикализма и применением индивидуальных стабилизирующих металлоконструкций. В зависимости от локализации опухоли при операциях на позвоночнике используют стабилизирующие системы, при вмешательствах на костях таза и конечностях проводятся операции с установкой эндопротезов, что снижает число инвалидизирующих исходов лечения [6].
Высокоагрессивный метастатический потенциал СЮ обусловливает большое количество больных, у которых при первом обращении даже при небольших первичных опухолях выявляют метастатическое поражение. Одной из наиболее частых зон метастазирования является легочная ткань, второй по частоте – костный мозг и кости скелета [7].
Отдельным аспектом проблемы выступает возможность использования комплексного подхода не только на диагностическом этапе, но и в ходе лечения. Усилия специалистов различного профиля создают условия для реализации индивидуального подхода к лечению данных пациентов, а использование современных технологий позволяет максимально эффективно, с учетом характера процесса и предпринятых объемов оперативного вмешательства, восстановить анатомо-физиологические структуры.
Целью работы являлось представление результатов использования персонифицированного подхода в комплексном мультидисциплинарном лечении злокачественной патологии опорнодвигательной системы с использованием многокомпонентной полихимиотерапии, 3D-конформной лучевой терапии и современных технологий для восстановления анатомических структур после хирургического лечения.
Представлен один из наиболее интересных случаев саркомы Юинга, которые наблюдались в отделении детской онкологии ФГБУ «РНИОИ» Минздрава России.
Клинический случай
Больная А., 2001 г.р., впервые поступила в отделение ФГБУ «РНИОИ» Минздрава России в апреле 2016 г. с жалобами на наличие опухолевого образования и умеренные боли в мягких тканях левой подвздошной области, левой нижней конечности, хромоту при ходьбе. Впервые обратила внимание на новообразование в марте 2016 г. В течение месяца стали беспокоить боли в левой подвздошной области, хромота. В конце апреля 2016 г. обратилась к хирургу по месту жительства, с диагнозом опухоль левой подвздошной кости была направлена в ФГБУ «РНИОИ» Минздрава России.
Результаты комплексного обследования:
– УЗИ мягких тканей левой подвздошной области (14.06.16): объемное образование солиднокистозной структуры в подвздошной области слева с неровными, нечеткими контурами, размерами 8,2×10,0 см; при ДГ гиперинтенсивный пери-нодулярный кровоток смешанного типа, умеренная гиперплазия паховых лимфоузлов до 1,4 см;
– СРКТ органов грудной клетки, брюшной полости и малого таза (15.06.16): в легочной ткани с обеих сторон множественные метастазы до 0,7 см в диаметре. Заключение: саркома крыла левой подвздошной кости с выраженным экстра-оссальным компонентом 10,0×8,0×9,0 см, неоднородной структурой (рис. 1);
– гистологическое исследование: недифференцированная круглоклеточная опухоль;
– иммуногистохимическое исследование: CD-45, миогенин, панцитокератин, CD3, СD20, хромогранин А, мелан А – отрицательная реакция; СD99 – позитивное окрашивание в опухолевых клетках. Заключение: морфологическая картина опухоли семейства саркомы Юинга. При FISH-исследовании транслокации в генах EWS и FLY не выявлено.
По данным обследования установлен диагноз: саркома Юинга левой подвздошной кости с метастазами в легкие IV стадии (Т3N0M1).
Консилиумом врачей ФГБУ «РНИОИ» Минздрава России принято решение о лечении согласно протокола Euro EWING 2008, предполагающему 6 курсов неоадъювантной полихимиотерапии, направленной на максимальное сокращение первичной опухоли до условий резектабельности и иррадикацию отдаленных метастатических очагов; хирургическое лечение первичной опухоли; лучевую терапию и многокурсовую адъювантную полихимиотерапиию, направленную на санацию ложа первичной опухоли и предупреждение метастатического распространения опухолевых клеток.
С апреля по декабрь 2016 г., по месту жительства в Онкологическом научном центре Министерства здравоохранения Республики Таджикистан проведено 5 курсов неоадъювантной полихимиотерапии по протоколу Euro Ewing 2008 (винкристин, ифосфамид, доксорубицин, этопозид). Лечение переносила с явлениями цитопенического синдрома (лейкопения II–III степени, анемия II степени, тромбоцитопения II–III степени). В декабре 2016 г., при оценке эффективности лечения по шкале ВОЗ, по данным контрольной СРКТ отмечалась положительная динамика в виде стабилизации опухолевого процесса: уменьшение размеров первичной опухоли на 30 %, исчезновение метастатических очагов в легких. В январе 2017 г. проведен 6-й курс по протоколу Euro Ewing 2008. Состояние пациентки ухудшилось: возобновились боли в левой подвздошной области, хромота при ходьбе. Повторно обратились в ФГБУ «РНИ-ОИ» Минздрава России. При контрольном МРТ (25.01.17): в проекции левой подвздошной кости с признаками ее деструкции выявлено образование солидно-кистозной структуры, размерами 10,3×8,8×11,9 см, с массивным экстраоссальным распространением, опухолевой инфильтрацией левых подвздошной, большой поясничной и малой ягодичной мышц. При СРКТ органов грудной клетки (26.01.17): метастатическое поражение легочной ткани: справа в средней доле очаг до 0,5 см, в нижней доле – до 0,3 см в диаметре.
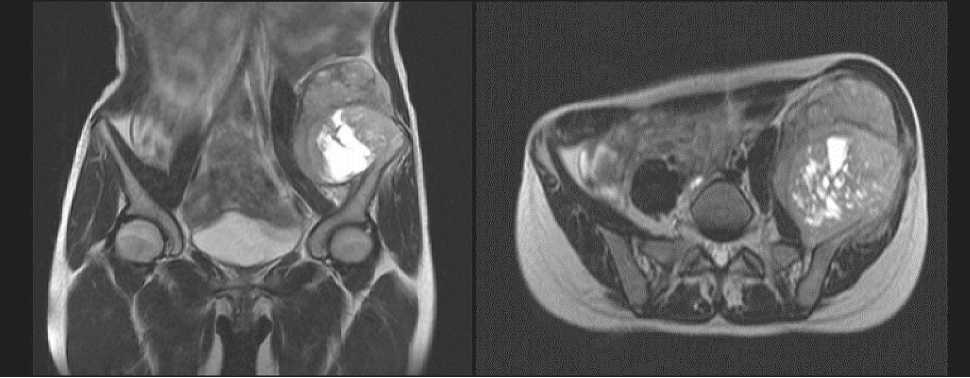
Рис. 1. СРКТ. Опухоль крыла левой подвздошной кости
Fig. 1. Spiral CT images. Tumor of the left iliac wing
Учитывая молодой возраст пациентки, гистотип опухоли, распространенность процесса, ранее проведенное лечение, ухудшение состояния с возобновлением болей, консилиум врачей ФГБУ «РНИОИ» Минздрава России принял решение, что оперативное лечение в данный момент нецелесообразно, рекомендована полихимиотерапия II линии (иринотекан, винкристин, карбоплатин) с последующей дистанционной гамма-терапией (ДГТ) на первичный очаг и оценкой эффекта с определением возможности хирургического вмешательства.
С 3.02.17 по 7.02.17 проведен 1-й противорецидивный курс полихимиотерапии II линии (иринотекан 67,6 мг № 5, винкристин 2 мг № 2, карбоплатин 742,5 мг № 1). С 8.02.17 по 10.02.17 после топометрической разметки и дозиметрического планирования начат курс конформной дистанционной гамма-терапии на область первичного очага, РОД 2,4 Гр. Планировалось проведение 15 сеансов, однако с вечера 10.02.17 появилась диарея, периодические схваткообразные боли в животе, рвота. При лабораторном контроле: лейкопения II ст. – 2,2 × 109/л, анемия II cт. – 87 г/л, тромбоцитопения II cт. – 78 × 109/л, СОЭ 60 мм/ч. Состояние расценено как постхимиотерапевтический цитопенический синдром с явлениями токсического гастроэнтероколита.
После купирования данных осложнений выполнено УЗИ органов брюшной полости (13.02.17), при котором определялось образование крыла левой подвздошной кости, размером 7,0×11,0 см. Учитывая выраженность клинического эффекта на фоне 1-го противорецидивного курса химиотерапии II линии, 3 сеансов ДГТ (СОД 7,2 Гр), развитие цитопенического синдрома с явлениями токсического гастроэнтероколита, дистанционная гамма-терапия прекращена, с 3.03.17 по 7.03.17 проведен 2-й курс противорецидивной полихимиотерапии. При СРКТ-контроле (16.03.17) в нижней доле правого легкого – солитарный метастаз, диаметром до 0,5 см; опухоль крыла левой подвздошной кости, размером
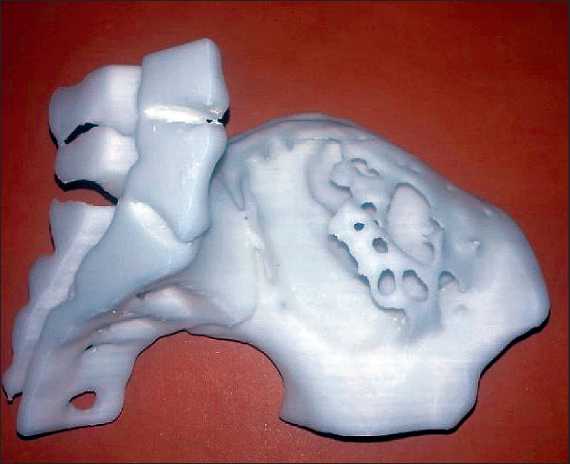
Рис. 2. Индивидуальная 3D-модель возмещаемого участка подвздошной кости
Fig. 2. Individual 3D-model of the replaced ilium fragment
9,3×6,3×7,0 см, с выраженным экстраоссальным компонентом. МРТ малого таза (15.03.17): саркома левой подвздошной кости с экстраоссальным ростом и инвазией в окружающие мягкие ткани, размером 65×79×93 мм, без инвазии в магистральные сосуды. Повторным консилиумом врачей ФГБУ «РНИОИ» Минздрава России решено провести хирургическое лечение.
Перед операцией по данным МРТ и СРКТ-исследований проведено индивидуальное моделирование планируемого участка резекции подвздошной кости без опухоли в натуральную величину при помощи 3D-принтера с целью интраоперационного моделирования цементного материала по форме образовавшегося дефекта (рис. 2).
31.03.2017 выполнено хирургическое лечение. На первом этапе операции выполнена мобилизация опухоли в пределах здоровых тканей, резекция левой подвздошной кости (рис. 3). На втором этапе проведено одномоментное моделирование полиметилметакрилатом по форме образовавшегося дефекта, далее выполнены установка и фиксация
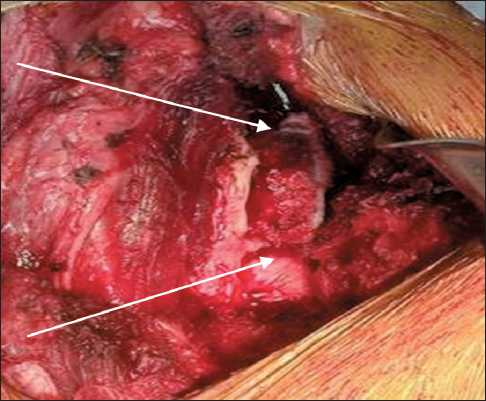
Рис. 3. Рана после резекции подвздошной кости с зонами остеотомии, указаны стрелками
Fig. 3. Wound after iliac resection with osteotomy areas (arrows)
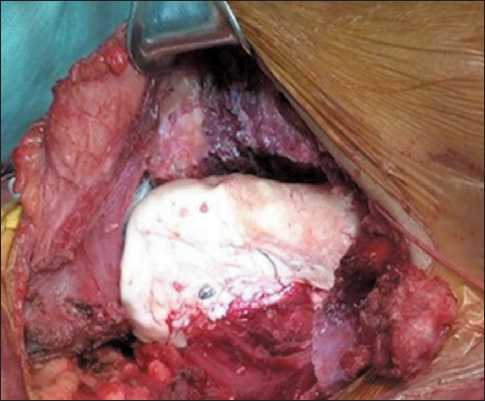
Рис. 4. Рана после установки полиметилметакрилата
Fig. 4. Wound after polymethyl methacrylate implantation
временного цементного спейсера при помощи 4 титановых винтов (рис. 4). Послеоперационный период протекал без осложнений.
Гистологическое исследование операционного материала (10.04.17): саркома Юинга с инфильтративным ростом, очаговыми кровоизлияними, отложением гемосидерина.
С 4.05.17 по 24.05.17 проведена дистанционная гамма-терапия на область легких (тотальная), РОД 2 Гр, СОД 12 Гр. С апреля по сентябрь 2017 г. проведено 8 курсов адъювантной полихимиотерапии согласно протоколу Euro Ewing 2008 по схеме VAC с перерывом на курс дистанционной лучевой терапии на область первичного опухолевого очага, РОД 2,4 Гр 5 фракций в нед, СОД 46 изоГр. (75 ЕД ВДФ). Лучевое лечение переносила удовлетворительно, лучевых реакций не наблюдалось. При СРКТ-контроле в легочной ткани без очаговых и инфильтративных изменений, при МРТ – в ложе удаленной опухоли данных за рецидив не выявлено.
С сентября 2017 г. больная находилась под наблюдением в ФГБУ «РНИОИ» Минздрава России. При регулярном контрольном обследовании данных за прогрессирование заболевания не было.
С ноября 2018 г. больная стала предъявлять жалобы на выраженные боли в поясничной области, боль, дискомфорт, хромоту при ходьбе. По данным комплексного обследования (УЗИ, СРКТ, остеосцинтиграфия) в легочной ткани очаговых и инфильтративных изменений не выявлено, определяется проникновение одного из фиксирующих винтов в полость левого тазобедренного сустава вдоль кортикального слоя левой вертлужной впадины на протяжении 2 см. Сцинтиграфических признаков очагового поражения костей скелета не выявлено.
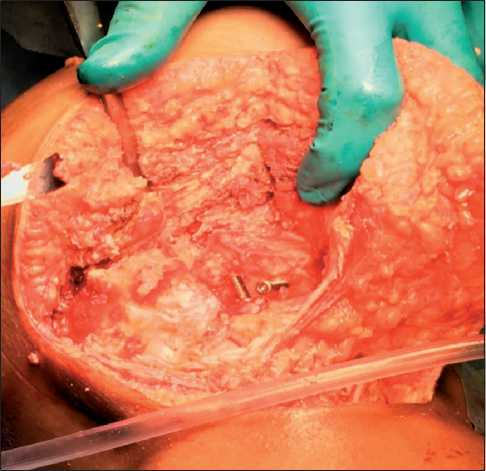
Рис. 5. Вид операционной раны после удаления временного цементного спейсера
Fig. 5. Surgical wound after removal of temporary cement spacer
Консилиумом врачей принято решение о проведении 2-го этапа хирургического лечения – отсроченной реконструктивно-пластической операции. 21.11.18 выполнено удаление временного цементного спейсера (рис. 5) с поэтапной установкой постоянной тазовой стабилизирующей системы под контролем электронно-оптического преобразователя. В лонную кость установлен транспедикулярный винт uCentum, длиной 55 мм, диаметром 5,5 мм; в 1-й и 2-й крестцовые позвонки – винты uBase, длиной 60 мм, диаметром 8,5 мм; в седалищную кость установлены 2 винта uBase, длиной 80 мм, диаметром 8,5 мм. При помощи электроннооптического преобразователя навигационного
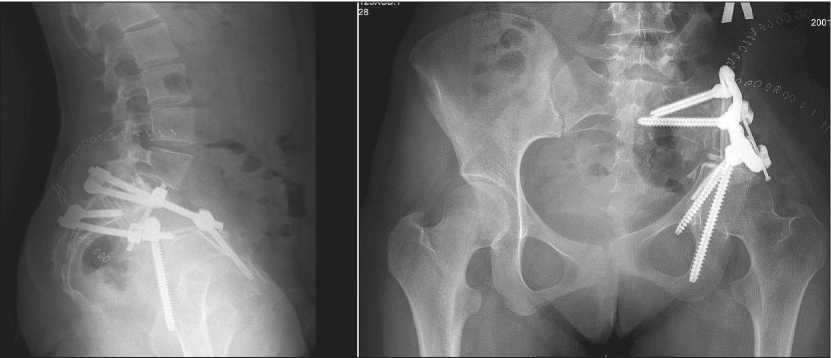
Рис. 6. Рентгенография костей таза с установленной индивидуальной титановой стабилизирующей системой Fig. 6. X-ray of the pelvic bones with individual titanium stabilizing system
устройства Pediguard смоделированы и уложены 2 штанги, диаметром 6 мм, между винтами. Выполнена предфиксация штанг. Дистракция сегмента на штангах, окончательная фиксация системы. Установлен поперечный коннектор Fixpine (рис. 6). Течение послеоперационного периода – без осложнений.
В послеоперационном периоде признаков нестабильности металлоконструкции не выявлено. С сентября 2017 г. больная находится под наблюдением в ФГБУ «РНИОИ» без признаков прогрессирования заболевания, передвигается самостоятельно, активные и пассивные движения в левом тазобедренном суставе – практически в полном объеме.
Список литературы Клинический случай успешного лечения подростка с саркомой Юинга IV стадии
- Александрова Г.А., Какорина Е.П., Караваева Л.В., Купеева И.А., Рыков М.Ю., Поляков В.Г. Эпидемиология злокачественных новообразований у детей: основные показатели в 2011-2016 гг. М., 2017. 208 с.
- Ewing J. The classic: diffuse endothelioma of bone. Proceedings of the New York Pathological Society. 1921; 12: 17. Clin Orthop Relat Res. 2006; 450: 25-27. DOI: 10.1097/01.blo.0000229311.36007.c7
- Юрченко Д.Ю., Бурцев Д.В., Кузнецов С.А., Сагакянц А.Б., Мкртчян Г.А., Старжецкая М.В., Беспалова А.И., Поповян О.П., Куштова Л.Б. Некоторые особенности молекулярно-генетического патогенеза Саркомы Юинга (обзор литературы). Современные проблемы науки и образования. 2019; 3. [Интернет]. URL: http:// science-education.ru/ru/article/view?id=28924.
- Рыков М.Ю. "Клинические маски" костных сарком у детей: шесть клинических случаев. Вопросы современной педиатрии. 2018; 17(1): 89-93. DOI: 10.15690/vsp.v17i1.1860
- Кит О.И., Балязин-Парфёнов И.В., Барашев А.А.; Ростовский научно-исследовательский онкологический институт. Способ лечения опухолей позвоночника. Патент № 2551622, МПК A61B, А61К, А61Р. № 20141063936; Заявл. 20.04.14; Опубл. 27.05.15, Бюл. № 15.
- Battacharjee S., Kuruganti Venkata S.R., Uppin M.S. Skull and spinal Ewing's sarcoma in children: An institutional study. J Pediatr Neu-rosci. 2018; 13: 392-7. DOI: 10.4103/jpn.JPN_109_18
- Рыков М.Ю., Севрюков Д.Д., Вилкова А.С. Злокачественные новообразования у детей: Клинические проявления и диагностика. Вопросы современной педиатрии. 2017; 16(5): 370-382


