Клиническое наблюдение типичного карциноида легкого с АКТГ-паранеопластическим синдромом
Автор: Левицкий А.В., Чемулова В.Ю., Авдалян А.М., Мосин С.В., Тер-Ованесов М.Д., Колган Е.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.24, 2025 года.
Бесплатный доступ
Актуальность. Нейроэндокринные опухоли, ассоциированные с АКТГ-эктопированной секрецией, являются редкими наблюдениями в клинической практике. Основная сложность данной патологии заключается в поздней диагностике из-за многообразия клинических проявлений эндокринопатии, что отдаляет специализированное лечение. Кроме того, наличие эктопированного синдрома Кушинга обусловливает риск метаболических, инфекционных осложнений, потенцирует тяжесть состояния больного и риск оперативного вмешательства, являющегося основным методом радикального лечения больных. Цель исследования – улучшение результатов лечения больных нейроэндокринными опухолями легких, ассоциированными с АКТГ-паранеопластическим синдромом, путем описания отдельного клинического наблюдения. Материал и методы. Материалом для статьи явились данные ГБУЗ ММКЦ «Коммунарка» департамента здравоохранения города Москвы, где проводились диагностика и лечение больной с нейроэндокринной опухолью легкого, ассоциированной с АКТГ-эктопированным синдромом. Проведен комплекс лабораторных и инструментальных методов обследования, направленный на анализ распространенности опухолевого процесса, оценку функционального статуса, изучение гормонального профиля и дифференциальную диагностику АКТГ-зависимого и АКТГ-независимого гиперкортицизма. По результатам обследования выполнена радикальная операция в объеме торакоскопической лобэктомии. В послеоперационном периоде отмечен регресс клинических и серологических проявлений АКТГ-эктопированного синдрома. Гистологическое и иммуногистохимическое исследование операционного материала подтвердило типичный вариант легочного карциноида. Заключение. Представленное клиническое наблюдение и анализ литературы демонстрируют сложность патологии, необходимость поливалентного и своевременного обследования больных, проведения предоперационной коррекции эндокринных нарушений и радикального хирургического лечения, определяющего прогноз заболевания.
Типичный карциноид легкого, нейроэндокринные опухоли легких, хирургическое лечение, паранеопластический синдром, АКТГ-эктопированная секреция, синдром Кушинга, гиперкортицизм
Короткий адрес: https://sciup.org/140313337
IDR: 140313337 | УДК: 616.24-006.6:616.453.72-008.61 | DOI: 10.21294/1814-4861-2025-24-6-183-191
Текст научной статьи Клиническое наблюдение типичного карциноида легкого с АКТГ-паранеопластическим синдромом
Нейроэндокринные опухоли легких – это гетерогенная группа новообразований из клеток нейроэндокринной APUD-системы, подразделяющиеся на две категории: высокодифференцированные, или собственно нейроэндокринные опухоли, и низкодифференцированные, или нейроэндокринные карциномы [1]. Устоявшийся для нейроэндокринных опухолей легких термин «карциноид» применим только для высокодифференцированной группы, включающей в себя типичный и атипичный варианты, соответственно низкой (G1) и умеренной (G2) степени злокачественности [1, 2].
В структуре всех злокачественных новообразований бронхолегочной локализации карциноиды составляют не более 1–2 % [3]. Несмотря на наличие специфических нейросекреторных гранул и способность к синтезу гормонально-активных биологических веществ, паранеопластические синдромы при карциноидах встречаются редко. Так, карциноидный синдром встречается лишь в 7,6 % случаев [4], а синдром Кушинга, вследствие эктопированной АКТГ секреции, не более чем в 4,3 % [5]. Несмотря на редкость синдрома АКТГ-эктопированной секреции при карциноидных опухолях, его клиническое значение весьма высоко, поскольку оно оказывает влияние на сроки выявления заболевания, усложняет диагностический алгоритм, утяжеляет состояние больных за счет симптомов гиперкортицизма, что, в свою очередь, потенцирует риск послеоперационных осложнений и диктует необходимость специфической предоперационной подготовки.
Представлено клиническое наблюдение хирургического лечения пациентки с карциноидом легкого, ассоциированного с АКТГ-эктопическим синдромом Кушинга, в отделении торакальной онкологии ГБУЗ ММКЦ «Коммунарка» ДЗМ.
Клиническое наблюдение
Пациентка А., 1960 г.р., в 2021 г. взята под наблюдение районной поликлиникой по поводу впервые выявленных сахарного диабета II типа и гипертонической болезни. Гипертоническая болезнь отличается кризовым течением с подъемами артериального давления до 220/110 мм рт. ст. Дважды, в 2021 и в 2023 г., перенесла острое нарушение мозгового кровообращения по ишемическому типу на фоне гипертонии.
В июле 2023 г., в связи с декомпенсацией сахарного диабета, госпитализирована в эндокринологический стационар. Основными жалобами были выраженная мышечная слабость, потеря массы тела, суммарно за 2 года составившая 40 кг, или 55 % от исходного веса. Индекс массы тела пациентки составлял 17,3 кг/м2. Лабораторно, наряду со стойкой гипергликемией до 18 ммоль/л, впервые была выявлена гипокалиемия, со снижением уровня калия до 2 ммоль/л.
По результатам комплексного обследования, включающего гормональный статус гипофизарнонадпочечниковой системы, выявлено повышение уровня АКТГ до 108,0 пг/мл (референсные значения 7,2–63,3 пг/мл), кортизола суточной мочи до 466 мкг/сут (референсные значения 4,3–176 мкг/сут), кортизола крови в утренние часы до 1700 нмоль/л (референсные значения: 250–650 нмоль/л). Ночной подавляющий тест с 1 мг дексаметазона выявил отсутствие подавления уровня кортизола, с сохранением его на исходном уровне. С целью дифференциальной диагностики АКТГ-зависимого и АКТГ-независимого гиперкортицизма проведена большая дексаметазоновая проба. По полученным конечным результатам проба расценена как отрицательная, поскольку не было выявлено подавления кортизола, уровень которого составил также 1700 нмоль/л, как изначально.
Для выявления источника патологической секреции АКТГ выполнены МРТ головного мозга с контрастным усилением и КТ грудной клетки и брюшной полости с контрастным усилением. Изменений в гипофизе и надпочечниках не обнаружено. Единственной выявленной опухолевой патологией явилось периферическое образование нижней доли правого легкого (рис. 1).
На основании полученных данных был выставлен диагноз периферической опухоли нижней доли правого легкого, предварительно расцененной как карциноид cT2aN0M0, ассоциированной с АКТГ-паранеопластическим синдромом. Учитывая наличие достаточно явного предполагаемого источника патологической секреции АКТГ, отсутствие данных за регионарное и отдаленное метастазирование, дополнительная визуализирующая диагностика в виде соматостатин-рецепторной сцинтиграфии или ПЭТ с 68Ga-DOTA-конъюгированным аналогом соматостатина не проводилась.
Как осложнение стероидогенеза был выставлен остеопороз средней степени тяжести, с патологической клиновидной деформацией тел грудных позвонков, стероидный диабет, артериальная гипертензия. Пациентке назначена комплексная симптоматическая терапия, включающая ингибиторы стероидогенеза в виде кетоконазола, препараты калия, инсулинотерапию, антигипертензивную терапию.
Под наблюдение Центра амбулаторной онкологической помощи ММКЦ «Коммунарка» больная взята в октябре 2023 г.
К моменту постановки на онкологический учет общесоматический статус пациентки расценивался как ECOG 3, индекс Карновского 40 %, что было обусловлено вышеприведенными осложнениями стероидогенеза, истощением, хроническим болевым синдромом на фоне остеопороза и деформации позвонков. Несмотря на тяжелый соматический статус, принято решение о хирургическом лечении в объеме торакоскопической нижней лобэктомии справа с ипсилатеральной медиастинальной лимфодиссекцией. Дооперационная морфологическая верификация опухоли не производилась.
Пациентка оперирована 13.11.23 в указанном объеме. При интраоперационной ревизии выпота в плевральной полости, плевропульмональной дис-семинации, лимфаденопатии корня и средостения выявлено не было. Опухоль находилась в заднем базальном сегменте (S10), интрапаренхиматозно, без вовлечения висцеральной плевры. Длительность операции составила 130 мин с кровопотерей 50 мл. Пациентка была экстубирована на операционном столе. Длительность пребывания в отделении реанимации составила 1 сут.
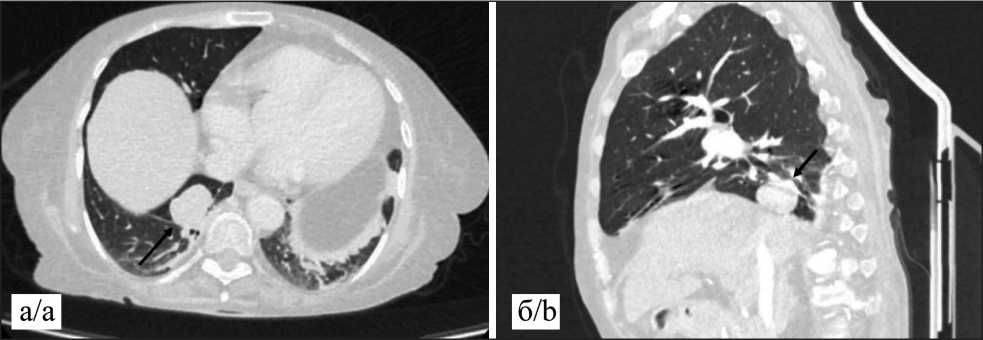
Рис. 1 Компьютерная томография в аксиальной (а) и сагиттальной (б) проекции в легочном и мягкотканом окне, толщина срезов 1,5 мм. В S10 правого легкого паравертебрально солидное периферическое образование с четкими контурами, размерами 32×26×20 мм, с высоким градиентом накопления контраста с 35 до 150 ед HU в артериальную фазу. Данных за внутригрудное лимфогенное или отдаленное метастазирование не выявлено. Примечание: рисунок выполнен авторами
Fig. 1. Axial (a) and sagittal (b) computed tomography scans with lung and soft tissue windows, slice thickness of 1.5 mm. In S10 of the right lung, there is a paraventricular solid peripheral lesion with clear contours, measuring 32×26×20 mm, with a high contrast accumulation gradient from 35 to 150 HU in the arterial phase. No evidence of intrathoracic lymphatic or distant metastasis was detected. Note: created by the authors
Начиная со 2-х сут послеоперационного периода отмечена нормализация уровня кортизола и АКТГ. На 2-е и 7-е сут после операции уровень кортизола в утренние часы составил 357,0 нмоль/л и 495,8 нмоль/л соответственно, при референсных значениях 250–650 нмоль/л, АКТГ на 2-е сутки составил 9,95 пг/мл, при референсных значениях 7,2–63,3 пг/мл. Также нормализовался уровень глюкозы крови, исчезла потребность в инсулинотера-пии. Заместительная глюкокортикоидная терапия не проводилась ввиду отсутствия клинических проявлений надпочечниковой недостаточности, электролитных нарушений, а также сохранения уровня кортизола крови и АКТГ в пределах референсных значений. Субъективно пациентка отметила уменьшение выраженности мышечной слабости.
Течение послеоперационного периода осложнилось пролонгированным сбросом воздуха. Аэростаз был достигнут на 12-е сут после операции с последующим удалением плеврального дренажа. Выписана на 14-е сут после операции с улучшением состояния, оцениваемого по шкале ECOG в 2 балла.
При патоморфологическом исследовании операционного материала получены следующие данные. Операционный материал был фиксирован сразу после операции в забуференном 10 % растворе нейтрального формалина в течение 24 ч при температуре +4–5 °С, после чего рутинным методом с использованием заливки в парафин были изготовлены серийные гистологические препараты, окрашенные гематоксилином и эозином. Патологоанатомические исследования проводили, строго соблюдая принципы биобезопасности. Иммуногистохимическое исследование проводили с использованием иммуностейнера Ventana BenchMark Ultra и антител к CD 56, Chromogranin A, Synaptophysin, TTF-1, Ki67, Pan Keratin.
При макроскопическом исследовании препарата: опухоль представлена узловым образованием, размерами 3,8×3,0×2,0 см, мягко-эластической консистенции, в тонкой гладкой светло-серой капсуле, на разрезе серовато-желтоватого цвета, однородного вида, без инвазии висцеральной плевры.
При микроскопическом исследовании: опухоль преимущественно тубулярного типа строения, с отчетливыми гландулярными структурами с периваскулярным типом роста и образованием розетковидных формирований (рис. 2). Клетки мономорфного типа с округлым ядром с гранулярным нежным хроматином по типу «соль и перец», единичными мелкими ядрышками. Митотическая активность низкая (менее 2 митозов на 2 мм2). Строма по периферии в виде тонких гиалинизиро-ванных прослоек. При ИГХ-исследовании выявлена выраженная экспрессия опухолевыми клетками Chromogranin A. Также выявлена экспрессия Synaptophysin, CD56, TTF1 (рис. 3). Индекс проли-
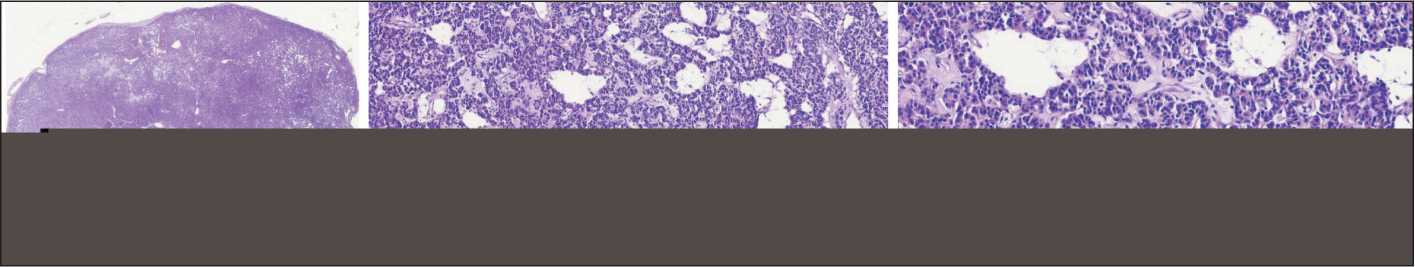
Рис. 2. Микрофото. Образование отграничено от окружающей ткани без инфильтративного роста (а), преимущественно с тубулярным типом строения с построением отчетливых гландулярных структур с периваскулярным типом роста и образованием розетковидных формирований с клетками с округлым ядром и гранулярным нежным хроматином по типу «соль и перец», единичными мелкими ядрышками. Митотическая активность низкая (менее 2 митозов на 2 мм2 (б–в)). Окраска гематоксилином и эозином; а – ×4; б – ×10; в – ×20. Примечание: рисунок выполнен авторами
Fig. 2. Microphoto. The lesion is delineated from the surrounding tissue without infiltrative growth (a), predominantly with a tubular type of structure with the formation of distinct glandular structures with a perivascular type of growth and rosettes with cells having a rounded nucleus with granular, delicate chromatin in a “salt and pepper” pattern, and single small nucleoli. Mitotic activity is low (less than 2 mitoses per 2 mm2 (b–c). Hematoxylin and eosin staining; a – ×4; b – ×10; c – ×20. Note: created by the authors
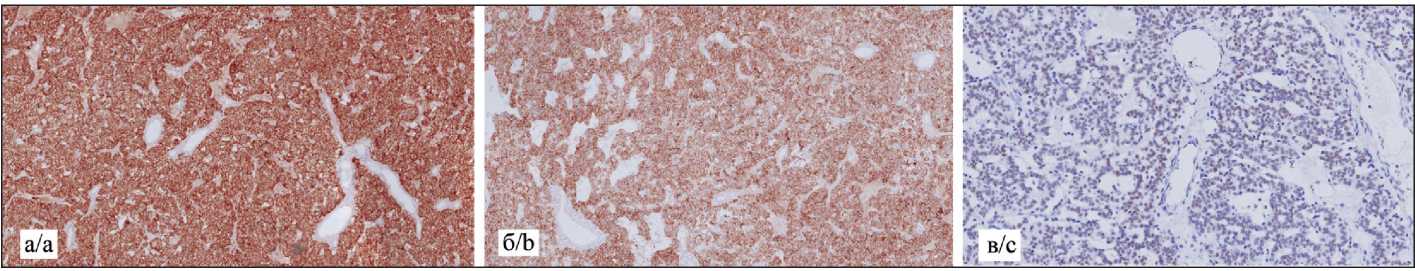
Рис. 3. Микрофото. ИГХ-исследование. Цитоплазматическая выраженная экспрессия Synaptophysin (а) и CD56 опухолевыми клетками (б); ядерная экспрессия TTF1 опухолевыми клетками на периферии образования от слабой до умеренно выраженной (в); а–в – ×10. Примечание: рисунок выполнен авторами
Fig. 3. Microphoto. IHC study. Cytoplasmic strong expression of Synaptophysin (a) and CD56 by tumor cells (b), The nuclear expression of TTF1 by tumor cells on the periphery of the lesion is weak to moderate (c); a–c – ×10. Note: created by the authors
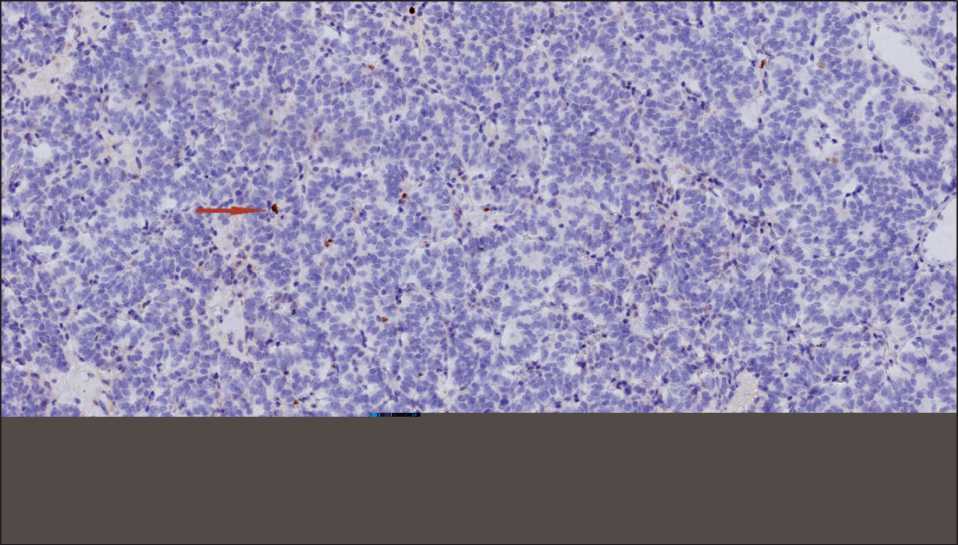
Рис. 4. ИГХ-исследование. Индекс Ki67 равномерный, невысокий – до 2 % (стрелками обозначены единичные позитивные клетки), ×10. Примечание: рисунок выполнен авторами
Fig. 4. Microphoto. IHC study. Ki67 index is uniform, low, up to 2 %; ×10. The arrows indicate single positive cells.
Note: created by the authors
ферации по уровню экспрессии маркера Ki67 был равномерным и невысоким – до 2 % (рис. 4). На основании морфологической картины подтвержден типичный карциноид нижней доли правого легкого T2aN0M0 IB стадии.
В течение 14 мес диспансерного наблюдения признаков прогрессирования заболевания не выявлено. Уровень кортизола крови на 2, 6 и 10-й мес диспансерного наблюдения составил 362, 306 и 292 нмоль/л соответственно (референсные значения – 176,6–629 нмоль/л). Течение гипертонической болезни в настоящее время контролируемое, при минимальном объеме антигипертензивной терапии, гликемия натощак при самоконтроле составляет 5–6 ммоль/л. Прием пероральных сахароснижающих препаратов не требуется. Помощь в самообслуживании требуется в минимальном объеме, статус по шкале ECOG в постреабилитационном периоде составляет 1 балл.
Обсуждение
АКТГ-эктопированный синдром является крайне редкой и одной из самых серьезных эндокринных паранеоплазий, обусловленных гиперпродукцией адренокортикотропного гормона (АКТГ) и кортикотропин-рилизинг гормона, патологическим источником которых может являться злокачественная нейроэндокринная опухоль.
Впервые пациента с признаками АКТГ-эктопированного синдрома Кушинга на фоне мелкоклеточного рака легкого описал W. Hurst Brown в 1928 г. Однако автором не прослежена взаимосвязь между опухолью и гиперкортицизмом [6]. Понимание о подобной связи получено лишь в 60-х гг. XX века, благодаря работе G.W. Liddle et al. [7], открывших способность некоторых внеги-пофизарных опухолей секретировать АКТГ.
Одной из исторических фундаментальных работ, представившей АКТГ-эктопированный синдром во взаимосвязи с нейроэндокринными опухолями, является исследование J. Aniszewski et al. [8]. В это ретроспективное исследование включено 106 пациентов с АКТГ-эктопированным синдромом, оперированных в период с 1956 по 1998 г. Нейроэндокринные опухоли бронхолегочной локализации были определены как наиболее частый источник АКТГ секреции, карциноидные опухоли легкого из всей когорты составили 25 %, мелкоклеточный рак легкого – 11 %.
Ассоциация нейроэндокринных опухолей легких и АКТГ-эктопированного синдрома продемонстрирована и в более поздних отечественных когортных исследованиях [9, 10]. В них нейроэндокринные опухоли в основном были представлены карциноидами легких (62,3 %). Более редкими источниками АКТГ-эктопического синдрома явились нейроэндокринные опухоли тимуса (7 %) и поджелудочной железы (5,4 %), феохромоцитома (3,8 %), медуллярный рак щитовидной железы (0,8 %), Следует отметить, что в достаточно большом количестве наблюдений манифестации АКТГ-эктопированного синдрома, составивших 19,2 %, выявить локализацию нейроэндокринной опухоли не удавалось [9]. Для таких больных основным методом, по сути, паллиативного лечения являлась двусторонняя адреналэктомия.
В литературе приводятся данные по частоте двух вариантов АКТГ-эктопированного синдрома при карциноидах торакальной локализации. Первый вариант – АКТГ-эктопированный синдром, определяемый только при лабораторной диагностике, встречается с частотой 24,8 % [11], второй вариант – АКТГ-секреция с клиническими проявлениями синдрома Кушинга – встречается гораздо реже, с частотой не более 2–4,3 % [5, 11]. Течение первого варианта ничем не отличается от течения типичной нейроэндокринной опухоли без гормональных проявлений и в рутинной практике остается недиагностированным, если по какой-либо причине не назначается гормональный профиль
-
[5] . Второй вариант, обусловленный клиническими проявлениями, требует более взвешенного подхода в алгоритме диагностики и лечения.
При подозрении на наличие у пациента синдрома Кушинга диагностическая концепция состоит из трех этапов: подтверждение эндогенного гиперкор-тицизма; дифференциальная диагностика между АКТГ-зависимым и АКТГ-независимым синдромом Кушинга; определение локализации источника продукции АКТГ (гипофиз или эктопическая секреция) [12–14]. В алгоритм поиска источника эктопической секреции входят КТ органов грудной клетки, брюшной полости и малого таза с контрастным усилением в сочетании с УЗИ щитовидной железы и МРТ с контрастным усилением головного мозга. Опционально выполняются гастро- и колоноскопия. Соматостатин-рецепторная сцинтиграфия и ПЭТ с 68Ga-DOTA-конъюгированным аналогом соматостатина используются как методы уточняющей диагностики [13].
Сложность и частая задержка в обследовании и своевременной диагностике нейроэндокринной опухоли с гиперкортицизмом обусловлена двумя основными факторами. Во-первых, незаметным началом и медленным прогрессированием заболевания, в связи с чем первые симптомы нередко интерпретируются как последствия возрастных изменений или хронических заболеваний [11]. В этой связи, согласно литературным данным, интервал от появления симптомов гиперкортицизма до постановки диагноза АКТГ-эктопированного синдрома довольно широк и составляет от 2 до 264 мес [5, 9, 10]. Во-вторых, преобладающе малыми размерами самой гормонально-активной опухоли [12, 15]. Например, в работе K.P. Seastedt et al. [15], посвященной результатам хирургического лечения пациентов с нейроэндокринными опухолями легких, из всех карциноидов с АКТГ-эктопированным синдромом 55,9 % были размерами менее 10 мм. Следует отметить отсутствие зависимости между выраженностью клинических проявлений гипер-кортицизма и размерами опухоли [12, 15].
В представленном наблюдении АКТГ-эктопиро-ванный синдром манифестировал артериальной гипертензией и стероидным диабетом. Учитывая атипичную картину течения болезни и отсутствие характерных для синдрома Кушинга изменений внешности: диспластического ожирения, лунообразного лица, стрий, гирсутизма, целевое обследование на гиперкортицизм длительное время не проводилось.
Также следует отметить, что с момента появления признаков сахарного диабета, в рамках общего диспансерного наблюдения, пациентке трижды выполнялась обзорная рентгенография органов грудной клетки, однако опухолевая патология легких не была выявлена. При этом итоговый размер опухоли в нашем наблюдении, 3,8 см, малым не является, соответствует критерию T2 по класси- фикации TNM 8 [14] и доступен для обнаружения при стандартной рентгенографии. Возможно, сложность в диагностике была обусловлена локализацией опухоли в заднебазальном сегменте (S10) по заднему скату диафрагмы. КТ органов грудной клетки на амбулаторном этапе пациентке не выполнялась.
Таким образом, из-за неспецифичности симптомов и низкой информативности лучевой диагностики методом рутинной рентгенографии временной интервал от первых клинических проявлений гиперкортицизма до обнаружения опухоли в нашем наблюдении составил 24 мес. За указанный период у пациентки развились осложнения стероидогенеза. Помимо диабета и кризовой гипертензии, на фоне которых больная дважды перенесла острое нарушение мозгового кровообращения, у нее развились стероидная миопатия, остеопороз с клиновидной деформацией тел грудных позвонков и хроническим болевым синдромом, а также алиментарная гипотрофия, что в совокупности негативно сказалось на качестве жизни.
Единственным методом радикального лечения больных с АКТГ-эктопированным гиперкортициз-мом является хирургическое удаление источника патологической гормональной секреции, после чего отмечается полный регресс клинических проявлений [16, 17]. Объем операции, согласно клиническим рекомендациям, – анатомическая резекция с ипсилатеральной медиастинальной диссекцией – лобэктомия либо при периферической опухоли размером до 2 см – сегментэктомия [14, 18]. Операции меньшего объема, атипичные резекции не рассматриваются как радикальные при хирургическом лечении больных нейроэндокринными опухолями легких. В нашем наблюдении, учитывая размер опухоли, выполнена стандартная лобэктомия торакоскопическим доступом с ипсилатеральной медиастинальной лимфодиссекцией.
Еще одним обсуждаемым фактором лечения больных нейроэндокринными опухолями с АКТГ-эктопированным синдромом являются особенности послеоперационного периода. В литературе указывается на возможную тяжесть послеоперационного периода и риск послеоперационных осложнений как инфекционных, так и сердечно-легочных и метаболических, что обусловлено, во-первых, уже сформированными эндокринными нарушениями, с которыми больной поступает в клинику [9, 13, 17], во-вторых, риском синдрома рикошета, в виде развития острой надпочечниковой недостаточности после удаления очага эктопической секреции [19, 20]. Некоторые авторы указывают на необходимость профилактического применения системных глюкокортикоидов в послеоперационном периоде [19]. В нашем наблюдении мы не столкнулись с тяжелым послеоперационным периодом, отличающимся от типичного после анатомических резекций легких. Признаков надпочечниковой недостаточ- ности не было, системные глюкокортикоиды мы не применяли. Наоборот, мы отмечаем постепенное уменьшение уровня кортизола и АКТГ сыворотки крови и нормализацию гликемического профиля. Единственное осложнение, которое мы фиксируем у пациентки, было пролонгированное продувание в течение 12 сут. Данное осложнение не является зависимым от АКТГ-эктопированной секреции фактором. После хирургического лечения симптомы гиперкортицизма купированы в течение первой недели послеоперационного периода.
Как известно, карциноиды бронхолегочной локализации после хирургического лечения характеризуются благоприятным прогнозом, с общей 5-летней выживаемостью после хирургического лечения 82–100 % при типичном и 50–95 % при атипичном карциноиде [21]. По мнению ряда авторов, АКТГ секретирующие карциноиды обладают большей агрессивностью и большей частотой метастазирования в регионарные лимфатические узлы, по сравнению с функционально неактивными вариантами: 50 % против 21 % [22], однако доказательной негативной корреляции гормональной активности карциноидов с показателями общей и безрецидивной выживаемости в литературе не представлено [5, 23].


