Клиническое наблюдение успешного лечения BRAF-ингибитором непрерывно рецидивирующего гистиоцитоза из клеток Лангерганса
Автор: Валиев Т.Т., Белышева Т.С., Хачатрян А.А., Бабелян С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Клиническое наблюдение
Статья в выпуске: 4 т.18, 2022 года.
Бесплатный доступ
Результаты лечения больных гистиоцитозом из клеток Лангерганса (ГКЛ) в настоящее время являются весьма успешными. Современные протоколы лечения LCH III, LCH IV позволяют получить практически 100% выживаемость при односистемном ГКЛ. В случаях мультисистемного заболевания 5-летняя общая выживаемость (ОВ) составляет 81,2%. Возникающие рецидивы требуют более интенсивной полихимиотерапии, которая является достаточно эффективной (5-летняя ОВ при рецидивах достигает 85%), но весьма токсичной. Одной из возможных опций в лечении рецидивов ГКЛ является таргетная терапия, направленная на мутацию в гене BRAF, которая присутствует у 60% больных ГКЛ. BRAF-ингибиторы только начинают использоваться при ГКЛ у детей, но предварительные результаты позволяют надеяться на высокую эффективность и низкую токсичность. В настоящей статье представлен сложный дифференциально-диагностический и терапевтический случай ГКЛ у ребенка 4 лет. Дебют заболевания с кожных проявлений привел к ошибочному диагнозу атопического дерматита, неэффективное лечение которого топическими кортикостероидами, присоединение системных поражений заставило усомниться в диагнозе и провести биопсию кожи. На момент получения морфо-иммунологического заключения, ГКЛ диссеминировал до мультисистемного, многоочагового заболевания, которое прогрессировало на фоне проведения терапии первой и второй линий. Попытка терапии BRAF-ингибитором (вемурафенибом) оказалась успешной. Получен частичный эффект.
Гистиоцитоз из клеток лангерганса, дерматит, мутация brafv600, вемурафениб, дети
Короткий адрес: https://sciup.org/170196136
IDR: 170196136
Текст научной статьи Клиническое наблюдение успешного лечения BRAF-ингибитором непрерывно рецидивирующего гистиоцитоза из клеток Лангерганса
детей до 1-2 лет [1].
Наиболее часто заболевание поражает кости (80%), кожу (33%), гипофиз (25%), печень (15%), селезенку (15%), костный мозг (15%), легкие (15%), лимфатические узлы (5-10%) и центральную нервную систему (2-4%). Системные симптомы, такие как лихорадка, вялость и потеря веса, могут отмечаться у пациентов с односистемным или мультиси- стемным заболеванием. Лихорадка наблюдается в 50% случаев. Разнообразие симптомов способствует высокой частоте ошибочных диагнозов (16%), что в дальнейшем приводит к диссеминации патологического процесса и задержке в терапии [2,3].
Кожа является второй по частоте поражения системой организма при ГКЛ. Вовлечение кожи в патологический процесс в 87-93% сопровождается мультисистемными проявлениями заболевания. В случаях кожных поражений у больных присутствуют и другие клинические симптомы: лихорадка (52%), гепатомегалия (52%), спленомегалия (48%), очаги деструкции в костях (39%) и очаговые изменения легких (36%). Изолированная кожная/слизи-стая локализация ЛКГ встречается у 2% больных и, как правило, ассоциирована с хорошим прогнозом при проведении современной терапии [1].
Для ГКЛ характерен полиморфизм кожных высыпаний. Очаги на коже располагаются симметрично, генерализовано, чаще всего локализуются на коже головы и туловища. При осмотре кожные поражения напоминают себорейный или атопический дерматит, экзему. Элементы сыпи представлены точечными эритематозными или телесного цвета папулами или пустулами, возможно присутствие петехий с чешуйками, корками или без них. Описаны элементы пурпуры при кожной локализации ГКЛ. В ряде случаев кожные поражения могут напоминать ксантомы, витилиго, крапивницу, что существенно затрудняет диагностику ГКЛ. В виде единичных наблюдений приводятся кожные поражения, напоминающие кандидоз, когда только микробиологическая идентификация грибов рода Candida помогает подтвердить либо опровергнуть диагноз [4].
С учетом частого поражения кожи при ГКЛ, пациенты на первом этапе попадают на прием к врачу-дерматологу, который, подозревая атопический дерматит, псориаз или экзему, рекомендует терапию топическими глюкокортикостероидами. Но поражения кожи при ГКЛ практически не реагируют на проводимое местное лечение, что заставляет усомниться в диагнозе и провести биопсию кожи с последующим морфо-иммунологическим исследованием.
Современная терапия ГКЛ проводится по протоколам LCH-III и LCH-IV (винбластин, преднизолон, метотрексат, 6-меркаптопурин). Прогноз при односистемном ГКЛ хороший с практически 100% выживаемостью. При мультисистемном заболевании 5-летняя бессобытийная выживаемость (БСВ) составляет 49,4%, общая выживаемость – 81,2%. Как правило, рецидивы возникают в местах первичной локализации, реже – в другом месте. При поражении «органов риска» (печени, селезенки, костного мозга) с нарушением их функций 5-летняя БСВ больных с мультисистемным поражением ниже и составляет 29,3+/-10% [5].
Не только поражение «органов риска» является фактором неблагоприятного прогноза, но и ответ на проводимую терапию в течение первых 6 недель (винбластин и преднизолон) является прогностически значимым. В отличие от пациентов с ранним ответом на терапию, у пациентов, которые на терапию не ответили, выше показатели смертности и реже случаи достижения полной ремиссии (70% против 20%) [1].
При рецидивах ГКЛ применяется кладрибин в сочетании с цитарабином. Данная схема позволяет получить 5-летнюю ОВ у 85% больных, но сопровождается высокими показателями токсичности 4 степени [6].
Важным молекулярно-биологическим событием при ГКЛ стало открытие мутации V600Е в гене BRAF, который относится к семейству RAF-киназ. Частота мутации BRAFV600E при ГКЛ достигает 60%. Однако, даже при отсутствии мутации в гене BFAF в 100% случаев ГКЛ происходят мутации сигнального пути MAPK/ERK, включающего ряд протеин-киназ RAS-RAF-MEK-ERK. Данные протеинкиназы регулируют клеточную дифференцировку, пролиферацию и апоптоз. Мутации в гене BRAF оказались удобной таргетной мишенью, а разработка BRAF-ингибиторов (вемурафениба) открыла дополнительные терапевтические перспективы при ГКЛ [7].
Вемурафениб был одобрен FDA в 2011 году для пациентов с рецидивным или рефрактерным течением ЛКГ. Позднее стали предприниматься попытки включения вемурафениба в программы терапии пациентов с мультисистемным поражением, в том числе с вовлечением «органов риска», особенно при развитии жизнеугрожающих состояний. Клинический эффект при лечении вемурафенибом наступает уже на первой неделе терапии, тогда как наилучший ответ достигается, в среднем, через 5,25 месяцев от начала лечения. В 58% возможен полный регресс проявлений ГКЛ, у 36% больных регистрируется существенный регресс проявлений и улучшение общего состояния, а общее число ответов на лечение вемурафенибом составляет 94,4% [8]. Несмотря на высокую эффективность вемурафениба у пациентов с неблагоприятным прогнозом, остается открытым вопрос длительности терапии.
Современный опыт применения вемурафениба у детей с рецидивами ГКЛ небольшой, в связи с чем представление каждого нового клинического наблюдения представляет интерес.
Пациент Б, 21.03.2017 г.р. Родители пациента без отягощенного по атопии семейного анамнеза. Впервые отметили появление у ребенка высыпаний на коже волосистой части головы, ушных раковин в возрасте 1,5 лет. Поражения кожи были представлены эритемой, выраженным шелушением, трещинами, желтоватыми корками, папулами, не сопровождались зудом. Отечности, экссудации, мокнутия в области высыпаний не отмечалось. Кожа лица, кистей, бедер, наружных поверхностей голеней оставалась интактной. Пациент наблюдался по месту жительства у дерматолога с диагнозом атопический дерматит, получал лечение антигистаминными препаратами, топическими кортикостероидами длительно без терапевтического эффекта. Улучшения на фоне соблюдения гипоаллергенной диеты также не отмечалось. Сезонности обострений и влияния провоцирующих факторов (аллергенов, ирритантов, пищевых продуктов) не прослеживалось. Количество элементов сыпи (папул красновато-коричневого цвета, корок желтовато-серого цвета) проградиент-но увеличивалось, постепенно вовлекая в процесс кожу лица (лоб, височные области), туловища. В то же время кожа задней поверхности шеи, области локтевых и подколенных складок, сгибательных поверхностей голеностопных и лучезапястных суставов оставалась свободной от высыпаний. Жалобы на зуд все также отсутствовали. Ребенок продолжал находиться под наблюдением дерматолога по месту жительства, периодически получая терапию топическими кортикостероидами без эффекта.
В январе 2021года, в возрасте 4 лет, при диспансерном наблюдении в общем анализе крови отмечалось снижение уровня гемоглобина до 50 г/л, со стороны остальных показателей – без отклонений. Исследование обмена железа не проводилось, но педиатром были назначены препараты железа с незначительным эффектом. В марте 2021 года при осмотре ребенка мать заметила дефекты теменной и височной костей черепа. В мае 2021 года стала нарастать слабость, бледность кожных покровов, снижение аппетита у ребенка. По рекомендации педиатра 28.05.2021г проведено УЗИ периферических лимфатических узлов: с обеих сторон шеи - увеличенные лимфатические узлы до 14 х 8 мм справа, 17 х 8 мм слева с неровным утолщением, снижением эхогенности; подмышечные лимфатические узлы до 6 х 3 мм, паховые до 12 х 5 мм справа, 11х 8 мм слева, однородной структуры.
По данным компьютерной томографии (КТ) органов грудной клетки с внутривенным контрастированием 01.06.21 - легкие без очаговых и инфильтративных изменений. Обнаружены признаки гидроперикарда, гепатомегалия (вертикальный размер правой доли печени - 136 мм, +36 мм из-под ребра), очаговые образования не определялись, вне-/ внутрипеченочные протоки не изменены. Спленомегалия (вертикальный размер селезенки - 106 мм, +28 мм из-под ребра). Обнаружено небольшое количество свободной жидкости в брюшной полости и полости таза. Литический очаг в области правой подвздошной кости 8 х14 х 14 мм. Множественные литические очаги и зоны деструкции в костях свода черепа, наиболее выраженные изменения на уровне чешуи височных костей со вздутием. Зоны литических изменений верхнечелюстных пазух, двусторонний катаральный гайморит. Гипоплазия интракраниальной части позвоночной артерии.
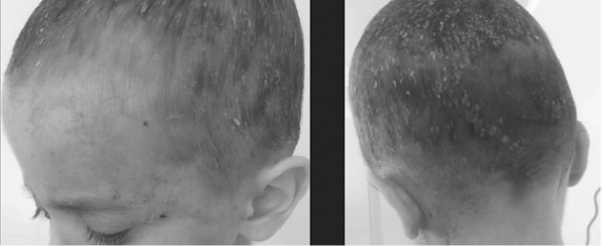
С целью дообследования, уточнения диагноза и определения тактики лечения ребенок был направлен в НИИ ДОиГ. При поступлении в июне 2021 г. состояние тяжелое, субфебрилитет, обращали на себя внимание гепатоспленомегалия, пастозность мягких тканей бедер, отек мошонки, увеличение окружности живота (59см). Высыпания на коже лица, волосистой части головы, туловища были представлены эритемой, папулами красновато-коричневого цвета диаметром от 0,2 до 0,4 см, желтовато-серыми корками (рис.1-3).
При обследовании в условиях НИИ ДОиГ 17.06.2021г по данным УЗИ определялась свободная жидкость в брюшной полости в умеренном количестве, забрюшинные лимфатические узлы патологически не изменены, дополнительные объемные образования не определялись. Печень - увеличена (КВР – 133 мм, ЛД – 56 мм), углы печени сглажены. Паренхима повышенной эхогенности, структура однородная без очаговых образований. Сосудистый рисунок обеднен. Диаметр воротной вены 6 мм. Внутрипеченочные и внепеченочные протоки не расширены. Селезенка - увеличена (100 х 46 мм), структура без очаговых изменений. Селезеночная вена расширена до 8 мм. Ультразвуковые признаки патологии со стороны желчного пузыря, поджелудочной железы, почек, яичек не выявлены.
При проведении радиоизотопного исследования с 99Тс 22.06.2021 г. на обзорных сцинтиграм-мах определялись очаги пониженного накопления радиофармпрепарата (РФП) в области костей свода черепа. Определяется повышенное накопление РФП в области костей таза. В других отделах скелета - без видимой очаговой патологии. Отмечены очаговые изменения литического характера в костях черепа.
По данным миелограммы признаков гистио-цитарной инфильтрации не было, но с учетом результатов общего анализа крови (лейкоциты 1,55 х 109/л, эритроциты 3,45 х 1012/л, тромбоциты 93 х 109/л, нейтрофилы 0,5 х 109/л) в соответствии с протоколом LCH III констатирована костномозговая недостаточность – вовлечение костного мозга при ГКЛ.
В биохимическом анализе крови (11.06.2021г) обращало внимание снижение общего белка до 56 г/л, альбумина до 29 г/л. Показатели трансаминаз, мочевины, мочевой кислоты, электролитов были нормальными.
23.06.2021 г. проведена биопсия кожи с элементами сыпи. По результатам гистологического заключения в сосочковой дерме - плотный инфильтрат из гистиоцитов со светлой цитоплазмой и инвагинацией ядерной мембраны, лимфоцитов и плазматических клеток. При иммуногистохимическом исследовании определялась экспрессия CD1а, лангергина.
На основании комплексного лабораторно-инструментального обследования был установлен диагноз: Мультисистемный, многоочаговый гисти- оцитоз из клеток Лангерганса с поражением кожи, височных костей, правой подвздошной кости, верхнечелюстных пазух, лимфатических узлов шеи, паховых, подмышечных с обеих сторон, органов риска (печень, селезенка, костный мозг). Группа высокого риска.
С июня 2021 г. была начата терапия по протоколу LCH III. Первый инициальный курс ПХТ (преднизолон, винбластин) был проведен с 11.06.2022 по 20.07.2022 гг., параллельно проводилась инфузионная терапия, заместительные трансфузии альбумина. После завершения 6-недельного курса терапии выполнены УЗИ и сцинтиграфия с 99Тс первично вовлеченных зон, по результатам которых отмечена стабилизация размеров литических очагов в костях, уменьшение размеров печени и селезенки; при осмотре – существенный регресс элементов сыпи, уменьшение размеров живота.
С учетом инициальной стратификации больного в группу высокого риска, дальнейшее лечение по протоколу LCH III предполагало введение метотрексата 500 мг/м2 наряду с винбластином и преднизолоном. Терапия метотрексатом проведена с 30.07.2021 г. по 11.09.2021 г. Лечение ребенок переносил тяжело, в постхимиотерапевтическом периоде развилась аплазия кроветворения, требовавшая проведения заместительной терапии эритроцитной массой, тромбоконцентратом; на фоне лейкопении IV степени присоединился инфекционный синдром (микробиологические исследования крови не выявили роста возбудителя). Проводимая комплексная интенсивная терапия с включением меропенема, линезолида, амикацина, вориконазола, стимуляции лейкопоэза гранулоцитарным колониестимулирующим фактором (Г-КСФ) позволила улучшить состояние больного, восстановить уровень лейкоцитов до нормальных значений, купировать инфекционные эпизоды.
При проведении контрольных обследований после завершения терапии метотрексатом по результатам сцинтиграфии с 99Тс (16.09.2021 г.) отмечено прогрессирование ГКЛ в виде появления новых очагов повышенного накопления РФП в области нижне-грудных и поясничных позвонков, костях таза и проксимальных отделах бедренных костей; неравномерно повышенное накопление РФП было в рукоятке грудины, проксимальных отделах плечевых, костей предплечий. Но в инициально пораженных костях свода черепа произошло снижение уровня накопления РФП.
По данным УЗИ 13.09.2021 г. также отмечена отрицательная динамика в виде увеличения размеров печени и селезенки, увеличения размеров лимфатических узлов в области ворот селезенки.
С учетом полученных инструментальных данных, констатировано прогрессирование ГКЛ и пациент был переведен на вторую линию терапии – цитарабин 500 мг/м2 х 2 р/сут и кладрибин (2-CdA) 9 мг/ м2/сут с 1 по 5 день терапии. Терапия по выбранной схеме начата 20.09.2021 г. На 8 день 2 курса терапии цитарабин+кладрибин в общем анализе крови лейкоциты составляли 0,3 х 109/л, тромбоциты 19 х 109/л, гемоглобин 89 г/л. Отмечен подъем температуры тела до 390С. Уровень прокальцитонина крови составлял 17 нг/мл. Были взяты образцы крови для микробиологического исследования, выполнен мазок из ануса, начата антибактериальная терапия в объеме пиперациллин/тазобактам и амикацин. Через 6-8 часов отмечены признаки дыхательной недостаточности, появление одышки до 38 в минуту, что потребовало перевода пациента в отделение реанимации и интенсивной терапии (ОРИТ). Проводилась стимуляция лейкопоэза Г-КСФ, заместительная терапия эритроцитной взвесью и тромбоконцентра-том. По данным рентгенографии органов грудной клетки очаговых и инфильтративных изменений в легких не было. Тем не менее, состояние ребенка ухудшалось, нарастало число эпизодов лихорадки, в связи с чем была проведена экскалация противоми-кробной терапии: пиперациллин/тазобактам был заменен на меропенем, к назначениям добавлен вориконазол.
По данным микробиологического исследования мазка из ануса – рост Pseudomonas spp 1 х 105, с учетом чувствительности возбудителя меропенем был заменен на цефтазидим+авибактам, к терапии добавлен колистин. Несмотря на проводимую терапию, сохранялась лихорадка до фебрильных цифр, нарастали явления сепсиса, в крови – рост прокальцитонина до 37 нг/мл, С-реактивного белка до 136 мг/л, в связи с чем было принято решение о проведении экстракорпоральных методов детоксикации. Выполнены 3 сорбционных сеанса с применением детоксикационных колонок. Проведенная терапия оказалась эффективной, позволила купировать септическое состояние. Восстановление лейкоцитов до 1,5 х 109/л отмечено к 12.10.21, купирование лихорадки – к 14.10.22, нормализация прокальцитонина и С-реактивного белка – 15.10.21.
Для оценки эффекта после проведенного лечения по схеме цитарабин+кладрибин выполнено УЗИ, по данным которого – отрицательная динамика в виде увеличения числа лимфатических узлов в воротах селезенки (визуализировалось 5 лимфатических узлов размером до 11 мм), появления единичных увеличенных лимфатических узлов в воротах печени, ультразвуковых признаков фиброза при сохраняющихся увеличенных размерах печени (косо-вертикальный размер правой доли печени – 139 мм, левой доли – 55 мм) и селезенки (113 х 49 мм).
При проведении сцинтиграфии с 99 Тс на сканограммах скелета - очаги повышенного накопления РФП в костях черепа, костях таза, грудине и неравномерное повышение накопления РФП в области проксимальных отделов плечевых, бедренных костей и костей предплечий, а также в области ниж-
1А
1Б
Рис 1А и 1Б состояние кожи головы до начала лечения
2А 2Б
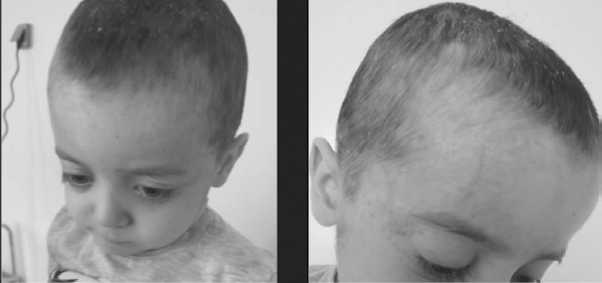
Рис 2А и 2Б – состояние кожи головы после 2х недель терапии – разрешение элементов сыпи.
не-грудных позвонков. По сравнению с предыдущим исследованием отмечается уменьшение уровня накопления РФП в области костей черепа. Появилось неравномерное повышение накопления РФП в области отдельных ребер слева. В других отделах - без существенной динамики.
В связи с отсутствием эффекта после проведенного противоопухолевого лечения, тяжелыми осложнениями постхимиотерапевтического периода и высоким риском развития фатальных осложнений при проведении полихимиотерапии (ПХТ), сохраняющейся органной дисфункцией (гипоальбумине-мия, требующая заместительных трансфузий альбу- мина 2 р/нед; лейкопения IIIст, тромбоцитопения IV ст, анемический синдром III ст) было принято решение о невозможности продолжения химиотерапии. Для определения возможности проведения терапии BRAF-ингибитором вемурафенибом предпринята попытка проведения молекулярно-генетического исследования на гистологических блоках инициальной биопсии, но оставшийся объем материала оказался недостаточным для проведения исследования. Проведение биопсии появившихся по данным УЗИ лимфатических узлов в брюшной полости или очагов костной деструкции было сопряжено с высокими хирургическими и анестезиологически-
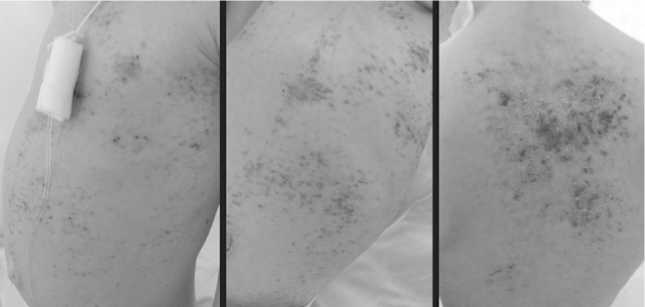
Рис.3. Состояние кожи живота и спины до начала лечения (на момент поступления в июне 2021 г.)
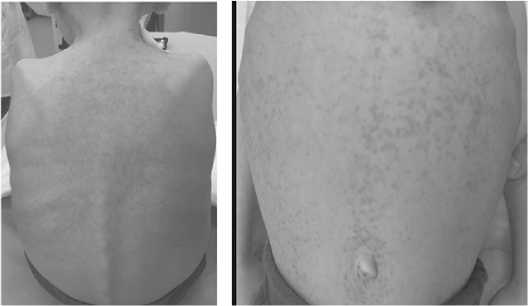
Рис. 4 Состояние кожи живота и спины до начала терапии вемурофенибом.
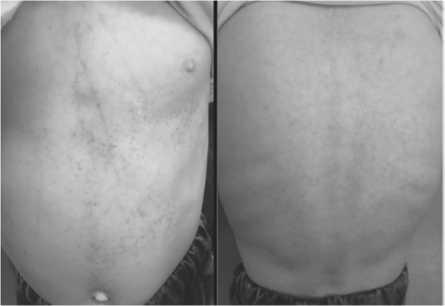
Рис. 5 Состояние кожи живота и спины спустя 6 месяцев приема вемурофениба.
ми рисками, ввиду тромбоцитопении, требовавшей проведения заместительной коррекции тромбо-концентратом, лейкопении (лейкоциты по данным общего анализа крови составляли 1,5 х 109/л), сохраняющегося белковосинтетического дефицита (общий белок по данным биохимического анализа крови 58 г/л, альбумин 28г/л, несмотря на заместительную терапию альбумином).
Учитывая неизвестный молекулярно-генетический статус заболевания, прогрессию ГКЛ на фоне проводимого лечения, наличие сочетанных соматических осложнений, но описанной достаточно высокой частоте (60%) мутаций в гене BRAFV600E при ГКЛ было принято решение об эмпирической терапии BRAF-ингибитором вемурафенибом. Данное решение было закреплено решением консилиума врачей.
Пациент начал прием вемурафениба в монорежиме в ноябре 2021 г. В течение 1 мес терапии отмечена положительная динамика в виде уменьшения элементов сыпи, снижения частоты трансфузий тромбоконцентрата, альбумина (рис.4-5). На втором месяце терапии показаний к трансфузиям тромбо-концентрата и альбумина не было.
Лечение больной переносит хорошо. Нежелательные явления и осложнения терапии не отмечены. При контрольном обследовании через 6 мес. от начала терапии вемурафенибом (май 2022 г.) в общем анализе крови лейкоциты 3,39 х 109/л, эритроциты 3,69 х 1012/л, гемоглобин 110 г/л, тромбоциты 150 х 109/л, нейтрофилы 1,93 х 109/л. Показатели биохимического анализа крови – в пределах референсных значений. По данным УЗИ органов брюшной полости печень остается увеличенной, косо-вертикальный размер правой доли печени – 130 мм, левой доли – 41 мм, паренхима стала более однородной, эхогенность средняя. Контуры ровные, четкие. Вну-трипеченочные желчные протоки не расширены. Желчный пузырь в объеме не увеличен, 64 х 19 мм, просвет анэхогенный, стенки не утолщены. Селезенка увеличена в размерах - 131 х 45 мм, паренхима средней эхогенности, контуры ровные. При КТ и сцинтиграфии с 99Тс отмечается восстановление большинства литических дефектов теменных, височных, верхнечелюстных, лобной, основной костей. Костная структура пораженных костей неоднородно уплотнена. Сохраняются литические очаги в теменных (до 14 мм справа, 11 мм слева) и лобной (несколько мелких очажков до 3мм с зоной склероза по периферии) костях.
Таким образом, после 6 мес. терапии можно констатировать частичный эффект на фоне проводимой терапии вемурафенибом в монорежиме. Больной продолжает лечение.
Обсуждение
Высокая эффективность терапии больных с впервые установленным диагнозом ГКЛ обусловлена улучшением диагностики и разработкой риск-адаптированных режимов терапии. Тем не менее, лечение рецидивов ГКЛ представляет собой сложную задачу. Программы полихимиотерапии второй линии, основанные на применении кладрибина, являются весьма токсичными.
По мере изучения молекулярно-биологических особенностей ГКЛ оказалось, что в 60% случаев обнаруживается мутация BRAFV600E, которая стала мишенью для действия таргетного препарата вему-рафениб. Мутация BRAFV600E является активирующей и приводит к быстрому повышению активности RAF-киназы и последующей активации сигнального пути RAS-RAF-MEK-ERK-MAP. В настоящее время опыт применения вемурафениба при ГКЛ ограничен описанием нескольких клинических наблюдений, но результаты, весьма обнадеживающие [7].
Представленный клинический случай демонстрирует необходимость большей онкологической настороженности со стороны врачей-дерматологов, особенно при неэффективности проводимого лечения, назначенного по поводу неопухолевой кожной патологии (атопического дерматита, псориаза и др), которая может напоминать кожные поражения ГКЛ.
Нетипичный для атопического дерматита анамнез заболевания, клиническая картина, отсутствие эффекта от топических кортикостероидов и эли- минационной диеты заставили усомниться в диагнозе. Превалирование поражения одного органа, в данном случае кожи, без развернутой клинической симптоматики заболевания привело к диагностической ошибке. Однако, изначально обращают на себя внимание: нехарактерная для атопического дерматита локализация сыпи, как в первом, так и втором возрастном периоде (интактные крупные складки), нетипичная окраска элементов (красно-коричневая, бордовая), отсутствие у пациента 4-х лет в клинической картине инфильтрации, лихенизации, экскориаций, очагов гипо- или гиперпигментации в зоне разрешившихся высыпаний, симптома Денни–Моргана (Dennie-Morgan) – продольной складки нижнего века, отсутствие такого патогномоничного симптома для атопического дерматита как зуд в течении всего периода болезни, наконец - отсутствие эффекта от местного применения глюкокортикостероидов. Дифференциальный диагноз при атопическом дерматите традиционно проводят с себорейным, пеленочным, аллергическим контактным дерматитом, обыкновенными ихтиозом и псориазом, микробной экземой, розовым лишаем Жибера, герпетиформным дерматитом Дюринга, синдромом Вискотта-Олдрича, десквамативной эритродермией Лейнера-Муссу, однако онкологическая настороженность требует проведения дифференциального диагноза и с ГКЛ.
Длительный анамнез ГКЛ (2 года) способствовал диссеминации опухолевого процесса, в результате на момент постановки диагноза ГКБ был уже многосистемным, многоочаговым с поражением органов риска. Подобная распространенность ГКЛ является фактором неблагоприятного прогноза с вероятностью гибели пациента в 20% случаев. Терапия первой линии по протоколу LCH III оказалась неэффективной. Попытка терапии второй линии по схеме цитарабин+кладрибин сопровождалась развитием жизнеугрожающих осложнений без противоопухолевого эффекта. В качестве терапии третьей линии был рассмотрен вемурафениб, который позволил получить противоопухолевый эффект. Больной будет продолжать терапию, поскольку рекомендаций по оптимальной продолжительности лечения вему-рафенибом в настоящее время нет.
Конфликты интересов отсутствует
Источник финансирования: Исследование не имело источника финансирования
Вклад авторов
Концепция и дизайн: все авторы
Сбор и обработка данных: все авторы
Предоставление материалов исследования: все авторы
Анализ и интерпретация: все авторы Подготовка рукописи: все авторы Окончательное одобрение рукописи: все авторы
Список литературы Клиническое наблюдение успешного лечения BRAF-ингибитором непрерывно рецидивирующего гистиоцитоза из клеток Лангерганса
- Jolie Krooks, Milen Minkov, Angela G. Weatherall, Boca Raton. Langerhans cell histiocytosis in children History, classification, pathobiology, clinical manifestations, and prognosis J.Am.Acad.Dermatol. - vol.78.-N6.-1035-1044.
- Валиев Т.Т., Махонова Л.А., Ковригина А.М. и др. Случай врожденного лангергансоклеточного гистиоцитоза у ребенка раннего возраста. Онкогематология. 2011. Т. 6. № 2. С. 19-23.
- Haupt R., Minkov M., Astigarraga I. et al. Langerhans cell histiocytosis (LCH): guidelines for diagnosis, clinical work up, and treatment for patients till the age of 18 years. Pediatr Blood Cancer. 2013.-vol.60.- 175-184.
- Li Z., Yanqiu L., Yan W. et al. Two case report studies of Langerhans cell histiocytosis with an analysis of 918 patients of Langerhans cell histiocytosis in literatures published in China. Int.J.Dermatol. 2010.-vol.49. - 1169-1174.
- Sidharth Totadri, Deepak Bansal, Amita Trehan et al. The 5-year EFS of Multisystem LCH with risk-organ involvement is suboptimal: a single-center experience from India. J. Pediatr. Hematol. Oncol.-2016;38(1).-1-5.
- DU Y, Xiong H, Li H. et al. Recurrent and Refractory Langerhans Cell Histiocytosis in Children Treated with the Combination of Cladribine and Cytarabine. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2022 Jun;30(3):943-949.
- Hogstad B, Berres ML, Chakraborty R. et al. RAF/MEK/extracellular signal-related kinase pathway suppresses dendritic cell migration and traps dendritic cells in Langerhans cell histiocytosis lesions. J Exp Med. 2018 Jan 2;215(1):319-336.
- Heisig A., Sörensen J., Zimmermann S.Y. et al. Vemurafenib in Langerhans cell histiocytosis: report of a pediatric patient and review of the literature. Oncotarget. 2018 Apr 24;9(31):22236-22240.


