Клинико-генетическая характеристика больных ишемическим инсультом молодого и среднего возраста
Автор: Овсянникова Анна Николаевна, Машин Виктор Владимирович, Белова Людмила Анатольевна, Саенко Юрий Владимирович, Бырина Анна Вадимовна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
С целью изучения полиморфизма генов системы гемостаза как предиктора развития ишемического инсульта проведен анализ генетических факторов риска острой ишемии мозга путем исследования полиморфных вариантов генов свертывающей системы крови у больных ишемическим инсультом (ИИ) молодого и среднего возраста. Материалы и методы. Обследовано 172 пациента. Для исследования выбраны описанные в литературе полиморфизмы генов-кандидатов ишемического поражения головного мозга: полиморфизм 20210G>A гена FII, 1691G>A гена FV, 10976G>A гена FVII, -455G>A гена FGB, -675 5G>4G гена PAI-1, 807C>T гена ITGA2, 1565Т>С гена ITGB3. Использовалась технология выявления и идентификации однонуклеотидных полиморфизмов (SNP) с анализом кривых температуры плавления («ДНК-Технология»). Изучено влияние генетических факторов на особенности течения острого периода, а также исход ИИ в обследуемой группе больных. Результаты. У больных ИИ по сравнению с контрольной группой статистически значимо преобладают полиморфные варианты генов FBG, FII, F5, ITGB3. Наиболее часто встречаемым является полиморфизм -455G гена фибриногена. Наличие полиморфных вариантов генов свертывающей системы крови определяет клинические особенности течения острого периода ишемического инсульта (патогенетический подтип инсульта, количество очагов ишемии, тяжесть неврологического дефицита) и не влияет на функциональный исход к концу острого периода заболевания. Установлено наличие генетической детерминированности ИИ у лиц молодого и среднего возраста.
Гены-кандидаты, факторы риска, ишемический инсульт, тромбофилия
Короткий адрес: https://sciup.org/14113176
IDR: 14113176 | УДК: 616.831-005.1:616-052:575
Текст научной статьи Клинико-генетическая характеристика больных ишемическим инсультом молодого и среднего возраста
Введение. Ишемическая цереброваскулярная патология представляет собой актуальную проблему современной медицины, являясь одной из основных причин смертности и инвалидизации населения [1–4]. Высокая доля в структуре заболеваемости и смертности населения, значительные показатели временных трудовых потерь и первичной инвалидности обусловливают большое медико-социальное значение сосудистых заболеваний головного мозга [3].
Основное место в структуре цереброваскулярных заболеваний занимают инсульты.
В последние годы во всем мире отмечается рост распространенности заболеваний острыми нарушениями мозгового кровообращения, при этом увеличивается количество инсультов среди лиц трудоспособного возраста – до 64 лет [2, 5].
В России заболеваемость и смертность от инсульта остаются одними из самых высоких. Так, частота инсультов в Российской Федерации составляет, по разным данным, 350–400 случаев на 100 тыс. населения [1–3, 5]. По данным Регистра инсульта (2009), в г. Ульяновске среднегодовая заболеваемость инсультом составляла 2,1 на 1000 населения в год [6]. Смертность в остром периоде инсульта составляет 35 % и достигает к концу года почти 50 % [2, 7]. Наряду с высокой смертностью, социально значимыми являются и последствия инсультов: развитие стойкой инвалидности с потерей трудоспособности, высокий риск повторных нарушений мозгового кровообращения, сосудистой деменции.
Известно, что большинство ишемических инсультов относятся к мультифакториальным заболеваниям: их развитие, клиническое течение и исход во многом обусловлены комплексным влиянием факторов внешней среды и наследственной предрасположенностью [6].
Одной из актуальных проблем современного здравоохранения является выяснение молекулярно-генетических основ развития сердечно-сосудистых заболеваний. На современном этапе одним из наиболее плодотворных подходов к изучению наследственной предрасположенности к ишемическому инсульту является исследование ассоциаций полиморфных вариантов генов-кандидатов с риском развития заболевания. В первую очередь это гены, продукты которых либо вовлечены в липидный гомеостаз, либо оперируют в системе свертывания крови, либо влияют на физиологию стенки сосудов [8].
Обнаружение генетических маркеров тромбофилических состояний позволит значительно повысить возможности проведения своевременной профилактики, адекватного патогенетического лечения, а также правильной оценки риска развития повторного инсульта и дальнейшего прогноза.
Цель исследования. Изучить полиморфизм генов системы гемостаза как предиктора развития ишемического инсульта у лиц молодого и среднего возраста.
Материалы и методы. Клинико-инструментальные методы. Обследовано 172 пациента в остром периоде ишемического инсульта в возрасте от 25 до 60 лет включительно, находившихся на лечении в неврологическом отделении для больных с острыми нарушениями мозгового кровообращения ГУЗ «Центральная клиническая медико-санитарная часть им. заслуженного врача России В.А. Егорова» г. Ульяновска с 2012 по 2015 г. В числе обследованных – 69 женщин (40,1 %) и 103 мужчины (59,9 %). Средний возраст пациентов – 58 (56; 60) лет, средний возраст женщин – 56 (48; 58) лет, мужчин – 60 (58; 60) лет.
В ходе обследования пациента выяснялись его анамнестические данные (с учетом сопутствующей патологии).
Всем больным проводилось тщательное клинико-инструментальное обследование с целью выявления факторов риска цереброваскулярной патологии, верификации сосудистой патологии головного мозга, а также ус- тановления патогенетического механизма развития ишемического инсульта. Обследование включало: неврологический осмотр, терапевтический осмотр, проведение рентгеновской компьютерной томографии (РКТ) головного мозга, дуплексного сканирования экстракраниальных артерий, транскраниальной эхокардиографии, электрокардиографии, лабораторное исследование с оценкой липидного спектра, исследование гемореологических показателей и параметров системы гемостаза. Всем пациентам проводился генетический анализ с целью выявления полиморфизмов генов системы гемостаза, ассоциированных с повышенным риском развития тромбофилии.
Оценка степени тяжести ишемического инсульта проводилась с использованием шкалы тяжести инсульта Национального института здоровья США (the National Institutes of Health Stroke Scale – NIHSS) с интерпретацией результатов данной шкалы по критериям L.B. Goldstein et al. [9]. При суммарном результате менее 6 баллов определяется легкий инсульт; 7–12 баллов – инсульт средней степени тяжести; более 14 баллов – тяжелый инсульт. Оценка тяжести состояния и степени нарушения сознания проводилась с использованием шкалы Глазго (Glazgow). Для оценки функционального исхода использовалась шкала Рэнкин.
Диагноз ишемического инсульта у всех пациентов подтверждался методом нейровизуализации: всем пациентам проводилась РКТ головного мозга при поступлении и через 24 ч от начала заболевания.
Распределение пациентов по группам в зависимости от размера очага ишемии проводилось в соответствии с классификацией Н.В. Верещагина, Л.К. Брагиной (1983): обширные инфаркты – инфаркты, распространяющиеся на весь бассейн внутренней сонной артерии или на весь бассейн артерий вертебрально-базилярной системы; к большим относят инфаркты, распространяющиеся на весь бассейн основных ветвей (передней, средней, задней мозговых, базилярной и мозжечковой артерий); средние инфаркты – это инфаркты бассейна корковых и глубоких ветвей; малые – инфаркты в бассейнах внут- римозговых артерий, отходящих от передней, задней, средней мозговых, позвоночной и базилярной артерий, размер не превышает 1–1,5 см.
Группу контроля (ГК) составили 90 практически здоровых лиц (39 (43,3 %) женщин и 51 (56,7 %) мужчина; средний возраст – 57 (54; 59) лет), не имеющих цереброваскулярной патологии, по полу и возрасту сопоставимых с группой обследованных больных.
Молекулярно-генетическое исследование осуществлялось в лаборатории молекулярной и клеточной биологии Научно-исследовательского технологического института имени С.П. Капицы ФБГОУ ВО «Ульяновский государственный университет». Экстракция геномной ДНК проводилась из лейкоцитов замороженной венозной крови с использованием набора «Ампли Прайм ДНК-сорб-АМ». Генетические полиморфизмы определялись с использованием комплекта реагентов для определения генетических полиморфизмов, ассоциированных с риском развития тромбофилии, методом полимеразной цепной реакции (ПЦР) в режиме реального времени «Кардио-ГенетикаТромбофилия», разработанным компанией «ДНК-Технология» (регистрационный номер 2010/08414 от 22.07.2010). ПЦР проводились на ДНК-амплификаторе CFX96.
Проводился анализ полиморфизмов генов, кодирующих белки системы свертывания крови и гемостаза. Для исследования были выбраны описанные в литературе полиморфизмы генов, которые с теоретических позиций могут иметь отношение к повышенному риску ишемического поражения головного мозга: полиморфизм 20210G>A гена FII, полиморфизм 1691G>A гена FV, полиморфизм -455G>A гена FGB, полиморфизм -675 5G>4G гена PAI-1, полиморфизм 807C>T гена ITGA2, полиморфизм 1565Т>С гена ITGB.
Статистическая обработка полученных данных проводилась с применением пакета прикладных программ «Статистика 6.1» (StatSoft, 2003, США). Группы сравнивались по качественным данным с помощью критерия χ2, точного критерия Фишера. Также при описательной статистике количественных признаков использовались методы оценки непараметрических данных с вычислением медианы и межквартильного интервала (25–75-й процентили), при сравнении двух связанных признаков – критерий Уилкоксо-на. При сравнении двух несвязанных признаков для проверки гипотезы о различии выборок групп больных применялся тест Манна– Уитни (Mann–Whitney U-test). Данные представлены в виде медианы, 25 и 75 % квартилей (Me (25; 75 %)). При проверке гипотез статистически значимыми считались результаты при уровне вероятности более 95 % (p<0,05).
Результаты и обсуждение. Клиническая характеристика больных. Согласно возрастной классификации ВОЗ (2009) все больные ИИ были разделены на две группы. Первую группу составили больные ИИ молодого возраста (25–44 года), вторую группу – больные среднего (зрелого) возраста (45–60 лет). Распределение больных по возрастным группам показало преобладание больных ИИ среднего (зрелого) возраста (р<0,001).
Распределение больных по десятилетиям жизни показало преобладание пациентов с ИИ в возрасте 50–59 лет – 41,9 % (72 чел.) и в возрасте 60 лет – 40,1 % (69 чел.) (р<0,001). В возрасте 20–29 лет было выявлено 1,7 % больных (3 чел.), в возрастной группе 30–39 лет – 4,1 % (7 чел.), 12,2 % (21 чел.) составили больные ИИ в возрасте 40–49 лет (р>0,05).
Среди обследованных пациентов преобладали мужчины (р<0,001).
По локализации ишемического очага отмечалось преобладание полушарных инсультов – 70,9 % (n=122) (р<0,01). Из них в бассейне левой средней мозговой артерии – 54,1 % (n=66), в бассейне правой средней мозговой артерии – 31,9 % (n=39), в бассейне левой задней мозговой артерии – 7,4 % (n=9), в бассейне правой передней мозговой артерии – 4,1 % (n=5), в бассейне левой передней мозговой артерии – 2,5 % (n=3). Локализация ишемического инсульта в вертебральнобазилярном бассейне выявлена у 19,8 % обследованных пациентов (n=34), из них у 70,6 % (n=24) очаг ишемии располагался в стволе головного мозга, у 29,4 % (n=10) – в мозжечке. В 9,3 % случаев (n=16) было вы- явлено два «свежих» ишемических очага: у всех пациентов один очаг ишемии локализовался в мозжечке, второй – в полушариях головного мозга.
Среди мужчин чаще встречалась локализация очага ишемии в бассейне левой средней мозговой артерии – 44,6 % (n=46), а также в мозжечке – 8,7 % (n=9). У женщин инфаркт мозга чаще развивался в бассейне правой средней мозговой артерии – 34,8 % (n=24) (р<0,05).
Отмечено преобладание полушарного ишемического инсульта среди лиц молодого возраста – 87,1 % (n=27) (р<0,05).
Различий по локализации зоны инфаркта в правом или левом полушарии головного мозга, а также в различных долях у больных не выявлено (р>0,05).
По результатам РКТ головного мозга в соответствии с классификацией, принятой в НЦ неврологии РАМН (Верещагин Н.В. с со-авт., 1983), отмечалось преобладание средних инфарктов – у 50 % (n=86), малые (лакунарные) инфаркты наблюдались в 22,7 % случаев (n=39), большие ишемические инфаркты – в 20,9 % (n=36), обширные инфаркты – в 6,4 % случаев (n=11) (рис. 1).
Отмечено достоверное преобладание очагов инфаркта средних размеров среди мужчин – 57,3 % (р=0,029) и больших инфарктов у женщин – 28,9 % (р=0,037) и у пациентов молодого возраста (младше 45 лет) – 35,5 % (р=0,048). Обширные инфаркты диагностированы только у пациентов среднего возраста (45–60 лет) – 7,8 %. Лакунарные инфаркты наблюдались одинаково часто в двух возрастных группах – 19,4 и 23,4 % (p>0,05).
Среди обследованных больных с ишемическим инсультом чаще была диагностирована болезнь крупных сосудов (атеротромботи-ческий инсульт, АТИ) – у 75 пациентов (43,6 %) (р<0,023), из них 53 (70,6 %) мужчины и 22 женщины (29,3 %) (р<0,00001). У 47 больных (27,3 %) имел место кардиоэмболический подтип ишемического инсульта (КЭИ): у 31 мужчины (69,5 %) и 16 женщин (34,1 %) (р<0,001). Лакунарный инсульт (ЛАИ) выявлен у 39 пациентов (22,7 %): 27 женщин (69,2 %) и 12 мужчин (30,8 %) (р<0,001). Гемодинамический подтип ИИ
(ГДИ) отмечен у 11 пациентов (6,4 %), одинаково часто у мужчин и женщин – 7 (63,6 %) и 4 (36,4 %) случая соответственно (р>0,05).
Инсульта по типу гемореологической микроокклюзии в группе обследованных пациентов не выявлено (рис. 2).
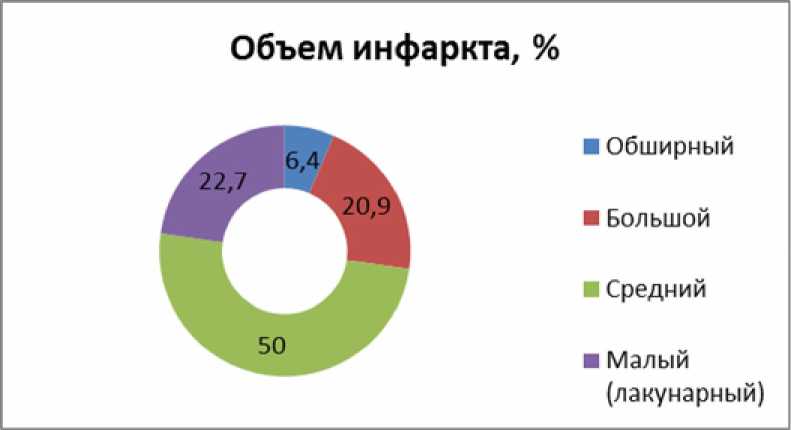
Рис. 1. Объем инфаркта в группе обследованных больных
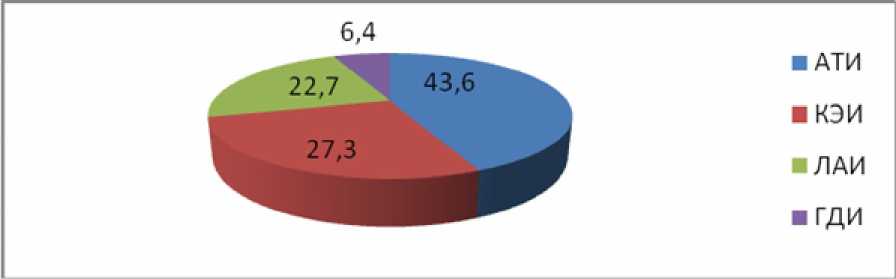
Рис. 2. Распределение патогенетических подтипов ИИ у обследованных больных
Получены гендерные и возрастные различия по частоте встречаемости подтипов ИИ. Отмечено преобладание АТИ у лиц среднего (зрелого) возраста – 48,9 % (р=0,002), а также у мужчин – 51,5 % (р=0,012). У пациентов в возрасте младше 45 лет (48,4 %) (р=0,0005) и у женщин (39,1 %) достоверно чаще преобладал ЛАИ (р=0,00035).
Распределение больных в зависимости от патогенетического подтипа и объема очага поражения показало преобладание среди пациентов с АТИ больших инфарктов – 40 % (n=30) (р<0,05). Средние инфаркты чаще раз- вивались при КЭИ – 57,3 % (n=43) (p<0,05). Лакунарные инфаркты соответственно выявлены у пациентов с лакунарным подтипом инсульта – 100 % (n=39) (p=0,001). Обширные ишемические инфаркты, распространяющиеся на весь бассейн внутренней сонной артерии или на весь бассейн артерий вертебрально-базилярной системы, диагностированы только у больных с АТИ – 14,7 % (n=11). Различий по частоте встречаемости ишемических очагов различного объема у пациентов с ГДИ не выявлено (р>0,05).
Отмечено достоверное преобладание очагов ишемии средних размеров у мужчин –
57,3 % (р=0,029) и больших инфарктов у женщин – 28,9 % (р=0,037) и у пациентов молодого возраста (младше 45 лет) – 35,5 % (р=0,048). Обширные инфаркты диагностированы только у пациентов среднего возраста (45–60 лет) – 7,8 %, одинаково часто у мужчин и у женщин – 7 (6,8 %) и 4 (5,8 %) соответственно (р>0,05). Лакунарные очаги и инфаркты средних размеров диагностированы одинаково часто у мужчин и женщин – 21 (20,4 %) и 18 (26,1 %) (р>0,05).
Нарушение сознания различной глубины в остром периоде ИИ зарегистрировано у 58 пациентов (33,7 %). Из них в оглушении (13–14 баллов по шкале Глазго) находились 34 пациента (58,6 %), в сопоре (9–12 баллов по шкале Глазго) – 20 больных (34,5 %), кома (менее 8 баллов по шкале Глазго) диагностирована у 4 пациентов (6,9 %). 114 (68 %) больных находились в состоянии ясного сознания (15 баллов).
Независимо от подтипа инсульта большая часть пациентов в остром периоде заболевания находилась в состоянии ясного сознания (15 баллов по шкале Глазго) – 66,3 %, а также в состоянии оглушения (13–14 баллов) – 58,6 % пациентов. Наибольшую степень нарушения сознания (оглушение, сопор, кома) имели пациенты с АТИ – 56 %, по сравнению с пациентами других патогенетических подтипов инсульта (р<0,05).
Получены различия в состоянии уровня сознания пациентов в зависимости от объема инфаркта мозга. Отмечена тенденция к усугублению степени нарушения сознания до сопора и комы у больных с большими (23,7 и 2,6 %) и обширными (36,4 и 27,3 %) инфарктами мозга, в то время как пациенты с лакунарными и средними инфарктами находились в состоянии ясного сознания (92,3 и 68,6 %) или оглушения (5,4 и 24,4 % соответственно) (р<0,05).
При оценке неврологического статуса пациентов в остром периоде ИИ в 41,9 % случаев (n=72) ведущими неврологическими синдромами были нарушения двигательной сферы, при этом у 31,9 % пациентов (n=23) была выявлена плегия, у 20,9 % (n=15) – глубокие парезы (до 2 баллов), умеренные парезы (3 балла) встречались в 33,3 % случаев
(n=24), легкие парезы (4 балла) – в 13,8 % (n=10). Нарушения в сфере чувствительности наблюдались у 2,9 % обследованных пациентов (n=5). Вестибуло-мозжечковый синдром являлся ведущим синдромом у 8,2 % больных (n=14). Изолированная афазия также диагностирована у 14 пациентов (8,2 %), у 6 (42,9 %) из которых выявлена тотальная афазия, у 3 (21,4 %) – моторная, у 5 (35,7 %) – cен-сомоторная. Бульбарный синдром являлся ведущим у 6,9 % пациентов (n=12), глазодвигательные нарушения диагностированы в 4,7 % случаев (n=8). У 47 пациентов (27,3 %) наблюдалось сочетание неврологических синдромов, равноценных по степени выраженности. Так, сочетание тотальной афазии и гемиплегии отмечено у 55,3 % больных (n=26), бульбарного синдрома и нарушений двигательной сферы – у 36,2 % (n=17), нарушений в координаторной сфере и гемипареза – у 8,5 % (n=4).
По степени тяжести ИИ с оценкой по шкале NIHSS отмечалось преобладание инсульта средней тяжести – у 75 пациентов (43,6 %), тяжелый инсульт наблюдался у 32 чел. (18,6 %), у 65 больных (37,8 %) инсульт расценивался как легкий. Средняя оценка по шкале NIHSS в группе обследованных пациентов составила 8 (4,5; 12) баллов, в группе мужчин – 5 (4; 12) баллов, в группе женщин – 10 (7; 13) баллов. Обращало на себя внимание преобладание тяжелого инсульта в группе мужчин по сравнению с группой обследованных женщин (20 и 12 больных соответственно), но данные различия не достигали уровня статистической значимости (p>0,05).
Различий по степени тяжести течения инсульта у больных в различных возрастных группах не выявлено.
При оценке степени тяжести инсульта по шкале NIHSS у пациентов с различными патогенетическими подтипами инсульта получено достоверное преобладание инсульта средней тяжести при АТИ и КЭИ по сравнению с другими подтипами инсульта (41 (57,3 %) и 22 (59,6 %) (р<0,05)). В случае ЛИ и ГДИ достоверно чаще развивался легкий инсульт (30 (76,9 %) и 8 (63,6 %) (р<0,05)). Тяжелый инсульт (более 14 баллов)
был диагностирован только при АТИ и КЭИ и встречался одинаково часто в обеих группах (21 (21,3 %) и 11 (14,9 %) соответственно (р>0,05)).
Наиболее тяжелое течение инсульта в остром периоде заболевания имели пациенты с наличием обширных – 90,9 % (n=10) и больших инфарктов – 50 % (n=18) по данным РКТ головного мозга (p=0,00003).
Получены различия в степени тяжести острого периода инсульта в зависимости от локализации ишемического очага. Более тяжелое течение имело место при локализации инфаркта в больших полушариях мозга, особенно при развитии патологического процесса в бассейне ЛСМА – 16 (24,3 %) (р<0,05).
Молекулярно-генетическая характеристика больных. Полиморфные варианты исследуемых генов системы гемостаза выявлены у 140 из 172 больных с ИИ (81,4 %), у 32 чел. (18,6 %) изменений генотипа по исследуемым генам не выявлено (р>0,001). Полиморфные варианты генов встречались одинаково часто у мужчин и женщин (76 (54,3 %) и 64 (45,7 %) случая соответственно), в независимости от возрастной группы (24 (77,6 %) и 116 (82,3 %)) (р>0,05).
Выявлены как одиночные, так и сочетанные полиморфизмы. Одиночные полиморфные варианты исследуемых генов определены у 53 чел. (37,9 %). Из них у 14 чел. (26,4 %) диагностирован полиморфизм -455G>A гена фибриногена, у 12 (22,6 %) пациентов – полиморфизм -675 5G>4G гена PAI-1 и полиморфизм 1691G>A гена FV. Полиморфный вариант 20210G>A гена FII выявлен у 8 чел. (15,1 %), одиночный полиморфизм 807 C>T гена ITGA2 – у 6 (11,3 %), полиморфизм 1565T>C гена ITGB3 – у 1 пациента (2 %).
У 87 (62,1 %) обследованных пациентов обнаружены сочетанные полиморфные варианты генов системы гемостаза (р>0,05). Полиморфные варианты в двух исследуемых генах системы гемостаза встретились у 47 (33,6 %) чел., в трех – у 40 (28,6 %).
Были выявлены следующие комбинации полиморфных вариантов исследуемых генов:
-
1) -455G>A гена FGB+1691G>A гена FV+20210G>A гена FII – 4 чел.;
-
2) -455G>A гена FGB+ -675 5G>4G гена PAI-1+1565 T>C гена ITGB3 – 18 чел.;
-
3) -675 5G>4G гена PAI-1+807C>T гена ITGА2+1565 T>C гена ITGB3 – 18 чел.;
-
4) -455G>A гена FGB+ -675 5G>4G гена PAI-1 – 22 чел.;
-
5) -455G>A гена FGB+1691G>A гена FV – 4 чел.;
-
6) -675 5G>4G гена PAI-1+807 C>T гена ITGА2 – 5 чел.;
-
7) -675 5G>4G гена PAI-1+1565T>C гена ITGB3 – 7 чел.;
-
8) 1565T>C гена ITGА2+1565T>C гена ITGB3 – 8 чел.;
-
9) -675 5G>4G гена PAI-1+1565T>C гена ITGB3 – 1 чел.
По сравнению с ГК среди пациентов с ИИ получено достоверное преобладание полиморфных вариантов следующих генов: полиморфизм -455G>A гена FGB – 33,7 %, полиморфизм 20210G>A гена FII – 6,9 %, полиморфизм 1691G>A гена FV – 11,6 %, полиморфизм -675 5G>4G гена PAI-1 – 12,8 %, полиморфизм 1565T>C гена ITGB3 – 29,7 %.
Анализ полиморфизма 1565Т>С гена ITGВ3 не показал статистически значимых различий в общем распределении наблюдаемых частот генотипов между группой больных с ИИ и ГК (табл. 1, 2).
Отмечена наибольшая частота встречаемости полиморфного варианта -455G>A гена фибриногена (33,7 % больных). Ведущие позиции данный полиморфизм занимает как при одиночном носительстве (26,4 %), так и в сочетании с полиморфными вариантами других генов системы гемостаза (55,2 %). Кроме того, только в группе обследованных пациентов с ИИ диагностирован редко встречающийся гомозиготный генотип А/А гена фибриногена, ассоциированный с наибольшим риском тромбофилических состояний (1,2 % больных).
Таблица 1
Частота встречаемости генотипов по исследованным генам системы гемостаза (FGB, FII, FV)
|
Обследованные группы |
Исследованные гены, выявленные генотипы, n (%) |
||||||||
|
Ген FGB (-455G>A) |
Ген FV (1691G>A) |
Ген FII (20210G>A) |
|||||||
|
G/G |
G/A |
A/A |
G/G |
G/A |
A/A |
G/G |
G/A |
A/A |
|
|
Больные ИИ |
112 (65,1) |
58 (33,7)* |
2 (1,2) |
152 (88,4) |
20 (11,6)* |
- |
160 (93,1) |
12 (6,9)* |
- |
|
Группа контроля |
82 (91,1) |
8 (8,9) |
- |
89 (98,9) |
1 (1,1) |
- |
89 (98,9) |
1 (1,1) |
- |
Примечание. * – статистически значимые различия с группой контроля (р<0,05).
Таблица 2
Частота встречаемости генотипов по исследованным генам системы гемостаза (PAI-1, ITGA2, ITGB3)
|
Обследованные группы |
Исследованные гены, выявленные генотипы, n (%) |
||||||||
|
Ген PAI-1 (-675 5G>4G) |
Ген ITGA2 (807C>T) |
Ген ITGB3 (1565T>C) |
|||||||
|
5G/5G |
5G/4G |
4G/4G |
C/C |
C/T |
T/T |
T/T |
C/T |
C/C |
|
|
Больные ИИ |
107 (62,2) |
43 (25,0) |
22 (12,8)* |
133 (77,3) |
25 (14,6) |
14 (8,1) |
121 (70,3) |
51 (29,7)* |
- |
|
Группа контроля |
64 (71,1) |
26 (28,9) |
- |
83 (92,2) |
5 (5,6) |
2 (2,2) |
82 (91,1) |
8 (8,9) |
- |
Примечание. * – статистически значимые различия с группой контроля (р<0,05).
Таким образом, полученные результаты проведенного исследования, а именно достоверное преобладание полиморфных вариантов исследуемых генов системы гемостаза у лиц с ишемическим поражением головного мозга, свидетельствуют о наличии ассоциации генотипов G/A и А/А (FGB), G/A (FII), G/A (FV), 4G/G/4G (PAI-1), С/Т ITGB3 генов системы гемостаза с повышенным риском развития тромбофилических состояний, в частности ишемического инсульта у лиц молодого и среднего возраста.
Результаты молекулярно-генетического исследования пациентов в остром периоде ИИ подтверждают существующие предположения о значительном вкладе генетических факторов в развитие ишемических нарушений мозгового кровообращения.
Анализ клинических и инструментальных данных выявил особенности клинического течения острого периода ИИ у пациентов с сочетанными полиморфными вариантами генов системы гемостаза. Только в данной группе больных имели место тромбоэмболические осложнения различных локализаций – у 28,7 % больных, в то время как у лиц с одиночными полиморфизмами тромбоэмболических ос- ложнений не наблюдалось (р=0,001). Наиболее часто острый период ИИ осложнялся развитием инфаркта миокарда – у 14,9 % больных, тромбозы глубоких вен развились у 10,3 % больных, тромбоэмболия легочной артерии – у 4,6 % больных с сочетанными полиморфизмами. У одного пациента, являющегося носителем сочетания полиморфных вариантов генов FGB, FII и FV, острый период ИИ осложнился развитием острого инфаркта миокарда в сочетании с тромбозом глубоких вен нижних конечностей. Следует отметить, что у 96 % больных с тромбоэмболическими осложнениями при генетическом исследовании диагностирован полиморфизм -455G>A гена FGB.
Результаты данного исследования показывают, что носительство полиморфных аллелей генов, кодирующих белки свертывающей системы крови, определяет клиникопатогенетический подтип ИИ, количество ишемических очагов, а также тяжесть неврологического дефицита и не влияет на функциональный исход инсульта.
У пациентов с полиморфным вариантом генов системы гемостаза достоверно преобладал АТИ (48,1 %), у пациентов с «нейтральным» генотипом – ГДИ (18,8 %). Выяв- лена зависимость патогенетического подтипа инсульта от полиморфного варианта гена. При наличии полиморфизма гена FGB преобладал АТИ (83,3 %), гена PAI-1 – АТИ и ЛАИ (50 и 35,7 %), гена ITGA2 – ЛАИ (66,7 %). При наличии сочетанного полиморфного варианта генотипа имели место АТИ и КЭИ (44,8 и 35,9 % соответственно (р<0,05)).
Среди пациентов с полиморфным вариантом генов системы гемостаза отмечено преобладание лиц с сочетанными ишемическими очагами (12,2 %) (р=0,043), а также с высокой балльной оценкой по шкале NIHSS, что соответствует тяжелому течению инсульта (16,8 %) (р=0,04).
Наибольшую балльную оценку тяжести инсульта имели пациенты с диагностированными полиморфными вариантами FGB, FII и FV (17,70±7,12; 9,60±2,77; 10,50±2,94), а также при сочетании полиморфизмов в генах PAI-I и ITGB3 (17,70±2,81). При этом достоверных различий балльной оценки степеней тяжести неврологического дефицита у пациентов с одиночными и сочетанными полиморфизмами исследуемых генов не выявлено (р>0,05).
При динамическом обследовании пациентов на 21-й день заболевания снижение баллов имело место у пациентов как с «нейтральным», так и с полиморфным генотипами, однако наибольший регресс баллов получен в группе пациентов без полиморфизма генов (-2,10±3,24 и -3,60±3,04 балла соответственно).
Среди пациентов с одиночными полиморфизмами наибольший регресс баллов в динамике получен у лиц с полиморфизмом в гене PAI-1 (-4,20±2,25 балла), наименьший – с полиморфизмом в гене FII (-1,00±1,41 балла). У пациентов с сочетанными полиморфизмами наибольший регресс баллов отмечен у лиц с сочетанием полиморфизма гена PAI-1 и гена ITGB3 (-12,40±4,07 балла), наименьший – с сочетанием полиморфизмов в генах FGB и PAI-1 (-0,1±2,49 балла).
В единственной группе пациентов с сочетанием полиморфных вариантов генов FGB, FII, FV получен прирост баллов в динамике к концу острого периода инсульта
(2,00±2,24 балла), что, вероятно, обусловлено наличием экстрацеребральных тромоэмболи-ческих осложнений в указанной группе больных. Однако данная динамика баллов оказалась статистически не значима (р=0,14).
Улучшение функционального исхода с оценкой по шкале Рэнкин на 21-й день от начала заболевания статистически значимым было как в группе больных с полиморфизмом генов, так и в группе без него.
Выводы:
-
1. Установлено наиболее тяжелое течение инсульта при атеротромботическом и кардиоэмболическом подтипах, при обширных и больших инфарктах мозга, а также при локализации инфаркта в больших полушариях мозга, особенно в левом каротидном бассейне.
-
2. Среди пациентов с ишемическим инсультом молодого и среднего возраста по сравнению с группой контроля преобладают полиморфные варианты генов фибриногена, V фактора свертывания крови (фактора Лейдена), протромбина, гена плазминогена I типа и гена бета-3 субъединицы тромбоцитарного рецептора фибриногена. Наиболее часто встречаемым является полиморфизм -455G>A гена фибриногена. Полиморфный вариант гена фибриногена занимает лидирующие позиции как при одиночном носительстве, так и в сочетании с полиморфными вариантами других генов системы гемостаза.
-
3. Наличие полиморфных вариантов генов, кодирующих белки свертывающей системы крови, определяет клинические особенности течения острого периода ишемического инсульта: клинико-патогенетический подтип инсульта, количество очагов ишемии, а также тяжесть неврологического дефицита, – и не влияет на функциональный исход к концу острого периода заболевания.
У пациентов с полиморфным вариантом генов системы гемостаза достоверно преобладал АТИ. Выявлена зависимость патогенетического подтипа инсульта от полиморфного варианта гена. При наличии полиморфизма гена FGB преобладает АТИ, гена PAI-1 – АТИ и ЛАИ, гена ITGA2 – ЛАИ. При наличии сочетанного полиморфного варианта генотипа имеют место АТИ и КЭИ. Среди пациентов с полиморфным вариантом генов системы гемостаза преобладают лица с сочетанными ишемическими очагами, а также с высокой балльной оценкой по шкале NIHSS. Грубый неврологический дефицит, соответствующий тяжелому течению инсульта, имеют пациенты с полиморфными вариантами генов фибриногена, V фактора свертывания крови и гена протромбина. Сочетание поли- морфизмов данных трех генов ассоциировано с нарастанием неврологического дефицита, а также с утяжелением общего состояния пациентов к концу острого периода заболевания, вероятно, за счет развития экстрацеребральных тромбоэмболических осложнений.
Список литературы Клинико-генетическая характеристика больных ишемическим инсультом молодого и среднего возраста
- Воробьев П.А. Инсульт. Нормативные документы. М.: Ньюдиамед; 2010.
- Гусев Е.И., Мартынов М.Ю., Камчатнов П.Р. Ишемический инсульт. Современное состояние проблемы//Доктор.ру. 2013; 5 (83): 2-7.
- Суслина З.А., Пирадов М.А., Домашенко М.А. Инсульт: оценка проблемы (15 лет спустя). Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; 11: 5-13.
- Alan S. AHA Statistical Update: Heart Disease and Stroke Statistics -2013 Update. A Report From the American Heart Association. Circulation. 2013; 127: 6-245.
- Скворцова В.И., Стаховская Л.В. Эпидемиология церебрального инсульта в РФ. Материалы Всероссийской научно-практической конференции «Нарушения мозгового кровообращения». Иркутск; 2011: 7-15.
- Машин В.В., Котова Е.Ю., Пинкова Е.А. Заболеваемость и факторы риска инсульта. Возможности профилактики. Неврологический вестник. Журнал им. В.М. Бехтерева. Т. XXXIX. Вып. 1. Материалы научного конгресса «Бехтерев -основоположник нейронаук: творческое наследие, история и современность» (приложение к журналу). 2007: 156-157.
- Lloyd-Jobes D., Adams R., Brown T. et al. Heart disease and stroke statistics-2010 update: a report from the American Heart Association. Circulation. 2010; 121: 46-215.
- Кобылина О.В., Гехт А.Б., Фаворова О.О., Гусев Е.И., Николаева Т.Я. Генетические аспекты ишемического инсульта. Инсульт, приложение к Журналу неврологии и психиатрии им. Корсакова. 2008; 23: 49-55.
- Goldstrein L., Bertels C., Davis J.N. Interrater reliability of the NIH Stroke Scale. Arch. Neurol. 1989; 46: 660-622.


