Комбинированное лечение фибрилляции предсердий при митральном пороке сердца
Автор: Стасев А.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2-2 т.25, 2010 года.
Бесплатный доступ
В статье представлены результаты применения комбинированного лечения фибрилляции предсердий в раннем послеоперационном периоде у пациентов с пороком митрального клапана. В исследование включено 34 пациента. Всем пациентам было выполнено оперативное лечение порока митрального клапана и радиочастотная процедура изоляции предсердий по типу «Лабиринт». В основной группе исследуемых оперативное лечение порока митрального клапана было дополнено шовной пластикой левого предсердия по собственно разработанной методике. В срок 1 год после операции средний размер левого предсердия в группе с атриопластикой составил 44,3±4,4 мм, объем левого предсердия - 118,39±22,4 мл, в группе без атриопластики - 46,7±2,7 мм и 152,6±34,2 мл соответственно, результаты между группами достоверно отличались друг от друга. Полный контроль ритма в послеоперационном периоде и проведение при необходимости кардиоверсий в срок 6-12 месяцев позволяют повысить частоту синусового ритма у этих пациентов до 85% на фоне применения антиаритмической терапии. Хирургическое уменьшение полости левого предсердия совместно с устранением гемодинамических (протезирование митрального клапана) и электрофизиологических причин (процедура РЧА «Лабиринт») развития фибрилляции предсердий значительно увеличивает частоту послеоперационного восстановления и сохранения синусного ритма, тем самым улучшая отдаленный прогноз этих пациентов.
Митральный клапан, левое предсердие, фибрилляция предсердий, атриомегалия
Короткий адрес: https://sciup.org/14919217
IDR: 14919217 | УДК: 616.125.2
Текст научной статьи Комбинированное лечение фибрилляции предсердий при митральном пороке сердца
Атриомегалия является распространенным осложнением многих заболеваний сердца. Наиболее часто атри-омегалия сопровождает (до 19% случаев) пороки митрального клапана. Процесс ремоделирования сердца при митральном пороке затрагивает не только левый желудочек, но и вызывает органическое изменение левого предсердия с дилатацией его полости. В настоящее время увеличение размеров левого предсердия рассматривается как фактор развития фибрилляции предсердий, кардиогенных тромбоэмболий и внезапной смерти [2, 8, 11, 14]. Увеличенное левое предсердие может сдавливать соседние органы грудной клетки: бронхиальное дерево, развивая респираторные расстройства, базальные сегменты нижней доли легкого и пищевод, развивая дисфагии, но такие нарушения редки и возможны при истинно гигантском предсердии [3, 9, 15].
Согласно Фрамингемскому исследованию, увеличение размеров левого предсердия на 5 мм увеличивает риск развития фибрилляции предсердий на 39% и при наличии фибриляции предсердий увеличивает риск сердечно-сосудистых осложнений основного заболевания [5, 11]. Совместное выполнение хирургической редукции полости ЛП и хирургии фибрилляции предсердий позволяет восстановить синусовый ритм и повысить частоту сохранения синусового ритма в раннем послеоперационном периоде [1, 12, 14].
В настоящее время нет единого мнения о методике уменьшения полости левого предсердия при хирургии митрального клапана. Существующая методика уменьшения полости ЛП путем ушивания ушка ЛП не позволяет значимо уменьшить полость левого предсердия [6, 7, 9]. Способ уменьшения полости левого предсердия, разработанный Sinatra R. и заключающийся в триангулярной резекции задней стенки левого предсердия между легочными венами, метод спиральной резекции стенки левого предсердия, предложенный H. Sugiki, и метод частичной аутотрансплантации сердца [4, 10, 16] требуют рассечения стенки левого предсердия и последующего наложения швов, что увеличивает время искусственного кровообращения и риск кровотечения, и, следовательно, ведет к увеличению числа возможных осложнений в послеоперационном периоде.
Наиболее широко распространены методики шовной пластики – «классическая пликация» задней стенки ЛП [6, 7, 13], заключающаяся в наложении отдельных швов или продольных непрерывных швов на задненижнюю стенку ЛП, которые приводят к сморщиванию и уменьшению площади задней стенки ЛП и, следовательно, объема ЛП.
Цель нашей работы: оценить результаты комбинированного лечения фибрилляции предсердий в раннем послеоперационном периоде.
Материал и методы
Объектом исследования стали пациенты с дилатацией левого предсердия. Критериями отбора пациентов, которым будет проведена хирургическая коррекция митрального порока и радиочастотная процедура «Лабиринт» с признаками дилатации левого предсердия (переднезадний размер в М-режиме – более 45 мм, размер в 4-камерной позиции – более 45х55 мм), были: комбинированный или изолированный порок митрального клапана.
В исследование было включено 34 пациента, подвергшихся хирургическому лечению в ОССХ Учреждения РАМН НИИ кардиологии СО РАМН, Томск (2006–2008 гг.).
Клиническая характеристика больных представлена в таблице 1. Средний возраст пациентов составил 54,8±8,2 года, мужчин в группе было 13 человек (38%), женщин – 21 (62%). По этиологии порока пациенты распределились следующим образом: ревматизм – 73,6% (25 пациентов), миксоматозная дегенерация соединительной ткани – 14,7% (5 пациентов), инфекционный эндокардит – 11,7% (4). У 27 пациентов (79,5%) в анамнезе – фибрилляции предсердий длительностью более 6 месяцев, у 5 пациентов (8,8%) – пароксизмальная форма фибрилляции предсердий, синусовый ритм регистрировался у 2 пациентов (5,8%). У 30 человек сердечная недостаточность по классификации New York Heart Association (NYHA) была III функционального класса, у 4 – II функционального класса.
Всем пациентам проводилось стандартное трансто-
Таблица 1
Клиническая характеристика пациентов
|
Параметры |
Основная группа (n=20) |
Контрольная группа (n=14) |
|
Возраст |
53,8±10,7 |
51,8±7,7 |
|
NYHA |
3,12±0,23 |
2,92±1,2 |
|
Этиология |
||
|
– Ревматизм, n (%) |
14 (70%) |
11 (78,5%) |
|
– Миксоматозная дегенерация, n (%) |
4 (20%) |
1 (7%) |
|
– Инфекционный эндокардит, n (%) |
2 (10%) |
2 (7%) |
|
Ритм |
||
|
– Постоянная ФП, n (%) |
14 (70%) |
13 (92%) |
|
– Пароксизмальная ФП, n (%) |
4 (20%) |
1 (8%) |
|
– Синусовый ритм, n (%) |
2 (10%) |
- |
|
ЛП (мм) |
56,59±10,2* |
53,0±4,8 |
|
КДИ (мл/м2) |
76,62±25,3* |
76,4±28,2 |
|
КCИ (мл/м2) |
30,79±19,8* |
32,9±18,7 |
|
Объем ЛП (мл) |
223,95±72,4* |
219,9±52,3 |
|
ФВ (%) |
61,41±12,9* |
59,0±11,9 |
Примечание: * – p > 0,05 по сравнению с контрольной группой.
ракальное эхокардиографическое исследование сердца до операции и в раннем послеоперационном периоде (в сроки 6 и 12 месяцев).
Всем пациентам было проведено хирургическое лечение порока (табл. 2).
У 27 пациентов выполнено протезирование митрального клапана механическим двустворчатым протезом «Мединж 2», 3 пациентам проведено одномоментное протезирование митрального и аортального клапана механическими двустворчатыми протезами «Мединж 2», 1 пациенту выполнена секторальная пластика передней створки митрального клапана с пластикой фиброзного кольца опорным кольцом «Мединж АМ11». У 29 человек операция была дополнена проведением радиочастотной процедуры «Лабиринт» и у 20 человек – пластикой левого предсердия по собственно разработанной методике: наложение непрерывного шва вдоль задней полуокружности фиброзного кольца митрального клапана с продолжением на «куполе» левого предсердия. Операции проводились в условиях искусственного кровообращения и антеградной холодовой кардиоплегии миокарда раствором Custodiol (Dr. F. Kohler Chemie, Германия).
Для доступа к митральному клапану использовался верхне-предсердный доступ с резекцией ушка ПП и рассечением межпредсердной перегородки и купола ЛП.
В основной группе операции были дополнены выполнением шовной пластики левого предсердия по собственно разработанной методике: наложение циркулярного обвивного шва на задненижней стенке левого предсердия от верхнего края разреза межпредсердной перегородки, создающего складку, вдоль полуокружности фиброзного кольца митрального клапана с ушиванием ушка левого предсердия до верхнего края разреза крыши предсердия, тем самым уменьшая площадь задненижней стенки левого предсердия (рис. 1).
После выполнения основного этапа операции проте-
Таблица 2
Характеристика оперативного вмешательства
В послеоперационном периоде ритм сердца мониторировался первые 48 послеоперационных часов, затем в течение госпитализации выполнялись рутинные ЭКГ. Всем пациентам в послеоперационном периоде был назначен кордарон. В случае стойкого восстановления синусового ритма антиаритмик отменялся. У больных с сохраняющейся во время госпитализации ФП выполнялась кардиоверсия, которая в случае неудачи повторялась еще через 4 недели. Всем больным, независимо от ритма сердца, на все время исследования назначался варфарин (целевые значения МНО 2,5–3,5).
Статистическую обработку результатов выполняли с
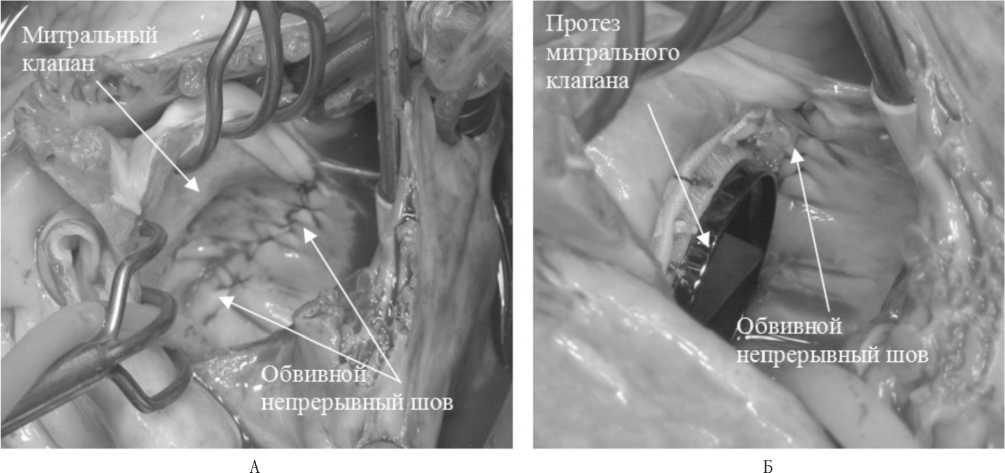
Рис. 1. А – фотография задней стенки ЛП с наложенным обвивным швом; Б – фотография задней стенки ЛП после протезирования митрального клапана
применением интегрированной системы статистического анализа и обработки результатов STATISTICA 6.0. фирмы Stat Soft Inc., USA, 1984–2001. Статистически значимыми считали различия при р<0,05. Оценку статистической достоверности проводили с помощью непараметрического критерия – U-test Mann–Whitney и хи-квадрат ( χ 2). Результаты представляли как среднее и среднеквадратичное отклонение (M±SD).
Результаты
Как показано в таблице 2, среднее время пережатия аорты и искусственного кровообращения статистически не отличалось между группами с атриопластикой и без нее (p<0,05).
В группе с атриопластикой инфузия адреналина в раннем послеоперационном периоде проводилась у 2 человек, тогда как во второй группе у 3 человек она была проведена (p=0,032).
Исходно средний размер левого предсердия в группе с атриопластикой составил 56,6±10,4 мм, объем левого предсердия – 223,9±72,4 мл, в группе без атриопластики – 51,0±4,8 мм и 219,9±52,3 мл соответственно. Статистически группы не отличались друг от друга (p<0,05).
При выписке в сроке до 1 месяца в группе с атрио-пластикой объем левого предсердия составлял до 128,42±12,9 мл, тогда как в группе без атриопластики – до 160,8±29,5 мл (табл. 2).
Средний процент уменьшения полости ЛП составил в группе с атриопластикой 42,6%, тогда как в группе без атриопластики – только 25,5% (p<0,05).
В срок 1 год после операции средний размер левого предсердия в группе с атриопластикой составил 44,3±4,4 мм, объем левого предсердия – 118,39±22,4 мл, в группе без атриопластики – 46,7±2,7 мм и 152,6±34,2 мл соответственно (p<0,05) (табл. 3).
Для анализа сократительной способности левого предсердия определялась амплитуда пика предсердной волны А трансмитрального потока. А-волна определялась у пациентов с синусовым ритмом при каждом обращении. Ее среднее значение составило 0,79±0,18 м/с, что говорит об эффективном сокращении левого предсердия.
При выписке из стационара в группе с атриопласти-кой у 14 пациентов регистрировался синусовый ритм, у 6 пациентов регистрировалась постоянная форма фибрилляции предсердий. У этих пациентов на операции был восстановлен синусовый ритм, но фибрилляция предсердий рецидивировала на 1–2-е сутки после операции и была резистентна к купируемой терапии. При выписке из стационара в группе с атриопластикой у 7 пациентов регистрировался синусовый ритм, у 6 пациентов отмечалась постоянная форма фибрилляции предсердий.
У 2 пациентов в послеоперационном периоде в контрольной группе и у 1 в группе с атриопластикой зафиксирован СССУ, и по показаниям была произведена имплантация ЭКС. У этих 2 пациентов регистрировался ритм от стимулятора, и у 1 определялся синусовый ритм на фоне отсутствия импульсов ЭКС, работающего в режиме demand.
Таблица 3
Динамика ЭхоКГ в раннем послеоперационном периоде (1 и 12 месяцев)
|
Данные ЭхоКГ |
Основная группа (n=20) |
Контрольная группа (n=14) |
||
|
1 мес. |
12 мес. |
1 мес. |
12 мес. |
|
|
ЛП (мм) |
46,7±6,3* |
44,3±4,4 |
46,7±2,7* |
46,7±2,7 |
|
КДИ (мл/м2) |
60,4±14,6* |
66,6±22,5 |
68,7±26,7* |
74,4±26,2 |
|
КCИ (мл/м2) |
22,6±7,5* |
29,3±20,0 |
28,3±18,5* |
31,9±19,4 |
|
Объем ЛП (мл) |
150,7±65,4* |
118,3±22,5# |
155,8±32,8* |
152,6±34,2 |
|
ФВ (%) |
60,3±10,3 |
59,0±14,3 |
61,9±11,7 |
60,0±13,2 |
Примечание: * – p<0,05 при сравнении с дооперационными значениями; # – p<0,05 при сравнении с контрольной группой.
Таблица 4
Динамика сохранения синусового ритма в раннем послеоперационном периоде
|
Параметры |
Основная группа с постоянной формой ФП |
Контрольная группа |
|
(n=14) |
(n=13) |
|
|
Синусовый ритм при выписке |
71% (10) |
54% (7) |
|
Синусовый ритм через 6 месяцев |
80% (11)* |
61,5% (8) |
|
Синусовый ритм через 12 месяцев |
85% (12)* |
69% (9) |
Примечание: * – p<0,05 при сравнении с контрольной группой (критерий χ 2).
В срок 1 месяц после операции 3 пациентам в основной группе и 2 в контрольной группе выполнялась элек-троимпульсная кардиоверсия в условиях стационара. В срок 6–8 месяцев после операции 2 пациентам с фибрилляцией предсердий и 2 пациентам с рецидивом фибрилляции предсердий проводилась повторная электро-импульсная кардиоверсия в условиях стационара на фоне продолжения антиаритмической терапии. Динамика сохранения синусового ритма после операции в группах представлена в таблице 4.
Таким образом, через 6 месяцев в группе с атриопла-стикой уже 11 (78%) пациентов имели синусовый ритм, и через 12 месяцев после операции количество пациентов, свободных от фибрилляции предсердий, выросло до 12 (85%), что выше по сравнению с группой без атриоп-ластики.
Заключение
В настоящее время дилатация левого предсердия считается одной из причин развития и рецидивирования фибрилляции предсердий после хирургического лечения фибрилляции предсердий. Наиболее широко распространены методики шовной пластики – «классическая пли-кация» задней стенки ЛП, заключающаяся в наложении отдельных швов или продольных непрерывных швов на задненижнюю стенку ЛП, которые приводят к сморщиванию и уменьшению площади задней стенки ЛП и, следовательно, объема ЛП. Уменьшение объема левого пред- сердия снижает диаметр полости и по закону Лапласа напряжение стенки предсердия, тем самым уменьшая основу для развития фибрилляции предсердий. Применение атриопластики позволяет повысить частоту сохранения синусового ритма у пациентов после процедуры «Лабиринт». В нашем исследовании у 71% пациентов при выписке из стационара сохранялся синусовый ритм. Полный контроль ритма в послеоперационном периоде и проведение при необходимости кардиоверсий в срок 6– 12 месяцев повышают частоту синусового ритма у этих пациентов до 85% на фоне применения антиаритмичес-кой терапии, что выше по сравнению с пациентами после процедуры «Лабиринт» без сопутствующей атриопла-стики.
Таким образом, хирургическое уменьшение полости левого предсердия совместно с устранением гемодинамических (протезирование митрального клапана) и электрофизиологических причин (процедура РЧА «Лабиринт») развития фибрилляции предсердий позволит значительно увеличить частоту послеоперационного восстановления и сохранения синусного ритма, тем самым улучшив отдаленный прогноз этих пациентов.
Список литературы Комбинированное лечение фибрилляции предсердий при митральном пороке сердца
- Choo, S.J. et al. Excellent results for atrial fibrillation surgery in the presence of giant left atrium and mitral valve disease//Eur.J. Cardiothorac. Surg. -2004. -No. 2. -Р. 336-41.
- Conradie C., Schall R., Marx J.D. Left atrial size -a risk factor for left atrial thrombi in mitral stenosis//Clin. cardiol. -1995. -No. 9. -P. 518-20.
- Eusanio G. et al. Giant left atrium and mitral valve replacement: risk factor analysis//Eur. J. Cardiothorac. Surg. -1988. -Vol. 3. -P. 151-59.
- Garcia-Villareal O., Rodriguez H., Trevino A. et al. Left atrial reduction and mitral valve surgery: the «Functional anatomic unit» concept//Ann. Thorac. Surg. -2001. -Vol. 71. -P. 1044-5.
- Holt B. Left atrial function in health and disease//Eur. Heart J. -2000. -Vol. 2 (Suppl. K). -P. 9-16.
- Isomura T., Hisatomi K., Hirano A. et al. Left atrial plication and mitral valve replacement for giant left atrium accompanying mitral lesion//J. Card. Surg. -1993. -Vol. 8. -P. 365-370.
- Johnson J., Danielson G.K., MacVaugh 3rd H. et al. Plication of the giant left atrium at operation for severe mitral regurgita tion//Surgery. -1967. -Vol. 61. -P. 118-121.
- Kannel W.B., Abbot R.D., Savage D.D. Epidemiologic features of chronic atrial fibrillation: The Framingham Study//N. Engl. J. Med. -1982. -Vol. 306. -P. 1018-1022.
- Kawazoe K., Beppu S., Takahara Y. et al. Surgical treatment of giant left atrium combined with mitral valvular disease. Plica tion procedure for reduction of compression to the left ventricle, bronchus and pulmonary parenchyma//J. Thorac. Cardiovasc. Surg. -1983. -Vol. 85. -P. 885-892.
- Lessana A., Scorsin M., Scheuble C. et al. Effective reduction of a giant left atrium by partial autotransplantation//Ann. Thorac. Surgery. -1999. -Vol. 10. -P. 1164-1165.
- Lloyd-Jones D.M., Wang T.J., Leip E.P. Lifetime risk for development of atrial fibrillation: The Framingham Heart Study//Circulation. -2004. -Vol. 110. -P. 1042-1046.
- Read D., Abbott R., Smucker M. Prediction of outcome after mitral valve replacement in patients with symptomatic mitral regurgitation. The importance of left atrial size//Circulation. -1991. -No. 84. -Р. 23-34.
- Sadatoshi Y., Takeshi S. et. al. Surgical treatment of giant left atrium using a combined superior transseptal approach//Ann. Thorac. Surg. -2003. -Vol. 75. -P. 1985-1986.
- Scherer M., Therapidis P., Miscovic A. et. al. Left atrial size reduction improves the sinus rhythm conversion rate after radiofrequency ablation for continuous atrial fibrillation in patients undergoing concomitant cardiac surgery//Thorac. Cardiovasc. Surg. -2006. -No. 54. -P. 34-38.
- Sinatra R., Pulitani I., Antonazzo A. et. al. A novel technique for giant left atrium reduction//Eur. J. Cardiothorac. Surg. -2001. -Vol. 20. -P. 412-414.
- Sugiki H., Murashita T., Yasuda K. et al. Novel technique for volume reduction of giant left atrium: simple and effective "Spiral Resection" method//Ann. Thorac. Surg. -2006. -Vol. 81. -P. 378-80.


