Комплексная оценка влияния генетических факторов на прогноз первичного миелофиброза
Автор: Полушкина Л.Б., Мартынкевич И.С., Шуваев В.А., Фоминых М.С., Мотыко Е.В., Мартыненко Л.С., Иванова М.П., Цыбакова Н.Ю., Волошин С.В., Бессмелъцев С.С., Чечеткин А.В.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.13, 2017 года.
Бесплатный доступ
Корреляция ряда генетических аберраций в опухолевых клетках с выживаемостью больных первичным миелофиброзом и широкая распространенность сочетанных геномных повреждений указывает на необходимость поиска новых моделей оценки прогноза. В данной работе проанализировано влияние кариотипа,драйверных мутаций, мутаций генов эпигенетической регуляции и их комбинации на общую выживаемость среди ПО пациентов с диагнозом ПМФ. Показано, что кариотип высокого риска,тройной негативный статус и наличие терминирующей мутации в гене ASXL1 ассоциированы с короткой выживаемостью. Статистически значимо отличались медианы общей выживаемостив группах пациентов, сформированных по комплексу характеристик «наличие драйверной мутации/ ASXL1 статус» (р
Первичный миелофиброз, мутации, кариотип, прогноз
Короткий адрес: https://sciup.org/170172518
IDR: 170172518
Текст научной статьи Комплексная оценка влияния генетических факторов на прогноз первичного миелофиброза
К настоящему времени опубликован ряд работ, демонстрирующих значимые отличия выживаемости больных в зависимости от выявленных генетических маркеров клонального гемопоэза. Неблагоприятные ХА (изолированные или 2 нарушения +8, 7/7q, i(17q), inv(3), 5/5q, 12p или перестройка Hq23, комплексный кариотип), отсутствие драйверной мутации, точечные повреждения генов ASXL1, EZH2, SRSF2, IDH1/2 ассоциированы со снижением общей выживаемости и выживаемости без лейкемической трансформации [11, 12, 13]. Мутации в гене CALR первого типа (L367fsX46 — делеция 52 пар оснований), напротив, являются благоприятным прогностическим фактором, коррелируя с наиболее длительной выживаемостью [14].
Учет данных цитогенетического анализа является неотъемлемой частью определения группы риска больного в соответствии с международной системой стратификации DIPSS+ [15, 16]. Исследование опухолевых клеток на наличие дру
Стратификация пациентов по группам риска
|
Шкала |
Группа риска |
|||
|
Низкий |
Промежуточный-1 |
Промежуточный-2 |
Высокий |
|
|
IPSS |
23,6% |
30,9% |
15,5% |
21,8% |
|
DIPSS |
23,6% |
39,1% |
25,5% |
3,6% |
Замену V617F в гене JAK2 и мутации 515 кодона гена MPL анализировали методом полиморфизма длин рестрикционных фрагментов. Исследование на наличие мутаций в генах CALR гих молекулярных повреждений редко выходит за рамки диагностического поиска, имеющего цель лишь подтвердить клональную природу заболевания. Это связано, главным образом, с отсутствием данных о комплексном влиянии выявляемых дефектов генома на прогноз при несомненной синергичности их действия. Около половины пациентов с диагнозом ПМФ имеет 2 и более соматические мутации [17], а частота аномалий кариотипа составляет 35-60% в дебюте заболевания, увеличиваясь до 90 % при бластной трансформации [5]. Таким образом, проблема совокупной оценки генетических факторов прогноза актуальна для большинства больных.
Выявление прогностически неблагоприятных сочетаний генетических дефектов позволит более уверенно интерпретировать данные кариоти-пирования и молекулярного анализа в контексте прогноза. Оценка свойств патологического клона особенно важна в группах пациентов «низкого» и «промежуточного-1» риска по шкале IPSS для определения объема и интенсивности терапевтических мер, а также для своевременного выявления кандидатов на аллогенную трансплантацию костного мозга.
Цель настоящей работы состояла в выявлении прогностически значимых сочетаний генетических аномалий опухолевых клеток у больных с первичным миелофиброзом.
Материалы и методы. В исследование были включены ПО пациентов с гистологически верифицированным диагнозом первичного миелофиброза (38 мужчин, 72 женщины), медиана возраста составила 59 лет (16-82 года), медиана наблюдения — 2,6 года (0,1-23,0 года). Распределение пациентов в соответствии с системами стратификации IPSS и DIPSS приведено в таблице 1.
Цитогенетическое исследование клеток костного мозга выполнено 48 (44%) пациентам: 32 — в дебюте заболевания, 6 — в фазе прогрессии, 10 — в бластной фазе.
Таблица 1
(9 экзон), ASXL1 (12 экзон), IDH1/2 (4 экзон) проводили методом прямого секвенирования, EZH2 (5, 8, 10, 17, 18, 19 экзоны) — методом плавления высокого разрешения с последую- щей верификацией результатов прямым секвенированием.
Статистическую обработку данных проводили с использованием программ STATISTICA 10.0 (StatSoft), Excel 2016 с надстройкой XL-STAT 2016 (Microsoft). Общую выживаемость анализировали методом Каплана-Майера с применением лог-рангового теста для оценки достоверности различий. В качестве точки отсчета выбирали дату постановки диагноза ПМФ. Регрессионный анализ проводили при помощи метода Кокса. Статистически значимыми считали различия при р<0,05.
Результаты. Среди 90 (81,8%) пациентов с драйверной мутацией /ЛХ2-положительными UAK2A были 55 (50%), CALR-положительными <<САЬК+^ — 28 (25,5%), УИРТ-положительными {MPL+} — 7 (6,4%). Тройными негативными (TH) были 20 (18,2%) больных.
Мутации генов эпигенетической регуляции обнаружены у 23 человек (21,7%): у 10(9,4%) — мутации нонсенс и сдвига рамки считывания гена ASXL1 (мутации преждевременной терминации трансляции— ASXLlterm\ у 4 (3,8%) — сочетание двух мутаций в гене ASXL1, у 5 (4,7 %) — миссенс мутации ASXLlmis, у 2 (1,9%) — сочетание ASXLlterm и EZH2, у 1 (0,9%) — сочетание ASXLlterm и IDH2, у 1(0,9 %) — IDH1.
Нормальный кариотип (НК) выявлен у 32 (66,7%) человек, благоприятный (одиночные del(13)(q22), del(20)(ql2)) — у 3 (6,3%), промежуточного прогноза (одиночные del(6)(ql5), add(6)(p25), del(X)(q22), t(X;7)(p21; qll)) —у 4 (8,3 %), неблагоприятный (+8 и другие трисомии (кроме +9),—7/7q-, i(17q), inv(3),—5/5q-, перестройки llq и 12p, моносомии, 2 и более ХА) — у 9 (18,7%). Хромосомные аберрации статистически значимо чаще выявляли на более поздних стадиях заболевания (21,9% против 68,7%, р = 0,004). Частота нормального кариотипа была значимо выше в хронической фазе (71,8% против 31,2%, р = 0,004), на поздних стадиях чаще выявляли повреждения с вовлечением 2 и более хромосом (56,3 % против 3,1 %, р<0,001).
При сравнении попарно общей выживаемости (ОВ) в группах с различными вариантами кариотипа не обнаружено статистически значимых отличий среди пациентов с НК (п=32) и благоприятными ХА (п=3) (медиана выживаемости для НК составила 6 лет, не достигнута при благоприятных ХА, р = 0,264), а также среди больных с промежуточными (п=4) и неблагоприятными ХА (п=9) (р =0,459, медиана выживаемости при неблагоприятном кариотипе была равна 1,5 годам, максимальное время наблюдения в группе с ХА промежуточного прогноза составило 1,4 года и соответствовало единственному летальному исходу среди 4 наблюдений). Было принято решение выделить лишь две группы кариотипов — низкого и высокого риска, — включающие пациентов с НК и благоприятными ХА или ХА промежуточного и неблагоприятного прогноза, соответственно.
По данным однопараметрического регрессионного анализа на ОВ оказывали негативное влияние: мутации ASXLlterm (отношение рисков (ОР) 2,9, 95% ДИ 1,2-7,2, р = 0,018), кариотип высокого риска (ОР 8,2, 95 % ДИ 2,5-27,3, р<0,001) и тройной негативный статус (ОР 8,1, 95% ДИ 3,2-20,2, р<0,001). Мутации в гене CALR коррелировали с более длительной выживаемостью при пограничном уровне значимости (ОР 0,3, 95% ДИ 0,1-1,0, р = 0,052). Мутации в генах JAK2 и MPL, а также миссенс мутации гена ASXL1 не оказывали статистически значимого влияния на выживаемость и не вошли в многопараметрический анализ.
Последовательное исключение переменных при проведении многопараметрического регрессионного анализа позволило определить, что ключевое негативное влияние на ОВ независимо друг от друга оказывают кариотип высокого риска (ОР 7,4, 95% ДИ 2,3-23,7, р=0,0008) и наличие терминирующей мутации в гене ASXL1 (ОР 2,8, 95% ДИ 1,2-6,6, р=0,023).
При оценке модели Кокса без учета кариотипа значимое влияние на ОВ оказывали отсутствие ДМ (ОР 2,4, 95% ДИ 1,0-5,9, р =0,050) и ASXLE статус (ОР 3,3, 95% ДИ 1,3-8,5, р = 0,012), тогда как для мутаций в гене CALR отмечено превышение порога статистической значимости (ОР 0,3, 95% ДИ 0,1-1,1, р=0,075). Данный фактор был значим, когда в качестве ковариаты выступал только положительный ASXL1-статус (ОР 0,2, 95% ДИ 0,1-0,7, р=0,075), который также сохранял свою значимость в данной модели (ОР 3,9, 95% ДИ 1,6-10,0, р = 0,0037). В модели, включавшей тройной негативный статус и положительный ASXLl-статус, оба параметра значимо влияли на выживаемость: ОР 3,6, 95% ДИ 1,5-8,2, р=0,003 и ОР 2,5, 95% ДИ 1,0-6,1, р = 0,048, соответственно.
тистически значимых отличий ОВ между CALR+ ASXL1+ (медиана не достигнута при времени наблюдения 10,1 года) и CALR+ ASXLlX^ePWMva. 10,3 года), CALR+ASXLPn CALR~ASXL Г (медиана 13,5 года) пациентами не выявлено.
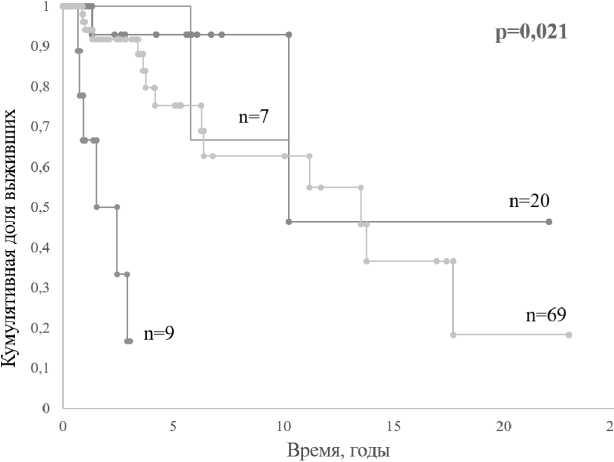
CALR(+)ASXL1(+) - CALR(+)ASXL1(-)
- CALR(-)ASXL1(+) CALR(-)ASXL1(-)
Puc. 1. Общая выживаемость пациентов с различной комбинацией генетических характеристик CALR/ASXL1
Медиана ОВ среди TH ASXLV пациентов составила 0,9 года, TH ASXL1~- 3,6 года, ДМ+ Л5ХТ7”-13,8 лет, не достигнута в ДМ+ ASXL1+ группе (при времени наблюдения 10,3 года) (р<0,0001) (рисунок 2). Попарный анализ показал, что обнаружение терминирующей мутации в гене ASXL1 значимо снижает ОВ TH больных (р = 0,007). Общая выживаемость ДМ+ ASXLF пациентов была выше в сравнении с ДМ_Л7Ж17_ больными (р = 0,044). Значимых отличий ОВ у ДМ+ пациентов с различным ASXL1 статусом не выявлено (р = 0,788).
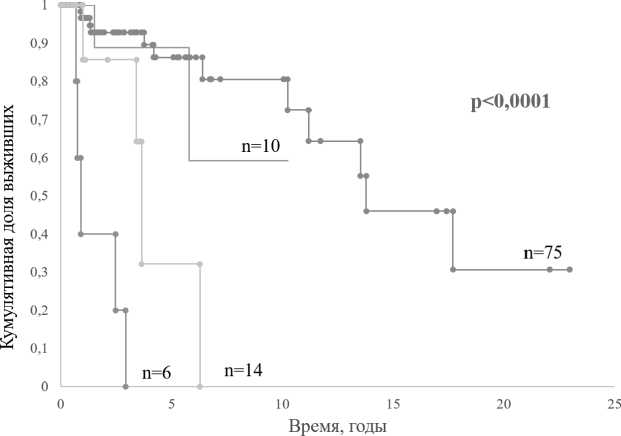
ДМ(+)/ШаЩ+) — ДМ(+)АУ.Х17(-.)
— TH ASXL1(+) — TH ASXLl(-)
Рис. 2. Сравнение общей выживаемости пациентов в зависимости от наличия/отсутствия драйверной мутации и ASXLl-cmamyca
При комплексном учете ASXL1 статуса и кариотипа медиана OB ASXL1 пациентов с кариотипом низкого риска статистически значимо не отличалась у ASXL1~ пациентов с хромосомными аберрациями высокого риска (медиана 1,6 и 1,4 года, соответственно, р = 0,291). Статисти чески значимых отличий не было обнаружено и среди ASXL1+ пациентов с кариотипами низкого и высокого риска (медиана OB 1,6 и 1,2 года, р = 0,610). Медиана OB ASXL1~ пациентов с кариотипом низкого риска составила 6,4 года (р = 0,0005) (рисунок 3).
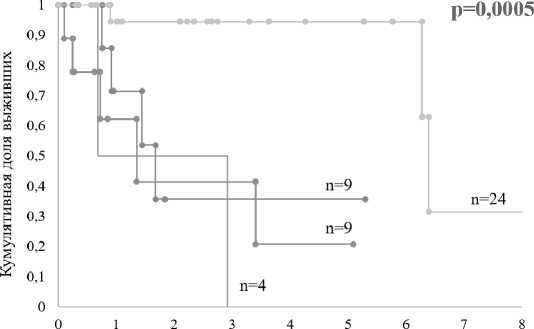
Время, годы
ASXL1(+) , ASXL1(+)
кариотип высокого риска кариотип низкого риска
_ ASXLl(-) ASXLl(-)
кариотип высокого риска кариотип низкого риска
Рис. 3. Сравнение общей выживаемости у пациентов в зависимости от мутационного статуса гена ASXL1 и кариотипа
Обсуждение. Сочетание различных клональных генетических аберраций в опухолевых клетках при ПМФ усложняет задачу оценки их влияния на прогноз. На сегодняшний день опубликованы лишь несколько работ, посвященных изучению комплексного влияния дефектов генома на выживаемость пациентов. Tefferi с соавт. [18] предлагают считать наиболее ценным прогностическим фактором CALR/ASXL1 статус, показав, что более длительную выживаемость независимо от DIPSS+ и IPSS стратификаций имеют CALR+ ASXL1~ а наименее длительную— CALR” ASXL 1 больные. Vannucchi с соавт. разработали усовершенствованный вариант IPSS стратификации (MIPSS — Mutation-Based Prognostic Scoring System), дополненный данными тестирования генов JAK2, MPL, CALR, ASXL1, SRSF2 [19]. Tefferi с соавт. также показали состоятельность прогностической модели, базирующейся только на данных молекулярного и цитогенетического анализа. Genetics-Based Prognostic Scoring System (GPSS), учитывающая данные возраста, кариотип, тип/отсутствие ДМ, ASXL1 и SRSF2-CTaTyc, позволила стратифицировать пациентов в группы риска, значимо отли чающиеся по ОВ и выживаемости без бластной трансфомации [20]. MIPSS и GIPSS требуют верификации на различных выборках пациентов.
По результатам нашего исследования, наиболее мощным прогностическим потенциалом обладали характеристики «наличие ДМ/ASXLl статус», «кариотип/ЛбАТ/ статус». Анализ ОВ с учетом данных характеристик позволил сделать ряд наблюдений. Наличие мутации в гене ASXL1 коррелировало со снижением ОВ в группе тройных негативных пациентов: 0,9 года против 3,6 года, р = 0,007. Значимых отличий в выживаемости пациентов с ДМ, но различным ASXL 1 -статусом, не выявлено (р = 0,788). Выживаемость TH ASXLI~ больных была короче не только, чем в ДММ/ЖТ- (р = 0,024), но и ДММА¥Т+(р = 0,044) группе, т. е. тройной негативный статус даже при отсутствии дополнительных молекулярных дефектов гена ASXL1 является неблагоприятным фактором для ОВ.
Стоит подчеркнуть, что по результатам однопараметрического анализа, только терминирующие мутации в гене ASXL1 оказывали влияние на ОВ. Негативный эффект терминирующих мутаций можно объяснить нарушением функ- циональной организации белка, участвующего в процессах репрессии транскрипции. Белок ASXL1 взаимодействует с комплексами молекул, модифицирующих хроматин, посредством С-концевого PHD домена (plant homeo domen). При нонсенс мутациях и мутациях сдвига рамки считывания, наблюдаемых в 12 экзоне гена, происходит полная потеря PHD домена, образованного 1506-1541 кодонами [21]. Миссенс мутации, обнаруживаемые за пределами данного участка, не влияют на сохранность связывающего домена.
Совместный анализ кариотипа и ASXL1 статуса показал, что выживаемость пациентов с наличием любого из параметров — кариотипа высокого риска и/или терминирующих мутаций гена ASXL1 — значимо хуже, чем у ASXL1 “пациентов с кариотипом низкого риска. Отсутствие статистически значимых отличий между OB ASXLP пациентов с кариотипом низкого риска и ASXL1~ пациентов с кариотипом высокого риска указывает на то, что неблагоприятные цитогенетические и молекулярные дефекты в равной степени могут ухудшать прогноз при ПМФ.
Таким образом, на основании данных молекулярно-генетического исследования могут быть выделены группы риска: крайне неблагоприятная — при отсутствии драйверной мутации и наличии мутации в гене ASXL1, неблагоприятная — при отсутствии мутаций в генах JAK2, CALR, MPL, ASXL1. промежуточная — при наличии драйверной мутации в сочетании с мутацией ASXL1, благоприятная — при наличии драйверной мутации и отсутствии мутации в гене ASXL1. Одновременный учет кариотипа и ASXL1 статуса позволяет отнести пациентов к группе высокого риска при наличии хотя бы одного из параметров.
Заключение. Кариотип высокого риска, отсутствие драйверной мутации, дефекты гена ASXL1, приводящие к остановке трансляции, являются факторами неблагоприятного прогноза при ПМФ. Общая выживаемость больных варьирует в зависимости от сочетания данных факторов. Комплексный анализ результатов цитогенетического и молекулярно-генетического исследований может послужить шагом к разработке новых, более полных моделей прогнозирования, учитывающих не только клинико-гематологические характеристики заболевания, но и биологические свойства опухолевого клона.
Список литературы Комплексная оценка влияния генетических факторов на прогноз первичного миелофиброза
- Абдулкадыров К. М., Шуваев В. А., Мартынкевич И. С. Первичный миелофиброз: собственный опыт и новое в диагностике и лечении. // Онкогематология. — 2015. Т. 10. — № 2. — С. 25-35.
- Абдулкадыров К. М., Шуваев В. А., Мартынкевич И. С. Миелопролиферативные новообразования. — Москва: Литтерра, 2016. — 304 с.
- Полушкина Л. Б., Мартынкевич И. С., Шуваев В. А. и др. Молекулярно-генетические и цитогенетические особенности первичного миелофиброза. // Гены и Клетки. — 2016. — Т. 11. — № 3. — С. 113-122.
- Tefferi A. Pathogenesis of myelofibrosis with myeloid metaplasia. // J ClinOncol. — 2005. — № 23. — Р. 8520-30.
- Hussein K., Van Dyke D. L., Tefferi A. Conventional cytogenetics in myelofibrosis: literature review and discussion. // European Journal of Haematology. — 2009. — № 82. — Р. 329-338.
- Singh N. R. Genomic diversity in myeloproliferative neoplasms: focus on myelofibrosis. // Transl Pediatr. — 2015. — Vol. 4. — № 2. — Р. 107-115.
- Tefferi A., Pardanani A. Myeloproliferative Neoplasms. A Contemporary Review. // JAMA Oncology. — 2015. — Vol. 1. — № 1. — Р. 97-105.
- Milosevic J. D., Kralovics R. Genetic and epigenetic alterations of myeloproliferative disorders. // Int J Hema-tol. — 2013. — № 97. — Р. 183-197.
- Harutyunyan A., Klampfl T., Cazzola M., Kralovics R. p53 lesions in leukemic transformation. // N Engl J Med. — 2011. — Vol. 364. — № 5 — Р. 488-490.
- Jager R., Gisslinger H., Passamonti F. et al. Deletions of the transcription factor Ikaros in myeloproliferative neoplasms. // Leukemia. — 2010. — Vol. 24 — № 7. — Р. 1290-1298.
- Tefferi A., Mesa R. A., Schroeder G. et al. Cytogenetic findings and their clinical relevance in myelofibrosis with myeloid metaplasia. // Br J Haematol — 2001. — № 113. — Р. 763-771.
- Rumi E., Pietra D., Pascutto C. et al. Clinical effect of driver mutations of JAK2, CALR, or MPL in primary myelofibrosis. // Blood. — 2014. — Vol. 124. — № 7. — Р. 1062-1069.
- Vannucchi A. M., Lasho T. L., Guglielmelli P. et al. Mutations and prognosis in primary myelofibrosis. // Leukemia. — 2013. — Vol. 27. — № 9. — Р. 1861-1869.
- Tefferi A., Lasho T. L., Finke C. et al. Type 1 vs type 2 calreticulin mutations in primary myelofibrosis: differences in phenotype and prognostic impact. // Leukemia. — 2014. — Vol. 28. — № 7. — P. 1568-70.
- Arber D. A., Orazi A., Hasserjian R., et al. The 2016 revision of the World Health Organization classification of myeloid neoplasms and acute leukemia. // Blood. — 2016. — Vol. 127. — № 20. — P. 2391-2405.
- Gangat N., Caramazza D., Vaidya R., et al. DIPSS Plus: A Refined Dynamic International Prognostic Scoring System for Primary Myelofibrosis That Incorporates Prognostic Information From Karyotype, Platelet Count, and Transfusion Status. // Journal of Clinical Oncology. — 2011. — Vol. 29. — № 4. — P. 392-397.
- Campregher P. V., Helman R., Pereira W. O. et al. The Presence of ASXL1 Mutations As Well As a Total Number of Myeloid Driver Mutations Higher Than Two Is Strongly Associated with the Diagnosis of Primary Myelofibrosis As Opposed to Essential Thrombocythemia. // Blood — 2014. —№ 124. — P. 4595.
- Tefferi A., Guglielmelli P., Lasho T. L., et al. CALR and ASXL1 mutations-based molecular prognostication in primary myelofibrosis: an international study of 570 patients. // Leukemia. — 2014. — Vol. 28. — № 7. — P. 1494-1500.
- Vannucchi A., Guglielmelli P., Rotunno G., et al. Mutation-enhanced international prognostic scoring system (MIPSS) for primary myelofibrosis: an AGIMM&IWG-MRT project. // Blood. — 2014. — Vol. 124. — № 21. — P. 405.
- Tefferi A., Guglielmelli P., Finke C. M., et al. Integration of mutations and karyotype towards a genetics-based prognostic scoring system (GPSS) for primary myelofibrosis. // Blood. — 2014. — Vol. 124. — № 21. — P. 406.
- Argote J. A., Dasanu C. ASXL1 mutations in myeloid neoplasms: pathogenetic considerations, impact on clinical outcomes and survival, Current Medical Research and Opinion. // doi: 10.1080/03007995.2016.1276896


